É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fósforo-31 Magnetic Resonance Spectroscopy: uma ferramenta para medir
Neste Artigo
Resumo
This work demonstrates the feasibility of an in vivo phosphorus-31 magnetic resonance spectroscopy (31PMRS) technique to quantify mitochondrial oxidative phosphorylation (OXPHOS) capacity in human skeletal muscle.
Resumo
Skeletal muscle mitochondrial oxidative phosphorylation (OXPHOS) capacity, which is critically important in health and disease, can be measured in vivo and noninvasively in humans via phosphorus-31 magnetic resonance spectroscopy (31PMRS). However, the approach has not been widely adopted in translational and clinical research, with variations in methodology and limited guidance from the literature. Increased optimization, standardization, and dissemination of methods for in vivo 31PMRS would facilitate the development of targeted therapies to improve OXPHOS capacity and could ultimately favorably impact cardiovascular health. 31PMRS produces a noninvasive, in vivo measure of OXPHOS capacity in human skeletal muscle, as opposed to alternative measures obtained from explanted and potentially altered mitochondria via muscle biopsy. It relies upon only modest additional instrumentation beyond what is already in place on magnetic resonance scanners available for clinical and translational research at most institutions. In this work, we outline a method to measure in vivo skeletal muscle OXPHOS. The technique is demonstrated using a 1.5 Tesla whole-body MR scanner equipped with the suitable hardware and software for 31PMRS, and we explain a simple and robust protocol for in-magnet resistive exercise to rapidly fatigue the quadriceps muscle. Reproducibility and feasibility are demonstrated in volunteers as well as subjects over a wide range of functional capacities.
Introdução
O objetivo deste trabalho é apresentar um método reprodutível para medir de forma não invasiva in vivo a função mitocondrial do músculo esquelético em indivíduos que possuem uma ampla gama de habilidades. disfunção mitocondrial aberrante é uma indicação de uma ampla gama de síndromes metabólicas e doenças genéticas, a partir de condições comuns, tais como o envelhecimento e a diabetes de doenças raras tais como a ataxia de Friedreich.
Síndrome metabólica e disfunção mitocondrial
A síndrome metabólica foi mostrado para interromper a função mitocondrial, deprimir OXPHOS músculo esquelético, e levar ao armazenamento de lípidos ectópica em músculos esqueléticos 1, 2. Organelas tão crítica que regulam a homeostase metabólica e energia, as mitocôndrias são implicados na fisiopatologia da obesidade 3, 4, 5 resistência à insulina , Diabetes mellitus tipo 2 (DM2) 6, 7, relacionada com a diabetes micro- 8, 9, 10, 11 e complicações macrovasculares 12, 13 e doença hepática gordurosa não alcoólica (DHGNA) 14, 15, 16, entre outros .Insulin resistência é caracterizada por profundas mudanças na atividade mitocondrial do músculo esquelético, incluindo diminuição da taxa mitocondrial do ácido tricarboxílico (TCA) de fluxo, taxa de síntese de ATP e citrato sintase e NADH: O 2 actividade de oxidoredutase 5. Uma hipótese é que estas alterações pode ser devido à acumulação de ácidos gordos livres (FFA) metabólitos no músculo, que são marcadamente aumentada durante a obesidade e outras obesidade-rdoenças exaltados 2, 17. A exposição de músculo de FFAs elevados e intermediários lipídicos podem diminuir a expressão de genes na via oxidativa lipídica, bem como o ciclo de TCA e de electrões da cadeia de transporte de carga (ETC) 18. Esta redução de capacidade OXPHOS músculo esquelético mitocondrial na definição de uma sobrecarga lipídica é acompanhado por um declínio no quantitativa (conteúdo e biogênese das mitocôndrias) 19 e função qualitativa das mitocôndrias do músculo esquelético 20. Expondo o músculo esquelético e os miócitos para FFAs conduz a resistência severa à insulina, e aumento da absorção de FFA no músculo é associado à resistência à insulina em humanos e roedores 21. A ceramida intermediários lipídicos e diacilglicerol (DAG) foram mostrados para inibir directamente a via de sinalização de insulina, alterando a actividade de cinases, tais como a proteína-quinase C e Protein quinase B 21. Consequentemente, as moléculas derivadas de lípidos parecem desempenhar um papel importante no desenvolvimento de resistência à insulina muscular esquelético e DMT2. No entanto, ainda não está claro se as mudanças na capacidade mitocondrial são uma causa ou uma consequência da resistência à insulina 22.
Ataxia e Disfunção Mitocondrial de Friedrich
Diminuição OXPHOS também podem surgir de defeitos genéticos. Ataxia de Friedrich (FA), a forma mais comum de ataxia hereditária, é uma desordem genética causada por uma mutação no frataxin gene (FXN), resultando na acumulação de ferro intra-mitocondrial, a produção de espécies de oxigénio reactivo, e anomalias da fosforilação oxidativa 23, 24, 25, 26. Esta importante descoberta conduziu ao desenvolvimento de terapias específicas, which objectivo de melhorar a função mitocondrial ao nível sub-celular. Apesar deste conhecimento, tem havido desenvolvimento limitada in vivo, os biomarcadores reprodutíveis para FA investigação clínica. Na verdade, uma barreira crítica na avaliação eficaz de terapias-alvo em FA é a incapacidade de acompanhar as mudanças na função mitocondrial. medidas funcionais atuais, por exemplo, pode identificar diminuição do débito cardíaco; no entanto, eles são incapazes de determinar o nível em que a disfunção ocorre (Figura 1). O desenvolvimento de um marcador fiável da função mitocondrial que pode ser utilizado para identificar e avaliar a progressão da doença na ataxia de Friedrich é crucial para avaliar o impacto mecânico relevante de terapias específicas.
OXPHOS prejudicada e disfunção cardíaca
função mitocondrial aberrante, adquirida ou genética, pode contribuir para o desenvolvimento ou progressão de cardidisfunção AC. Nas condições de sobrecarga de pressão e a insuficiência cardíaca, a energia primária preferência substrato interruptores de FFA em glicose. Isto é associado com diminuição da atividade ETC e fosforilação oxidativa 27. A fisiopatologia do bioenergética mitocondrial na disfunção cardíaca pode ser diferente, consoante a origem primária da lesão mitocondrial. Diabetes e síndrome metabólica resulta em anormalidades mitocondriais em miocárdio, tais como biogênese prejudicada e metabolismo de ácidos graxos, que levam a flexibilidade reduzida substrato, a eficiência energética, e, eventualmente, disfunção diastólica 28, 29. Em FA, por outro lado, uma deficiência resulta em acumulação frataxin ferro mitocondrial significativa em cardiomiócitos 30, 31. Acumulação de ferro conduz à produção de radicais livres através da reacção de Fenton 32 </ Sup> e aumenta a chance de danos livre de cardiomiócitos induzida por radicais. Acúmulo de ferro intra-mitocondrial está também associada a um aumento da sensibilidade ao estresse oxidativo e uma capacidade oxidativa reduzida 30, 31. Acúmulo de ferro e subsequente função mitocondrial aberrante, devido à deficiência de frataxina, pode, portanto, ser responsável por a energética cardíaca comprometida e cardiomiopatia observadas na FA 33, 34. É também interessante notar que a capacidade oxidativa reduzida em mitocôndrias do músculo esquelético é paralela à intolerância ao exercício e a redução da capacidade metabólica na insuficiência cardíaca (HF) 35. Medição da capacidade OXPHOS músculo esquelético, tal como aqui descrito, é facilmente implementável e robusto; juntamente com o significado da OXPHOS músculo esquelético em HF, estas características fazem dele um biomarcador atraente em estudos abrangentes de ouvirdoença de t 36.
OXPHOS prejudicada ea disfunção cardíaca que o acompanha não é um aspecto inconsequente de metabólica e doença mitocondrial. Indivíduos com diabetes e doença metabólica estão em maior risco de desenvolver doença cardiovascular e têm excesso de mortalidade após infarto do miocárdio (MI) 37, 38, 39, 40, 41; mais da metade dos indivíduos FA tem cardiomiopatia, e muitos morrem de arritmia cardíaca ou insuficiência cardíaca 42. Assim, a quantificação de OXPHOS reduzida não só poderia permitir a detecção e tratamento da disfunção cardíaca precoce, mas ele também pode aliviar um fardo clínico importante nestas doenças.
terapias direcionadas para aumentar diretamente a capacidade OXPHOS é uma área promissora para melhorar o tratamento de assuntos, wheterap a causa de disfunção metabólica é genética ou adquirida. Actualmente, o desenvolvimento de novas drogas que aliviam tanto a função mitocondrial anormal 43 ou corrigir o defeito genético primário 44 pode melhorar a característica bioenergética demente de FA alvo. No caso de disfunção mitocondrial adquirida, o aumento da actividade física pode melhorar a função mitocondrial 45, 46, 47.
31 Fósforo espectroscopia de ressonância magnética como biomarcador não invasivo da função mitocondrial
Independentemente da terapia testada, uma integrada na avaliação in vivo da bioenergética do músculo esquelético é uma ferramenta fundamental para avaliar o impacto das intervenções dirigidas, especialmente em indivíduos com intolerância ao exercício grave ou incapacidade de se submeter metabo convencionaltestes lic. Espectroscopia de ressonância magnética sintonizado de fósforo (31 PMRS), um núcleo endógena encontrado em vários substratos de alta energia no interior das células em todo o corpo, tem sido utilizada para quantificar a capacidade oxidativa mitocondrial usando uma variedade de abordagens, incluindo em-íman protocolos de exercício de recuperação e estimulação muscular protocolos 48. Os protocolos de exercícios de recuperação dependem de uma variedade de aparelhos que variam em complexidade de ergômetros MRI-compatíveis que regulam e medir carga de trabalho para simples configurações de correias e almofadas permitindo tipo explosão resistiva e exercício quase estático. Um dos principais objetivos de qualquer um destes protocolos é produzir um desequilíbrio de energia para os quais a demanda por trifosfato de adenosina (ATP) é inicialmente recebida através da quebra enzimática da fosfocreatina (PCr), através da creatina quinase reacção 49. Após interrupção do exercício, a taxa de produção de ATP é dominado por Pho oxidativosphorylation e representa o máximo de capacidade in vivo das mitocôndrias 50. Além disso, OXPHOS durante a recuperação pós-exercício pode ser descrita por uma reação velocidade de primeira ordem 51. A recuperação pós-exercício da PCr pode, portanto, ser quantificada pela instalação de uma constante de tempo exponencial (τ PCr), com menores valores de τ PCr representando maior capacidade para a síntese de ATP oxidativo. Esforços significativos foram feitos para validar 31 PMRS contra ex vivo e medidas mais diretas de OXPHOS e demonstrar o potencial de aplicabilidade clínica desta técnica 52, 53, 54, 55.
Notavelmente, o protocolo descrito no presente trabalho pode ser implementado em scanners clinicamente disponíveis, e isto tem sido amplamente validado como um biomarcador não invasivo Ofunção mitocondrial f 56. No entanto, um protocolo PMRS exercício 31 otimizado para aplicação em indivíduos com diferentes gravidades do comprometimento neuromuscular ou mobilidade não tem sido bem estabelecida 57. Um bem definida, protocolo de exercício amplamente aplicável e 31 PMRS técnica seria particularmente útil na avaliação de doenças com alterações fundamentais na função mitocondrial.
Vários estudos anteriores têm explorado as aplicações de técnicas não invasivas para quantificar a função mitocondrial em indivíduos. Por exemplo, estas técnicas têm mostrado OXPHOS alterada em indivíduos com diabetes tipo 2 36. Lodi et ai. primeiro testada a viabilidade das técnicas PMRs em indivíduos com FA e verificou que 1) o defeito genético fundamental na FA prejudica OXPHOS músculo esquelético e 2) o número de tripleto GAA repete é inversamente proporcional ao músculo esquelético óXPHOS 33. Mais recentemente, Nachbauer et ai. PMRS usado como uma medida de desfecho secundário em um teste de drogas FA com 7 indivíduos. PCr tempos de recuperação foram significativamente mais longa em indivíduos em relação aos controles, reafirmando trabalho anterior de Lodi e indicando que os efeitos da expressão aberrante frataxin em FA pode resultar em um declínio na capacidade mitocondrial que é detectável através de técnicas PMRs 58.
Métodos confiáveis para definir adequadamente em função do músculo esquelético vivo em um, o custo-benefício, e de maneira reprodutível viável são fundamentais para melhorar os resultados dos pacientes em uma série de doenças que afetam a função mitocondrial.
Este trabalho descreve um procedimento robusto para a obtenção da capacidade oxidativa máxima vivo do músculo esquelético usando 31 PMRS. O protocolo de exercício de imã em é bem tolerado por indivíduos que abrangem uma ampla gama de física e functional habilidades e oferece uma configuração simplificada assunto usando o equipamento barato e amplamente disponível.
Protocolo
Este protocolo é aprovado pelo e segue as diretrizes da Ohio State University Institutional Review Board para a investigação seres humanos. É extremamente importante que todos os procedimentos que envolvem equipamentos MR são realizadas por pessoal com formação adequada que aderiram aos mais altos padrões de segurança MR 59.
1. Materiais e Preparação
- Certifique-se de que todos os materiais necessários estão disponíveis antes do experimento (Figura 2).
- Ligue a bobina 31 P no conector bobina em-quadro no fim da mesa de exame mais próximo para o orifício. Coloque uma grande almofada de espuma triângulo perto da cabeceira da mesa de exames do MR, mas não diretamente sobre a bobina 31 P. Coloque um descanso de cabeça na outra extremidade da mesa de exame MR, mais distante do furo, para o conforto do sujeito.
2. Objecto de posicionamento (Figura 3a)
- Instrua o assunto mentir supino, pésprimeiro na mesa do MR. Coloque uma almofada de espuma sob os joelhos para apoiar a perna numa posição parcialmente flectida.
- Posicione o motivo perto do lado direito da tabela (o direito do sujeito), a fim de centralizar a coxa esquerda tão de perto ao isocentro ímã possível, garantindo, assim, a homogeneidade B0 ideal no músculo da coxa em exame. Fornecer o assunto com tampões de ouvido e / ou fones de ouvido.
- Posicione a bobina RF 31 P no quadríceps esquerdo aproximadamente no ponto médio entre a patela ea cabeça femoral, e segura para a perna utilizando cintas. Coloque a bobina ao longo da porção lateral da perna, acima do vasto lateral.
- Fixar o óleo para bebé para o aspecto medial da coxa com as mesmas tiras utilizadas para fixar a bobina para a perna. Isso facilita a localização de digitalização.
- Ligam-se as pernas do sujeito em conjunto com uma cinta colocada abaixo da bobina e acima do joelho. Fixe as pernas do sujeito para a mesa de RM com stra adicionalps, um acima do joelho e um meio caminho entre o joelho eo tornozelo.
- Use o guia de luz laser para delinear o centro da bobina e mover a tabela para o isocentro ímã usando este centragem marco.
Protocolo 3. Exercício
- Explique ao assunto que o protocolo de exercício consiste em três fases: uma fase inicial, linha de base; um curto, fase de exercício intenso; e uma fase de recuperação.
- Instrua o assunto para permanecer imóvel e relaxar seus músculos da perna durante a linha de base e recuperação fases da aquisição espectroscopia, a fim de minimizar artefatos de movimento.
- Fornecer uma contagem regressiva para o assunto indicando o início do exercício. Neste ponto, tem o objecto iniciar joelho flexão / extensão tão vigorosamente e tão rapidamente quanto possível contra a resistência das tiras.
NOTA: Os músculos do quadríceps são usados para mover a perna esquerda para cima e para baixo, até que seja instruído a parar. - Terminar o exercício depois de uma queda de 30%na altura do pico de PCR.
- Observe a altura do pico PCr na janela do visualizador de aquisição, e também visualizá-lo após a conclusão da sequência de exercícios.
NOTA: A orientação geral é que uma queda de aproximadamente 30% em PCR altura do pico corresponde a um pico Pi que é 50% da altura do pico de PCR. Se o esgotamento PCr não está ocorrendo rapidamente o suficiente para atingir uma queda de 30% durante a fase de exercício do exame, incentivar o assunto para chutar mais difícil ou mais rápido durante o exercício.
NOTA: Cessação de exercício é determinado pelo monitoramento da altura do pico PCr e duração do exercício. Isso pode resultar em um pouco diferentes durações de exercício em pacientes diferentes e pode ser contabilizado na análise.
- Observe a altura do pico PCr na janela do visualizador de aquisição, e também visualizá-lo após a conclusão da sequência de exercícios.
4. Protocolo de digitalização
- Adquirir um localizador tri-plano para verificar o posicionamento assunto apropriado e identificar a localização da bobina 31 P.
NOTA: A sequência de localizador inicia-se automaticamente e centraliza no Índicoposição ated usando o guia de luz laser (passo 2.9) - Adquirir um segundo localizador tri-avião.
- Abra a vista fatia nas primeiras imagens localizador Tri plano.
NOTA: Este processo pode ser diferente para diferentes sistemas de software e hardware. - Center e girar a orientação fatia clicando com o botão esquerdo e segurando o grupo fatia. Rode o grupo fatia. Assegure-se que a orientação final de fatias coincide com a posição do óleo para bebé.
- Na janela de rotina a sequência, aumentar o número de fatias para cobrir toda a perna na axial e imagens sagital (Figura 3B).
- Abra a vista fatia nas primeiras imagens localizador Tri plano.
- 31 P espectroscopia sequência:
- Utilize os seguintes parâmetros de sequência não localizadas pulse-Adquirir: TR: 1000 ms; TE: 0,34 mseg; largura espectral: 2.000 Hz; flip ângulo: 90 graus; pontos de dados adquiridos: 1.024; 4 médias resultantes em uma resolução de tempo de um espectro de cada 6 segundos.
- 31 P calço box colocação:
- Usando um mouse, arrastar o segundo imagens triplane localizador na janela de visualização na parte superior da tela. Arraste a sequência de espectroscopia na janela de protocolo e clique duas vezes para abrir.
- Use a barra de ferramenta de posição para visualizar a voxel calço (selecione o retângulo preto com linhas horizontais). Depois de selecionar essa opção, observar uma caixa verde nas imagens localizador.
NOTA: Este é o voxel calço. - Mova o voxel clicando com o botão esquerdo e segurando o voxel no centro. Alterar o tamanho e rodar a orientação do voxel clicando com o botão esquerdo e segurando o voxel no canto da caixa. Coloque a caixa de calço, de modo a garantir a homogeneidade campo B0 directamente abaixo da bobina e paralela ao plano dos quadríceps.
NOTA: Este é adequada para garantir calços dentro da região sensível sob a bobina, a qual é o volume de tecido directamente abaixo do centro da bobina. - Use as imagens tri-plano localizador para identificar o sensitive região da bobina e ajustar a caixa de calço para englobar esta região dentro do músculo quadriceps.
NOTA: A caixa de calço pode ser maior do que a verdadeira cobertura da bobina de superfície, a fim de garantir a homogeneidade B0 dentro da aquisição de dados voxel (Figura 3c). - Aquisição de teste 31 P:
- Abra a janela do visualizador de aquisição e selecione o ícone de cabeça na barra de ferramentas de aquisição. Isto irá permitir a visualização da aquisição espectroscopia em tempo real.
- Após a colocação do calço voxel 31P, executar a seqüência para obter um único espectro, clicando no botão "Run" na parte superior da janela do protocolo.
- Examinar a qualidade de calços B0. Observar o espectro resultante na janela de aquisição. Observar um pico de PCr proeminente centrado em 0 ppm e nenhum ruído significativa (Figura 4a, à esquerda).
NOTA: Solução de problemas: Se o espectro parece ter ruído, verifique se a caixa de calço é colocado dentro do músculo. de Anúnciosapenas o tamanho e a posição da caixa de calço para melhorar a relação sinal-ruído. Repetir o teste de aquisição, conforme necessário. - A fim de ver a altura do pico PCr, abrir o espectro na ferramenta de espectroscopia ( "Aplicações" → "Espectroscopia"). Abra a pasta do paciente (ícone da árvore de pastas), selecione a verificação adequada, e clique duas vezes para carregar o espectro.
- imagem T1 pré-exercício:
- Obter uma imagem em T1 axial de corte único, no centro de uma bobina.
- 31 P aquisição pré-exercício:
- Copie a sequência do passo 4.4 (que produziu a melhor qualidade espectral) clicando com o botão esquerdo e arrastando a sequência na janela do protocolo. Use esta sequência para todas as medições posteriores.
- Na janela de rotina a sequência, aumentar o número de medições de 1 a 10. selecione Executar para adquirir 10 medições enquanto o assunto está em repouso.
- 31 </ Sup> P aquisição de exercício:
NOTA: Tome nota cuidadosa dos horários de início e de exercício final, como isso vai ser importante para a análise.- Resto: Aplicar as configurações de calços da verificação anterior e definir a sequência de adquirir 20 medições. Instrua o assunto para começar a retroceder após uma contagem regressiva. Instrua o assunto a permanecer em repouso por 2 medições.
- Exercício: Peça ao sujeito para realizar o exercício de extensão do joelho para ~ 30 segundos (ou o tempo necessário para atingir uma diminuição de 30% no pico de amplitude PCr). Após o sujeito consegue esgotamento PCr suficiente, pedir-lhes para descansar.
- 31 P pós-exercício aquisições:
- Adquirir um adicional de 20 medições em repouso. Certifique-se de que as aquisições pós-exercício começará imediatamente após a sequência de exercícios, sem pausa ou calços (Figura 4a, à direita).
NOTA: A subdivisão deste período de recuperação em duas aquisições separadas permite a análise do initial 20 espectros dinâmica durante a aquisição do espectros de segunda 20 dinâmico, permitindo que o operador evite aquisição do período de recuperação completa se o exercício necessita de ser repetida.
- Adquirir um adicional de 20 medições em repouso. Certifique-se de que as aquisições pós-exercício começará imediatamente após a sequência de exercícios, sem pausa ou calços (Figura 4a, à direita).
- Assegurar a qualidade do exercício:
- Comparar as alturas de pico de PCr no início e no final do exercício. sessões de exercícios de alta qualidade resultar em uma diminuição ~ 30% na concentração de PCR.
- Verificar que a altura do pico de PCR é a mesma no início do repouso e no final de recuperação (tipicamente, <é desejada diferença de 10%). Isto assegura que não havia perda desprezível de homogeneidade campo durante a aquisição.
NOTA: Se a repartição PCr é insuficiente, ou se houve uma perda de homogeneidade campo, em seguida, repita a parte de exercícios / recuperação do exame (tendo o cuidado de evitar a fadiga), certifique-se de que a bobina e alças estão bem presos, e estender a duração do exercício e / ou incentivar o exercício mais vigoroso (Figura 4b).
NÃOE: Uma comparação das imagens obtidas nas etapas 6 e 11 permite um passo de controle de qualidade adicional para visualizar qualquer deslocamento da coxa e bobina em função do exercício, garantindo assim que o movimento mínima ocorreu durante o protocolo, o que poderia afetar de forma significativa os dados adquiridos .
- Seguindo pós-exercício de imagens T1, repita o pré-exercício axial imagem T1 (passo 4.5) usando os mesmos parâmetros de aquisição.
- Em adição à depleção suficiente de PCr, medir o pH exercício final para garantir que o exercício não induziu a acidose do músculo.
- Executar esta medindo a mudança química entre Pi e PCR (õP i) e usando a seguinte equação 60:
pH = 6,77 + log [(õP i -3,29) / (5,68-õP i)]
NOTA: O pH deve permanecer superior a 6,8 61. Se a desagregação de PCR é suficiente, mas o pH é demasiado baixo, repetir a sessão de exercício por um curtoer duração e / ou com uma intensidade diminuiu.
- Salvando dados:
- Salve todos os espectros adquiridos como arquivos DICOM e exportá-los para processamento usando JMRUI.
- Se estiver usando um scanner, selecione todas as aquisições de espectroscopia na janela "Navigator".
- Em "Aplicações", selecione "Ferramentas Dicom" → "Export MR espectroscopia," e salvar os arquivos DICOM (* .dcm) para C: / user / MedCom / temp / CDROFFLINE
(A ferramenta escolhe automaticamente a localização). - Em "Transferência", selecione "Exportar para Off-line." Guardar para o local desejado.
5. Processamento e Análise de Dados 62
- Analisar o MR espectros com software JMRUI livremente disponível (versão 5.2; http://www.jmrui.eu/).
- Apodize e fase de deslocar o espectro de assegurar a uniformidade sobre todos os pontos de tempo adquiridas (Figura 5). O pico PCr será centrado umt 0 ppm no espectro.
- Usar o algoritmo AMARES incorporada para quantificar a amplitude do pico de PCR, em cada espectro adquirido. A amplitude de pico representa a concentração da PCR dentro da região sensível da bobina de superfície nesse ponto de tempo particular.
- No software computacional, traçar as concentrações de PCR como uma função do tempo de aquisição. Usando o built-in ferramenta de ajuste de curva software computacional, ajustar os dados do período de recuperação de PCR para a seguinte equação 52, 63:
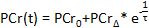
- Grave os valores da PCr linha de base (
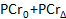 ), O menor PCR (
), O menor PCR (  ), E o tempo de recuperação (
), E o tempo de recuperação ( 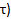 .
. - Assegurar que as condições apropriadas forem atendidas durante o exercise sessão através do cálculo da depleção de PCR, a diferença percentual entre a linha de base de PCr e o menor PCR. sessões de exercício ideais resultar numa 20 - esgotamento de 50%.
NOTA: A qualidade do ajustamento de curva pode ser assegurada por meio da verificação de que o valor de R2 é maior do que 0,75. Valores de R 2 são calculados automaticamente pelo software de adaptação.
Resultados
Estudo reprodutibilidade
Seis voluntários (4 homens e 2 mulheres, idade média: 24,5 ± 6,2 anos) com nenhum coração auto-reportados, metabólica ou doença mitocondrial foram submetidos a sessões do exercício técnica e de imagem 31 PMRS descrito em 2 dias diferentes dentro de 1 semana para avaliar técnica reprodutibilidade (Figura 6a). Os estudos realizados em voluntários n...
Discussão
Este documento descreve um protocolo padrão para 31 PMRS exame que permite a medição de série e não-invasivo in vivo da função mitocondrial do músculo esquelético. O protocolo mantém apelo considerável quando se considera a amplitude das investigações que visam a crescente carga de síndrome metabólica e sua morbidade e mortalidade resultante. Este protocolo 31 PMRS requer uma quantidade mínima de tempo scanner e pode ser incorporado em investigações metabólicas abrangent...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported in part by a Davis Heart and Lung Research Institute Trifit Award, as well as by the Intramural Research Program of the NIH National Institute on Aging.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 T MR Scanner | Siemens | manufacturer will not affect results | |
| 10 cm 31P transmit-receive coil, 1.5T compatible | PulseTeq | manufacturer will not affect results | |
| 3 fl oz Baby Oil | Johnson & Johnson | manufacturer will not affect results | |
| Foam triangle cushion (Knee) | Siemens | manufacturer will not affect results | |
| (3) plastic buckle resistive straps; table to table | Siemens | manufacturer will not affect results | |
| (1) plastic buckle resistive strap; self-connecting | Siemens |
Referências
- Eckel, R. H., Alberti, K. G., Grundy, S. M., Zimmet, P. Z. The metabolic syndrome. Lancet. 375 (9710), 181-183 (2010).
- Shulman, G. I. Ectopic fat in insulin resistance, dyslipidemia, and cardiometabolic disease. N Engl J Med. 371 (12), 1131-1141 (2014).
- Holmstrom, M. H., Iglesias-Gutierrez, E., Zierath, J. R., Garcia-Roves, P. M. Tissue-specific control of mitochondrial respiration in obesity-related insulin resistance and diabetes. Am J Physiol Endocrinol Metab. 302 (6), 731-739 (2012).
- Jheng, H. F., et al. Mitochondrial fission contributes to mitochondrial dysfunction and insulin resistance in skeletal muscle. Mol Cell Biol. 32 (2), 309-319 (2012).
- Petersen, K. F., et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance. Science. 300 (5622), 1140-1142 (2003).
- Kelley, D. E., He, J., Menshikova, E. V., Ritov, V. B. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes. Diabetes. 51 (10), 2944-2950 (2002).
- Liu, R., et al. Impaired mitochondrial dynamics and bioenergetics in diabetic skeletal muscle. PLoS One. 9 (3), 92810 (2014).
- Ha, H., Hwang, I. A., Park, J. H., Lee, H. B. Role of reactive oxygen species in the pathogenesis of diabetic nephropathy. Diabetes Res Clin Pract. 82, 42-45 (2008).
- Akude, E., et al. Diminished superoxide generation is associated with respiratory chain dysfunction and changes in the mitochondrial proteome of sensory neurons from diabetic rats. Diabetes. 60 (1), 288-297 (2011).
- Fernyhough, P. Mitochondrial dysfunction in diabetic neuropathy: a series of unfortunate metabolic events. Curr Diab Rep. 15 (11), 89 (2015).
- Chen, M., Wang, W., Ma, J., Ye, P., Wang, K. High glucose induces mitochondrial dysfunction and apoptosis in human retinal pigment epithelium cells via promoting SOCS1 and Fas/FasL signaling. Cytokine. 78, 94-102 (2016).
- Blake, R., Trounce, I. A. Mitochondrial dysfunction and complications associated with diabetes. Biochim Biophys Acta. 1840 (4), 1404-1412 (2014).
- Rains, J. L., Jain, S. K. Oxidative stress, insulin signaling, and diabetes. Free Radic Biol Med. 50 (5), 567-575 (2011).
- Serviddio, G., et al. Mitochondrial involvement in non-alcoholic steatohepatitis. Mol Aspects Med. 29 (1-2), 22-35 (2008).
- Perez-Carreras, M., et al. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology. 38 (4), 999-1007 (2003).
- Garcia-Ruiz, I., et al. Mitochondrial complex I subunits are decreased in murine nonalcoholic fatty liver disease: implication of peroxynitrite. J Proteome Res. 9 (5), 2450-2459 (2010).
- Patti, M. E., Corvera, S. The role of mitochondria in the pathogenesis of type 2 diabetes. Endocr Rev. 31 (3), 364-395 (2010).
- Muoio, D. M., Newgard, C. B. Obesity-related derangements in metabolic regulation. Annu Rev Biochem. 75, 367-401 (2006).
- Bonnard, C., et al. Mitochondrial dysfunction results from oxidative stress in the skeletal muscle of diet-induced insulin-resistant mice. J Clin Invest. 118 (2), 789-800 (2008).
- Jheng, H. F., Huang, S. H., Kuo, H. M., Hughes, M. W., Tsai, Y. S. Molecular insight and pharmacological approaches targeting mitochondrial dynamics in skeletal muscle during obesity. Ann N Y Acad Sci. 1350, 82-94 (2015).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends Endocrinol Metab. 23 (8), 391-398 (2012).
- Montgomery, M. K., Turner, N. Mitochondrial dysfunction and insulin resistance: an update. Endocr Connect. 4 (1), 1-15 (2015).
- Martelli, A., Puccio, H. Dysregulation of cellular iron metabolism in Friedreich ataxia: from primary iron-sulfur cluster deficit to mitochondrial iron accumulation. Front Pharmacol. 5, 130 (2014).
- Campuzano, V., et al. Frataxin is reduced in Friedreich ataxia patients and is associated with mitochondrial membranes. Hum Mol Genet. 6 (11), 1771-1780 (1997).
- Calabrese, V., et al. Oxidative stress, mitochondrial dysfunction and cellular stress response in Friedreich's ataxia. J Neurol Sci. 233 (1-2), 145-162 (2005).
- Ristow, M., et al. Frataxin activates mitochondrial energy conversion and oxidative phosphorylation. Proc Natl Acad Sci U S A. 97 (22), 12239-12243 (2000).
- Ardehali, H., et al. Targeting myocardial substrate metabolism in heart failure: potential for new therapies. Eur J Heart Fail. 14 (2), 120-129 (2012).
- Ren, J., Pulakat, L., Whaley-Connell, A., Sowers, J. R. Mitochondrial biogenesis in the metabolic syndrome and cardiovascular disease. J Mol Med (Berl). 88 (10), 993-1001 (2010).
- Marin-Garcia, J., Goldenthal, M. J. Understanding the impact of mitochondrial defects in cardiovascular disease: a review. J Card Fail. 8 (5), 347-361 (2002).
- Babcock, M., et al. Regulation of mitochondrial iron accumulation by Yfh1p, a putative homolog of frataxin. Science. 276 (5319), 1709-1712 (1997).
- Foury, F., Cazzalini, O. Deletion of the yeast homologue of the human gene associated with Friedreich's ataxia elicits iron accumulation in mitochondria. FEBS Lett. 411 (2-3), 373-377 (1997).
- Wardman, P., Candeias, L. P. Fenton chemistry: an introduction. Radiat Res. 145 (5), 523-531 (1996).
- Lodi, R., et al. Cardiac energetics are abnormal in Friedreich ataxia patients in the absence of cardiac dysfunction and hypertrophy: an in vivo 31P magnetic resonance spectroscopy study. Cardiovasc Res. 52 (1), 111-119 (2001).
- Raman, S. V., et al. Impaired myocardial perfusion reserve and fibrosis in Friedreich ataxia: a mitochondrial cardiomyopathy with metabolic syndrome. Eur Heart J. 32 (5), 561-567 (2011).
- Kitzman, D. W., et al. Skeletal muscle abnormalities and exercise intolerance in older patients with heart failure and preserved ejection fraction. Am J Physiol Heart Circ Physiol. 306 (9), 1364-1370 (2014).
- Scheuermann-Freestone, M., et al. Abnormal cardiac and skeletal muscle energy metabolism in patients with type 2 diabetes. Circulation. 107 (24), 3040-3046 (2003).
- Allcock, D. M., Sowers, J. R. Best strategies for hypertension management in type 2 diabetes and obesity. Curr Diab Rep. 10 (2), 139-144 (2010).
- Katzmarzyk, P. T., Church, T. S., Janssen, I., Ross, R., Blair, S. N. Metabolic syndrome, obesity, and mortality: impact of cardiorespiratory fitness. Diabetes Care. 28 (2), 391-397 (2005).
- Wang, J., et al. The metabolic syndrome predicts cardiovascular mortality: a 13-year follow-up study in elderly non-diabetic Finns. Eur Heart J. 28 (7), 857-864 (2007).
- Zambon, S., et al. Metabolic syndrome and all-cause and cardiovascular mortality in an Italian elderly population: the Progetto Veneto Anziani (Pro.V.A) Study. Diabetes Care. 32 (1), 153-159 (2009).
- Malik, S., et al. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation. 110 (10), 1245-1250 (2004).
- Ropper, A. H., Samuels, M. A. . Adams and Victor's Principles of Neurology. 9 edn. , (2009).
- Abeti, R., et al. Targeting lipid peroxidation and mitochondrial imbalance in Friedreich's ataxia. Pharmacol Res. 99, 344-350 (2015).
- Li, Y., et al. Excision of Expanded GAA Repeats Alleviates the Molecular Phenotype of Friedreich's Ataxia. Mol Ther. 23 (6), 1055-1065 (2015).
- Toledo, F. G., Goodpaster, B. H. The role of weight loss and exercise in correcting skeletal muscle mitochondrial abnormalities in obesity, diabetes and aging. Mol Cell Endocrinol. 379 (1-2), 30-34 (2013).
- Oldridge, N. B., Guyatt, G. H., Fischer, M. E., Rimm, A. A. Cardiac rehabilitation after myocardial infarction. Combined experience of randomized clinical trials. JAMA. 260 (7), 945-950 (1988).
- O'Connor, G. T., et al. An overview of randomized trials of rehabilitation with exercise after myocardial infarction. Circulation. 80 (2), 234-244 (1989).
- Ryan, T. E., Brizendine, J. T., McCully, K. K. A comparison of exercise type and intensity on the noninvasive assessment of skeletal muscle mitochondrial function using near-infrared spectroscopy. J Appl Physiol (1985). 114 (2), 230-237 (2013).
- Wallimann, T. Bioenergetics. Dissecting the role of creatine kinase. Curr Biol. 4 (1), 42-46 (1994).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. Am J Physiol Regul Integr Comp Physiol. 296 (1), 161-170 (2009).
- Korzeniewski, B., Rossiter, H. B. Each-step activation of oxidative phosphorylation is necessary to explain muscle metabolic kinetic responses to exercise and recovery in humans. J Physiol. 593 (24), 5255-5268 (2015).
- Meyer, R. A. A linear model of muscle respiration explains monoexponential phosphocreatine changes. Am J Physiol. 254 (4), 548-553 (1988).
- McCully, K. K., Fielding, R. A., Evans, W. J., Leigh, J. S., Posner, J. D. Relationships between in vivo and in vitro measurements of metabolism in young and old human calf muscles. J Appl Physiol (1985). 75 (2), 813-819 (1993).
- Layec, G., Haseler, L. J., Richardson, R. S. Reduced muscle oxidative capacity is independent of O2 availability in elderly people. Age (Dordr). 35 (4), 1183-1192 (2013).
- Larson-Meyer, D. E., Newcomer, B. R., Hunter, G. R., Hetherington, H. P., Weinsier, R. L. 31P MRS measurement of mitochondrial function in skeletal muscle: reliability, force-level sensitivity and relation to whole body maximal oxygen uptake. NMR Biomed. 13 (1), 14-27 (2000).
- Kemp, G. J., Ahmad, R. E., Nicolay, K., Prompers, J. J. Quantification of skeletal muscle mitochondrial function by 31P magnetic resonance spectroscopy techniques: a quantitative review. Acta Physiol (Oxf). 213 (1), 107-144 (2015).
- Lynch, D. R., et al. Near infrared muscle spectroscopy in patients with Friedreich's ataxia. Muscle Nerve. 25 (5), 664-673 (2002).
- Nachbauer, W., et al. Bioenergetics of the calf muscle in Friedreich ataxia patients measured by 31P-MRS before and after treatment with recombinant human erythropoietin. PLoS One. 8 (7), 69229 (2013).
- Kanal, E., et al. ACR guidance document on MR safe practices: 2013. J Magn Reson Imaging. 37 (3), 501-530 (2013).
- Petroff, O. A., Ogino, T., Alger, J. R. High-resolution proton magnetic resonance spectroscopy of rabbit brain: regional metabolite levels and postmortem changes. J Neurochem. 51 (1), 163-171 (1988).
- Jubrias, S. A., Crowther, G. J., Shankland, E. G., Gronka, R. K., Conley, K. E. Acidosis inhibits oxidative phosphorylation in contracting human skeletal muscle in vivo. J Physiol. 553 (2), 589-599 (2003).
- Layec, G., et al. Reproducibility assessment of metabolic variables characterizing muscle energetics in vivo: A 31P-MRS study. Magn Reson Med. 62 (4), 840-854 (2009).
- Iotti, S., Lodi, R., Frassineti, C., Zaniol, P., Barbiroli, B. In vivo assessment of mitochondrial functionality in human gastrocnemius muscle by 31P MRS. The role of pH in the evaluation of phosphocreatine and inorganic phosphate recoveries from exercise. NMR Biomed. 6 (4), 248-253 (1993).
- Wren, T. A., Bluml, S., Tseng-Ong, L., Gilsanz, V. Three-point technique of fat quantification of muscle tissue as a marker of disease progression in Duchenne muscular dystrophy: preliminary study. AJR Am J Roentgenol. 190 (1), 8-12 (2008).
- Milani, R. V., Lavie, C. J., Mehra, M. R., Ventura, H. O. Understanding the basics of cardiopulmonary exercise testing. Mayo Clin Proc. 81 (12), 1603-1611 (2006).
- Wust, R. C., van der Laarse, W. J., Rossiter, H. B. On-off asymmetries in oxygen consumption kinetics of single Xenopus laevis skeletal muscle fibres suggest higher-order control. J Physiol. 591 (3), 731-744 (2013).
- Ryan, T. E., Brophy, P., Lin, C. T., Hickner, R. C., Neufer, P. D. Assessment of in vivo skeletal muscle mitochondrial respiratory capacity in humans by near-infrared spectroscopy: a comparison with in situ measurements. J Physiol. 592 (15), 3231-3241 (2014).
- Hamaoka, T., McCully, K. K., Niwayama, M., Chance, B. The use of muscle near-infrared spectroscopy in sport, health and medical sciences: recent developments. Philos Trans A Math Phys Eng Sci. 369, 4591-4604 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados