È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fosforo-31 spettroscopia di risonanza magnetica: uno strumento per misurare
In questo articolo
Riepilogo
This work demonstrates the feasibility of an in vivo phosphorus-31 magnetic resonance spectroscopy (31PMRS) technique to quantify mitochondrial oxidative phosphorylation (OXPHOS) capacity in human skeletal muscle.
Abstract
Skeletal muscle mitochondrial oxidative phosphorylation (OXPHOS) capacity, which is critically important in health and disease, can be measured in vivo and noninvasively in humans via phosphorus-31 magnetic resonance spectroscopy (31PMRS). However, the approach has not been widely adopted in translational and clinical research, with variations in methodology and limited guidance from the literature. Increased optimization, standardization, and dissemination of methods for in vivo 31PMRS would facilitate the development of targeted therapies to improve OXPHOS capacity and could ultimately favorably impact cardiovascular health. 31PMRS produces a noninvasive, in vivo measure of OXPHOS capacity in human skeletal muscle, as opposed to alternative measures obtained from explanted and potentially altered mitochondria via muscle biopsy. It relies upon only modest additional instrumentation beyond what is already in place on magnetic resonance scanners available for clinical and translational research at most institutions. In this work, we outline a method to measure in vivo skeletal muscle OXPHOS. The technique is demonstrated using a 1.5 Tesla whole-body MR scanner equipped with the suitable hardware and software for 31PMRS, and we explain a simple and robust protocol for in-magnet resistive exercise to rapidly fatigue the quadriceps muscle. Reproducibility and feasibility are demonstrated in volunteers as well as subjects over a wide range of functional capacities.
Introduzione
L'obiettivo di questo lavoro è quello di delineare un metodo riproducibile per misurare in modo non invasivo in vivo funzione mitocondriale nel muscolo scheletrico in persone fisiche che hanno una vasta gamma di abilità. insufficienza mitocondriale aberrante è un segno distintivo di una vasta gamma di sindromi metaboliche e le malattie genetiche, dalle condizioni comuni come l'invecchiamento e il diabete di malattie rare come l'atassia di Friedreich.
Sindrome metabolica e disfunzione mitocondriale
La sindrome metabolica è stato indicato per interrompere la funzione mitocondriale, deprimere scheletrico OXPHOS muscolare, e portare a stoccaggio dei lipidi ectopica nel muscolo scheletrico 1, 2. Organelli come critici che regolano metabolismo e l'omeostasi energetica, i mitocondri sono implicati nella fisiopatologia dell'obesità 3, 4, 5 insulino-resistenza , Diabete di tipo 2 (DM2) 6, 7, correlata al diabete micro 8, 9, 10, 11 e complicanze macrovascolari 12, 13, e non alcoliche malattia del fegato grasso (NAFLD) 14, 15, 16, tra gli altri, .Insulin resistenza è caratterizzato da profondi cambiamenti nel muscolo scheletrico attività mitocondriale, tra cui diminuito mitocondriale degli acidi tricarbossilici (TCA) tasso di flusso, il tasso di sintesi di ATP e citrato sintasi e NADH: O 2 attività ossidoreduttasi 5. Una ipotesi è che queste alterazioni potrebbero essere dovute all'accumulo di acidi grassi liberi (FFA) metaboliti nel muscolo, che vengono notevolmente aumentata durante l'obesità e altri obesità-rmalattie euforico 2, 17. L'esposizione del muscolo FFAs elevati e intermedi lipidici può diminuire l'espressione di geni nella via ossidativa dei lipidi e il ciclo TCA e catena di trasporto degli elettroni (ETC) 18. Questa riduzione mitocondriale scheletrico capacità OXPHOS muscolare nella cornice di un sovraccarico di lipidi è accompagnata da una diminuzione del (contenuto e la biogenesi dei mitocondri) quantitativa 19 e la funzione qualitativa dei mitocondri dei muscoli scheletrici 20. Esponendo muscolo scheletrico e miociti a FFAs porta a grave resistenza all'insulina, e una maggiore assorbimento di FFA nel muscolo è associata alla resistenza all'insulina in entrambi gli esseri umani e roditori 21. Il intermedi lipidici ceramide e diacilglicerolo (DAG) hanno dimostrato di inibire direttamente la via di segnalazione dell'insulina alterando l'attività di chinasi, come la proteina chinasi C e protein chinasi B 21. Pertanto, molecole lipidiche di derivazione sembrano svolgere un ruolo di primo piano nello sviluppo della scheletrico insulino-resistenza muscolare e diabete di tipo 2. Tuttavia, non è chiaro se i cambiamenti nella capacità mitocondriale sono una causa o una conseguenza di insulino-resistenza 22.
Atassia e mitocondriale disfunzione di Friedrich
OXPHOS Diminuzione possono anche derivare da difetti genetici. L'atassia di Friedrich (FA), la forma più comune di atassia ereditaria, è una malattia genetica causata da una mutazione nel fratassina (FXN) gene, con conseguente accumulo di ferro intra-mitocondriale, la produzione di specie reattive dell'ossigeno, e anomalie della fosforilazione ossidativa 23, 24, 25, 26. Questa importante scoperta ha portato allo sviluppo di terapie mirate, which obiettivo di migliorare la funzione mitocondriale a livello sub-cellulare. Nonostante questa comprensione, vi è stato limitato sviluppo in vivo, biomarcatori riproducibili per la ricerca clinica FA. In realtà, una barriera critica nella valutazione efficace delle terapie mirate in FA è l'incapacità di tenere traccia delle modifiche in funzione mitocondriale. misure funzionali attuali, per esempio, può identificare diminuzione della gittata cardiaca; tuttavia, sono incapaci di determinare il livello a cui avviene il erettile (Figura 1). Lo sviluppo di un indicatore affidabile della funzione mitocondriale che può essere utilizzato per identificare e valutare la progressione della malattia in atassia di Friedrich è fondamentale per valutare il relativo impatto meccanicistica di terapie mirate.
OXPHOS deteriorate e disfunzione cardiaca
Aberrant funzione mitocondriale, sia acquisita o genetica, potrebbe contribuire allo sviluppo o la progressione di cardiLa disfunzione ac. Nelle condizioni di sovraccarico di pressione e di insufficienza cardiaca, l'energia primaria passa substrato di preferenza da FFA al glucosio. Questo è associato con diminuzione dell'attività ETC e fosforilazione ossidativa 27. La fisiopatologia della bioenergetica mitocondriale nella disfunzione cardiaca può essere diverso a seconda della provenienza primaria del difetto mitocondriale. Diabete e sindrome metabolica risultati in alterazioni mitocondriali nel miocardio, come la biogenesi compromessa e il metabolismo degli acidi grassi, che portano ad una ridotta flessibilità del substrato, l'efficienza energetica, e alla fine, la disfunzione diastolica 28, 29. In FA, invece, una carenza frataxin risultati in significativo accumulo di ferro mitocondriale in cardiomiociti 30, 31. Accumulo di ferro porta alla produzione di radicali liberi tramite la reazione di Fenton 32 </ Sup> e aumenta la possibilità di danni dei radicali liberi indotti cardiomiociti. L'accumulo di ferro intra-mitocondriale è anche associata ad una maggiore sensibilità allo stress ossidativo e una ridotta capacità ossidativa 30, 31. L'accumulo di ferro e la successiva funzione mitocondriale aberranti, a causa della carenza di fratassina, possono quindi essere responsabile per l'energetica cardiaca compromessa e cardiomiopatia osservati in FA 33, 34. E 'anche interessante notare che la capacità ossidativa ridotta nei mitocondri dei muscoli scheletrici parallela alla intolleranza esercizio e ridotta capacità metabolica nello scompenso cardiaco (HF) 35. Misurazione della scheletrico capacità OXPHOS muscolare, come specificato nel presente documento, è facilmente implementabile e robusto; accoppiato con il significato di OXPHOS muscolo scheletrico in HF, queste caratteristiche lo rendono un biomarker attraente in studi completi di sentiret malattia 36.
OXPHOS deteriorate e la disfunzione cardiaca di accompagnamento non è un aspetto irrilevante di metabolica e malattia mitocondriale. I soggetti con diabete e malattie metaboliche sono a più alto rischio di sviluppare malattie cardiovascolari e hanno eccesso di mortalità dopo infarto miocardico (MI) 37, 38, 39, 40, 41; oltre la metà dei soggetti FA avere cardiomiopatia, e molti muoiono di aritmia cardiaca o insufficienza cardiaca 42. Pertanto, la quantificazione della riduzione OXPHOS potrebbe non solo permettere la diagnosi precoce e il trattamento della disfunzione cardiaca, ma potrebbe anche alleviare un grande onere clinica in queste malattie.
terapie mirate per aumentare direttamente la capacità OXPHOS è un settore promettente per migliorare il trattamento di soggetti, whether la causa della disfunzione metabolica è genetica o acquisita. Attualmente, lo sviluppo di nuovi farmaci che alleviano o anormale funzione mitocondriale 43 o correggere il difetto genetico primario 44 in grado di migliorare la bioenergetica caratteristica squilibrato di FA mirati. Nel caso di disfunzione mitocondriale acquisita, aumento dell'attività fisica può migliorare la funzione mitocondriale 45, 46, 47.
31 Fosforo spettroscopia di risonanza magnetica come biomarcatore non invasivo della funzione mitocondriale
Indipendentemente dalla terapia testata, un integrato nella valutazione vivo di bioenergetica del muscolo scheletrico è uno strumento fondamentale per valutare l'impatto degli interventi mirati, soprattutto nei soggetti con grave intolleranza esercizio fisico o l'incapacità di subire metabo convenzionaletest lic. Spettroscopia di risonanza magnetica sintonizzato fosforo (31 PMRS), un nucleo endogena trovato in vari substrati ad alta energia all'interno delle cellule in tutto il corpo, è stato utilizzato per quantificare la capacità ossidativa mitocondriale utilizzando una varietà di approcci, compreso a magnete protocolli esercizio recupero e stimolazione muscolare protocolli 48. I protocolli esercizio di recupero si basano su una serie di apparecchi che vanno in complessità da ergometri compatibili con la risonanza magnetica che regolano e misurano il carico di lavoro per semplici configurazioni di cinghie e tamponi che consentono di scoppio di tipo resistivo e l'esercizio fisico quasi-statico. Uno degli obiettivi primari di qualsiasi di questi protocolli è quello di produrre uno squilibrio energetico per il quale la domanda di adenosina trifosfato (ATP) viene inizialmente soddisfatta attraverso la ripartizione enzimatica di fosfocreatina (PCR) attraverso la creatina chinasi reazione 49. Al momento della cessazione di esercizio, il tasso di produzione di ATP è dominata da pho ossidativosphorylation e rappresenta la massima capacità vivo dei mitocondri 50. Inoltre, OXPHOS durante il recupero post-esercizio può essere descritto da una reazione di primo ordine 51. Il recupero post-esercizio della PCR può quindi essere quantificata dal montaggio di una costante di tempo esponenziale (τ PCR), con i valori più bassi di τ PCr che rappresentano una maggiore capacità di sintesi di ATP ossidativo. Notevoli sforzi sono stati fatti per validare 31 PMRS contro ex vivo e misure più dirette di OXPHOS e dimostrare il potenziale applicabilità clinica di questa tecnica 52, 53, 54, 55.
In particolare, il protocollo descritto in questo lavoro può essere implementato su scanner clinicamente disponibili, ed è stato ampiamente validato quale non invasivo biomarker of funzione mitocondriale 56. Tuttavia, un esercizio di 31 protocollo PMRS ottimizzato per l'applicazione alle persone con diversi livelli di gravità della compromissione neuromuscolare o di mobilità non è stato ben definito 57. A ben definito, in generale, applicabile protocollo di esercizio e il 31 la tecnica PMRS sarebbero particolarmente utili nella valutazione delle patologie con anomalie fondamentali nella funzione mitocondriale.
Diversi studi precedenti hanno esplorato le applicazioni di tecniche non invasive per quantificare la funzione mitocondriale nei soggetti. Per esempio, queste tecniche hanno dimostrato OXPHOS ridotta nei soggetti con diabete di tipo 2 36. Lodi et al. prima testato la fattibilità di tecniche PMRS in soggetti con FA ed ha trovato che 1) il difetto genetico fondamentale nella FA danneggia scheletrico OXPHOS muscolare e 2) il numero di GAA tripletta ripetizioni è inversamente proporzionale al muscolo scheletrico OXPHOS 33. Più recentemente, Nachbauer et al. PMRS usato come misura di esito secondario in un trial clinico di FA con 7 soggetti. I tempi di recupero PCR sono stati significativamente più lungo nei soggetti rispetto ai controlli, riaffermando precedente lavoro di Lodi e che indica che gli effetti di espressione frataxina aberrante in FA possono causare una diminuzione della capacità mitocondriale che è rilevabile con tecniche PMRS 58.
Metodi affidabili per definire in modo adeguato in vivo funzione del muscolo scheletrico in un rapporto costo-efficacia, e modo riproducibile fattibile sono fondamentali per migliorare i risultati soggetti a una serie di malattie che colpiscono la funzione mitocondriale.
Questo lavoro delinea una procedura affidabile per ottenere in vivo massima capacità ossidativa del muscolo scheletrico con 31 PMRS. Il protocollo di esercizio in-magnete è ben tollerato da individui che coprono una vasta gamma di fisica e functionaL capacità e offre una messa a punto soggetto semplificata utilizzando attrezzature poco costoso e ampiamente disponibili.
Protocollo
Questo protocollo è approvato dalla e segue le linee guida della Institutional Review Board Ohio State University per la sperimentazione umana. E 'estremamente importante che tutte le procedure che coinvolgono attrezzature MR vengono eseguite da personale adeguatamente addestrato che aderiscono ai più alti standard di sicurezza MR 59.
1. Materiali e preparazione
- Assicurarsi che tutti i materiali necessari sono disponibili prima dell'esperimento (Figura 2).
- Inserire la bobina 31 P nel connettore bobina-tabella alla fine della tabella esame più vicino al foro. Mettere un grande cuscino di schiuma triangolo vicino alla testa del tavolo esame RM, ma non direttamente sulla bobina 31 P. Posizionare un cuscino capo all'altro capo del tavolo dell'esame MR, lontano dal foro, per il comfort soggetto.
2. Fatte salve di posizionamento (Figura 3a)
- Istruire il soggetto a mentire in posizione supina, piediprima sul tavolo MR. Posizionare un cuscino di schiuma sotto le ginocchia per sostenere la gamba in una posizione parzialmente flessa.
- Posizionare il soggetto vicino al lato destro della tabella (destra del soggetto) per centrare il più fedelmente la coscia sinistra alla isocentro magnete possibile, garantendo così l'omogeneità B0 ottimale nel muscolo della coscia in esame. Fornire l'argomento con tappi per le orecchie e / o cuffie.
- Posizionare la bobina RF 31 P sul quadricipite sinistro a circa il punto medio tra la rotula e la testa del femore, e fissare alla gamba utilizzando cinghie. Posizionare la bobina sulla porzione laterale della gamba, sopra vasto laterale.
- Fissare l'olio bambino al mediale della coscia con le stesse cinghie utilizzate per fissare la bobina alla gamba. Questo facilita la localizzazione di scansione.
- Legate gambe del soggetto insieme con una cinghia posto sotto la bobina e sopra il ginocchio. Fissare le gambe del soggetto al tavolo MR con Stra aggiuntivops, uno sopra il ginocchio e uno a metà strada tra il ginocchio e la caviglia.
- Utilizzare la guida di luce laser per delineare il centro della bobina e spostare la tavola all'isocentro magnete utilizza questo centraggio riferimento.
3. Esercizio protocollo
- Spiegare al soggetto che il protocollo di esercizio si compone di tre fasi: una fase della linea di base iniziale; una breve, fase di esercizio intenso; e una fase di recupero.
- Istruire il soggetto a restare immobile e rilassare i muscoli delle gambe durante le fasi iniziali e recupero dell'acquisizione spettroscopia per minimizzare artefatti da movimento.
- Fornire un conto alla rovescia per il soggetto che indica l'inizio di esercizio. A questo punto, ha il soggetto avviare ginocchio estensione / flessione come forza e il più rapidamente possibile contro la resistenza delle cinghie.
NOTA: I muscoli quadricipiti sono usati per spostare la parte inferiore della gamba sinistra su e giù, fino incaricato di fermare. - Termina esercizio dopo un calo del 30%in altezza del picco PCr.
- Osservare l'altezza del picco PCr nella finestra di visualizzazione di acquisizione, ed anche vederlo al termine della sequenza di esercizio.
NOTA: Una linea guida generale è che un approssimativo diminuzione del 30% in PCr altezza del picco corrispondente a un picco Pi che è il 50% dell'altezza del picco PCr. Se l'esaurimento la PCR non sta avvenendo abbastanza rapidamente per ottenere un calo del 30% durante la fase di esercizio della prova, di incoraggiare il soggetto a calciare più forte o più veloce durante l'attività fisica.
NOTA: cessazione di esercizio è determinata monitorando l'altezza di picco della PCr e durata di esercizio. Ciò può dar luogo a diverse durate di esercizio di diversi pazienti e può essere rappresentato nell'analisi.
- Osservare l'altezza del picco PCr nella finestra di visualizzazione di acquisizione, ed anche vederlo al termine della sequenza di esercizio.
4. Protocollo di scansione
- Acquisire un localizzatore tri-plane per verificare il corretto posizionamento soggetto e identificare la posizione della bobina 31 P.
NOTA: La sequenza localizzatore inizia automaticamente e centra al indicposizione ated utilizzando la guida di luce laser (passo 2,9) - Acquisire un secondo localizzatore tri-aereo.
- Aprire la vista fetta su le prime immagini localizzatore tri-aereo.
NOTA: Questo processo può essere diverso per i diversi sistemi software e hardware. - Centro e ruotare l'orientamento fetta sinistro del mouse e tenendo premuto sul gruppo fetta. Ruotare il gruppo fetta. Assicurarsi che l'orientamento finale di fette coincide con la posizione del bambino dell'olio.
- Nella finestra di routine di sequenza, aumentare il numero di fette di coprire l'intera gamba in immagini assiali e sagittali (Figura 3b).
- Aprire la vista fetta su le prime immagini localizzatore tri-aereo.
- 31 P sequenza spettroscopia:
- Utilizzare i seguenti parametri della sequenza non localizzato impulsi acquisire: TR: 1,000 msec; TE: 0,34 msec; larghezza spettrale: 2.000 Hz; flip angle: 90 gradi; punti di dati acquisiti: 1.024; 4 medie risultanti in una risoluzione temporale di spettro 1 ogni 6 sec.
- 31 P spessore box posizionamento:
- Utilizzo di un mouse, trascinare le seconde immagini triplane localizzatore nella finestra di visualizzazione nella parte superiore dello schermo. Trascinare la sequenza di spettroscopia nella finestra di protocollo e fare doppio clic per aprire.
- Utilizzare la barra degli strumenti di posizione per visualizzare la voxel spessore (selezionare il rettangolo nero con linee orizzontali). Dopo aver selezionato questa opzione, osservare una scatola verde sulle immagini localizzatore.
NOTA: Questo è il voxel spessore. - Spostare il voxel sinistro del mouse e tenendo premuto il voxel nel centro. Modificare le dimensioni e ruotare l'orientamento del voxel sinistro del mouse e tenendo premuto il voxel all'angolo della scatola. Posizionare la scatola spessore in modo da garantire l'omogeneità B0 campo direttamente sotto la bobina e parallelo al piano del quadricipite.
NOTA: Questo per garantire una corretta shimming nella regione sensibile sotto la bobina, che è il volume di tessuto direttamente sotto il centro della bobina. - Utilizzare le immagini tri-plane localizzatore per individuare il sensitive regione della bobina e regolare la casella shim per comprendere questa regione all'interno del muscolo quadricipite.
NOTA: La scatola spessore può essere lunga superiore alla copertura della bobina di superficie al fine di garantire l'omogeneità B0 ai acquisizione dati voxel (figura 3c). - Acquisizione di prova 31 P:
- Aprire la finestra di visualizzazione di acquisizione e selezionare l'icona testa nella barra degli strumenti di acquisizione. Ciò consentirà per la visualizzazione di acquisizione spettroscopia in tempo reale.
- Dopo il posizionamento del 31P spessore voxel, eseguire la sequenza per ottenere un singolo spettro facendo clic sul pulsante "Esegui" nella parte superiore della finestra del protocollo.
- Esaminare la qualità della B0 shimming. Osservare lo spettro risultante nella finestra di acquisizione. Osservare un importante picco di PCr centrato a 0 ppm e nessun rumore significativo (figura 4a, a sinistra).
NOTA: Risoluzione dei problemi: Se lo spettro appare rumorosa, assicurarsi che la casella di spessore è collocato all'interno del muscolo. Anno Dominisolo la dimensione e la posizione della casella shim per migliorare il rapporto segnale-rumore. Ripetere l'acquisizione di test come necessario. - Per vedere l'altezza del picco PCr, aprire lo spettro nello strumento di spettroscopia ( "Applicazioni" → "spettroscopia"). Aprire la cartella del paziente (cartella albero icona), selezionare la scansione appropriata, e fare doppio clic per caricare lo spettro.
- immagine T1 pre-esercizio:
- Ottenere un'immagine T1 pesate assiali singola slice al centro di una bobina.
- 31 P acquisizione pre-esercizio:
- Copiare la sequenza dal punto 4.4 (che ha prodotto la migliore qualità spettrale) sinistro del mouse e trascinando la sequenza nella finestra di protocollo. Utilizzare questa sequenza per tutte le misurazioni successive.
- Nella finestra di routine di sequenza, aumentare il numero di misurazioni da 1 a 10. Selezionare run acquisire 10 misurazioni mentre il soggetto è a riposo.
- 31 </ Sup> P acquisizione esercizio:
NOTA: Prendere nota dei tempi di inizio e di fine esercizio, in quanto questo sarà importante per l'analisi.- Riposo: Applicare le impostazioni shim dalla scansione precedente e impostare la sequenza di acquisire 20 misure. Istruire il soggetto di iniziare a calci dopo un conto alla rovescia. Istruire il soggetto a restare a riposo per 2 misure.
- Esercizio: Chiedi al soggetto di eseguire l'esercizio estensione del ginocchio per ~ 30 sec (o il tempo necessario per ottenere una riduzione del 30% nel picco di ampiezza PCr). Dopo che il soggetto raggiunge esaurimento PCr sufficiente, chiedere loro di riposare.
- 31 P post-esercizio acquisizioni:
- Acquisire ulteriori 20 misurazioni a riposo. Assicurarsi che le acquisizioni di post-esercizio iniziano subito dopo la sequenza di esercizio, senza pause o spessori (figura 4a, a destra).
NOTA: La suddivisione del periodo di recupero in due distinte operazioni consente di analizzare l'initial 20 spettri dinamica durante l'acquisizione del secondo 20 spettri dinamico, consentendo all'operatore di evitare l'acquisizione del periodo di recupero completo se l'esercizio deve essere ripetuta.
- Acquisire ulteriori 20 misurazioni a riposo. Assicurarsi che le acquisizioni di post-esercizio iniziano subito dopo la sequenza di esercizio, senza pause o spessori (figura 4a, a destra).
- Garantire la qualità esercizio:
- Confrontare le altezze dei picchi PCr all'inizio e alla fine dell'esercizio. sessioni di esercizio di alta qualità producono un ~ diminuzione del 30% della concentrazione PCr.
- Verificare che l'altezza del picco PCr è uguale all'inizio di riposo e al termine del recupero (tipicamente, <10% di differenza è desiderato). Ciò assicura che non vi era trascurabile perdita di campo omogeneità durante l'acquisizione.
NOTA: Se la ripartizione PCR è insufficiente, o se vi è stata una perdita di campo omogeneità, quindi ripetere la porzione di esercizio / recupero della prova (avendo cura di evitare l'affaticamento), assicurarsi che la bobina e le cinghie sono fissate in modo sicuro, e si estendono la durata di esercizio e / o incoraggiare l'esercizio più vigorosa (Figura 4b).
NONE: Il confronto delle immagini ottenute nei passaggi 6 e 11 permessi di un passo ulteriore controllo di qualità di visualizzare qualsiasi spostamento della coscia e la bobina per effetto dell'esercizio, assicurando così che il movimento minimo si è verificato durante il protocollo, che potrebbero influenzare in modo significativo i dati acquisiti .
- A seguito di imaging T1 post-esercizio, ripetere il pre-esercizio assiale di imaging T1 (passo 4,5) utilizzando gli stessi parametri di acquisizione.
- Oltre a sufficiente deplezione di PCr, misurare l'esercizio pH finale garantire che l'esercizio non induce acidosi del muscolo.
- Eseguire questa misurando lo spostamento chimico tra Pi e PCR (Ap i) e utilizzando la seguente equazione 60:
pH = 6.77 + log [(Ap i -3.29) / (5,68-Ap i)]
NOTA: Il pH dovrebbe rimanere superiore a 6.8 61. Se la ripartizione PCr è sufficiente ma il pH è troppo basso, ripetere l'esercizio per un breve periodoer durata e / o con una ridotta intensità.
- Salvataggio dei dati:
- Salva tutti gli spettri acquisiti come file DICOM ed esportarli per l'elaborazione utilizzando JMRUI.
- Se si utilizza uno scanner, selezionare tutte le acquisizioni di spettroscopia nella finestra "Navigator".
- In "Applicazioni", selezionare "Strumenti Dicom" → "Esporta MR spettroscopia", e salvare i file DICOM (* .dcm) a C: / user / MedCom / temp / CDROFFLINE
(Lo strumento sceglie automaticamente questa posizione). - In "Transfer", selezionare "Esporta in linea." Salvare nella posizione desiderata.
5. Elaborazione dati e analisi 62
- Analizzare la MR spettri con il software JMRUI liberamente disponibile (versione 5.2; http://www.jmrui.eu/).
- Apodize e sfasamento gli spettri per garantire l'uniformità di tutti i punti temporali acquisiti (Figura 5). Il picco PCR sarà centrato unt 0 ppm negli spettri.
- Utilizzare l'algoritmo amares incorporato per quantificare l'ampiezza del picco PCr in ogni spettro acquisito. L'ampiezza di picco rappresenta la concentrazione della PCr nella regione sensibile della bobina di superficie in quel particolare punto di tempo.
- Nel software computazionale, tracciare le concentrazioni PCr in funzione del tempo di acquisizione. Utilizzando il built-in strumento di curva-fit software di calcolo, si adattano i dati periodo di recupero PCR per la seguente equazione 52, 63:
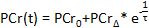
- Registrare i valori della linea di base PCr (
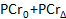 ), Il più basso PCr (
), Il più basso PCr (  ), E il tempo di recupero (
), E il tempo di recupero ( 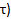 .
. - Assicurarsi che le condizioni appropriate siano soddisfatte durante il Exersessione CISE calcolando l'esaurimento PCr, la differenza percentuale tra la linea di base PCR e il più basso PCR. sessioni di esercizio ideale si ottiene un 20 - deplezione 50%.
NOTA: La qualità del montaggio di curva può essere assicurata verificando che il valore R 2 è maggiore di 0,75. R 2 valori vengono calcolati automaticamente dal software di montaggio.
Risultati
La riproducibilità di studio
Sei volontari (4 uomini e 2 donne, età media: 24,5 ± 6,2 anni) con nessun cuore auto-riportati, metabolica o malattia mitocondriale sono stati sottoposti a sessioni di esercizio e di imaging tecnica 31 PMRS descritto a 2 giorni diversi entro 1 settimana per valutare la tecnica riproducibilità (Figura 6a). Gli studi condotti su volontari sani conferma...
Discussione
Questo documento descrive un protocollo standard per l'esame 31 PMRS che permette la misurazione di serie e non invasiva in vivo del muscolo scheletrico funzione mitocondriale. Il protocollo tiene notevole appeal quando si considera l'ampiezza delle indagini rivolte al crescente peso della sindrome metabolica e la sua morbilità e mortalità che ne deriva. Questo protocollo 31 PMRS richiede una quantità minima di tempo scanner e può essere incorporato in indagini metaboliche glob...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported in part by a Davis Heart and Lung Research Institute Trifit Award, as well as by the Intramural Research Program of the NIH National Institute on Aging.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 T MR Scanner | Siemens | manufacturer will not affect results | |
| 10 cm 31P transmit-receive coil, 1.5T compatible | PulseTeq | manufacturer will not affect results | |
| 3 fl oz Baby Oil | Johnson & Johnson | manufacturer will not affect results | |
| Foam triangle cushion (Knee) | Siemens | manufacturer will not affect results | |
| (3) plastic buckle resistive straps; table to table | Siemens | manufacturer will not affect results | |
| (1) plastic buckle resistive strap; self-connecting | Siemens |
Riferimenti
- Eckel, R. H., Alberti, K. G., Grundy, S. M., Zimmet, P. Z. The metabolic syndrome. Lancet. 375 (9710), 181-183 (2010).
- Shulman, G. I. Ectopic fat in insulin resistance, dyslipidemia, and cardiometabolic disease. N Engl J Med. 371 (12), 1131-1141 (2014).
- Holmstrom, M. H., Iglesias-Gutierrez, E., Zierath, J. R., Garcia-Roves, P. M. Tissue-specific control of mitochondrial respiration in obesity-related insulin resistance and diabetes. Am J Physiol Endocrinol Metab. 302 (6), 731-739 (2012).
- Jheng, H. F., et al. Mitochondrial fission contributes to mitochondrial dysfunction and insulin resistance in skeletal muscle. Mol Cell Biol. 32 (2), 309-319 (2012).
- Petersen, K. F., et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance. Science. 300 (5622), 1140-1142 (2003).
- Kelley, D. E., He, J., Menshikova, E. V., Ritov, V. B. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes. Diabetes. 51 (10), 2944-2950 (2002).
- Liu, R., et al. Impaired mitochondrial dynamics and bioenergetics in diabetic skeletal muscle. PLoS One. 9 (3), 92810 (2014).
- Ha, H., Hwang, I. A., Park, J. H., Lee, H. B. Role of reactive oxygen species in the pathogenesis of diabetic nephropathy. Diabetes Res Clin Pract. 82, 42-45 (2008).
- Akude, E., et al. Diminished superoxide generation is associated with respiratory chain dysfunction and changes in the mitochondrial proteome of sensory neurons from diabetic rats. Diabetes. 60 (1), 288-297 (2011).
- Fernyhough, P. Mitochondrial dysfunction in diabetic neuropathy: a series of unfortunate metabolic events. Curr Diab Rep. 15 (11), 89 (2015).
- Chen, M., Wang, W., Ma, J., Ye, P., Wang, K. High glucose induces mitochondrial dysfunction and apoptosis in human retinal pigment epithelium cells via promoting SOCS1 and Fas/FasL signaling. Cytokine. 78, 94-102 (2016).
- Blake, R., Trounce, I. A. Mitochondrial dysfunction and complications associated with diabetes. Biochim Biophys Acta. 1840 (4), 1404-1412 (2014).
- Rains, J. L., Jain, S. K. Oxidative stress, insulin signaling, and diabetes. Free Radic Biol Med. 50 (5), 567-575 (2011).
- Serviddio, G., et al. Mitochondrial involvement in non-alcoholic steatohepatitis. Mol Aspects Med. 29 (1-2), 22-35 (2008).
- Perez-Carreras, M., et al. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology. 38 (4), 999-1007 (2003).
- Garcia-Ruiz, I., et al. Mitochondrial complex I subunits are decreased in murine nonalcoholic fatty liver disease: implication of peroxynitrite. J Proteome Res. 9 (5), 2450-2459 (2010).
- Patti, M. E., Corvera, S. The role of mitochondria in the pathogenesis of type 2 diabetes. Endocr Rev. 31 (3), 364-395 (2010).
- Muoio, D. M., Newgard, C. B. Obesity-related derangements in metabolic regulation. Annu Rev Biochem. 75, 367-401 (2006).
- Bonnard, C., et al. Mitochondrial dysfunction results from oxidative stress in the skeletal muscle of diet-induced insulin-resistant mice. J Clin Invest. 118 (2), 789-800 (2008).
- Jheng, H. F., Huang, S. H., Kuo, H. M., Hughes, M. W., Tsai, Y. S. Molecular insight and pharmacological approaches targeting mitochondrial dynamics in skeletal muscle during obesity. Ann N Y Acad Sci. 1350, 82-94 (2015).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends Endocrinol Metab. 23 (8), 391-398 (2012).
- Montgomery, M. K., Turner, N. Mitochondrial dysfunction and insulin resistance: an update. Endocr Connect. 4 (1), 1-15 (2015).
- Martelli, A., Puccio, H. Dysregulation of cellular iron metabolism in Friedreich ataxia: from primary iron-sulfur cluster deficit to mitochondrial iron accumulation. Front Pharmacol. 5, 130 (2014).
- Campuzano, V., et al. Frataxin is reduced in Friedreich ataxia patients and is associated with mitochondrial membranes. Hum Mol Genet. 6 (11), 1771-1780 (1997).
- Calabrese, V., et al. Oxidative stress, mitochondrial dysfunction and cellular stress response in Friedreich's ataxia. J Neurol Sci. 233 (1-2), 145-162 (2005).
- Ristow, M., et al. Frataxin activates mitochondrial energy conversion and oxidative phosphorylation. Proc Natl Acad Sci U S A. 97 (22), 12239-12243 (2000).
- Ardehali, H., et al. Targeting myocardial substrate metabolism in heart failure: potential for new therapies. Eur J Heart Fail. 14 (2), 120-129 (2012).
- Ren, J., Pulakat, L., Whaley-Connell, A., Sowers, J. R. Mitochondrial biogenesis in the metabolic syndrome and cardiovascular disease. J Mol Med (Berl). 88 (10), 993-1001 (2010).
- Marin-Garcia, J., Goldenthal, M. J. Understanding the impact of mitochondrial defects in cardiovascular disease: a review. J Card Fail. 8 (5), 347-361 (2002).
- Babcock, M., et al. Regulation of mitochondrial iron accumulation by Yfh1p, a putative homolog of frataxin. Science. 276 (5319), 1709-1712 (1997).
- Foury, F., Cazzalini, O. Deletion of the yeast homologue of the human gene associated with Friedreich's ataxia elicits iron accumulation in mitochondria. FEBS Lett. 411 (2-3), 373-377 (1997).
- Wardman, P., Candeias, L. P. Fenton chemistry: an introduction. Radiat Res. 145 (5), 523-531 (1996).
- Lodi, R., et al. Cardiac energetics are abnormal in Friedreich ataxia patients in the absence of cardiac dysfunction and hypertrophy: an in vivo 31P magnetic resonance spectroscopy study. Cardiovasc Res. 52 (1), 111-119 (2001).
- Raman, S. V., et al. Impaired myocardial perfusion reserve and fibrosis in Friedreich ataxia: a mitochondrial cardiomyopathy with metabolic syndrome. Eur Heart J. 32 (5), 561-567 (2011).
- Kitzman, D. W., et al. Skeletal muscle abnormalities and exercise intolerance in older patients with heart failure and preserved ejection fraction. Am J Physiol Heart Circ Physiol. 306 (9), 1364-1370 (2014).
- Scheuermann-Freestone, M., et al. Abnormal cardiac and skeletal muscle energy metabolism in patients with type 2 diabetes. Circulation. 107 (24), 3040-3046 (2003).
- Allcock, D. M., Sowers, J. R. Best strategies for hypertension management in type 2 diabetes and obesity. Curr Diab Rep. 10 (2), 139-144 (2010).
- Katzmarzyk, P. T., Church, T. S., Janssen, I., Ross, R., Blair, S. N. Metabolic syndrome, obesity, and mortality: impact of cardiorespiratory fitness. Diabetes Care. 28 (2), 391-397 (2005).
- Wang, J., et al. The metabolic syndrome predicts cardiovascular mortality: a 13-year follow-up study in elderly non-diabetic Finns. Eur Heart J. 28 (7), 857-864 (2007).
- Zambon, S., et al. Metabolic syndrome and all-cause and cardiovascular mortality in an Italian elderly population: the Progetto Veneto Anziani (Pro.V.A) Study. Diabetes Care. 32 (1), 153-159 (2009).
- Malik, S., et al. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation. 110 (10), 1245-1250 (2004).
- Ropper, A. H., Samuels, M. A. . Adams and Victor's Principles of Neurology. 9 edn. , (2009).
- Abeti, R., et al. Targeting lipid peroxidation and mitochondrial imbalance in Friedreich's ataxia. Pharmacol Res. 99, 344-350 (2015).
- Li, Y., et al. Excision of Expanded GAA Repeats Alleviates the Molecular Phenotype of Friedreich's Ataxia. Mol Ther. 23 (6), 1055-1065 (2015).
- Toledo, F. G., Goodpaster, B. H. The role of weight loss and exercise in correcting skeletal muscle mitochondrial abnormalities in obesity, diabetes and aging. Mol Cell Endocrinol. 379 (1-2), 30-34 (2013).
- Oldridge, N. B., Guyatt, G. H., Fischer, M. E., Rimm, A. A. Cardiac rehabilitation after myocardial infarction. Combined experience of randomized clinical trials. JAMA. 260 (7), 945-950 (1988).
- O'Connor, G. T., et al. An overview of randomized trials of rehabilitation with exercise after myocardial infarction. Circulation. 80 (2), 234-244 (1989).
- Ryan, T. E., Brizendine, J. T., McCully, K. K. A comparison of exercise type and intensity on the noninvasive assessment of skeletal muscle mitochondrial function using near-infrared spectroscopy. J Appl Physiol (1985). 114 (2), 230-237 (2013).
- Wallimann, T. Bioenergetics. Dissecting the role of creatine kinase. Curr Biol. 4 (1), 42-46 (1994).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. Am J Physiol Regul Integr Comp Physiol. 296 (1), 161-170 (2009).
- Korzeniewski, B., Rossiter, H. B. Each-step activation of oxidative phosphorylation is necessary to explain muscle metabolic kinetic responses to exercise and recovery in humans. J Physiol. 593 (24), 5255-5268 (2015).
- Meyer, R. A. A linear model of muscle respiration explains monoexponential phosphocreatine changes. Am J Physiol. 254 (4), 548-553 (1988).
- McCully, K. K., Fielding, R. A., Evans, W. J., Leigh, J. S., Posner, J. D. Relationships between in vivo and in vitro measurements of metabolism in young and old human calf muscles. J Appl Physiol (1985). 75 (2), 813-819 (1993).
- Layec, G., Haseler, L. J., Richardson, R. S. Reduced muscle oxidative capacity is independent of O2 availability in elderly people. Age (Dordr). 35 (4), 1183-1192 (2013).
- Larson-Meyer, D. E., Newcomer, B. R., Hunter, G. R., Hetherington, H. P., Weinsier, R. L. 31P MRS measurement of mitochondrial function in skeletal muscle: reliability, force-level sensitivity and relation to whole body maximal oxygen uptake. NMR Biomed. 13 (1), 14-27 (2000).
- Kemp, G. J., Ahmad, R. E., Nicolay, K., Prompers, J. J. Quantification of skeletal muscle mitochondrial function by 31P magnetic resonance spectroscopy techniques: a quantitative review. Acta Physiol (Oxf). 213 (1), 107-144 (2015).
- Lynch, D. R., et al. Near infrared muscle spectroscopy in patients with Friedreich's ataxia. Muscle Nerve. 25 (5), 664-673 (2002).
- Nachbauer, W., et al. Bioenergetics of the calf muscle in Friedreich ataxia patients measured by 31P-MRS before and after treatment with recombinant human erythropoietin. PLoS One. 8 (7), 69229 (2013).
- Kanal, E., et al. ACR guidance document on MR safe practices: 2013. J Magn Reson Imaging. 37 (3), 501-530 (2013).
- Petroff, O. A., Ogino, T., Alger, J. R. High-resolution proton magnetic resonance spectroscopy of rabbit brain: regional metabolite levels and postmortem changes. J Neurochem. 51 (1), 163-171 (1988).
- Jubrias, S. A., Crowther, G. J., Shankland, E. G., Gronka, R. K., Conley, K. E. Acidosis inhibits oxidative phosphorylation in contracting human skeletal muscle in vivo. J Physiol. 553 (2), 589-599 (2003).
- Layec, G., et al. Reproducibility assessment of metabolic variables characterizing muscle energetics in vivo: A 31P-MRS study. Magn Reson Med. 62 (4), 840-854 (2009).
- Iotti, S., Lodi, R., Frassineti, C., Zaniol, P., Barbiroli, B. In vivo assessment of mitochondrial functionality in human gastrocnemius muscle by 31P MRS. The role of pH in the evaluation of phosphocreatine and inorganic phosphate recoveries from exercise. NMR Biomed. 6 (4), 248-253 (1993).
- Wren, T. A., Bluml, S., Tseng-Ong, L., Gilsanz, V. Three-point technique of fat quantification of muscle tissue as a marker of disease progression in Duchenne muscular dystrophy: preliminary study. AJR Am J Roentgenol. 190 (1), 8-12 (2008).
- Milani, R. V., Lavie, C. J., Mehra, M. R., Ventura, H. O. Understanding the basics of cardiopulmonary exercise testing. Mayo Clin Proc. 81 (12), 1603-1611 (2006).
- Wust, R. C., van der Laarse, W. J., Rossiter, H. B. On-off asymmetries in oxygen consumption kinetics of single Xenopus laevis skeletal muscle fibres suggest higher-order control. J Physiol. 591 (3), 731-744 (2013).
- Ryan, T. E., Brophy, P., Lin, C. T., Hickner, R. C., Neufer, P. D. Assessment of in vivo skeletal muscle mitochondrial respiratory capacity in humans by near-infrared spectroscopy: a comparison with in situ measurements. J Physiol. 592 (15), 3231-3241 (2014).
- Hamaoka, T., McCully, K. K., Niwayama, M., Chance, B. The use of muscle near-infrared spectroscopy in sport, health and medical sciences: recent developments. Philos Trans A Math Phys Eng Sci. 369, 4591-4604 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon