Method Article
In Vitro Différenciation des myofibres matures pour l' imagerie en direct
Dans cet article
Résumé
Muscle cells are among the most complex eukaryotic cells. We present a protocol for the in vitro differentiation of highly mature myofibers that allows for genetic manipulation and clear imaging during all developmental stages.
Résumé
Les muscles squelettiques sont composés de myofibres, les plus grandes cellules dans le corps d'un mammifère et l'un des rares syncytia. Comment les structures complexes et évolutives conservées qui le composent sont assemblés toujours sous enquête. Leur taille et physiologiques caractéristiques limitent souvent les applications de manipulation et d'imagerie. La culture des lignées de cellules immortalisées est largement utilisé, mais il ne peut se répliquer les étapes précoces de la différenciation.
Ici, nous décrivons un protocole qui permet une manipulation génétique aisée des fibres musculaires provenant de myoblastes de souris primaires. Après une semaine de différenciation, les myofibres affichent contractilité, alignés sarcomères et les triades, ainsi que des noyaux périphériques. Le processus de différenciation complète peut être suivie d'imagerie en temps réel ou immunofluorescence. Ce système combine les avantages de l'existant ex vivo et dans des protocoles in vitro. La possibilité de transfection facile et efficace, ainsi quela facilité d'accès à tous les stades de différenciation élargit les applications potentielles. Myofibres peut ensuite être utilisé non seulement pour répondre aux questions de la biologie du développement et de cellules pertinentes, mais aussi de reproduire phénotypes de la maladie musculaire pour les applications cliniques.
Introduction
Muscle squelettique compose jusqu'à 40% du poids du corps humain 1. Troubles musculaires associées représentent un immense fardeau sanitaire et économique 2. Comment ce tissu très complexe et organisé est formé, entretenu et régénéré constitue un champ de recherche approfondie et bien établie. En fonction de l'intérêt scientifique particulier, l'approche la plus adaptée peut varier de cultures de myotubes simples à complexes dans des modèles in vivo 3 - 6.
L'objectif de ce protocole est de fournir un système in vitro qui permet le suivi de la myogenèse grâce à l' imagerie en direct et immunofluorescence. Par rapport aux approches traditionnelles, ce système offre un aperçu très complet et dynamique dans le processus myogénique de la souris. Les cellules peuvent être suivies à partir du stade de myoblastes à la maturité, myofibres multinucléées affichage triades transversales et des noyaux périphériques 7. Ce niveau de maturation peutêtre réalisé en utilisant un équipement habituel de culture cellulaire, sans nécessiter de dispositifs stimulateurs ou mécaniques complexes. Bien que certains succès dans des systèmes in vitro ont été signalés 8,9, à notre connaissance, ceci est le seul protocole de génération de souris myofibres matures avec T-tubules transversalement jumelé avec réticulum sarcoplasmique (SR). Ainsi, ce système in vitro peut être utilisé pour étudier les mécanismes moléculaires de la formation triade, qui sont encore mal connus 10.
Un autre avantage de ce système réside dans la disponibilité des ressources de souris ciblées validées, telles que des anticorps, des médicaments et des outils d'ARNi. Le protocole relativement simple ne nécessite pas d'étapes laborieuses, la manipulation hautement qualifiée, ou de l'équipement coûteux et dédié. Myofibres échues commencent à apparaître après 5 d de différenciation de culture 7, affichant la contractilité couplé avec des étincelles de calcium (données non publiées). En une semaine, le développement différental étapes de l' une des cellules les plus complexes dans le corps d'un mammifère peuvent être étudiés en combinaison avec une variété d'essais in vitro.
Protocole
NOTE: Un des rendements de souris myoblastes suffisantes pour environ deux boîtes de 35 mm ou deux plats live-imagerie, de sorte que paillassons de plan, la dissection, et revêtement (étape 2.6) en conséquence. Depuis myoblastes sont isolées par centrifugations successives et prédépôt, le protocole doit être effectué par lots de 5 - 10 animaux.
Toutes les procédures impliquant des sujets animaux ont été approuvés par le Comité d'éthique animale à l'Institut de médecine moléculaire et de l'Université Pierre et Marie Curie
1. Dissection de souris néonatale Muscles des membres postérieurs
- Préparer toutes les solutions à l' avance (tableau des matériaux) et stériliser par filtration (filtre de 0,22 um). Assurez - vous que tous les médias sont à 37 ° C avant l' addition aux cellules, à l' exception des formulations contenant sous - sol matrice de la membrane (par exemple, Matrigel).
- Stériliser le matériel de dissection (un chacun: des ciseaux courbes, ciseaux droits, pinces régulières,et une pince à pointe fine) et le banc de travail en les essuyant avec 70% d'éthanol.
- Préparer un plat de 100 mm de Pétri avec 5 ml de solution saline tamponnée phosphate de Dulbecco (DPBS) pour la collecte des muscles et de la garder sur la glace jusqu'à ce que l'étape de hachage.
- Décapitez P6 - souris P8 avec des ciseaux droites et stériliser la peau avec 70% d'éthanol.
- Faire une incision dans la peau du dos et tirez doucement vers les membres postérieurs jusqu'à ce qu'il soit retiré, exposant complètement la musculature des membres postérieurs.
- Utilisez la pince pour enlever les tissus adipeux sans endommager les muscles.
- Pour supprimer les muscles dorsaux des membres postérieurs, garder le membre tendu et plier la patte pour exposer les tendons du talon. Utilisez les ciseaux courbes de muscle séparé de l'os, à partir des tendons, en faisant coulisser doucement et coupe vers le haut. Exciser les muscles et les placer dans DPBS glacé.
- Isoler les quadriceps en pinçant le muscle avec une pince à pointe fine et couper autour d'elle, sans endommager le fémur ou l'articulation du genou.
- Après dissection tous les animaux, procéder à une hotte à flux laminaire de culture cellulaire stérile, où toutes les étapes suivantes doivent être effectuées.
2. myoblastes Isolation
- Retirer l'excès de DPBS. Émincer le tissu avec des ciseaux courbes stérilisées afin d'obtenir une masse uniforme.
- Recueillir le tissu haché dans un tube à centrifuger conique de 50 ml à l'aide de 5 ml de la digestion et de mélange incuber sous agitation à 37 ° C pendant 90 min.
- Mettre un terme à la digestion en ajoutant 6 ml de milieu de dissection et centrifuger la suspension pendant 5 mn à 75 x g pour sédimenter les tissus restants.
- Recueillir soigneusement le surnageant. Assurez - vous de ne pas ramasser les débris de tissu. Centrifuger à 350 g pendant 5 min; remettre en suspension dans 5 ml de milieu de dissection.
- Filtrer la suspension de cellules à travers un tamis cellulaire de 40 pm. Ajouter 25 mL de milieu de dissection et preplate dans un plat de 150 mm pendant 4 h dans un incubateur de culture cellulaire (37 ° C et 5% de CO 2 </ Sub>) pour permettre les fibroblastes adhèrent.
- Alors que prédépôt, plats manteau avec 500 pi de sous-sol matrice de membrane diluée 1: 100 dans IMDM froid pendant 1 h à température ambiante. Laver une fois avec du DPBS et plaque les cellules immédiatement (étape 2.8) ou à laisser avec un milieu de croissance jusqu'à ce que le placage.
- Après prédépôt, recueillir le surnageant et centrifuger à 350 g pendant 10 min.
- Remettre en suspension dans un milieu de croissance et à compter les cellules sur un hémocytomètre. Réglez le volume de sorte qu'entre 150.000 et 250.000 cellules sont étalées par membrane basale plat de matrice revêtu. Maintenir les cellules dans un incubateur de culture cellulaire.
3. myofibre Différenciation
NOTE: Après 3 d, les cellules devraient commencer à fusibles et forment myotubes à environ 70% de confluence (figure 1B).
- A ce stade, transfecter les cellules, si on le désire, avec un ARNsi ou d'ADN présentant un intérêt. Si les cellules ne sont pas à transfecter, passer directement à un milieu de différenciation et de skip à l'étape 3.4.
- Transfecter avec des réactifs de transfection en suivant les instructions du fabricant. Incuber les cellules pendant 5 h avec des complexes d'ARNsi-lipide (20nm + 1 pl de réactif) ou des complexes d'ADN-lipide (1 pg + 1 pl de réactif). Optimiser les concentrations de siRNA et d'ADN si nécessaire.
- Lavez-les une fois avec un milieu de différenciation, puis passer à nouveau milieu de différenciation.
- Le jour suivant, on dilue la matrice de la membrane basale 1: 2 dans un milieu de différenciation glacée. Retirez le support existant et ajouter 200 pi de matrice glacée à chaque plat.
- Incuber pendant 30 min dans un incubateur de culture cellulaire.
- Compléter le milieu de différenciation avec l'agrine (100 ng / ml) et on ajoute avec précaution 2 ml aux cellules.
- changer soigneusement la moitié du milieu tous les 2 d, toujours en complétant avec agrine à une concentration finale de 100 ng / ul.
- Surveiller la différenciation cellulaire et la viabilité. En fonction de divers facteurs (tels que FBS et cHicken extrait d'embryon origines), les cellules peut prendre entre 5-10 différenciation d pour atteindre sa pleine maturation (figure 2).
4. immunocoloration en plats à fond de verre
- Pour immunocoloration, à tout moment, point d'intérêt, laver les cellules une fois avec DPBS et les fixer avec 4% de PFA à température ambiante pendant 10 min.
- Lavez-les deux fois avec DPBS. À ce stade, les cellules peuvent être conservées à 4 ° C.
- les perméabiliser avec 0,5% de Triton X-100 pendant 5 min à température ambiante.
- Lavez-les deux fois avec du PBS et bloquer avec une solution de blocage pendant 30 min à température ambiante.
- les Incuber avec l'anticorps primaire dilué dans une solution de blocage O / N à 4 ° C.
- Lavage 3x avec du DPBS pendant 5 min à température ambiante.
- les laisser incuber avec l'anticorps secondaire, et 0,2 pg / ml de DAPI pendant 1 h à température ambiante.
- Lavage 3x avec du DPBS pendant 5 min à température ambiante.
- Ajouter 200 ul de milieu de montage et procéder à l'imagerie.
Résultats
La mesure du développement des fibres musculaires est essentiellement déterminée par la pureté et la viabilité des myoblastes isolés. L'adhérence, la prolifération et la capacité de fusion peut être utilisé pour accéder à ces paramètres de façon empirique (figure 1 A, B). À la prolifération D2, les myoblastes auraient adhéré et devraient afficher la forme typique fusiforme. Prolifération devrait se produire largement à ce stade, ce qui conduit à la formation de myotubes spontanée le jour suivant (figure 1B).
Cellule de confluence pourrait avoir besoin de légers ajustements. Il devrait être augmenté si les myoblastes prennent plus de 3 d à proliférer et fusible. Il devrait être diminuée si myofibres ne sont pas autorisés à croître et allongé relativement simple en raison de leur densité. Confluence diminue généralement depuis le centre jusqu'à la périphérie de la coupelle, de sorte que les meilleures fibres musculaires doivent être trouvées vers les régions externes.
Myotubes vont rapidement allongée et affichage multiple de noyaux alignés au centre (Figure 1C). Par D5, certaines cellules commencent à acquérir des striures et en déplaçant leurs noyaux vers la périphérie. Le nombre de myofibres avec des caractéristiques matures augmentera avec le temps, ainsi que d' une épaisseur de cellule (figure 1D).
Le degré de différenciation peut encore être observé par immunofluorescence. Myofibres fixes à la différenciation D8 triades présente transversales. Cela peut être confirmé par des composants d'imagerie des T-tubules (DPHR) et le SR (triadine), qui devraient colocalisent les triades (figure 2).
La fonctionnalité de myofibres peut être traitée par l'imagerie en direct. De la différenciation D3 partir, les cellules présentent des contractions spontanées. En transfectant un capteur de calcium (par exemple ,., GCaMP6f 11), il est possible d'observer que les contractions sont couplées avec des pics de calcium (Figure 3).
Grâce à ce système, nous avons été en mesure d'identifier une voie moléculaire roman qui est perturbée dans les myopathies de centronucléaires et dystrophies myotonique, qui peut donc être une nouvelle cible pour les thérapies moléculaires innovants 7. Nous avons également adapté cette méthode pour étudier le développement de la jonction neuromusculaire (JNM) 12. À travers la co - culture avec la moelle épinière chez le rat explants de moelle, nous avons décrit un rôle dans la formation dynéine NMJ 13.

Figure 1: Stades de développement de la culture myoblastes. A) À la prolifération D2, myoblastes ont adhéré et ont commencé à proliférer. B) À prolifration D3, une confluence de 60-80% est atteint et commence la fusion de myoblastes spontanément. C) A la différenciation D3, myotubes contenant des noyaux situés au centre sont prédominants. D) De la différenciation D5 partir (par exemple, le jour 8), myofibres commencer présentant des stries et des noyaux périphériques et commencent à épaissir. Barre d'échelle: 50 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
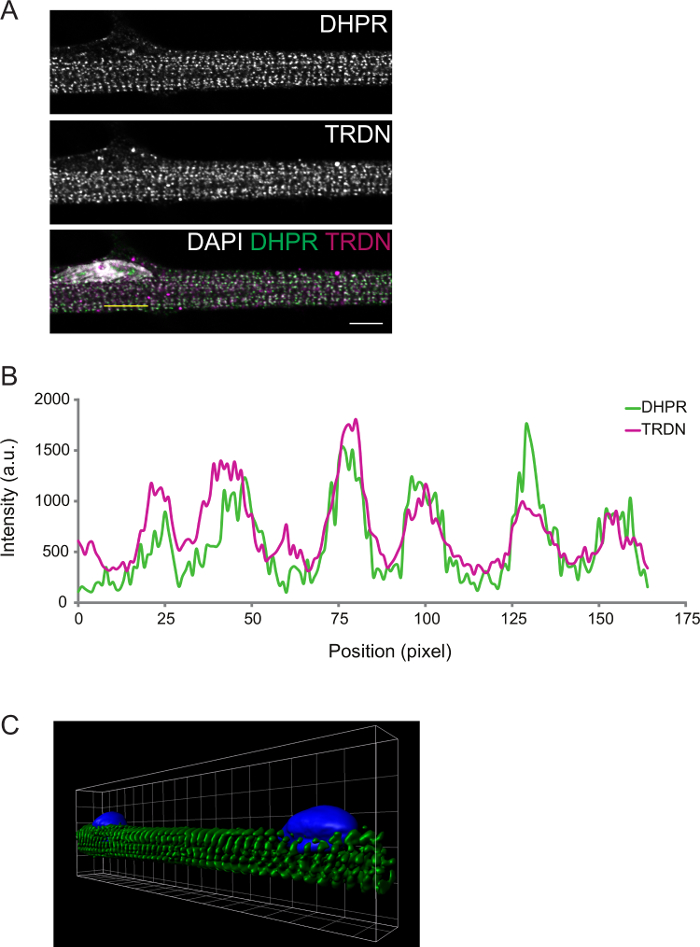
Figure 2: Représentant confocale Image d'un J8 myofibre immunocoloration. A) immunocoloration pour le récepteur de la dihydropyridine (DHPR, panneau supérieur) et triadine (TRDN, panneau du milieu). Une superposition des canaux DHPR, TRDN et DAPI montre colocalisation des composants de la triade. B) Un profil d'intensité de la ligne jaune tracée dans A. C) Une image 3D de rendu de volume de myofibres colorées pour α-actinine (vert) et DAPI (bleu). Barre d'échelle et de la grille largeur: 5 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
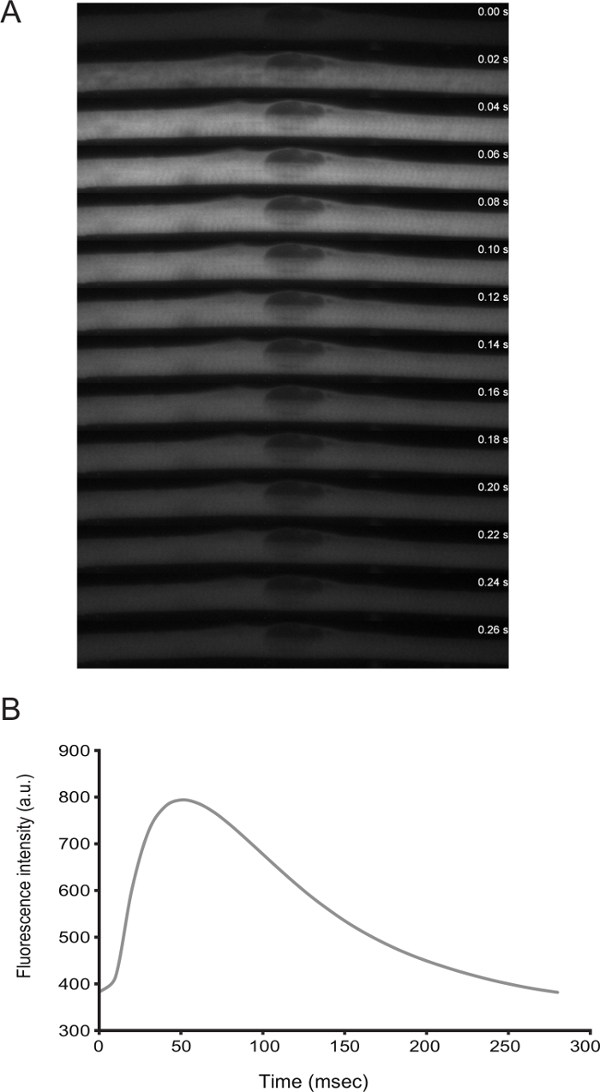
Figure 3: Imagerie en direct des niveaux de calcium dans myofibres avec Spontaneous Twitching. A) haute vitesse time-lapse (trames de 20 ms) la microscopie d'une étincelle de calcium dans un myofibre de secousses. Le calcium a été détectée par l'expression de GCaMP6f (Addgene plasmide # 40755). B) Quantification de l'intensité de la fluorescence au cours du temps pour le capteur de calcium dans le panneau A._blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
L'utilisation de ce protocole pour la culture des myoblastes primaires donne lieu à un créneau particulier qui nourrit grandement le développement de myofibres. Ceci est partiellement dû à d'autres types de cellules qui sont également présentes en très petits nombres. Un équilibre entre la concentration de myoblastes et la pureté de la culture doit être atteint. Une bonne culture de cellules dépend également de la qualité des produits utilisés pour la formulation de milieu. Tous les produits dérivés d'origine animale doivent être soigneusement testés. Dans notre expérience, les conditions de digestion doivent également être surveillés.
Comme d'habitude pour les cultures primaires, la variabilité expérimentale peut être plus élevé que dans les études avec des fibres isolées ou myoblastes immortalisés. Cette variabilité peut être diminuée par la normalisation des moyens et la digestion des composants, des souris âge et la taille, et les points de temps pour la manipulation de la culture et des résultats collection. Néanmoins, l'avantage de scruter en temps réel les mécanismes complexesnécessaire pour le développement de myofibre dépasse largement l'inconvénient de la variabilité.
Ce protocole confère les avantages des approches in vitro sans compromettre la différenciation cellulaire. Myofibres matures jusqu'à triades sont formées et les contractions sont couplées à des étincelles de calcium. Ces sorties fonctionnelles sont accessibles dans différentes conditions expérimentales. En outre, il peut y avoir de nombreuses variantes techniques apportées au protocole. Les myoblastes peuvent être récoltées à partir de souris néonatales avec des mutations d'intérêt liés au développement musculaire. Les cellules peuvent être lysées pour une analyse biochimique à différents points de temps de différenciation. Les indicateurs de calcium peuvent être ajoutés à la culture à suivre sa dynamique. constructions optogénétiques peuvent être utilisés pour appliquer certaines voies de signalisation ou d'induire des réponses locales spécifiques. Enfin, les myofibres peuvent être co-cultivées avec des types d'autres cellules pour étudier leurs interactions.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
This work was supported by the European Research Council (ERG) and EMBO installation (ERG) and by a PhD fellowship from the Fundação para a Ciência e Tecnologia (MP).
matériels
| Name | Company | Catalog Number | Comments |
| Dispase II | Gibco | 17105041 | |
| Collagenase type V | Sigma-Aldrich-Aldrich | C9263 | |
| IMDM, Glutamax supplemented | Gibco | 31980022 | |
| Matrigel Growth reduced factor | Corning | 354230 | protein concentration of the lot should be around 10 mg/mL and endotoxin result should be <1.5 |
| Chicken Embryo Extract | MP biomedical | 2850145 | it is also possible to prepare in the lab (Danoviz ME, Yablonka-Reuveni Z. Methods Mol Biol (2012)) |
| Recombinant rat agrin | R&D systems | 550-AG-100 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Horse Serum | GE Healthcare | 11581831 | |
| Lipofectamine RNAiMAX | Invitrogen | 13778-150 | used to transfect siRNA |
| Lipofectamine LTX | Invitrogen | 15338-100 | used to transfect DNA |
| Lipofectamine 2000 | Invitrogen | 11668030 | used to transfect siRNA plus DNA |
| DPBS | Gibco | 14190094 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF0001 | |
| Cell strainer | Corning | 21008-949 | |
| Fluorodishes | World precision instruments | FD35-100 | dishes used to cultivate cells for live imaging |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| 16% PFA (Paraformaldehyde) | Science Services GmbH | E15710 | |
| Goat Serum | Sigma-Aldrich | G9023 | |
| BSA (Bovine Serum Albumine) | Sigma-Aldrich | A7906 | |
| Saponine | Sigma-Aldrich | 47036 | |
| DAPI | Sigma-Aldrich | D9542 | use at 200 ng/µL |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| Name | Company | Catalog Number | Comments |
| Solutions and Media | |||
| Digestion Mix | in DPBS 5 mg/mL collagenase 3.5 mg/mL dispase sterile filtered, can be stored in working aliquotes for 2 weeks at -20 °C | ||
| Dissection Medium | in IMDM Glutamax supplemented 10% FBS 1% Penicillin/Streptomycin sterile filtered | ||
| Growth Medium | in IMDM Glutamax supplemented 20% FBS 1% Chicken Embryo Extract 1% Penicillin-Streptomycin sterile filtered | ||
| Differentiation Medium | in IMDM Glutamax supplemented 2% Horse Serum 1% Penicillin-Streptomycin sterile filtered | ||
| Blocking Solution | in DPBS 10% Goat Serum 5% BSA add 0.1% saponine when incubating with primary and secondary antibodies |
Références
- Janssen, I., Heymsfield, S. B., Wang, Z., Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol. 89 (1), 81-88 (2000).
- Manring, H., Abreu, E., Brotto, L., Weisleder, N., Brotto, M. Novel excitation-contraction coupling related genes reveal aspects of muscle weakness beyond atrophy-new hopes for treatment of musculoskeletal diseases. Front Physiol. 5, 37 (2014).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270 (5639), 725-727 (1977).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. J Vis Exp. (73), (2013).
- Meng, H., Janssen, P. M. L., et al. Tissue Triage and Freezing for Models of Skeletal Muscle Disease. J Vis Exp. (89), (2014).
- Demonbreun, A. R., McNally, E. M. DNA Electroporation, Isolation and Imaging of Myofibers. J Vis Exp. (106), (2015).
- Falcone, S., Roman, W., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6 (11), 1455-1475 (2014).
- Flucher, B. E., Phillips, J. L., Powell, J. A. Dihydropyridine receptor alpha subunits in normal and dysgenic muscle in vitro: expression of alpha 1 is required for proper targeting and distribution of alpha 2. J Cell Biol. 115 (5), 1345-1356 (1991).
- Cooper, S. T., Maxwell, A. L., et al. C2C12 co-culture on a fibroblast substratum enables sustained survival of contractile, highly differentiated myotubes with peripheral nuclei and adult fast myosin expression. Cell Motil Cytoskeleton. 58 (3), 200-211 (2004).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle. 1, 26 (2011).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system to study mechanisms of neuromuscular junction development and maintenance. Development. , (2016).
- Vilmont, V., Cadot, B., Vezin, E., Le Grand, F., Gomes, E. R. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 6, 27804 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon