Method Article
라이브 영상에 대한 성숙한 근섬유의 체외 분화
요약
Muscle cells are among the most complex eukaryotic cells. We present a protocol for the in vitro differentiation of highly mature myofibers that allows for genetic manipulation and clear imaging during all developmental stages.
초록
골격 근육은 근섬유 가장 큰 포유 동물의 체내에서 세포와 몇 syncytia의 한 구성된다. 어떻게 그것을 구성하는 복잡하고 진화 적으로 보존 된 구조를 조립하는 조사를 받고 남아있다. 크기와 생리 학적 기능은 종종 조작 및 이미징 응용 프로그램을 제한. 불멸화 세포주의 배양에 널리 사용되지만, 단지 분화의 초기 단계를 복제 할 수있다.
여기, 우리는 기본 마우스 근육 아세포에서 발생하는 근섬유의 쉬운 유전자 조작을 가능하게하는 프로토콜을 설명합니다. 차별화 일주일 후, 근섬유가 수축 정렬 근섬유 분절과 화음뿐만 아니라 주변 핵을 표시합니다. 전체 분화 과정은 라이브 영상이나 면역 형광 다음에 할 수 있습니다. 이 시스템은 기존의 생체 외 및 생체 외 프로토콜의 이점을 결합한다. 쉽고 효율적인 형질 전환의 가능성뿐만 아니라,모든 분화 단계에 대한 접근의 용이성 응용 가능성을 넓게. 근섬유이어서 관련 발생 및 세포 생물학 문제를 해결할뿐만 아니라, 임상 적 적용을위한 근육 질환 표현형을 재현 할뿐만 아니라, 사용될 수있다.
서문
골격근은 몸무게 1 40 %를 구성한다. 근육 관련 질환은 엄청난 건강과 경제적 부담이를 나타냅니다. 이 매우 복잡하고 조직화 된 조직이 형성 유지 및 재생하는 방법을 광범위하고 잘 확립 된 연구 분야를 구성한다. 6 - 특정 과학적인 관심에 따라 가장 적합한 방법은 생체 내 모델 3 복잡한 간단한 myotube 문화에 이르기까지 다양 할 수 있습니다.
이 프로토콜의 목적은 실시간 영상 및 면역을 통한 근육 생성을 모니터링 할 수있는 시험 관내 시스템을 제공하는 것이다. 전통적인 접근 방법에 비해,이 시스템은 마우스 근육 조직 과정에 매우 완전한 동적 통찰력을 제공한다. 세포 횡단 화음 및 주변 핵 (7)를 표시하는 성숙한, 다핵 근섬유에 근원 세포 단계에서 따라 할 수 있습니다. 이 성숙 수준 수복잡한 자극 또는 기계 장치를 필요로하지 않고, 보통 세포 배양 장치를 이용하여 달성 될 수있다. 체외 시스템에 약간의 성공은 8,9를보고되었지만, 우리의 지식, 이것은 횡 근질 그물 자리 (SR)와 결합 T-tubules와 성숙 마우스 근섬유를 생성하는 유일한 프로토콜입니다. 따라서,이 시험 관내 시스템은 여전히 좋지 10 이해 트라이어드 형성의 분자 메커니즘을 연구하기 위해 이용 될 수있다.
본 시스템의 또 다른 장점은 항체, 약물, 및 RNAi의 도구로서 유효 마우스 타겟 자원의 가용성이다. 비교적 간단한 프로토콜은 힘든 단계, 고도로 숙련 된 조작, 또는 고가의 전용 장비를 필요로하지 않습니다. 성숙 근섬유는 칼슘 스파크 (게시되지 않은 데이터)과 함께 수축력을 표시, 문화의 분화 (7)의 5 D 후 나타나는 시작합니다. 일주에서, 다른 개발포유 동물 신체에서 가장 복잡한 셀들 중 하나의 스테이지 등은 시험 관내 분석의 다양한 조합으로 연구 될 수있다.
프로토콜
참고 : 약 2 35mm 요리 또는 두 개의 라이브 영상 요리, 그래서 계획 mattings, 해부, 따라서 코팅 (단계 2.6)에 대한 하나의 마우스 수익률 충분한 근육 아세포. (10) 동물 - 근육 아세포가 순차적 회 원심 및 예비 도금을 통해 고립되어 있기 때문에, 프로토콜은 5 일괄 적으로 수행해야합니다.
동물 주제와 관련된 모든 절차는 연구소의 드 Medicina 분자와 대학의 피에르 등의 마리 퀴리의 동물 윤리위원회에 의해 승인되었다
신생아 쥐 뒷다리 - 사지 근육의 1. 해부
- 사전 (재료 표)의 모든 솔루션을 준비하고 여과 (0.22 μm의 필터)에 의해 소독. 모든 미디어가 기저막 매트릭스 (예를 들어, 마트 리겔)를 포함하는 제제를 제외하고, 세포에 추가하기 전에 37 ° C에 있는지 확인합니다.
- 곡선 가위, 바로 가위, 일반 집게 : 해부 물질 (하나의 각을 소독미세 팁 포셉) 및 70 % 에탄올로 닦아 워크 벤치입니다.
- 근육 수집 둘 베코 인산염 완충 생리 식염수 (DPBS) 5 mL를 가진 100mm 페트리 접시를 준비하고 닦지 단계까지 얼음에 보관하십시오.
- 직선 가위 P8 마우스 및 70 % 에탄올로 피부를 소독 - P6을 참살.
- 다시 피부에 절개를하고 완전히 뒷다리 - 사지 근육을 노출, 제거 될 때까지 뒷다리쪽으로 부드럽게 잡아 당깁니다.
- 근육을 손상시키지 않고 지방 조직을 제거하는 집게를 사용합니다.
- 지느러미 뒷다리 - 사지 근육을 제거하려면 뻗어 사지를 유지하고 발 뒤꿈치 힘줄을 노출하는 발을 구부. 부드럽게 슬라이딩 위쪽으로 절단하여, 힘줄에서 시작, 뼈에서 별도의 근육에 곡선 가위를 사용합니다. 근육을 절제하고 아이스 DPBS에 배치합니다.
- 좋은 팁 집게로 근육을 곤란 및 대퇴골 또는 무릎 관절에 손상을주지 않고 주위 절단하여 대퇴사 두근을 분리합니다.
- 모든 동물을 해부 한 후, 다음의 모든 단계를 수행해야 멸균 층류 세포 배양 후드를 진행합니다.
2. 근육 모세포 분리
- DPBS의 초과를 제거합니다. 일정한 질량을 얻기 위해서는 멸균 곡선 위 조직을 말하다.
- 소화 혼합물 5 mL를 이용하여 50 ㎖의 원추형 원심 분리 튜브에 다진 조직을 수집하고 90 분 동안 37 ℃에서 교반하여 배양한다.
- 나머지 조직을 펠렛 (75) XG에서 해부 매체와 원심 분리기 5 분 동안 정지를 6 mL로 추가하여 소화를 중지합니다.
- 조심스럽게 상층 액을 수집합니다. 조직 파편을 수집하지해야합니다. 5 분 350 XG에 그것을 원심 분리기; 해부 배지 5ml에이를 재현 탁.
- 40 μm의 세포 여과기를 통하여 세포 현탁액을 필터. 25 ㎖ 해부 매질에 추가하고, 세포 배양 인큐베이터에서 4 시간 (37 ℃, 5 % CO 2 <하는 150mm의 접시를 preplate/ 서브>) 섬유 아세포가 준수 할 수 있도록.
- RT에서 1 시간 동안 차가운 IMDM 100 : 예비 도금 동안 기저막 매트릭스 500 μL 코트 접시 1 희석. DPBS로 한번 세척하고 즉시 세포를 플레이트 (2.8 단계) 또는 도금까지 성장 매체로 둡니다.
- 예비 도금 후, 상등액을 수집하고 10 분 동안 350 × g으로 원심 분리하여 그것을.
- 성장 배지에 재현 탁하고을 혈구 세포의 수를 계산. 15 만 내지 25 만 세포가 기저막 매트릭스 코팅 접시 당 도금되도록 볼륨을 조절합니다. 세포 배양 인큐베이터에서 세포를 유지한다.
3. 근섬유의 차별화
참고 : 3 일 후, 세포가 약 70 %의 컨 플루 (그림 1B)에서 퓨즈 및 양식 myotubes로 시작해야합니다.
- 원하는 경우,이 시점에서, 또는 관심의 siRNA와 DNA, 세포를 형질. 세포를 형질 전환 할 수없는 경우, 분화 배지로 직접 변경 스키p는 3.4로 진행한다.
- 제조업체의 지침에 따라 형질 전환 시약과 형질. siRNA의 지질 복합체 5 시간 동안 세포 (시약 20 nM의 + 1 μL) 또는 DNA 지질 복합체 (1 μg의 시약 + 1 μL)을 품어. 필요한 경우의 siRNA 및 DNA 농도를 최적화합니다.
- 차별화 매체로 한 번에 세척 한 후 새로운 차별화 매체로 전환합니다.
- 다음 날, 기저막 매트릭스 1을 희석 : 2 얼음처럼 차가운 차별화 매체에. 기존 매체를 제거하고 각 접시에 얼음처럼 차가운 행렬의 200 μL를 추가합니다.
- 세포 배양 인큐베이터에서 30 분 동안 인큐베이션.
- 아 그린과 차별화 매체 (100 NG / ㎖)을 보충 조심스럽게 셀에 2 mL를 넣어.
- 조심스럽게 항상 100 NG / μL의 최종 농도 아 그린과 보완, 매체의 반마다 2 일을 변경합니다.
- 세포 분화 및 생존 능력을 모니터링합니다. 이러한 FBS와 C 등의 요인 (다양한에 따라전체 성숙 (그림 2)에 도달하는 10 분화 D - hicken는 배아 추출물 기원), 세포는 5 ~ 걸릴 수 있습니다.
유리 바닥 요리 4. 면역 염색
- 면역 염색에 대한 관심의 시간 지점에서, 10 분 동안 실온에서 4 % PFA로를 DPBS로 한 번 세포를 씻어 수정합니다.
- DPBS로 두 번을 씻으십시오. 이 시점에서, 세포를 4 ℃에서 저장 될 수있다.
- RT에서 5 분 동안 0.5 % 트리톤 X-100을 Permeabilize 하시려면.
- PBS로 두 번을 씻고 RT에서 30 분 동안 차단 솔루션으로 차단합니다.
- 솔루션 O / N 4 ℃에서 차단에 희석 차 항체를 품어.
- 실온에서 5 분간 DPBS 씻을 배.
- 이차 항체와 실온에서 1 시간 동안 DAPI의 0.2 μg의 / mL로 그들을 품어.
- 실온에서 5 분간 DPBS 씻을 배.
- 설치 매체의 200 μL를 추가하고 이미지로 이동합니다.
결과
근섬유 개발의 범위는 주로 절연 아세포의 순도 및 생존 능력에 의해 결정된다. 접착 증식 및 융합 용량 경험적 이러한 파라미터들 (도 1 A, B)에 액세스하기 위해 사용될 수있다. 확산 D2에서 근육 아세포가 준수해야하고 전형적인 방추형 모양을 표시해야합니다. 확산은 자연 myotube 형성 다음날 (그림 1B)로 이어지는,이 단계에서 광범위하게 일어날 것으로 예상된다.
셀 컨 플루는 약간의 조정이 필요할 수 있습니다. 근육 아세포 증식 및 퓨즈 이상 3 일이 걸릴 경우가 증가한다. 근섬유가 그들의 밀도로 성장하고 상대적으로 직선 신장 할 수 없습니다 경우이 감소한다. 가장 근섬유가 외측 영역으로 볼 수 있도록한다 포화 상태는 전형적으로 접시의 외주의 중심에서 감소된다.
Myotubes 빠르게 신장 디스플레이 여러 중앙 정렬 핵 (도 1C을)한다. D5으로 일부 세포는 줄무늬를 획득하고 주변에 자신의 핵을 움직이기 시작. 성숙 특성 근섬유의 수는 시간뿐만 아니라, 셀 두께 (도 1D)으로 증가한다.
분화의 정도는 상기 면역 형광에 의해 관찰 될 수있다. 차별화 D8 본 횡단 화음에 고정 근섬유. 이것은 화음 (그림 2)에서 colocalize 것으로 예상되는 T-세관 (DPHR) 및 SR (triadin)의 이미징 구성 요소에서 확인할 수있다.
근섬유의 기능은 실제 촬상에 의해 해결 될 수있다. 이후 차별화 D3에서, 세포는 자연 경련을 표시합니다. 칼슘 센서 형질 저자 (예를 들어., GCaMP6f 11)는 수축 칼슘 피크 (도 3)에 결합되는 것을 관찰 할 수있다.
이 시스템을 사용하여, 우리는 따라서 혁신적인 분자 요법 7의 신규 표적이 될 수 centronuclear의 근육 병증 및 근긴장 성 이영양증에서 파쇄 된 신규 분자 경로를 식별 할 수 있었다. 우리는 또한 신경 근육 접합부 (NMJ) 12의 개발을 연구하는이 방법을 적용하고있다. 쥐의 척수 절편와 공 배양을 통해, 우리는 NMJ 형성 13 네인의 역할을 설명했다.

그림 1 : 근육 모세포 문화의 발달 단계. A) 확산 D2에서, 근육 아세포가 부착 및 증식하기 시작했습니다. prolif에서 B)eration D3 60의 생장 - 80 %에 도달 한 아세포 자발적으로 융합 시작한다. 차별화 D3에서 C)는, 중앙에 위치한 핵을 포함 myotubes이 지배적이다. 이후 차별화 D5에서 D)는 (예를 들어, 하루 8), 근섬유는 줄무늬와 주변 핵을 전시 시작하고 두껍게하기 시작합니다. 스케일 바 : 50 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
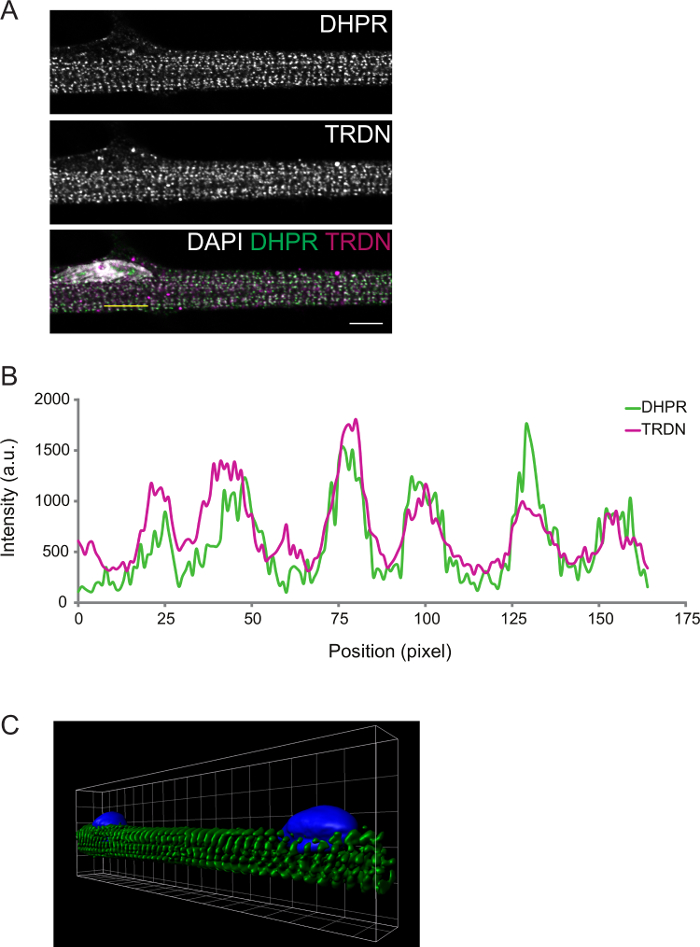
그림 2 : D8 근섬유 발현 사이의 대표 공 촛점 이미지. A) 하이드로 피리딘 수용체 (DHPR, 상단 패널)에 대한 면역 염색과 (TRDN, 중간 패널) triadin. DHPR, TRDN 및 DAPI 채널의 오버레이는 트라이어드 구성 요소의 colocalization을 보여줍니다. B) A.의 C에 그려진 노란 선) α-티닌 (녹색) 및 DAPI (파란색)에 대한 스테인드 근섬유의 볼륨 렌더링의 3D 이미지의 강도 프로파일. 스케일 바, 그리드 폭 : 5 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
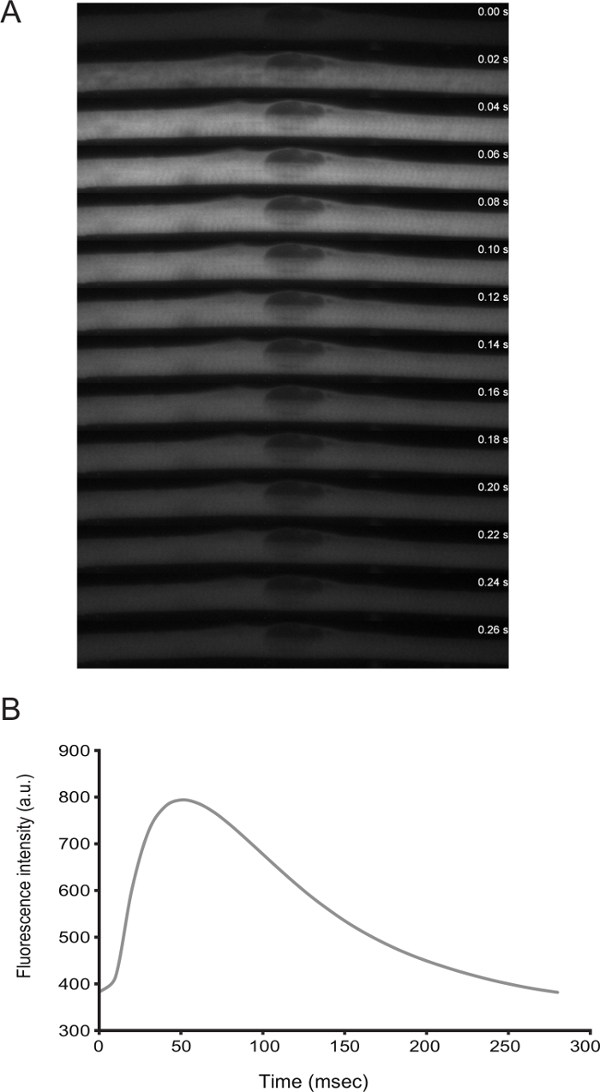
그림 3 : 자발적인 경련과 근섬유의 칼슘 수준의 라이브 영상. 꿈틀 근섬유의 칼슘 스파크의) 고속 시간 경과 (20 밀리 프레임) 현미경. 칼슘은 GCaMP6f의 발현 (Addgene 플라스미드 # 40755)를 통해 검출되었다. 패널 A. 칼슘 센서 시간에 따른 형광 세기의 B) 정량"_blank>이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
기본 아세포의 배양이 프로토콜의 사용은 크게 근섬유의 개발을 육성 특별한 틈새가 발생한다. 이것은 매우 적은 수에 존재하는 다른 유형의 세포에 부분적으로 기인한다. 근원 세포 농도와 문화의 순도 사이의 균형을 달성해야합니다. 좋은 세포 배양 물은 배지 조성물에 사용되는 제품의 품질에 의존한다. 동물의 소스에서 파생 된 모든 제품은 철저하게 테스트해야합니다. 우리의 경험에 의하면, 소화 상태도 모니터링해야합니다.
차 문화에 대한 평소와 같이, 실험적인 변화는 고립 된 섬유 또는 불후의 근육 아세포와 연구에 비해 높을 수있다. 이 변화는 매체 및 소화 구성 요소, 마우스의 나이와 크기 및 문화 조작 및 결과 수집에 대한 시점의 표준화에 의해 감소 될 수있다. 그럼에도 불구하고, 복잡한 메커니즘 실시간 면밀히 장점근섬유 개발에 필요한 크게 변동의 단점을 능가한다.
이 프로토콜은 세포 분화를 손상시키지 않고 생체 외 접근법의 이점을 부여한다. 화음이 형성되고 수축 칼슘 스파크에 결합 될 때까지 근섬유 성숙. 이 기능 출력은 다른 실험 조건에 액세스 할 수 있습니다. 또한, 상기 프로토콜에 대한 다양한 기술 변형이있을 수있다. 근육 아세포는 근육 발달에 관한 관심의 돌연변이와 신생아 생쥐에서 수확 할 수 있습니다. 세포 분화 다른 시점에서의 생화학 적 분석에 용해 될 수있다. 칼슘 지표의 역학을 수행하는 문화에 추가 할 수 있습니다. Optogenetic 구조는 특정 신호 전달 경로를 적용하거나 특정 지역 응답을 유도하는데 사용될 수있다. 마지막으로, 근섬유가 상호 작용을 연구하는 다른 세포 유형과 함께 공동 배양 될 수있다.
공개
저자는 공개 아무것도 없어.
감사의 말
This work was supported by the European Research Council (ERG) and EMBO installation (ERG) and by a PhD fellowship from the Fundação para a Ciência e Tecnologia (MP).
자료
| Name | Company | Catalog Number | Comments |
| Dispase II | Gibco | 17105041 | |
| Collagenase type V | Sigma-Aldrich-Aldrich | C9263 | |
| IMDM, Glutamax supplemented | Gibco | 31980022 | |
| Matrigel Growth reduced factor | Corning | 354230 | protein concentration of the lot should be around 10 mg/mL and endotoxin result should be <1.5 |
| Chicken Embryo Extract | MP biomedical | 2850145 | it is also possible to prepare in the lab (Danoviz ME, Yablonka-Reuveni Z. Methods Mol Biol (2012)) |
| Recombinant rat agrin | R&D systems | 550-AG-100 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140122 | |
| Horse Serum | GE Healthcare | 11581831 | |
| Lipofectamine RNAiMAX | Invitrogen | 13778-150 | used to transfect siRNA |
| Lipofectamine LTX | Invitrogen | 15338-100 | used to transfect DNA |
| Lipofectamine 2000 | Invitrogen | 11668030 | used to transfect siRNA plus DNA |
| DPBS | Gibco | 14190094 | |
| Fetal Bovine Serum (FBS) | Eurobio | CVFSVF0001 | |
| Cell strainer | Corning | 21008-949 | |
| Fluorodishes | World precision instruments | FD35-100 | dishes used to cultivate cells for live imaging |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| 16% PFA (Paraformaldehyde) | Science Services GmbH | E15710 | |
| Goat Serum | Sigma-Aldrich | G9023 | |
| BSA (Bovine Serum Albumine) | Sigma-Aldrich | A7906 | |
| Saponine | Sigma-Aldrich | 47036 | |
| DAPI | Sigma-Aldrich | D9542 | use at 200 ng/µL |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| Name | Company | Catalog Number | Comments |
| Solutions and Media | |||
| Digestion Mix | in DPBS 5 mg/mL collagenase 3.5 mg/mL dispase sterile filtered, can be stored in working aliquotes for 2 weeks at -20 °C | ||
| Dissection Medium | in IMDM Glutamax supplemented 10% FBS 1% Penicillin/Streptomycin sterile filtered | ||
| Growth Medium | in IMDM Glutamax supplemented 20% FBS 1% Chicken Embryo Extract 1% Penicillin-Streptomycin sterile filtered | ||
| Differentiation Medium | in IMDM Glutamax supplemented 2% Horse Serum 1% Penicillin-Streptomycin sterile filtered | ||
| Blocking Solution | in DPBS 10% Goat Serum 5% BSA add 0.1% saponine when incubating with primary and secondary antibodies |
참고문헌
- Janssen, I., Heymsfield, S. B., Wang, Z., Ross, R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol. 89 (1), 81-88 (2000).
- Manring, H., Abreu, E., Brotto, L., Weisleder, N., Brotto, M. Novel excitation-contraction coupling related genes reveal aspects of muscle weakness beyond atrophy-new hopes for treatment of musculoskeletal diseases. Front Physiol. 5, 37 (2014).
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270 (5639), 725-727 (1977).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. J Vis Exp. (73), (2013).
- Meng, H., Janssen, P. M. L., et al. Tissue Triage and Freezing for Models of Skeletal Muscle Disease. J Vis Exp. (89), (2014).
- Demonbreun, A. R., McNally, E. M. DNA Electroporation, Isolation and Imaging of Myofibers. J Vis Exp. (106), (2015).
- Falcone, S., Roman, W., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6 (11), 1455-1475 (2014).
- Flucher, B. E., Phillips, J. L., Powell, J. A. Dihydropyridine receptor alpha subunits in normal and dysgenic muscle in vitro: expression of alpha 1 is required for proper targeting and distribution of alpha 2. J Cell Biol. 115 (5), 1345-1356 (1991).
- Cooper, S. T., Maxwell, A. L., et al. C2C12 co-culture on a fibroblast substratum enables sustained survival of contractile, highly differentiated myotubes with peripheral nuclei and adult fast myosin expression. Cell Motil Cytoskeleton. 58 (3), 200-211 (2004).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet Muscle. 1, 26 (2011).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system to study mechanisms of neuromuscular junction development and maintenance. Development. , (2016).
- Vilmont, V., Cadot, B., Vezin, E., Le Grand, F., Gomes, E. R. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 6, 27804 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유