Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode de calcul pour quantifier l’activité circadienne mouche
Dans cet article
Résumé
On présente une méthode pour quantifier les principales caractéristiques temporelles vus voler rythmes locomotrice circadienne. La quantification est réalisée par montage mouche activité avec une forme d’onde modèle multi paramétrique. Les paramètres du modèle décrivent la forme et la taille du matin et les sommets de la soirée de l’activité quotidienne.
Résumé
Dans la plupart des animaux et des plantes, horloges circadiennes orchestrent les processus comportements et moléculaires et les synchronisent au quotidien cycle lumière-obscurité. Les mécanismes fondamentaux qui sous-tendent ce contrôle temporel sont largement étudiés à l’aide de la drosophile Drosophila melanogaster comme un organisme modèle. Chez les mouches, l’horloge est généralement étudié en analysant plusieurs jours enregistrement locomotrice. Une telle inscription montre un schéma complexe bimodal avec deux pics d’activité : une pointe du matin qui se passe autour de l’aube et un pic de la soirée qui se passe autour de crépuscule. Ces deux pics forment une forme d’onde qui est très différent des oscillations sinusoïdales observée dans les gènes de l’horloge, ce qui suggère que les mécanismes en plus de l’horloge ont des effets profonds en produisant les tendances observées dans les données comportementales. Ici nous fournissent des instructions sur l’utilisation d’une méthode de calcul développée récemment que mathématiquement décrit les tendances temporelles dans l’activité de mouche. La méthode s’adapte à des données d’activité avec une forme d’onde du modèle qui se compose de quatre termes exponentiels et neuf paramètres indépendants qui décrivent parfaitement la forme et la taille du matin et les soirée pics d’activité. Les paramètres extraits peuvent aider à élucider les mécanismes cinétiques des substrats qui sous-tendent les patrons d’activité bimodal fréquemment observés dans les rythmes locomotrices mouches.
Introduction
L’horloge circadienne est un oscillateur endogène biochimique avec une période d’environ 24 heures et est presque omniprésent chez les animaux et plantes1,2. L’horloge permet de synchroniser les processus internes de l’organisme et le comportement au cycle noir lumière externe. La structure génétique de l’horloge circadienne a été largement étudiée depuis les années 1960 à l’aide de la mouche à fruit, d. melanogaster. Chez cet insecte, le noyau de l’horloge circadienne est constitué de quatre protéines : période, TIMELESS, horloge et CYCLE. Ces éléments de base ainsi que d’autres molécules forment une boucle de rétroaction qui produit des oscillations sinusoïdales près horloge gènes3,4. L’horloge circadienne chez les mouches est largement étudié en utilisant des enregistrements de locomotrices plusieurs jours où l’activité mouche est détectée avec un seul faisceau infrarouge traverse au milieu de chaque tube5. Une mouche typique d’enregistrement a un patron bimodal complexe avec deux pics bien distinctes : de pointe du matin (M) qui commence à la fin de la nuit et a un maximum lorsque les lumières s’allument ; et le pic de soir (E) qui commence à la fin de la journée et a un maximum lorsque lumières coupe6. Fait intéressant, la forme de cet enregistrement comportemental est très différente des oscillations sinusoïdales simples observées à l’échelle moléculaire, ce qui suggère l’action d’autres mécanismes qui contribuent aux tendances temporelles observées. Pour mieux comprendre ces mécanismes cachés, nous avons développé un outil de calcul qui fournit une description quantitative des tendances temporelles.
Dans notre travail, rythmes locomoteurs sont définis par une forme d’onde qui imite le modèle d’activité mouche. Étant donné que les ondes sinusoïdales simples ne peuvent servir à modéliser les changements rythmiques observés en activité, nous avons testé différentes formes de signaux pour sélectionner le plus simple qui capture toutes les caractéristiques saillantes dans les enregistrements. Mouche des fruits circadienne comportement est contrôlé par l’activité des neurones d’horloge qui ont souvent des modèles exponentiels de l’activation et la désactivation7. La dynamique exponentielle et l’analyse visuelle des données nous motivés pour construire un modèle avec des termes exponentiels consistant en quatre exposants avec neuf paramètres indépendants et ressemblant étroitement à l’activité fly modèle8. En plus des données locomotrices, nous analysons également son spectre de puissance. Spectre d’activité mouche typique montre plusieurs pics harmoniques T02, T03, etc., en plus du pic fondamentaux attendu à la période circadienne T0. Selon le théorème de Fourier, seulement une onde sinusoïdale pure produit un seul pic dans les spectres de puissance, alors que les signaux plus complexes présentent plusieurs pics spectraux aux harmoniques de la période primaire (Figure 1). Par conséquent, étant donné le modèle temporel non sinusoïdale en activité mouche8, un spectre de puissance multi-pointe des données devrait mathématiquement et n’implique pas nécessairement la présence de multiples périodes d’oscillation. Ce qui est important, le spectre de puissance de l’onde du modèle proposé montre également pics à toutes les harmoniques de la période primaire, semblable aux mouches enregistrements locomotrices, soulignant ainsi la haute fidélité avec laquelle notre modèle décrit les données mouches en temps et en fréquence.
Avec des résolutions de temps de quelques minutes ou moins, l’activité mouche données semble bruyantes, rendant difficile d’extraire les paramètres directement à partir de données brutes. Binning données dans des intervalles de temps plus longs peuvent réduire le niveau de bruit, mais, peuvent modifier les données d’une manière qui peut influer sur l’estimation des paramètres du modèle. Nous obtenons donc les paramètres des spectres de puissance des relevés, à l’aide d’une expression analytique pour les spectres de puissance prévue, calculées à partir de la transformée de Fourier de la fonction modèle8 (voir fiche supplémentaire 1 de référence8). Cette approche d’obtenir paramètres à partir des spectres de puissance donne des valeurs de paramètre précise sans aucune manipulations supplémentaires, tels que binning ou de filtrage, des données brutes de l’activité. Des détails mathématiques du modèle et des applications aux données de type sauvage et les mutantes sont décrites dans référence8. Le protocole présenté ici se concentre sur les étapes à suivre pour utiliser l’outil informatique.
Protocole
1. mesurant Fly Locomotion utilisant drosophile activité moniteur (DAM)
Remarque : pour plus de détails, voir référence 5.
- Prepare individuel voler des tubes avec de la nourriture à une extrémité et de coton sur l’autre. La fin avec les aliments doit être étanches pour éviter que les aliments ne se dessèchent pas.
- Mettre 5-6 g d’aliment mouche dans un bécher de 50 mL. Coupez les aliments en petits morceaux pour qu’il soit plus facile à fondre it.
- 32 raccorder des tubes de verre individuels avec une bande élastique.
- Fondre les aliments dans le bol en le chauffant dans un four à micro-ondes pour 10-15 s. Stop au micro-ondes tous les 5 s et agiter prudemment le bécher pour assurer la fusion égal de nourriture.
- Alors que la nourriture est encore liquide, mettre les tubes individuels disposés dans le bécher avec de la nourriture. Les tubes de monter et descendre donc ils sont tout aussi remplis.
- Autoriser la nourriture de refroidir et se solidifier pour environ 1 h.
- Une fois les aliments solides, retirer les tubes avec la nourriture du bécher.
- Sceller la fin contenant de la nourriture à l’aide de cire. Tout d’abord, nettoyer soigneusement un tube à l’aide d’une serviette en papier, puis appuyez sur le tube contre la cire. Visuellement vérifier la qualité du joint et le cas échéant, répétez l’étanchéité nouveau.
- Fermer l’autre extrémité du tube avec du coton, coton permettra de traverser tout en gardant une mouche enfermée dans le tube de l’air.
- Placer une mouche unique dans chaque tube individuel et placer les tubes dans le barrage de. Moniteurs de
- Place dans un incubateur qui maintient l’humidité et température constante. Basé sur l’expérience, définir les bonnes conditions de lumière/obscurité comme suit.
- Pour des expériences de lumière/obscurité Gardez les mouches dans cycle lumière/obscurité pour l’expérience entière. N’utilisez pas le premier jour des mesures dans l’analyse.
- Pour des expériences de l’obscurité totale, tout d’abord garder les mouches pendant deux jours dans des conditions de lumière/obscurité pour l’entraînement et la synchronisation des horloges et passera ensuite à l’obscurité totale. Ne pas utiliser les mesures dès le premier jour de l’obscurité totale dans l’analyse.
- Recueillir au moins quatre jours de données qui peuvent être utilisées dans l’analyse.
Remarque : Le système de barrage va afficher un seul fichier avec un enregistrement de locomotion de toutes les mouches dans le moniteur de.
2. Analyse des données
- Split fichier de sortie de l’écran en plusieurs fichiers de la seule activité de mouche, chaque fichier doit être une colonne unique ' .txt ' fichier avec une mesure individuelle de locomotion mouche.
- Run ' ModelFitPS3.m ' fonction dans une fenêtre de commande de Matlab avec les paramètres d’entrée suivants :
- pour samplingrate, définissez l’intervalle d’échantillonnage des données en quelques secondes. Par exemple, si l’activité a été mesurée à chaque minute, entrez 60 comme le samplingrate.
- Pour bin_interval, définissez l’intervalle de temps en minutes auquel les données vont être mis en cellule pour meilleure visualisation ; l’intervalle bin recommandée est de 20-30 min.
- Pour la tendance, entrez " 1 " si les données montrent l’évolution de base et " 0 " autrement ; données avec tendance vont être redressées tout d’abord par montage un polynôme de second ordre et il en soustrayant ensuite les données.
- Dans la fenêtre contextuelle, sélectionnez un fichier de seule activité mouche.
Remarque : La première parcelle est spectre de puissance de données et pas le tracé de l’activité familière. Dans le spectre de puissance tracés, déterminer la période primaire T 0 : cliquez avec le bouton gauche de la souris sur le pic du rythme circadien, ou avec le bouton droit de la souris sur le second pic harmonique (autour de T 0 / 2). - Sur le tracé de données ouvert, vérifiez si le matin et les sommets de la soirée sont bien visualisées. Si ce n’est pas le cas, modifiez la valeur de bin_interval par un clic droit n’importe où sur le graphique et l’entrée de la nouvelle valeur de bin_interval dans la boîte de dialogue. Le programme va redessiner les données avec la nouvelle valeur de l’intervalle. Pour accepter la valeur de bin_interval, à gauche cliquez n’importe où sur le graphe.
- Le programme va redessiner les données à nouveau et montrer les cinq premiers jours d’activité. Sur ce terrain, cliquez sur le premier pic de M qui est utilisé dans l’analyse (parfois il est nécessaire de sauter une ou deux journées).
NOTE : Le programme va redessiner le graphique à partir de la pointe du matin cueillies. Les lignes bleues et rouges indique la position approximative de la E PIC et de la prochaine journée M pic, respectivement, selon la période déterminée à l’étape 2.4. - Sur le même graphique, choisir les données pour un ajustement préliminaire des données avec le modèle : cliquez sur les points suivants (dans cet ordre ; Notez que l’emplacement du clic sera indiquée avec une étoile rouge sur le fond) : le sommet de (i) haut de M ; (ii) la fin du sommet de la M ; (iii) début du pic E ; (iv) haut de la crête E ; (v) la fin du sommet de la E ; (vi) Sommet du pic du lendemain M.
- Notez que le programme présente maintenant le spectre de puissance.
Remarque : L’axe des x est maintenant donné en fréquence.- Dans la fenêtre ouverte avec le spectre de puissance, choisir les points qui seront utilisés pour le montage de l’expression analytique pour le spectre de puissance de modèle. La période détectée à l’étape 2.4 est marquée par une ligne rouge. Pour sélectionner des points de fixation, tout d’abord déterminer approximativement la période primaire, semblable à l’étape 2.4. Puis en utilisant le glisseur, peaufiner la période primaire de valeur pour que le raccord pointe (montré avec les cercles rouges, apparaîtra après avoir déplacé le curseur) sont fermés à des valeurs crête.
- Après la sélection visuelle maximale, cliquez sur " Accept " et le programme s’adaptera à des points choisis avec l’expression analytique pour calculer les paramètres du modèle.
- Notez que les paramètres et l’erreur de forme spectrale sont enregistrés dans le fichier " model_fit_parameters.txtŔ le programme permettra en outre d’économiser 2 chiffres avec des ajustements des données locomotrices et son spectre de puissance.
Résultats
La méthode présentée ici permet la quantification des principales caractéristiques en jacquard de locomotion mouche. La quantification est réalisée en ajustant les données d’activité avec un modèle qui se compose de quatre termes exponentiels :
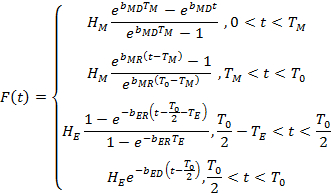
Le modèle a neuf paramètres indépendants qui ...
Discussion
Cet ouvrage présente des instructions pour l’utilisation d’un outil de calcul qui fournit une description quantitative du motif de locomotion mouche. L’outil adapté locomotion données avec un modèle mathématique consistant en quatre termes exponentiels qui ensemble décrivent la forme et la taille des sommets M et E. Les valeurs finales pour les paramètres du modèle sont obtenus à partir de montage les spectres de puissance des données, où l’utilisation des données brutes peut éviter des effets artéf...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous sommes reconnaissants à Stanislav Lazopulo pour obtenir de l’aide du contenu vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Drosophila Activity Monitor | TriKinetics | DAM2, DAM5 | Measures fly locootion using single infrared beam |
| MatLab | Mathworks | Computing environment and programming language, MatLab should include Optimization and Symbolic Math toolboxes | |
| Drosophila melanogaster | per[S], per[L], iso31(wild type) | Our analysis can be performed with fly mutants of any circadian period |
Références
- Pittendrigh, C. S. Circadian systems: general perspective. Biological Rhythms. II, 57-80 (1981).
- Zhang, E. E., Kay, S. A. Clocks not winding down: unravelling circadian networks. Nat Rev Mol Cell Biol. 11 (11), 764-776 (2010).
- Tataroglu, O., Emery, P. The molecular ticks of the Drosophila circadian clock. Curr Opin Insect Sci. 7, 51-57 (2015).
- Plautz, J. D., et al. Quantitative analysis of Drosophila period gene transcription in living animals. J Biol Rhythms. 12 (3), 204-217 (1997).
- Chiu, J. C., Low, K. H., Pike, D. H., Yildirim, E., Edery, I. Assaying locomotor activity to study circadian rhythms and sleep parameters in Drosophila. J Vis Exp. (43), e2157 (2010).
- Helfrich-Förster, C. Differential control of morning and evening components in the activity rhythm of Drosophila melanogaster--sex-specific differences suggest a different quality of activity. J Biol Rhythms. 15 (2), 135-154 (2000).
- Dautzenberg, F. M., Neysari, S. Irreversible binding kinetics of neuropeptide Y ligands to Y2 but not to Y1 and Y5 receptors. Pharmacology. 75 (1), 21-29 (2005).
- Lazopulo, A., Syed, S. A mathematical model provides mechanistic links to temporal patterns in Drosophila daily activity. BMC Neuroscience. 17 (1), 14 (2016).
- Donelson, N., Kim, E. Z., Slawson, J. B., Vecsey, C. G., Huber, R., Griffith, L. C. High-resolution positional tracking for long-term analysis of Drosophila sleep and locomotion using the "tracker" program. PloS ONE. 7 (5), e37250 (2012).
- Schlichting, M., et al. A Neural Network Underlying Circadian Entrainment and Photoperiodic Adjustment of Sleep and Activity in Drosophila. J Neurosci. 36 (35), 9084-9096 (2016).
- Guo, F., et al. Circadian neuron feedback controls the Drosophila sleep-activity profile. Nature. 536 (7616), 292-297 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon