Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un test Simple et peu coûteuse pour mesurer la déambulation dans des modèles murins de la dystrophie musculaire
Dans cet article
Résumé
Ce protocole décrit un système flexible et peu onéreuse pour mesurer ambulation de souris en un dosage de l’activité de plein champ. Nous montrons qu’un test de marche de 6 minutes basé sur ce système détecte une diminution des mouvements volontaires chez la souris mdx et distingue précisément amélioration à un sauvetage d’un muscle spécifique de ces animaux.
Résumé
Mesurer les résultats fonctionnels dans le traitement de la dystrophie musculaire est un aspect essentiel des essais précliniques. L’évaluation de l’ambulation volontaire dans des modèles murins est un test non invasif et reproductible de l’activité qui est directement analogues aux mesures du patiente ambulation tel que le test de marche de 6 minutes et scores de mobilité. Beaucoup de méthodes communes pour tester la souris ambulation vitesse et la distance sont basées sur le test de plein champ, où la libre circulation de l’animal dans une arène est mesurée au fil du temps. Un inconvénient majeur de cette approche est que les logiciels commerciaux et équipements pour le suivi de mouvement haute résolution est coûteux et peut nécessiter le transfert de souris à des établissements spécialisés pour les tests. Nous décrivons ici un système peu coûteux et axée sur la vidéo pour mesurer ambulation de souris qui utilise des logiciels libres et open source. Utilisant ce protocole, nous démontrons qu’ambulation volontaire dans le modèle de souris mdx de la dystrophine null pour la dystrophie musculaire de Duchenne (DMD) est diminuée par rapport à l’activité souris sauvage. Dans mdx , souris exprimant le transgène utrophine, ces déficits d’activité ne sont pas respectées et la distance totale parcourue est indiscernable de la souris de type sauvage. Cette méthode est efficace pour mesurer les variations ambulation volontaire associé à une pathologie dystrophique et fournit une plate-forme polyvalente qui peut être facilement adaptée aux paramètres de recherche diversifié.
Introduction
Des mesures fiables et reproductibles des fonctions musculaires sont essentiels pour évaluer l’efficacité des thérapies potentielles de DMD. DMD est un trouble génétique causé par des mutations dans le gène de la dystrophine, conduisant à une faiblesse musculaire progressive, perte de déambulation et éventuelle insuffisance cardiorespiratoire. Le modèle animal plus largement utilisé de DMD est la souris mdx de la dystrophine null. Une batterie de tests fonctionnels sont apparus comme des tests de routine pour évaluer la progression de la maladie chez la souris mdx , ainsi que dans des modèles animaux similaires d’autres dystrophies musculaires et myopathies. Couramment utilisés en vivo essais comprennent des mesures de la force de préhension des membres antérieurs, fil pour accrocher des temps, rotarod maximum, temps d’épuisement au cours du suivi d’activité en cours d’exécution et moteur tapis roulant. Il y a eu un effort considérable dans le domaine de normaliser ces tests, dans le but de réduire la variabilité entre les études précliniques et accroître le potentiel translationnel des agents thérapeutiques testés dans la souris1,2.
Un volet important des essais précliniques est la mesure des mouvements volontaires, un paramètre qui est fréquemment altéré dans les modèles murins de la dystrophie musculaire. Ceci est généralement testé par des études basées sur le contrôle de l’activité de plein champ et peut évaluer horizontal (à pied) ou des mouvements verticaux (élevage) sur un parcours de quelques minutes ou heures2,3,4. Un certain nombre d’études ont montré des mouvements volontaires pour être modifiée chez les souris mdx , notamment après l’exercice, et ces mesures ont démontré d’être sensible à la progression de la maladie et de traitement drogue. Une des limites principales dans l’exécution de ces tests est le besoin d’équipement spécialisé et coûteux. Ici, une méthode peu coûteux qui suit ambulation de souris à l’aide des ressources disponibles est présentée.
La distance de marche de 6 minutes est une mesure couramment utilisée comme un outil d’évaluation clinique chez les personnes atteintes de la dystrophie musculaire de Duchenne5,6. Modifications de cette mesure ont été utilisées pour évaluer les résultats dans des modèles animaux de Duchenne, y compris de souris mdx 7 et de chiens golden retriever de Duchenne (GRMD)8. Dans cette étude, nous enregistrons le mouvement volontaire de plein champ dans les 6 minutes immédiatement après une faute d’exercice doux. Distance de marche a ensuite été calculé à l’aide de logiciel open source libre pour mesurer le mouvement horizontal au fil du temps.
Le principal avantage de cette méthode est que les animaux peut être testés dans une variété de configurations sans avoir besoin d’équipement spécialisé ou coût élevé des logiciels commerciaux pour l’analyse. Un aspect important de cette analyse est qu’elle peut être réalisée dans un environnement de laboratoire de base sans avoir besoin de déplacer ou de transférer la souris hors du vivarium à un laboratoire spécialisé central. Le protocole de suivi vidéo décrit ici est bien adapté à l’évaluation de déambulation au cours de périodes relativement peu de temps et peut détecter des différences d’activité entre souris sauvage et mdx , ainsi que révèlent une amélioration fonctionnelle dans une opération de sauvetage modèle de DMD.
Protocole
Les méthodes décrites ici ont été approuvées par le Comité de l’urbanisme à l’Université de Californie, Los Angeles et d’institutionnels animalier. Sauvage (C57BL/6J) et souris mdx (C57Bl/10ScSn fond) ont été achetées à une source commerciale. MDX: souris utrophine-Tg étaient un cadeau de James Ervasti, avec la permission de Kay Davies et se sont maintenus sur le fond de mdx . Ambulation analyses ont été effectuées sur des souris mâles à l’âge de 6 mois. Souris ont été maintenues dans le Vivarium de Sciences de la vie de Terasaki directives établies par l’animalier institutionnel et le Comité de l’urbanisme à l’Université de Californie, la Los Angeles (autorisation #2000-029-43) et l’approbation de ces études a été accordée par le UCLA Animal Welfare Assurance (agrément n° A3196-01).
1. préparation de la chambre
- Effectuer la collecte de données dans une pièce silencieuse, de la température contrôlée à la fois cohérente du jour9. Effectuer les essais aveuglés pour le génotype et le traitement de la souris à l’essai.
- S’adapter à n’importe quel système de chambre de plein champ pour cette analyse.
Remarque : Dans cette étude, nous utilisons une chambre d’enregistrement peu coûteux et facilement transportable construite à partir d’une grande poubelle. L’arène de plein champ est un plateau situé sur une cage ou une plate-forme surélevée semblable. - Placez la caméra sur un treillis métallique au-dessus de la chambre d’enregistrer dans l’arène pleine.
- Nettoyer la chambre enregistrement de désinfectant avant chaque essai.
2. exercer de pré collecte de données et de protocole
- En option, immédiatement avant l’enregistrement de l’activité, contester chaque souris avec un protocole d’activation musculaire.
NOTE : Ceci est facultatif, mais recommandé dans les expériences impliquant des souris mdx .- Laissez la souris pour saisir la barre de traction d’un dynamomètre numérique et tirer doucement jusqu'à ce que la barre de traction est libérée. Répétez cette procédure cinq fois par procès.
- Tension de pic inégalé (N) pour chaque essai.
Remarque : En plus d’être un défi d’exercice pour le dosage de la déambulation, la force exercée par l’animal au cours de ce test de force de préhension peut être utilisée comme une mesure de résultat fonctionnel supplémentaire2,10. - Effectuer cinq essais totales pour chaque souris, avec 1 min de repos entre chaque essai.
- Immédiatement après l’essai de résistance de poignée ou tout autre protocole d’exercice, placez votre souris dans la chambre de l’activité.
- Démarrer l’enregistrement du mouvement de la souris sur la scène de la chambre. Laissez la souris pour explorer librement pendant 6 min.
- Arrêter l’enregistrement à 6 min et regagner sa cage maison de la souris.
3. video analyse
- Vous pouvez également préparer vidéo pour l’analyse en réduisant la fréquence d’images. Afin de réduire la fréquence d’images pour le suivi de l’analyse, utilisez le protocole suivant dans une vidéo éditant le logiciel (p. ex., iMovie ou un programme similaire) à décimer la fréquence d’images vidéo par un facteur de 2.
Remarque : Selon la longueur et la cadence de la vidéo, il peut être utile réduire la fréquence d’images vidéo avant l’analyse. Dans cette étude, la vidéo a été enregistrée à 30 images/s (6 min d’enregistrement, environ 10 800 cadres de totales).- Chargez la vidéo dans le logiciel.
- Sous le menu « Vitesse », sélectionnez "vitesse : rapide" et régler la vitesse à 2 x.
- Exporter la vidéo décimée au format de fichier .mp4 pour le suivi de l’analyse.
- Ouvrir la vidéo pour l’analyse dans le logiciel. Régler l’étalonnage pour l’enregistrement vidéo en utilisant l’outil en ligne. Tracez une ligne le long d’un côté de la chambre. Faites un clic droit sur la ligne, puis sélectionnez « Calibrate mesure... » Entrez la taille réelle du côté chambre en centimètres.
- Pour commencer le suivi semi automatique de la position de la souris, cliquez sur le curseur de « déplacer ».
À partir de la trame initiale dans la vidéo, clic droit sur le point d’être suivis ; le point de suivi est marqué avec un cercle bleu.
Remarque : Dans la présente étude, la position de chaque animal a été suivie par tracer la base de la queue. - Avancer l’image en cliquant sur la flèche droite du clavier ; le point de suivi devrait déplacer automatiquement basé sur la position de la base de la queue.
- Si la position de suivi n’est pas alignée avec le point d’intérêt dans un cadre donné, aligner manuellement le cercle bleu à la base de la queue.
Remarque : Selon la qualité de la vidéo et la vitesse de la souris, le suivi peut exiger des niveaux variables d’entrée d’utilisateur pour maintenir l’alignement avec le centre d’intérêt. Le chemin de la souris doit faire progresser tout au long de la vidéo.
- Si la position de suivi n’est pas alignée avec le point d’intérêt dans un cadre donné, aligner manuellement le cercle bleu à la base de la queue.
- Lorsque le suivi de la vidéo complète est terminée, enregistrez la superposition vidéo et de traçage. Exporter les données positionnelles de la vectorisation en sélectionnant « Exporter à feuille de calcul ».
4. analyse des données
- Ouvrez les données de position dans un logiciel tableur. Le logiciel d’analyse de mouvement signale que le X, Y coordonnée de la position de la souris sur chaque image.
- Pour calculer la distance parcourue par l’image, utilisez l’équation suivante (où est la position dans le cadre un x1, y1 et cadre deux est x2, y2) :
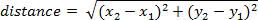
Remarque : La distance cumulée au fil du temps peut être calculée en ajoutant la distance parcourue entre chaque image.
Résultats
Les variations du dosage plein champ ont démontré être une méthode efficace pour vérifier la progression de la maladie dans les modèles de la dystrophie musculaire. Ici, nous démontrons une vidéo polyvalente suivi la méthode d’analyse de mouvement de la souris à deux dimensions à l’aide d’appareil de contrôle facilement accessibles et logiciels open source (Figure 1 a–B). Conformément aux résultats signa...
Discussion
L’essai de champ libre offre un moyen efficace et non invasif pour tester la fonction motrice chez les modèles murins de la maladie du muscle, et les variations de ce test peuvent servir en guise de point de terminaison précieuse pour des études précliniques. Une limitation majeure avec ce type de test est l’accessibilité limitée et de desserte à coût élevé de l’activité des systèmes de surveillance. Dans cette étude, nous montrons un système peu coûteux pour l’analyse d’activités de plein champ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de la National Institutes of Health [R01 AR048179 et R01 HL126204 R.C.W, AR059033 T32 et F32 AR069469to E.M.G] et la Muscular Dystrophy Association USA [274143 et 416364 à R.C.W.].
matériels
| Name | Company | Catalog Number | Comments |
| Video camera | Apple Inc. | ME553LL/A | For recording ambulation video, iPhone 5S Plus (or equivalent) |
| Kinovea software (version 0.8.15) | Kinovea Association | Open source video analysis software. Free download, PC compatible (Version 0.8.15, www.kinovea.org) | |
| iMovie (version 10.0.6) | Apple Inc. | Any similar software can be used to reduce video frame rate (optional) | |
| Roughneck 32 Gallon Black Round Trash Bin (Open field chamber) | Rubbermaid | # 1778013 | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. |
| Avant White Plastic Tray 15"W x 10"D x 1.45"H (Open field chamber) | US Acrylic, LLC | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. | |
| C57BL/6J | Jackson Laboratory | #000664 | Male 6 month mice |
| C57BL/10ScSn-Dmd/J (mdx) | Jackson Laboratory | #001801 | Male 6 month mice |
| mdx: utrophin-Tg (fiona) | Gift from from James Ervasti, with permission from Kay Davies | Male 6 month mice |
Références
- Nagaraju, K., Carlson, G., De Luca, A. Behavioral and locomotor measurements using open field animal activity monitoring system. TREAT-NMD SOP Number M2.1.002. 2. 2, (2010).
- Tatem, K. S., et al. Behavioral and locomotor measurements using an open field activity monitoring system for skeletal muscle diseases. J Vis Exp. (91), e51785 (2014).
- Kobayashi, Y. M., et al. Sarcolemma-localized nNOS is required to maintain activity after mild exercise. Nature. 456 (7221), 511-515 (2008).
- Belanto, J. J., et al. Microtubule binding distinguishes dystrophin from utrophin. Proc Natl Acad Sci U S A. 111 (15), 5723-5728 (2014).
- McDonald, C. M., et al. The 6-minute walk test in Duchenne/Becker muscular dystrophy: longitudinal observations. Muscle Nerve. 42 (6), 966-974 (2010).
- Mazzone, E., et al. Star Ambulatory Assessment, 6-minute walk test and timed items in ambulant boys with Duchenne muscular dystrophy. Neuromuscul Disord. 20 (11), 712-716 (2010).
- Kobayashi, Y. M., Rader, E. P., Crawford, R. W., Campbell, K. P. Endpoint measures in the mdx mouse relevant for muscular dystrophy pre-clinical studies. Neuromuscul Disord. 22 (1), 34-42 (2012).
- Acosta, A. R., et al. Use of the six-minute walk test to characterize golden retriever muscular dystrophy. Neuromuscul Disord. 26 (12), 865-872 (2016).
- Sousa, N., Almeida, O. F., Wotjak, C. T. A hitchhiker's guide to behavioral analysis in laboratory rodents. Genes Brain Behav. 5, 5-24 (2006).
- Gibbs, E. M., et al. High levels of sarcospan are well tolerated and act as a sarcolemmal stabilizer to address skeletal muscle and pulmonary dysfunction in DMD. Hum Mol Genet. 25 (24), 5395-5406 (2016).
- Gillis, J. M. Multivariate evaluation of the functional recovery obtained by the overexpression of utrophin in skeletal muscles of the mdx mouse. Neuromuscul Disord. 12, S90-S94 (2002).
- Tinsley, J., et al. Expression of full-length utrophin prevents muscular dystrophy in mdx mice. Nat Med. 4 (12), 1441-1444 (1998).
- Song, Y., et al. Suite of clinically relevant functional assays to address therapeutic efficacy and disease mechanism in the dystrophic mdx mouse. J Appl Physiol. 122 (3), 593-602 (2017).
- Bolivar, V. J. Intrasession and intersession habituation in mice: from inbred strain variability to linkage analysis. Neurobiol Learn Mem. 92 (2), 206-214 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon