Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Простой и недорогой Assay для измерения передвигаться в моделях мыши мышечной дистрофии
В этой статье
Резюме
Этот протокол описывает гибкий, лоу кост системы для измерения мыши передвигаться в открытом поле деятельности assay. Мы показывают, что 6-минутный передвигаться пробирного, основанными на этой системе обнаруживает снижение добровольного движения в многомерных выражений мышей и точно отличает улучшение мышц конкретных спасения этих животных.
Аннотация
Измерения функциональных результатов в лечении мышечной дистрофии является важным аспектом доклинических испытаний. Assay неинвазивные и воспроизводимости результатов деятельности, который непосредственно аналогичных мер пациента передвигаться как тест 6-ти минутах ходьбы и связанных мобильности оценки является оценка добровольного передвигаться в моделях мыши. Многие общие методы для тестирования скорости мыши передвигаться и расстояние основаны на открытом поле тест, где свободное передвижение животных в арену измеряется временем. Один из основных недостатков этого подхода является что коммерческого программного обеспечения и оборудования для отслеживания движения с высоким разрешением дорого и может потребовать передачи мышей для специализированных объектов для тестирования. Здесь мы описываем лоу кост, основанные на видео системы для измерения передвигаться мышью, которая использует свободное и открытое программное обеспечение. Используя этот протокол, мы показываем что добровольные передвигаться в мышиной модели делеций null mdx для мышечной дистрофии Дюшенна (ДМД) снизился относительно деятельности одичал тип мыши. В многомерных выражениях мышей, выражая utrophin трансген, эти дефициты активности не наблюдалось и общее пройденное неотличима от мышей дикого типа. Этот метод является эффективным для измерения изменений в добровольных передвигаться, связанные с дистрофическими патологии и предоставляет универсальная платформа, которая может быть легко адаптирована для настройки различных исследований.
Введение
Надежных и воспроизводимых измерений функции мышц имеют решающее значение для оценки эффективности потенциальных терапий для ДМД. DMD является генетическим расстройством, вызванных мутациями в гене делеций приводит к прогрессивная мышечная слабость, потеря передвигаться, и возможного кардиореспираторной недостаточности. Наиболее широко используемых животных модель DMD является мышь делеций null многомерных выражений . Функциональных тестов появились как рутинных анализов для оценки прогрессирования заболевания в многомерных выражений мышью, а также аналогичных животных моделей другие дистрофий и миопатии. Часто используемые в vivo анализы включают измерения прочности сжатия передних конечностей, проволока, висит время, максимум rotarod, время до исчерпания во время беговой дорожки идущий и двигательной активности отслеживания. Там был значительные усилия в области стандартизации этих испытаний, с целью снижения изменчивости между доклинические исследования и увеличения трансляционная потенциал терапии, испытания на мышах1,2.
Одной из важных категорий доклинических испытаний является измерение добровольного движения, параметр, который часто изменяется в мышиных моделях мышечной дистрофии. Это обычно тестируется анализов, основанный на открытом поле мониторинг активности и может оценить горизонтальное (пешком) или вертикальными движениями (выращивание) течение минут или часов2,3,4. Ряд исследований показали добровольного движения должна быть изменена в многомерных выражений мышей, особенно после тренировки, и эти измерения показали быть чувствительным к наркотиков лечения и болезнь прогрессии. Одним из основных ограничений в выполнении этих анализов является потребность в специализированных, высокой стоимости оборудования. Здесь представлен метод лоу кост, который отслеживает мыши передвигаться с помощью легко доступных ресурсов.
6-ти минутах ходьбы находится метрика, широко используется в клинической оценки в качестве инструмента лиц с мышечной дистрофии Дюшенна5,6. Модификации этой меры были использованы для оценки результатов в животных моделях Дюшенна, включая mdx мышей7 и мышечная дистрофия (GRMD) Золотой ретривер собаки8. В этом исследовании мы фиксируем движения добровольных открытом поле в 6 минут, сразу же после вызов легкие упражнения. Расстояние передвигаться тогда была рассчитана с использованием бесплатно с открытым исходным кодом для измерения горизонтального движения с течением времени.
Основным преимуществом этого метода является, что животных можно протестированы в различных параметров без необходимости специализированного оборудования или высокой стоимости коммерческого программного обеспечения для анализа. Одним из важных аспектов этого анализа является, что она может быть выполнена в основных лабораторных условиях без необходимости перемещения или передачи мышей из виварий специализированного основного объекта. Протокол видео слежения, описанный здесь хорошо подходит для оценки передвигаться за относительно короткий период времени и может обнаруживать активность различия между мышей дикого типа и многомерных выражений , а также раскрыть функциональные улучшения в спасательной модель DMD.
протокол
Описанные здесь методы были утверждены институциональный уход животных и использования Комитетом в Калифорнийском университете, Лос-Анджелес. Одичал тип (C57BL/6J) и многомерных выражений мышей (C57Bl/10ScSn фон) были приобретены у коммерческого источника. MDX: utrophin-Tg мышей были подарок от Джеймса Ervasti, с разрешения от Kay Дэвис и были сохранены на фоне многомерных выражений . Передвигаться анализы проводились на самцов мышей в возрасте 6 месяцев. Мышей были сохранены в виварий Terasaki наук о жизни, следуя руководящим принципам институциональный уход животных и использование Комитета в Калифорнийском университете, Лос-Анджелес (утверждение #2000-029-43) и утверждения для этих исследований был предоставлен UCLA животного благосостояния гарантий (утверждение #A3196-01).
1. Подготовка камеры
- Выполните сбор данных в комнату отдыха, контролем температуры во время последовательного день9. Выполните тесты, ослепленный генотип и лечения мыши проходит проверку.
- Адаптировать любой системы камеры открытом поле для этого анализа.
Примечание: В этом исследовании, мы используем недорогой и легко транспортируется запись камеры построены с большой мусорное ведро. Открытое поле Арена является набор на клетке или аналогичных повышенных платформа лоток. - Поместите фотокамеру на проволочную сетку выше камеры для записи через полное Арена.
- Очистите записи камеры с дезинфицирующим средством до каждого разбирательства.
2. Предварительный протокол и осуществлять сбор данных
- При необходимости непосредственно перед активность записи, вызов каждой мыши с протоколом активации мышц.
Примечание: Это необязательно, но рекомендуется в экспериментах с участием mdx мышей.- Разрешить мыши для захвата вытащить бар датчика цифровой силы и осторожно потяните назад до тех пор, пока панели потяните освобождается. Повторите эту процедуру пять раз в суде.
- Напряжение (N) записи пик для каждого разбирательства.
Примечание: в дополнение к действующей как вызов упражнения для assay передвигаться, сила животного во время этот assay прочность сцепления может использоваться как дополнительный функциональный результат измерения2,10. - Выполните пять всего испытаний для каждой мыши с 1 мин отдыха между каждого разбирательства.
- Сразу же после пробирного прочность сцепления или другие упражнения протокол, поместите курсор мыши в деятельности Палаты.
- Начните запись видео движения мыши на арене камеры. Позволяет мыши, чтобы свободно исследовать за 6 мин.
- Остановить запись в 6 мин и вернуть его домой клетку мыши.
3. видео анализ
- При необходимости подготовка видео для анализа путем уменьшения частоты кадров. Чтобы уменьшить частоту кадров для отслеживания анализа, используйте следующий протокол в видео редактирования программного обеспечения (например, iMovie или аналогичной программе) уничтожить частота кадров видео с коэффициентом 2.
Примечание: В зависимости от длины и частоту кадров видео, он может быть полезен для снижения частоты кадров видео до анализа. В этом исследовании видео было записано на 30 кадров/с (6 мин записи, приблизительно 10 800 кадров всего).- Загрузите видео в программное обеспечение.
- В меню «Скорость», выберите ' скорость: Fast' и установите скорость 2 x.
- Экспортируйте уничтожена видео в формате .mp4 для отслеживания анализа.
- Откройте видео для анализа в программе. Установите калибровки для записи с помощью инструмента линия видео. Нарисуйте линию вдоль одной стороны камеры. Щелкните правой кнопкой мыши на линии и выберите пункт «Калибровать мера...» Введите фактический размер стороны камеры в сантиметрах.
- Чтобы начать полу Автоматизированное отслеживание позиции мыши, нажмите на «переместить» курсор.
Начиная с первоначального кадра в видео, щелкните правой кнопкой мыши на точке отслеживания; точка отслеживания помечена с синий круг.
Примечание: В настоящем исследовании, позиция каждого животного было считано путем отслеживания основание хвоста. - Заранее кадр, нажав кнопку со стрелкой вправо на клавиатуре; точка отслеживания должна автоматически смещаться на позиции основанию хвоста.
- Если позиция отслеживания не выравнивается с точки интереса в данном кадре, вручную выровняйте синий круг к основанию хвоста.
Примечание: В зависимости от качества видео и скорость мыши, отслеживания может потребоваться различные уровни пользовательского ввода для поддержания выравнивание с точки интереса. Путь мыши следует заранее через курс видео.
- Если позиция отслеживания не выравнивается с точки интереса в данном кадре, вручную выровняйте синий круг к основанию хвоста.
- При завершении отслеживания полное видео, сохраните видео и трассировки оверлея. Экспорт в позиционных данных трассировки, выбрав «Экспорт в электронную таблицу».
4. анализ данных
- Откройте позиционные данные в программу электронных таблиц. Программное обеспечение для анализа движения сообщает, что X, Y координировать позиции указателя мыши в каждом кадре.
- Чтобы вычислить расстояние, пройденное кадра, используйте следующее уравнение (где это положение в кадре, один x1, y1 и два кадра является x2, y2):
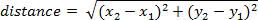
Примечание: Совокупное расстояние со временем можно рассчитать путем добавления расстояния между каждого кадра.
Результаты
Вариации в открытом поле анализа было показано, быть эффективным методом для тестирования прогрессирования заболевания в моделях мышечной дистрофии. Здесь мы демонстрируем универсальный видео отслеживания метод для анализа движения двумерных мыши, с помощью легко ?...
Обсуждение
Assay открытое поле обеспечивает эффективную и неинвазивный способ проверить моторную функцию в моделях мыши заболевания мышц, и вариации этот assay может служить ценным конечной меры для доклинических исследований. Одним из основных ограничений с этим типом пробирного является высокой с...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана грантов от национальных институтов здоровья [R01 AR048179 и R01 HL126204 R.C.W, T32 AR059033 и F32 AR069469to E.M.G] и мышечной дистрофии ассоциации США [274143 и 416364 к R.C.W.].
Материалы
| Name | Company | Catalog Number | Comments |
| Video camera | Apple Inc. | ME553LL/A | For recording ambulation video, iPhone 5S Plus (or equivalent) |
| Kinovea software (version 0.8.15) | Kinovea Association | Open source video analysis software. Free download, PC compatible (Version 0.8.15, www.kinovea.org) | |
| iMovie (version 10.0.6) | Apple Inc. | Any similar software can be used to reduce video frame rate (optional) | |
| Roughneck 32 Gallon Black Round Trash Bin (Open field chamber) | Rubbermaid | # 1778013 | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. |
| Avant White Plastic Tray 15"W x 10"D x 1.45"H (Open field chamber) | US Acrylic, LLC | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. | |
| C57BL/6J | Jackson Laboratory | #000664 | Male 6 month mice |
| C57BL/10ScSn-Dmd/J (mdx) | Jackson Laboratory | #001801 | Male 6 month mice |
| mdx: utrophin-Tg (fiona) | Gift from from James Ervasti, with permission from Kay Davies | Male 6 month mice |
Ссылки
- Nagaraju, K., Carlson, G., De Luca, A. Behavioral and locomotor measurements using open field animal activity monitoring system. TREAT-NMD SOP Number M2.1.002. 2. 2, (2010).
- Tatem, K. S., et al. Behavioral and locomotor measurements using an open field activity monitoring system for skeletal muscle diseases. J Vis Exp. (91), e51785 (2014).
- Kobayashi, Y. M., et al. Sarcolemma-localized nNOS is required to maintain activity after mild exercise. Nature. 456 (7221), 511-515 (2008).
- Belanto, J. J., et al. Microtubule binding distinguishes dystrophin from utrophin. Proc Natl Acad Sci U S A. 111 (15), 5723-5728 (2014).
- McDonald, C. M., et al. The 6-minute walk test in Duchenne/Becker muscular dystrophy: longitudinal observations. Muscle Nerve. 42 (6), 966-974 (2010).
- Mazzone, E., et al. Star Ambulatory Assessment, 6-minute walk test and timed items in ambulant boys with Duchenne muscular dystrophy. Neuromuscul Disord. 20 (11), 712-716 (2010).
- Kobayashi, Y. M., Rader, E. P., Crawford, R. W., Campbell, K. P. Endpoint measures in the mdx mouse relevant for muscular dystrophy pre-clinical studies. Neuromuscul Disord. 22 (1), 34-42 (2012).
- Acosta, A. R., et al. Use of the six-minute walk test to characterize golden retriever muscular dystrophy. Neuromuscul Disord. 26 (12), 865-872 (2016).
- Sousa, N., Almeida, O. F., Wotjak, C. T. A hitchhiker's guide to behavioral analysis in laboratory rodents. Genes Brain Behav. 5, 5-24 (2006).
- Gibbs, E. M., et al. High levels of sarcospan are well tolerated and act as a sarcolemmal stabilizer to address skeletal muscle and pulmonary dysfunction in DMD. Hum Mol Genet. 25 (24), 5395-5406 (2016).
- Gillis, J. M. Multivariate evaluation of the functional recovery obtained by the overexpression of utrophin in skeletal muscles of the mdx mouse. Neuromuscul Disord. 12, S90-S94 (2002).
- Tinsley, J., et al. Expression of full-length utrophin prevents muscular dystrophy in mdx mice. Nat Med. 4 (12), 1441-1444 (1998).
- Song, Y., et al. Suite of clinically relevant functional assays to address therapeutic efficacy and disease mechanism in the dystrophic mdx mouse. J Appl Physiol. 122 (3), 593-602 (2017).
- Bolivar, V. J. Intrasession and intersession habituation in mice: from inbred strain variability to linkage analysis. Neurobiol Learn Mem. 92 (2), 206-214 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены