Method Article
Imagerie de la Neuroinflammation utilisant [11C] DPA-713 dans un modèle murin d’accident vasculaire cérébral ischémique d’animal familier
Dans cet article
Résumé
Imagerie de la tomographie par émission de positrons (TEP) de translocator protéine 18 kDa (TSPO) fournit un moyen non invasif pour visualiser le rôle dynamique de la neuro-inflammation dans le développement et la progression des maladies du cerveau. Ce protocole décrit une autoradiographie TSPO-PET et ex vivo pour détecter la neuro-inflammation dans un modèle murin d’accident vasculaire cérébral ischémique.
Résumé
Neuroinflammation est au centre de la cascade pathologique après accident vasculaire cérébral ischémique. Méthodes d’imagerie moléculaires non invasifs sont susceptibles de donner un aperçu critique de la dynamique temporelle et le rôle de certaines interactions neuro-immune en course. Plus précisément, l’imagerie de translocator protéine 18 kDa (TSPO), un marqueur d’activé la microglie et les cellules périphériques de lignée myéloïde, tomographie par émission de positrons (TEP) fournit un moyen pour détecter et suivre in vivode la neuro-inflammation. Nous présentons ici une méthode pour quantifier avec précision à l’aide de la neuro-inflammation [11C]N,N-Diethyl-2-[2-(4-methoxyphenyl)-5,7-dimethylpyrazolo[1,5-a]pyrimidin-3-yl]acetamide ([11C] DPA-713), une prometteuse deuxième génération TSPO-PET traceurs radioactifs, en occlusion de l’artère cérébrale moyenne distale (dMCAO) par rapport aux souris opérés. MRI a été effectué 2 jours post-dMCAO chirurgie afin de confirmer l’accident vasculaire cérébral et de définir l’emplacement de l’infarctus et le volume. L’imagerie PET/Computed Tomography (CT) a été réalisée 6 jours post-dMCAO pour capturer l’augmentation maximale en niveaux TSPO suite accident vasculaire cérébral. Analyse quantitative d’images PET a été menée afin d’évaluer l’absorption du [11C] DPA-713 dans le cerveau et la rate des souris dMCAO et sham pour évaluer le niveau central et périphérique de l’inflammation. In vivo [11C] Absorption de cerveau DPA-713 a été confirmée par ex vivo autoradiographie.
Introduction
L’AVC est la cinquième cause de décès et une cause majeure d’invalidité chez les États-Unis1. Accident vasculaire cérébral ischémique représente une écrasante majorité de ces cas (~ 87 %), qui se produisent lorsqu’il y a perturbation localisée dans la circulation sanguine vers le cerveau (par exemple, par un caillot sanguin ou un dépôt graisseux). Fournitures d’oxygène et des nutriments dans les zones touchées sont réduits par la suite, et une cascade complexe pathologique est enclenchée résultant dans la mort neuronale dans le noyau d’accident vasculaire cérébral (infarctus) en plus des zones environnantes. Neuroinflammation est une composante essentielle dans la voie menant à ces dommages, avec les deux cellules immunitaires du cerveau résident (microglies) et l’infiltration des cellules immunitaires périphériques (neutrophiles, lymphocytes T, lymphocytes B et monocytes/macrophages) censés contribuer à cet destructeur de cascade2,3. Macrophages et la microglie activée sont au cœur de cette réponse de neuroinflammatoire, avec les rapports des effets délétères et bénéfiques après accident vasculaire cérébral ischémique2. Ainsi, il est impératif d’évaluer la contribution in vivo de ces cellules après accident vasculaire cérébral.
Animal de compagnie est une puissante technique d’imagerie moléculaire 3 dimensions qui permet la visualisation du biologique traite in vivo par l’utilisation de certaines molécules marquées avec positron (β +) émettant des radionucléides tels que 11C, 13N, 15O et 18F. Cette méthode non invasive présente de nombreux avantages par rapport aux méthodes ex vivo (p. ex., immunohistochimie) car il permet l’acquisition de l’information moléculaire en temps réel, dans des sujets vivants intacts et permet une enquête longitudinale. L’imagerie PET du TSPO, un marqueur d’activé la microglie et les cellules périphériques de lignée myéloïde, fournit un moyen de quantifier et de suivi des réponses des cellules immunitaires innée dans le corps et peut être utilisé pour évaluer l’inflammation après accident vasculaire cérébral et de la réponse à la thérapeutique interventions. TSPO, anciennement appelé le récepteur des benzodiazépines de type périphérique, est une protéine de 18 kDa qui est censée jouer un rôle dans le transport du cholestérol et la synthèse des neurosteroids4. En outre, suggèrent que TSPO est impliqué dans la neuro-inflammation et la survie des neurones5,6, avec rapports d’augmentation de l’expression dans nombreux troubles neurologiques, mettant en cause une inflammation dont AVC7, démence8, maladie de Parkinson,9 et10de la sclérose en plaques. TSPO est situé sur la membrane mitochondriale externe et est fortement exprimée dans la périphérie, en particulier dans les tissus attenants stéroïdes (par exemple, les glandes) et avec des niveaux intermédiaires, dans le coeur, les reins et les poumons,10. Cependant dans le cerveau en bonne santé, les niveaux TSPO sont faibles et réservé principalement aux cellules gliales6,11. Sur les lésions neuronales, telle que celle observée dans les accidents vasculaires cérébraux, des niveaux TSPO dans le système nerveux central (CNS) augmentent de manière significative. Cette augmentation observée du TSPO peut être exploitée pour image neuroinflammation in vivo, avec des niveaux d’expression fournit un indicateur précis de la gravité de l’inflammation. Par conséquent, cette méthode vise à quantifier avec précision la contributionin vivo de la neuro-inflammation dans un modèle murin d’accident vasculaire cérébral ischémique en utilisant TSPO-PET.
Plusieurs traceurs TSPO ont été développés pour l’imagerie TEP de la neuroinflammation. TSPO-TEP est décrit ici, à l’aide de DPA-713 [11C]12, une prometteuse deuxième génération traceur TSPO, qui a montré un signal amélioré pour le bruit et abaisser les liaisons non spécifiques que le plus historiquement utilisée [11C] PK11195 13 . À titre d’exemple, le modèle de souris dMCAO de course a été choisi pour cette méthode de14. Ce modèle comprend une craniotomie temporelle et permanente ligature de l’artère cérébrale moyenne distal, ce qui entraîne une ischémie focale du cortex somatosensoriel. C’est avantageux dans la recherche sur les AVC précliniques due la reproductibilité élevée de lésions ischémiques et les taux de mortalité faible associés à ce modèle. A ce jour, études d’imagerie TSPO-PET doivent encore être déclarées dans le modèle de rongeurs dMCAO. Cependant, des études d’imagerie antérieures PET en utilisant le modèle d’occlusion (OACM) artère cérébrale moyenne, un modèle de course plus sévère et plus variable, les souris et les rats, ont rapporté des expression TSPO passer de jour 3 et pic vers le 7e jour post-accident vasculaire cérébral15, 16,17,18. Par conséquent, nous avons effectué PET 6 jours post-dMCAO d’imagerie afin de coïncider avec l’expression TSPO élevée. [11C] DPA-713 absorption dans le cerveau a été évaluée chez ipsilatéral (infarci) et hémisphère controlatéral. TSPO-PET a été combiné avec IRM structurelle, ce qui permet une délimitation précise des infarctus et controlatérales régions d’intérêt (ROIs). Nous décrivons ici les un atlas et une approche axée sur le MRI ROI pour calculer l’absorption DPA-713 [11C]. Captation du radiotraceur dans la rate a aussi évaluée afin d’étudier les niveaux périphériques d’inflammation entre les groupes. Cette méthode a le potentiel pour donner un aperçu essentiel de la dynamique spatio-temporelle et le rôle des interactions neuro-immune spécifique dans les accidents vasculaires cérébraux et autres maladies neurologiques.
Protocole
Toutes les études animales ont été effectuées conformément à la Commission Administrative sur la Laboratory Animal Care (APLAC) à l’Université de Stanford, un programme accrédité par l’Association pour l’évaluation et l’Accreditation of Laboratory Animal Care. Avant cette procédure, les souris femelles C57BL/6 trois mois a été opéré dMCAO suivant la procédure normale et conditions stériles14.
1. structure MRI (2 jours Post-dMCAO chirurgie)
- Ouvrez le logiciel d’exploitation (voir Table des matières) et mise en place l’acquisition en créant un nouvel examen. Sélectionnez l’alignement de piste et séquences T2 turborare dans l’Explorateur de palette et faites glisser dans la fenêtre de l’examen.
- Sécuriser l’appareil respiratoire et chauffer des sondes sur le lit de la souris à l’aide de ruban souple, placer une bande de protection absorbant rembourrage sur les deux pour créer un environnement stérile.
- Accrocher un réchauffeur d’air sur la benne animale et allumez le ventilateur afin que l’air chaud est sur et maintenir la souris chauffée. Utiliser un système automatisé de surveillance pour s’assurer que la température corporelle et rythme respiratoire sont maintenus à des niveaux appropriés pour la durée de l’analyse.
-
Anesthésier la souris dans une chambre d’induction à l’aide de 3 % Isoflurane initialement, puis maintenir à 1-2 % (2 L/min, 100 % O2). Assurer qu'une bouillote est allumé sous la chambre de l’induction pour réchauffer la souris durant l’induction. Une fois anesthésié, appliquer du lubrifiant oculaire à la souris pour éviter le séchage et la formation d’ulcères cornéens.
- Allumez le système d’anesthésie (Isoflurane 1 à 2 %, 2 L/min 100 % O2) connecté au scanner MRI et transférer l’animal dans le lit de la souris.
- Position de la souris tête sujettes sur la barre de la morsure et fixer les barres de l’oreille en place, en vous assurant qu’ils ne dépassent pas en dehors du diamètre du lit.
- Glisser la bobine RF sur la tête de la souris et enfoncez la bobine et le lit dans l’alésage, plaçant spécialement pour isocenter.
- Acquérir l’alignement de piste pour afficher la position de la souris dans les 3 dimensions et utiliser cette image pour définir le volume pour T2 turborare (TE : 33 ms, TR : 2 500 ms, 2 moyennes, 17 tranches, résolution de 0,083 x 0,92 mm, temps total de 2 min 40 s) acquisition. dMCAO chirurgie entraîne un infarctus dans le cortex somatosensoriel14; par conséquent, s’assurer que cette région est couverte dans les images pondérées en T2.
- Retirer les souris du scanner et récupérer les souris dans une chambre chauffée.
2. TEP/CT étalonnages et programme d’installation de Workflow (6 jours Post-dMCAO chirurgie)
- Créer un flux de travail d’imagerie dans le logiciel d’exploitation scanner d’inclure une acquisition d’atténuation CT, la 60 minutes C-11 PET acquisition dynamiques (350-650 keV niveau discrimination, 3.438 ns coïncidence fenêtre), l’histogramme (20 images : 5 x 15 sec, 4 x 1 min, 11 x 5 min, avec correction du temps morts) et une reconstruction de 3DOSEM-OP (2 itérations, 18 sous-ensembles) pour créer des 128 x 128 x 159 images à 0.776 x 0.776 x 0,96 mm taille de voxel.
- Effectuer le conditionnement via le panneau de calibration CT situé dans le coin supérieur gauche de l’interface de source de rayons x. Ce calibrage doit effectuer chaque semaine ou avant que le balayage si le système n’a pas été utilisé dans les dernière 48 h.
-
Effectuer sombre/clair (D/L) et l’offset de centre (c/o) des étalonnages.
- Bouton de calibrage de presse la CT (X) en haut à gauche de l’interface.
- Sélectionnez D/L et a/s du fichier CT que vous utiliserez, retirer le lit du portique et exécuter le calibrage de la D/L.
- Insérez le lit d’outil de calibration dans le scanner et exécuter le calibrage c/o, en veillant à passer la sélection sur l’interface « outil de calibration » au lieu de « palette de 70 mm ».
- Enlever l’outil de calibration et retourner le lit PET standard, en veillant à changer la sélection sur l’interface de retour à la « palette de 70 mm ».
- Garantir un lit d’imagerie 4-souris sur le plateau du scanner à l’aide de ruban adhésif et raccorder la tubulure de l’anesthésie (Figure 1A). Veiller à ce qu’isoflurane ne circule dans les tubes et qu’il n’y sont aucuns déformé.
- Poussez le lit avant donc c’est dans le centre du champ de vision (FOV), fermer la porte de la CT et obtenir une vue de scout de la CT pour s’assurer que le lit est en position correcte.
-
Effectuer un calibrage « standard » du scanner TEP/CT à l’aide d’un fantôme manufacturé interne contenant une dose connue de solution C-11 comme une source de rayonnement.
- Préparez une seringue de 20 mL remplie avec la dose de traceur équivalente à administrée à une souris (~ 250-350 µCi/9 - 13 MBq de traceur C-11 dilué dans une solution saline).
- Enregistrer l’activité dans la norme à l’aide d’un calibrateur de dose et noter l’heure de la mesure.
- Procéder à un balayage de TEP/CT de la norme en utilisant les mêmes paramètres exactes qui serviront à des souris de l’image (comme décrit ci-dessus). Faire cet hebdomadaire pour créer un facteur de correction pour l’appareil de TEP à appliquer aux données d’imagerie.
3. espace de travail paramétrage pour l’imagerie TEP/CT
- Créer un environnement stérile en utilisant un désinfectant virucide (voir Table des matières) et en plaçant un rembourrage absorbant protecteur sur toutes les surfaces.
- S’assurer que les réservoirs isoflurane et l’oxygène sont adéquatement remplis.
- Préparez queue veine cathéters en remplissant une seringue de 1 mL (munie d’une pointe d’aiguille de 27,5 G) de chlorure de sodium 0,9 % (sérum physiologique stérile) et bouffées de chaleur à travers un 27,5 G, cathéter papillon 24 cm. Couper les ailes du cathéter avant canulant pour s’assurer qu’ils ne bloquent pas l’opinion de la veine caudale et pour aider avec la facilité de déplacement des souris dans le scanner sans déplacer le cathéter.
- S’assurer que tous les équipements essentiels sont aménagé au poste de travail y compris rechange seringues « RAS » (remplis de solution saline stérile), Lubrifiant oculaire, écouvillons éthanol, lampes chauffantes, préparé des cathéters (pré-rempli avec du sérum physiologique), colle tissu, ruban chirurgical, seringues de 0,5 mL de dose, ciseaux et un briquet pour sceller le cathéter après placement réussi dans la veine caudale (Figure 1B).
4. canulation et préparation animaux
- Peser la souris pour déterminer le volume maximum autorisé à être injecté dans chaque souris (c.-à-d., volume de traceur et toute saline doit administré ne dépasse ne pas 10 % du poids corporel).
- Anesthésier la souris dans une chambre d’induction à l’aide de 3 % Isoflurane et maintenir à 1-2 % (2 L/min 100 % O2).
- Appliquer du lubrifiant oculaire pour chaque souris et confirmer anesthetization via pédale réflexe (pincement de l’orteil). Ajuster les niveaux de l’anesthésie si nécessaire.
- Placez votre souris sur un lit chauffant équipé d’un cône de nez pour livrer l’isoflurane à 1-2 % (2 L/min 100 % O2).
-
Alors que la souris est anesthésiée, effectuez une canulation veineuse queue en utilisant le protocole suivant :
- Placez la souris sur le côté d’exposer une des veines latérales, tout en tête reste dans le cône de nez.
- Chauffer la queue à l’aide d’une lampe chauffante, en veillant à ne pas surchauffer ou brûler la queue et essuyer avec une lingette d’alcool pour dilater la veine et de stériliser le site d’injection.
- Tenez l’aiguille avec le biseau vers le haut et l’aligner avec la veine sous un angle aigu.
- Presser légèrement pour perforer la peau et l’aiguille de niveau donc il s’inscrit dans la veine.
- Doucement avancer quelques millimètres au-delà du biseau afin que l’aiguille pénètre dans la veine.
- Confirmer que le cathéter se trouve à en administrant un flush small (10-20 µL) de solution saline. La solution saline doit laisser la seringue en douceur et la veine doit nettoyer. Si on observe aucune pression de résistance ou de dos, il est probable le cathéter n’est pas dans la veine et réessayer la canulation est conseillé. Si la coagulation est observée, utiliser l’héparine (héparine de 1 000 unités par mL de solution saline) pour une configuration de canulation et bouffées de chaleur.
NOTE : Nous avons évalué la canulation avec ou sans héparine dans la souche de souris d’intérêt, et puisqu’aucune coagulation a été observée, une solution saline seule servait pour canules. - Fixer le cathéter à la queue à l’aide d’une petite goutte de colle tissu, suivie de ruban chirurgical, pour s’assurer que le cathéter reste immobile lors du transfert des souris au scanner.
- Retirer la seringue RAS de l’extrémité du cathéter et sceller la fin avec briquet, assurant le chercheur n’est pas près d’une isoflurane ou l’éthanol.
- Répéter pour les 3 autres souris afin que toutes les 4 souris à analyser sont canulés et préparés.
- Activer le flux d’anesthésie (2,5 % Isoflurane, 2 L/min 100 % O2) qui est relié à la TEP/CT et soigneusement position les souris dans le lit de scanner, assurant des cathéters restent en place et tête de chaque souris est rectiligne et sûr au sein de la coiffe. Le chef de bande et le corps de chaque souris au lit avec un ruban chirurgical doux, assurant la respiration n’est pas restreint par le placement de la bande. Enregistrer la position de chaque souris permettant l’emplacement correct et l’attribution des groupes pour l’analyse de l’image.
- Gardez la souris chauffées tout au long de la procédure (par exemple, à l’aide d’une lampe chauffante ou un système de pompe à air chaud pour souris sont gardés au chauds sans surchauffe). Surveiller la fréquence respiratoire de toutes les souris, soit visuellement si vous utilisez un portique ouvert ou par un système de télésurveillance à l’aide de garnitures respiratoires et modifier les niveaux d’anesthésie si nécessaire.
5. Acquisition de CT
- Une fois que les animaux est sécurisés dans le lit et la respiration est stable, allumer le laser Croix poils et déplacer le balayage de lit afin qu’ils alignent avec le cerveau des quatre souris. Déplacer le lit de scanner à l’acquisition (poste 3) avec le cerveau des souris comme à proximité du centre de la FOV que possible.
- Acquérir une image de vue scout des souris pour vérifier leur position (utilisez un 200 mm champ de vision) et régler la position en faisant glisser la zone de champ de vision sur l’interface si nécessaire. Cliquez sur « Démarrer le flux de travail » dans le logiciel de numérisation pour commencer le CT scan, en veillant à sélectionner « Afficher les invites utilisateur interactif » donc le PET scan peut être lancé manuellement avant l’injection du traceur.
6. [11C] préparation de Dose DPA-713
- Synthétiser [11C] DPA-713 décrite précédemment12, en veillant à ce que vous portez des EPI (équipements de protection individuelle) pour la manipulation de radioactivité, y compris une blouse, des gants et des dosimètres personnels de doigt et le corps. Assurez-vous de les changer régulièrement pour prévenir la contamination radioactive et augmenter votre distance de la source radioactive lorsque cela est possible.
- Forceps permet de transférer soigneusement le flacon de traceurs radioactifs derrière un écran de plomb.
- Préparer les seringues de dose de 0,5 mL pour chaque souris, contenant environ 250-350 µCi/9-13 MBq en volume µL 100-200 pour s’assurer une dose suffisante pour un 60-minute dynamique TEP-scan (dose administrée doit être déterminé compte tenu de la demi-vie de l’isotope et échéancier de l’étude, avec le volume en fonction du poids de la souris).
- Mesure de l’activité à l’aide d’un calibrateur de dose définie sur C-11, située à proximité du site de canulation et enregistrer les temps de mesure et d’injection pour activer la correction de la carie. Dresser les doses juste avant les extrémités de CT pour limiter la décroissance et assurer le niveau désiré de la radioactivité seront injectées dans chaque souris.
- Vérifiez qu’il n’y a aucune bulle d’air dans la seringue avant de mesurer l’activité et l’injection dans chaque souris.
7. PET Acquisition
- Une fois que les souris avancement automatiquement de CT au PET, mis en place au dos du scanner pour injection de DPA-713 [11C] (Figure 1C). Placer un rembourrage absorbant protecteur sur une corniche et s’assurer ciseaux et briquet sont à votre disposition.
- Découper les tubes scellés avec des ciseaux, vérifier les lignes cathéter éloignés de toute bulle et confirment que la canule est toujours dans la veine en effectuant une chasse d’eau saline µL 10-20. Charger les seringues à dose mesurée de l’étape 6.4 dans chacune des 4 cathéters, suivi de quelle dose a été administrée à chaque souris.
- Cliquez sur « OK » lorsque le PET scan est prêt à démarrer tout en démarrant simultanément une minuterie 10 seconde. Avoir en main, deux chercheurs à l’arrière du scanner avec les dose de seringues à injecter toutes les 4 souris simultanément sur la minuterie atteint zéro. Rincer chaque cathéter avec 50-100 µL de solution saline (selon la longueur de la tubulure du cathéter — c'est-à-dire le volume mort) pour s’assurer que la dose entière pénètre dans la veine caudale et refermer le tube une fois de plus à l’aide d’un briquet.
- Mesurer les dose de seringues en utilisant un étalon de la dose pour obtenir une valeur de radioactivité résiduelle (tous traceur a laissé dans la seringue). Prenez note des valeurs et le temps qu’ils sont enregistrés.
- Une fois l’analyse terminée, accueil le lit PET sur sa position initiale en utilisant le bouton « home » horizontal au sein de la motion panneau de contrôle. Retirer les souris du scanner et enlever avec précaution le cathéter. Exercez une légère pression sur le site de canulation afin d’éviter un saignement excessif.
- Mesurer l’activité résiduelle dans le cathéter à l’aide d’un calibrateur de dose comme décrit précédemment.
- Si la souris doivent être recouvrés s’assurer que cela se fait dans un environnement chaud (par exemple, dans une boîte avec un coussin chauffant sous ou contenant un gant rempli d’eau chaude) pour faciliter la récupération. Si l’intention d’euthanasier les souris, placer les souris dans une chambre d’induction contenant isoflurane afin qu’elles restent anesthésiés avant euthanasie par perfusion.
- Pour reconstruire les données, ouvrez le logiciel de gestion post-traitement (voir Table des matières), qui reconstruira automatiquement chaque scan en utilisant les données d’histogramme généré à partir du fichier lst.
8. cerveau autoradiographie
- Avant l’expérience, effacer le film numérique autoradiographie en exposant pour lumière pendant 10-15 min blanche et garder dans un endroit sec radioactivité jusqu'à utilisation.
- Préparer les seringues de dose de 0,5 mL pour chaque souris contenant environ 1,0 à 1,5 mCi/37-56 MBq pour s’assurer une dose suffisante pour l’autoradiographie.
- Mesurer la radioactivité dans la seringue, à l’aide d’un étalon de dose, avant l’injection pour obtenir une lecture précise de l’activité.
- Cathétériser comme décrit précédemment et injecter la souris immédiatement dans un espace convenable pour la radioactivité.
- Retirer le cathéter après injection et mesurer la radioactivité résiduelle.
- Laissez les souris dans une chambre chauffée induction afin qu’elles restent anesthésiés avant la perfusion et l’euthanasie.
-
Effectuer l’euthanasie tandis que les souris sont profondément anesthésiés (inhalation continue de 4 % Isoflurane, 2 L/min 100 % O2) par perfusion de PBS et injection de DPA-713 thoracotomie bilatérale 30 min après [11C].
- Ouvrir la cavité abdominale et couper à travers le diaphragme pour exposer le cœur.
- Insérer une aiguille de perfusion cathéter papillon dans le ventricule gauche du coeur, et découper l’oreillette droite et la veine cave inférieure.
- Perfuse lentement avec du PBS (~ 20 à 30 mL) à l’aide d’une seringue de 20 mL.
- Retirer délicatement le cerveau du crâne à l’aide de pinces et ciseaux.
- Placer le cerveau dans un moule de congélation rempli avec la température de coupe optimale liquide (OCT), faisant que le cerveau soit de niveau et centré dans le moule, avec les bulbes olfactifs orientés vers les encoches dans le moule (pour fournir des points de repère et orientation une fois le cerveau est retirée du moule).
- Moule de place sur la glace sèche pour 10-15 min ou jusqu'à ce que l’outil OPO devient opaque.
- Placer chaque moule du cryostat microtome jeu à-18 ° C immédiatement et équilibrer pendant 10 min avant le montage.
- Décollez le moule congélation et monter au cerveau de la plate-forme microtome à l’aide d’une petite quantité d’OCT fraîche comme la « colle ».
- Laisser le cerveau monté dans le microtome à geler pendant 2 min.
- Couper à travers le cerveau jusqu'à ce que le lieu de l’accident vasculaire cérébral est exposée (c.-à-d., ROI). L’image de M. permet de localiser l’infarctus dans le cerveau de chaque animal. Pour dMCAO, cela devrait être systématiquement dans le cortex somatosensoriel ; Cependant, la longueur de la course peut varier légèrement.
- Section de la région du cerveau s’étendant sur l’infarctus, plaçant 20 µm d’épaisseur sections sur lames de microscope de verre étiquetées avec le nombre de souris approprié.
- Ouvrir la cassette autoradiographie et Tapissez le fond de la cassette avec une seule feuille de Saran wrap. Organiser la glisse vers le haut sur le dessus de la pellicule saran dans la cassette de l’article et prendre note de la position de chaque diapositive. Vous pouvez également prendre une photo du placement diapositive pour aider à l’analyse ultérieure.
- Placez délicatement une autre couche de saran wrap sur le dessus (après une attente d’environ 2 min après le prélèvement de la dernière section du cerveau - ce qui lui permet de sécher et de se conformer à la diapositive) et placer soigneusement le film d’autoradiographie numérique (côté blanc vers le bas) sur le dessus de la glisse.
- Bien fermer la cassette et laisser dans un congélateur à-20 ° C, ce qui permet des sections à décliner sur le film pour un temps de pose adéquate (demi-vie ~ 5-10).
- Scannez le film après le temps d’exposition à l’aide d’un imageur de phosphore pour générer une image numérique pour une analyse ultérieure.
9. dynamique PET Image Analysis
- Ouvrez le logiciel d’analyse image (voir la Table des matières) et cliquez sur l’icône « ouvrir les données » pour charger l’image de CT (comme source) et l’icône « Ajouter des données » pour charger l’animal dynamique (comme la référence).
- Effectuer un contrôle visuel de la qualité des données via l’opérateur de la série chronologique dans le menu déroulant : sélectionnez référence (« ref ») et « global » et appliquez un approprié min et max de l’échelle de couleurs. Visualiser les données dynamiques de PET image par image, vérifier l’absorption de la radioactivité et vérifiant pour toute motion confond dans l’analyse.
- Créer une image moyenne de PET à l’aide de l’opérateur « arithmétique ».
- Choisissez « moyenne sélectionnée », désélectionner « ref » et d’assurer l’entrée 1 (« Inp1 »), entrée 2 (« Inp2 ») et l’étoile d’entrée (« Inp * »-comprend le reste des cadres PET dans l’analyse) sont sélectionnés pour créer une moyenne de toutes les images du PET.
- Allez dans l’onglet « data manager » (DM) et faites glisser l’image moyenne jusqu'à la position « input1 » à des fins de visualisation. Redistribuer l’échelle de couleurs en cliquant sur le calcul automatique de l’outil « min-max ».
- S’inscrire à la CT au moyen fichier PET à l’aide de la fonction « automatique 3D » dans le menu déroulant « ré-orientation/inscription ».
- Sélectionnez « ref » et « Inp1 » et choisissez « rigide », « rapide », l’enregistrement « Inp1 à Ref ». Vérifier visuellement l’enregistrement dans les 3 dimensions et de régler manuellement si nécessaire dans l’onglet « 3D manuelle » en utilisant les fonctions « traduction » et « rotation ».
- Lorsque vous êtes satisfait de l’enregistrement, sélectionnez « Inp2 » et « Inp * » et s’appliquent à tous les cadres de PET en cliquant sur la coche. Faites un clic droit sur les fichiers CT et PET DM et enregistrer en tant que raw.
- Recadrer le cerveau d’une souris à la fois pour l’analyse de cerveau à l’aide de la CT comme guide : sélectionnez « recadrage » dans le menu déroulant, puis faites glisser les limites de l’image pour recadrer la tête de la souris sous le tronc cérébral. Réorienter les images TEP et CT en utilisant la fonction « manuel 3D réorientation » tel que décrit ci-dessus afin que le crâne est droite dans toutes les dimensions.
- Charger l’image de Monsieur pour que la souris (au format DICOM) en utilisant le bouton « Ajouter des données » en haut à gauche de l’interface. Déplacer le Monsieur à l’aide de la « réorientation 3D manuelle » et apte au crâne dans l’image de CT (Assurez-vous que toutes les modalités sont dans la même orientation).
- Dessinez le tracé ROI sur l’image de Monsieur à l’aide de l’outil ROI « 3D ».
- Désactiver la visualisation de PET en décochant il dans l’onglet contrôleur visuel (VC) et seulement le MR et le CT pour dessiner le ROI.
- Cliquez sur le « ROI » ajouter pour créer un nouveau ROI et nommez-le « infarctus ». Sélectionnez l’outil « spline », faites un clic gauche pour dessiner la bordure ROI et faites un clic droit pour le fermer.
- Répétez à toutes les tranches qui englobe le coup, en faisant attention à ne pas capturer tout du crâne dans le retour sur investissement, avec la meilleure pratique est de laisser un espace de voxel entre la frontière de crâne et de la course ROI.
- Générer un ROI controlatéral en utilisant le volume de l’infarctus.
- Créer un nouveau ROI et l’étiquette « contralatéral ». Faites un clic droit sur le retour sur investissement de l’infarctus et sélectionnez « Exporter ». Faites glisser le ROI en position 2 (« Inp1 »).
- Avec seulement « Inp1 » sélectionné, appliquer une inversion droite gauche en utilisant la fonction « opérateur » dans le menu « réorientation/inscription ». Cochez la case « ROI », choisissez « afficher uniquement » et déplacer manuellement le nouveau ROI de la région identique du côté controlatéral. Sélectionnez l’opérateur de le « arithmétique » et appliquez une multiplication scalaire de 2 sur le nouveau ROI, permettant la quantification indépendante des ROIs.
- Revenir à l’outil 3D de retour sur investissement. Allez dans l’onglet « expert et expérimental » et cliquez sur le bouton « Importer le ROI ». Sélectionnez Inp1 dans la boîte de dialogue charger le nouveau volume comme le ROI controlatérale.
- Faites un clic droit sur l’image moyenne de PET et le décharger et ré-allumer le PET. Générer les résultats quantitatifs de l’absorption à l’aide de l’icône « exporter les résultats » au sein de l’outil 3D de retour sur investissement.
- Effectuer une analyse du cerveau divisés supplémentaires si vous le souhaitez (c.-à-d. automatisé ROI génération de droit par rapport à des régions d’hémisphère gauche du cerveau en utilisant un module plugin de souris 3D brain atlas pour le logiciel Vivoquant).
- Re-charger les images enregistrées de TEP/CT.
- Importer l’atlas de cerveau de la souris en cliquant sur le menu « modules avancés » et sélectionner l’outil d’atlas du cerveau 3D. Sélectionnez « tous les régions left/right » dans les « paramètres avancés » et cliquez sur « Exécuter » pour importer l’atlas 3D.
- Ajuster manuellement l’atlas dans le cerveau à l’aide du crâne comme frontière.
- Exécutez de nouveau l’atlas en vous assurant que « l’importation 3D ROI » est cochée pour générer une feuille de calcul des résultats pour tous les ROIs d’hémisphère droit et gauche 14 (bulbe rachidien, cervelet, mésencéphale, pons, cortex, hippocampe, thalamus, hypothalamus, striatum, pallidum, bulbes olfactifs, corps calleux et la substance blanche).
- Quantifier la captation du traceur dans la rate à l’aide du scanner, logiciels d’exploitation (voir Table des matières).
- Charger des fichiers d’images TEP et CT en sélectionnant dans la base de données en cliquant sur « analyse générale ».
- Cliquez sur l’onglet Enregistrement et enregistrer des images TEP et CT en cliquant sur l’icône « rigid registration ».
- Cliquez sur l’onglet de quantification du ROI, cliquez sur l’icône « créer un retour sur investissement » et nommez-le rate.
- Choisissez l’outil « sphère » dessiner rate ROIs en utilisant le fichier CT comme référence, assurer il n’y a pas de chevauchement avec l’absorption du rein (en utilisant l’image de l’animal et du signal afin d’éviter le débordement des reins).
- Modifier la ROIs pour maintenir leurs volumes ROI cohérentes entre les animaux.
- Calculer une valeur de correction standard pour la normalisation de l’absorption.
- Charger les données de la TEP/CT de l’analyse standard et créer un cylindre ROI englobant la seringue de 20 mL à l’aide de l’outil « ROI 3D manuelle ».
- Obtenir le niveau de radioactivité dans la norme à l’aide de l’icône de feuille de calcul.
- Utilisez ce résultat nCi/cc et la radioactivité originale enregistrée pour le standard (c'est-à-dire, la mesure de calibrateur de dose de la norme de la nCi/cc) pour créer un facteur de correction pour les valeurs d’absorption de PET. Autrement dit, diviser la radioactivité de la norme enregistrée par le calibrateur de dose par la radioactivité calculée à partir de l’image de l’animal de la norme.
- Utiliser les activités de dose et l’heure de mesures à décomposition correcte au moment de l’acquisition de l’animal de compagnie pour toutes les souris (c’est à dire calculer l’activité de la dose au début de la TEP-scan).
- Répétez pour les valeurs résiduelles et en soustraire la dose corrigée de désintégration pour calculer l’activité exacte de chaque animal a reçu.
- Après avoir appliqué cette correction de désintégration, s’appliquent également la correction standard pour s’assurer que les données sont au niveau des activités de droite. S’assurer que ces corrections sont appliquées aux résultats ROI dessinées manuellement et aux régions cérébrales atlas ROI données cérébrales pertinentes pour l’emplacement de dMCAO (c.-à-d., cortex, hippocampe et du striatum).
- Calculer le %ID/g pour tous les ROIs à l’aide de l’équation suivante : %ID/g = (radioactivité ROI dans nCi/cc / corrigé dose reçue dans nCi/cc de désintégration) x 100. Terrain %ID/g en fonction du temps en utilisant le logiciel graphique pour générer des courbes temps/activité pour chaque ROI.
- Utiliser un logiciel de scanner pour la génération de visualisation et figure image finale. Normaliser les images en fonction de la dose corrigée de désintégration reçue par chaque souris au moment de la numérisation, assurant toutes les images sont sur la même échelle de %ID/g.
NOTE : Ceci est nécessaire pour permettre une comparaison précise des images provenant de souris différentes et/ou des images provenant d’études effectuées sur des jours différents
10. autoradiographie Image Analysis
- Ouvrez l’image numérique (fichier .gel) dans les logiciels ImageJ. Régler la luminosité et le contraste à seuil visuellement de l’image et d’appliquer une couleur appropriée « table de choix ».
NOTE : Royal ressemble plus précisément à l’échelle de couleur utilisée en PET. - Utilisez le gestionnaire de ROI dessiner manuellement des ROIs autour d’infarctus et régions controlatérales correspondantes.
- Utilisez la fonction de mesure pour quantifier l’intensité moyenne des pixels de chaque ROI et exporter les résultats. Tracer à l’aide d’un logiciel de statistique.
Résultats
Souris a subi MRI pour vérifier la course réussie et [11C] DPA-713 PET a été réalisée par balayage 4 souris en même temps. PET, CT et des images de résonance ont été conjointement inscrits avant manuellement dessin cerveau ROIs et effectue l’analyse d’atlas de cerveau split semi-automatisé, afin d’étudier la captation du traceur en régions homolatérale et controlatérale (Figure 2).
Images TEP/CT et courbes temps/activité (activité de TAC-traceurs radioactifs en fonction du temps) affichent l’absorption accrue [11C] DPA-713 dans l’ipsilatéral contre hémisphère controlatéral (Figure 3A). Données de quantification des images dynamiques de cerveau PET, à l’aide de résumés de 50 à 60 min, a révélé une augmentation significative de traceur de participation (% ID/g dans l’ipsilatéral (infarcie) par rapport à l’hémisphère controlatéral dans dMCAO, mais pas chez les souris de sham utilisant le manuellement dessiné) Approche ROI (Figure 3B). Une absorption accrue a été observée également dans l’hémisphère ipsilatéral entre souris dMCAO et sham. Aucune différence significative entre les hémisphères homolatéral et controlatéral ont été observés en utilisant l’approche de l’atlas, probablement en raison de l’atlas ROIs étant supérieure à la taille de l’infarctus (généralement limitée au cortex somatosensoriel), donc diluer la signal. Cependant, augmentation de l’absorption globale en dMCAO par rapport à l’imposture a été observée pour tous les ROIs, qui s’aligne sur les rapports précédents, en utilisant des souris modèle OACM, démontrant une expression TSPO accrue dans les régions à l’extérieur de l' infarctus19. Les ratios ipsilatéral/controlatérale augmentaient dans la dMCAO par rapport aux souris factice à l’aide de ces deux approches ; Toutefois, cette différence n’est significative dans le cortex à l’aide de l’approche d’atlas du cerveau en raison de la plus grande variance dans l’approche ROI. Ceci peut être surmonté en augmentant le nombre de souris dans chaque groupe. Quantification de l’absorption de DPA-713 [11C] dans la rate ont montré aucune différence significative entre les groupes (Figure 4).
Résultats d’imagerie de PET de souris de le dMCAO cerveau ont été confirmés par l’ex vivo haute résolution numérique autoradiographie (Figure 5). L’absorption accrue [11C] DPA-713 a été observée chez infarci tissu avec signal négligeable en entourant les tissus cérébraux sains. Analyse quantitative de ces images a révélé homolatéral, controlatéral ratios allant de 1,4 à 2,09 chez la souris dMCAO.

Figure 1 : TEP et configuration de l’espace de travail. Tous les espaces de travail étaient couverts de rembourrage de protection absorbant pour créer un environnement stérile. (A) après étalonnage, un lit de souris 3D-imprimés, équipé pour l’imagerie 4 souris en même temps a été obtenu dans le scanner et les coiffes pour toutes les 4 souris attachées à l’anesthésie. (B) l’équipement nécessaire pour l’imagerie TEP ont été préparées à l’avance, y compris les cathéters de 27,5 G remplis de solution saline, Lubrifiant oculaire, éthanol écouvillons, lampes chauffantes, ruban chirurgical, colle tissu, seringues de dose de 0,5 mL, ciseaux et un briquet. (C) pour l’injection de traceurs radioactifs, place salin-flush seringues et ciseaux à l’arrière du scanneur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
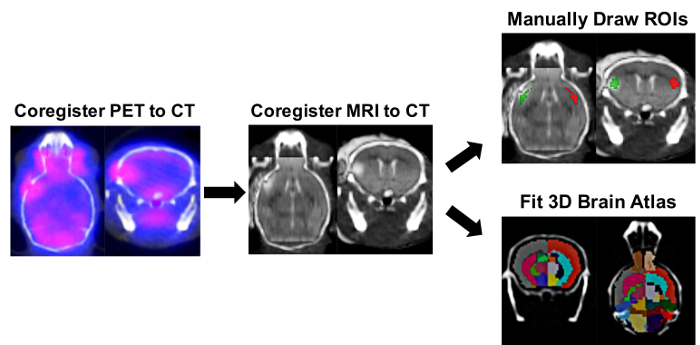
Figure 2 : ROI ipsilatéral/controlatérale et hémisphère droit/gauche-Split Brain Atlas PET Image analyse processus. Analyse d’image logiciel a été utilisé pour déterminer la captation du traceur dans les régions d’intérêt (ROIs) en utilisant manuellement homolatérale et controlatérale tirées des ROIs et une approche semi-automatisée 3D atlas « split brain ». Enregistrement automatique de TEP/CT 3D a été réalisé suivie d’une inscription manuelle de l’IRM cérébrale dans le crâne de souris correspondant défini dans l’image de CT. L’outil ROI 3D a été utilisé pour dessiner manuellement ipsilatéral (rouge) et controlatérales ROIs (verts) à l’aide de l’infarctus, comme une référence sur l’IRM. Pour l’approche « split brain », l’atlas de cerveau de souris gauche/droite-split 3D a été chargé et monté à l’intérieur du crâne au sens de l’image de CT. ROIs de cerveau utilisés pour la quantification dans cet atlas de cerveau de souris 3D incluent Cortex gauche (gris foncé), hippocampe de gauche (bleu bleuet), gauche Striatum (Deep Pink), Cortex droit (rouge tomate), hippocampe de droite (vert) et droit Striatium (Cyan). L’absorption du [11C] DPA-713 dans chacune des régions a été obtenue en nCi/cc et a été par la suite converti en %ID/g en normalisant à la dose de correction de désintégration au moment de la numérisation pour chaque souris. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
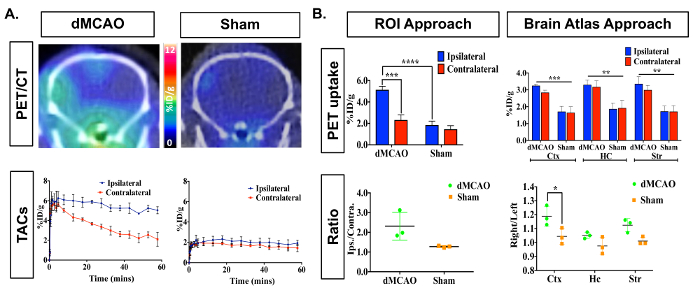
Figure 3 : Représentant In Vivo [11C] DPA-713 cerveau absorption DMCAO et les souris de l’imposture. (A) images TEP/CT dynamique et TAC démontrent l’absorption accrue [11C] DPA-713 dans le cortex ipsilatérale de souris qui a subi une DMCAO (n = 3) et une légère augmentation pour sham (n = 3) exploité souris, souris DMCAO démontrer significativement plus contraste dans la dose injectée de pourcentage entre l’infarctus et le côté controlatéral du cerveau (%ID/g). (B) quantification PET (50-60 min a résumé) a révélé une absorption accrue significativement dans le retour sur investissement ipsilatérale en utilisant l’approche ROI et dans le cortex (Ctx) en utilisant l’approche « split brain » atlas. Aucune des différences significatives dans l’hippocampe (HC) ou striatum (Str). Ratios ipsilatéral à controlatérale accrues ont été vus analysant les deux approches, mais n’est statistiquement significative dans le Ctx en utilisant l’approche d’atlas du cerveau. * (p < 0,05), *** (p < 0,001) s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
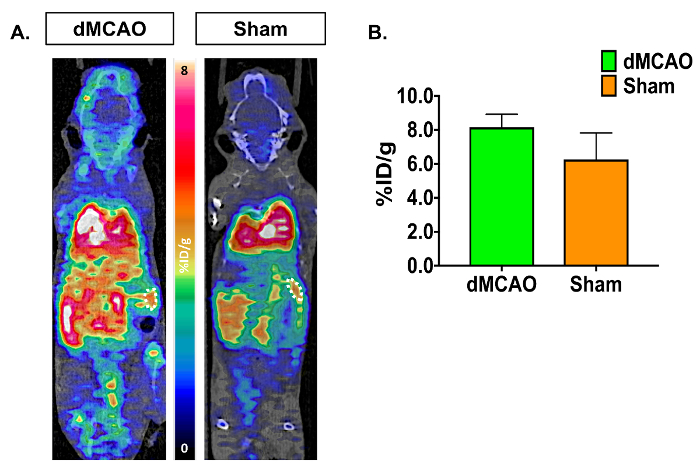
Figure 4 : Représentant In Vivo [11C] DPA-713 rate absorption dans les dMCAO et les souris de Sham. (A) images TEP/CT dynamiques DPA-713 [11C] montrant rate ROIs de dMCAO (n = 3) et sham (n = 3) souris. (B) résultats quantitatifs ne démontrent aucun résultat significatif en absorption rate entre souris dMCAO et sham. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
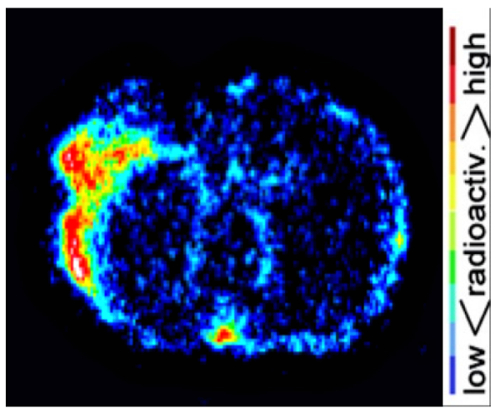
Figure 5 : Représentant l’autoradiographie résultats. Images numériques autoradiographie démontrent accrue [11C] DPA-713 absorption dans l’ipsilatéral par rapport à l’hémisphère controlatéral. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le protocole présenté décrit une méthode pour la quantification de la neuro-inflammation chez la souris dMCAO et sham en utilisant [11C] DPA-713-PET. TSPO-PET est le plus largement étudié biomarqueur d’imagerie pour la visualisation et la mesure neuroinflammation in vivo à ce jour. Expression du TSPO est augmentée sur les cellules gliales du cerveau lors d’une inflammation permettant la détection non invasif et la quantification de la neuroinflammation. En outre, c’est une technique très traduisible, ce qui en fait un outil précieux dans la recherche clinique et préclinique. Ce protocole et les résultats représentatifs mettent en évidence la pertinence de l’utilisation [11C] DPA-713 PET pour détecter et surveiller les modifications thérapeutiques dans les accidents vasculaires cérébraux et autres troubles neurologiques en vivo.
Dans cette étude, dMCAO chirurgie a été réalisée à l’aide de la souris femelles de 3 mois C57BL/6. Ce modèle a été choisi car il donne lieu à un infarctus hautement reproductible restreint au cortex somatosensoriel, fournissant un modèle d’ischémie focale permanente avec une faible variabilité par rapport aux autres modèles d’accident vasculaire cérébral (p. ex. milieu cérébral artériel méthode de l’occlusion (OACM) de filament)14. Imagerie PET des modèles de course a l’avantage de contenir une région de référence interne dans le cerveau pour chaque animal à l’aide de ROIs au sein de l’hémisphère controlatéral. Puisqu’il y aura une inflammation que les résultats de la chirurgie seule, il est important d’inclure des souris qui a été opéré trompe-l'œil dans la conception de l’étude, selon laquelle craniotomie et manipulation des méninges sans occlusion de l’artère a été effectuée. Perturbation peut entraîner pour le tissu neuronal sous-jacent et l’introduction d’agents pathogènes conduisant à des réponses immunitaires indépendants d’AVC20craniotomie seul. Une inflammation post-opératoire de l’imposture est donc à prévoir et devrait être évaluée en parallèle à dMCAO afin d’exclure la possibilité du signal en raison de la chirurgie seule. Afin d’éviter notamment l’inflammation résultant de la chirurgie sans accident vasculaire cérébral chez dMCAO analyse de cohorte, M. formation image doit être effectué pour confirmer le développement de la chirurgie et infarctus AVC réussie. MRI fournit également un cadre de référence structurelles, qui est indispensable pour dessiner avec précision les infarctus et les ROIs controlatérales. En outre, traitement de l’image précise notamment d’images et définition de retour sur investissement sont nécessaires pour garantir une quantification fiable.
Les limites additionnelles doivent garder à l’esprit lorsque vous travaillez avec C-11 marqué traceurs radioactifs pour études TEP et l’autoradiographie. Il est impératif de considérer la courte demi-vie (20,33 min) de C-11, avec son utilisation que se limite généralement à la recherche des instituts avec accès sur le site de cyclotron. Voie de transport appropriés de radioactivité, administration d’une dose et points dans le temps-acquisition doivent être déterminées à l’avance avec un plan détaillé préparé à l’avance du flux de travail de l’expérience afin que l’équipe peut travailler rapidement et efficacement. La conception et la mise en place de cette étude a été décrit pour tenir compte de l’imagerie des 4 souris simultanément pour augmenter le rendement de données disponibles lorsque vous utilisez un traceur C-11. Si possible, il est conseillé d’avoir toutes les souris canulés et au milieu de leur scanner au moment où le traceur C-11 arrive à l’installation d’imagerie afin d’assurer la décomposition minimale de traceurs radioactifs avant l’injection. Ce protocole étape par étape est également mieux réalisé par une équipe contenant au moins 3 chercheurs permettant de canulation rapide, mesure de dose, injection du traceur, balayage d’animal de compagnie et cerveau découpe avant une radioactivité importante. Il faut deux personnes pour procéder à l’ouverture de la TEP et l’injection des 4 souris en même temps. La raison pour le début de l’acquisition de l’animal juste avant l’injection est d’assurer que la pharmacocinétique et la dynamique de la répartition du traceur dans le sang et les régions d’intérêt sont correctement et complètement capturés. Beaucoup d’étapes peut-être exiger la formation vigoureuse et pratique afin d’assurer le bon déroulement de l’expérience. En particulier, le présent protocole est tributaire de la canulation veineuse réussie queue de souris C57BL/6, qui peut être difficile à cause de cheveux noirs présent sur leurs queues et peuvent devenir plus difficiles après la survenance d’accident vasculaire cérébral ou si imagerie les souris mêmes à plusieurs points de temps .
Une autre considération pour l’imagerie TEP comprend attention enregistrement radiotraceur dose et résiduel de mesures d’activité, y compris l’heure exacte de la mesure. Ceci est essentiel pour la correction de la décomposition précise de la dose injectée au moment de l’analyse et permet d’obtenir une mesure précise de l’absorption de traceur(% ID/g) pour chaque ROI. Il est impératif de connaître le montant exact de la radioactivité qui était présent dans chacune des souris au moment de la numérisation afin d’assurer l’analyse des images précises. Il est donc conseillé de synchroniser les horloges sur le scanner ordinateur et calibrateur de dose pour éviter toute erreur lors de l’utilisation des isotopes de courte durée tels que C-11.
Quantification précise d’image PET peut également être limitée par l’exactitude de la scanner et la mise en place. Donc pour assurer une quantification précise des images TEP/CT, il est important de procéder à des contrôles de qualité pour les composants de la CT et PET du scanner. CT de contrôles de qualité ont également x-ray source climatisation, clair/sombre et centre off set étalonnages. Ces étalonnages mesurent et correct pour moûts et bruit système être effectué avant l’acquisition, tel que recommandé par le fabricant du scanneur. Étalonnages devraient également être effectuées pour le PET scanner. Cela implique généralement un balayage « phantom standard / PET », contenant une concentration connue de la radioactivité de numérisation. Lors de l’élaboration de la norme, il est préférable d’utiliser le même radio-isotope utilisé dans l’étude, une dose comparable à celui administré à une seule souris dans un volume semblable au corps d’une souris et l’acquisition de même paramètres comme l’imagerie animale. Une seringue de 20 mL remplie à traceurs radioactifs dilué dans l’eau est utilisée pour la norme dans ce protocole, avec les résultats d’imagerie PET utilisées pour calculer un facteur de correction basé sur la dose réelle mesurée par le détecteur d’étalonnage. Le ratio de correction peut être appliqué aux données d’imagerie a acquises de l’expérience afin d’assurer une quantification précise de la captation du traceur dans les régions d’intérêt dans les images de PET. Ce qui représente la plage de positron du radionucléide en plus de considérer toute activité de fond présente le jour de la numérisation. Le calibrateur de dose fait partie intégrante de la génération de ce facteur de correction, il est impératif que cet équipement est étalonné aussi régulièrement selon les directives du fabricant.
Lorsqu’il procède à l’ex vivo autoradiographie, il est important de choisir un point de temps optimal pour l’euthanasie après l’injection, afin d’assurer le signal-à-fond élevé dans la région (s) d’intérêt. Après injection de trente minutes a été choisi pour l’autoradiographie de DPA-713 [11C] à l’aide de données acquises au cours de l’imagerie TEP dynamique -c'est-à-dire in vivo dynamiques TAC comme guide, tout en tenant compte également de la courte demi-vie du C-11 et du temps impliqué de section et d’exposer le tissu cérébral après extraction. Considérant cela, autoradiographie DPA-713 [11C] doit être effectuée sur une cohorte distincte de souris permettant l’injection d’une dose plus élevée de DPA-713 [11C] et à 30 minutes temps point de perfusion et de l’euthanasie sous anesthésie. Effectuer un petit en vivo étude pilote PET avec une souris de 3-4 avant de mener l’ex vivo autoradiographie sera utile pour déterminer le moment optimal pour l’autoradiographie. Une autre considération pour l’ex vivo autoradiographie est s’il faut récupérer les souris après injection ou gardez-les anesthésiés avant l’euthanasie. En les gardant anesthésiés imite les conditions de l’analyse et assure les cinétiques de distribution ou l’excrétion de traceurs radioactifs ne sont pas modifiées par la récupération. En outre, vous éviterez une pression supplémentaire sur les souris en évitant la récupération et l’induction ultérieure. Enfin, un complément utile au protocole ex vivo serait d’évaluer la détérioration régionale dans les tranches de cerveau utilisé pour l’autoradiographie via immunohistochemical souillant (après la désintégration radioactive) pour générer une image haute résolution de localisation de l’infarctus et volume.
Qu’il sont a des limites à l’utilisation d’un traceur C-11 basé, ce protocole peut facilement être modifié pour utilisation avec un F-18 (demi-vie de 109,77 min) fondée TSPO traceur, qui peut s’appliquer davantage à des endroits sans un cyclotron sur place. En outre, le présent protocole décrit l’utilisation d’une installation d’imagerie 4-souris. Bien que cette méthode de haut débit est optimale lorsque vous utilisez un traceur C-11, ce protocole peut également être modifié pour ceux qui utilisent l’imagerie lits simple de souris. Une planification minutieuse et une formation uniforme dans les techniques décrites dans le présent protocole conduira à la génération d’une multitude de données à l’aide [11C] DPA-713, qui peut facilement être appliqué à sonder le rôle de la neuroinflammation dans la manifestation de la maladie et progression dans les autres modèles de rongeurs des troubles neurologiques. En outre, cette technique pourrait être utilisée pour évaluer la réponse en vivo de thérapies immunomodulatrices visé des microglies/macrophages.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs tiennent à remercier le laboratoire Buckwalter (en particulier le Dr Todd Peterson) pour fournir le modèle murin et effectuer les chirurgies dMCAO et sham. En outre, nous tenons à remercier Thomas Liguori de Invicro pour son assistance technique avec le logiciel d’analyse image VivoQuant, Dr. Tim Doyle, Dr. Laura Pisani, Dr Frezghi Habte depuis le petit animal SCi3 imaging facility à Stanford pour leurs conseils et assistance dans l’élaboration de ce protocole d’imagerie et la facilité de radiochimie (surtout Dr Jun Park) pour leur aide avec la synthèse du [11C] DPA-713.
matériels
| Name | Company | Catalog Number | Comments |
| Inveon PET/CT scanner | Siemens | Version 4.2 | |
| MRI scanner | Varian | 7 Telsa | |
| ParaVision software | Bruker | Version 6.0.1 | MRI operating software |
| VivoQuant software | InVicro | Version 2.5 | Image analysis software |
| Inveon Research Workspace software | Siemens | Version 4.2 | Scanner operating software. Includes microQView, the post-processing managing software |
| Dose calibrator | Capintech | CRC-15 PET | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| Butterfly catheters | SAI Infusion Technologies | BFL-24 | 27.5 G needle |
| 1 mL syringes | BD | ||
| Insulin syringes | BD | 329461 | 0.5 mL insulin syringes with needle |
| 20 mL syringe | VWR | BD302831 | BD Syringe Slip Tip Graduated |
| Tissue glue | Santa Cruz Animal Health | sc-361931 | 3 mL |
| Heat lamp | Fluker | 27002 | 5.5" reptile heat lamp with clamp and switch |
| 0.9% sterile saline | Pfizer | 00409-4888-10 | 0.9% sodium chloride for injection, 10 mL |
| Eye lubricant | Watson Rugby | PV926977 | Artificial Tears Lubricant Eye Ointment, 1/8 oz |
| Chux absorbent sheets | ThermoFisher Scientific | 1420662 | Disposable absorbent padding |
| Iris scissors | World Precision Instruments | 503708-12 | 11.5 cm, Straight, 12-pack |
| Surgical tape | 3M Durapore | 1538-0 | 1/2" x 10 yard roll, silk, hypoallergenic |
| Mouse PET bed | In house | 4 mouse PET bed | |
| Lighter | Bic | UDP2WMDC | |
| Isoflurane | Henry Schein | NDC 11695-6776-2 | Isothesia, inhalation anesthetic, 250 mL |
| Oxygen | Praxiar | UN1072 | Compressed gas |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 × 25 cm, screen only |
| Microtome blades | ThermoFisher Scientific | 30-508-35 | MB35 Premier Disposable, 34° cutting angle |
| Microtome | Microm | HM 550 | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost™ Plus Microscope Slides |
| OCT liquid | VWR | 25608-930 | Formulation of water-soluble glycols and resins for cryostat sectioning at temperatures of -10°C (14°F) and below |
| Freezing molds | Poly sciences | 18646A-1 | Disposable paraffin molds |
| Saran wrap | Saran | 25700001300 | |
| Disinfectant | Virkon S |
Références
- Benjamin, E. J., et al. Heart disease and stroke statistics-2017 update: A report from the american heart association. Circulation. 135 (10), 146-603 (2017).
- Jin, R., Yang, G., Li, G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells. J Leukoc Biol. 87 (5), 779-789 (2010).
- Wang, Q., Tang, X. N., Yenari, M. A. The inflammatory response in stroke. J Neuroimmunol. 184 (1-2), 53-68 (2007).
- Brown, R. C., Papadopoulos, V. Role of the peripheral-type benzodiazepine receptor in adrenal and brain steroidogenesis. Int Rev Neurobiol. 46, 117-143 (2001).
- Papadopoulos, V., Lecanu, L., Brown, R. C., Han, Z., Yao, Z. X. Peripheral-type benzodiazepine receptor in neurosteroid biosynthesis, neuropathology and neurological disorders. Neuroscience. 138 (3), 749-756 (2006).
- Scarf, A. M., Kassiou, M. The translocator protein. J Nucl Med. 52 (5), 677-680 (2011).
- Cerami, C., Perani, D. Imaging neuroinflammation in ischemic stroke and in the atherosclerotic vascular disease. Curr Vasc Pharmacol. 13 (2), 218-222 (2015).
- Stefaniak, J., O'Brien, J. Imaging of neuroinflammation in dementia: a review. J Neurol Neurosurg Psychiatry. 87 (1), 21-28 (2016).
- Gerhard, A. TSPO imaging in parkinsonian disorders. Clin Transl Imaging. 4, 183-190 (2016).
- Airas, L., Rissanen, E., Rinne, J. O. Imaging neuroinflammation in multiple sclerosis using TSPO-PET. Clin Transl Imaging. 3, 461-473 (2015).
- Fan, J., Lindemann, P., Feuilloley, M. G., Papadopoulos, V. Structural and functional evolution of the translocator protein (18 kDa). Curr Mol Med. 12 (4), 369-386 (2012).
- James, M. L., et al. Synthesis and in vivo evaluation of a novel peripheral benzodiazepine receptor PET radioligand. Bioorg Med Chem. 13 (22), 6188-6194 (2005).
- Boutin, H., et al. 11C-DPA-713: A novel peripheral benzodiazepine receptor PET ligand for in vivo imaging of neuroinflammation. J Nucl Med. 48 (4), 573-581 (2007).
- Doyle, K. P., Buckwalter, M. S. A mouse model of permanent focal ischemia: distal middle cerebral artery occlusion. Methods Mol Biol. 1135, 103-110 (2014).
- Wang, Y., et al. [(18)F]DPA-714 PET imaging of AMD3100 treatment in a mouse model of stroke. Mol Pharm. 11 (18), 3463-3470 (2014).
- Domercq, M., et al. PET Imaging with [(18)F]FSPG evidences the role of system xc(-) on brain inflammation following cerebral ischemia in rats. Theranostics. 6 (11), 1753-1767 (2016).
- Toth, M., et al. Acute neuroinflammation in a clinically relevant focal cortical ischemic stroke model in rat: longitudinal positron emission tomography and immunofluorescent tracking. Brain Struct Funct. 221 (3), 1279-1290 (2016).
- Walter, H. L., et al. In vivo analysis of neuroinflammation in the late chronic phase after experimental stroke. Neuroscience. 292, 71-80 (2015).
- Rojas, S., et al. Imaging brain inflammation with [(11)C]PK11195 by PET and induction of the peripheral-type benzodiazepine receptor after transient focal ischemia in rats. J Cereb Blood Flow Metab. 27 (12), 1975-1986 (2007).
- Glazier, S. S., O'Rourke, D. M., Graham, D. I., Welsh, F. A. Induction of ischemic tolerance following brief focal ischemia in rat brain. J Cereb Blood Flow Metab. 14 (4), 545-553 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon