Method Article
Imaging del Neuroinflammation utilizzando [11C] DPA-713 in un modello murino di ictus ischemico per animali
In questo articolo
Riepilogo
Formazione immagine di tomografia a emissione di positroni (PET) di translocator proteina 18 kDa (TSPO) fornisce un mezzo non invasivo per visualizzare il ruolo dinamico del neuroinflammation nello sviluppo e nella progressione delle malattie del cervello. Questo protocollo descrive autoradiografia TSPO-PET ed ex vivo per rilevare neuroinflammation in un modello murino di ictus ischemico.
Abstract
Neuroinflammation è centrale per la cascata patologica dopo ictus ischemico. Metodi non invasivi di imaging molecolare hanno il potenziale per fornire approfondimenti critici la dinamica temporale e il ruolo di determinate interazioni neuroimmune nel colpo. In particolare, la formazione immagine di tomografia a emissione di positroni (PET) di translocator proteina 18 kDa (TSPO), un marker di microglia attivata e cellule mieloidi periferiche, fornisce un mezzo per rilevare e tracciare neuroinflammation in vivo. Qui, presentiamo un metodo per quantificare con precisione utilizzando neuroinflammation [11C]N,N-Diethyl-2-[2-(4-methoxyphenyl)-5,7-dimethylpyrazolo[1,5-a]pyrimidin-3-yl]acetamide ([11C] DPA-713), una promettente seconda generazione TSPO-PET radiotraccitore, nell'occlusione distale dell'arteria cerebrale media (dMCAO) rispetto ai topi falsità-azionati. MRI è stata effettuata 2 giorni post-dMCAO chirurgia per confermare il colpo e definire la posizione di infarto e il volume. Imaging PET/computata tomografia computerizzata (TC) è stata effettuata 6 giorni post-dMCAO per catturare l'aumento di picco nei livelli TSPO colpo seguente. Quantificazione di immagini PET sono stati intrapresi per valutare l'assorbimento di [11C] DPA-713 nel cervello e milza di topi dMCAO e sham per valutare i livelli centrali e periferici di infiammazione. In vivo [11C] Assorbimento DPA-713 del cervello è stata confermata usando ex vivo autoradiografia.
Introduzione
Il colpo è la quinta causa di morte e delle principali cause di disabilità negli Stati Uniti1. Ictus ischemico rappresenta la stragrande maggioranza di questi casi (~ 87%), che si verificano quando c'è rottura localizzata nel flusso di sangue al cervello (per esempio, da un coagulo di sangue o il deposito di grasso). Rifornimenti di ossigeno e nutrienti per le zone colpite sono successivamente ridotto e una cascata patologica complessa viene avviata con conseguente morte di un neurone all'interno del nucleo di ictus (infarto) oltre alle zone circostanti. Neuroinflammation è una componente cruciale nella via che conduce a questo danno, con entrambe le cellule immunitarie del cervello residente (microglia) e infiltrazione di cellule immuni periferiche (neutrofili, linfociti T, linfociti B e monociti/macrofagi) pensato per contribuire a questo la cascata distruttiva2,3. Macrofagi e microglia attivata sono fondamentali per questa risposta neuroinfiammatorie, con segnalazioni di effetti deleteri sia benefici dopo ictus ischemico2. Pertanto, è indispensabile per valutare il contributo in vivo di queste cellule che segue il colpo.
PET è una potente tecnica di imaging molecolare 3-dimensionale che permette la visualizzazione del biologico i processi in vivo mediante l'utilizzo di specifiche molecole etichettati con positroni (β +) che emettono i radionuclidi come 11C, 13N, 15O e 18F. Questo metodo non-invasivo ha molti vantaggi rispetto ai metodi ex vivo (ad es., immunoistochimica) poiché permette l'acquisizione di informazioni molecolari in tempo reale, in soggetti intatto di viventi e consente per indagine longitudinale su. Imaging PET di TSPO, un indicatore di microglia attivata e cellule mieloidi periferiche, fornisce un mezzo per quantificare e tenere traccia delle risposte delle cellule immuni innate all'interno del corpo e può essere utilizzato per valutare l'infiammazione dopo ictus e risposta terapeutica interventi. TSPO, precedentemente noto come il recettore periferico delle benzodiazepine, è una proteina di 18 kDa che è creduta per svolgere un ruolo nel trasporto del colesterolo e la sintesi di neurosteroidi4. Inoltre, la prova suggerisce che TSPO è coinvolto nella neuroinflammation e sopravvivenza neuronale5,6, con rapporti di espressione aumentata in molti disordini neurologici che coinvolgono l'infiammazione compreso colpo7, 8di demenza, morbo di Parkinson9 e sclerosi multipla10. TSPO si trova sulla membrana mitocondriale esterna ed è altamente espresso in periferia, in particolare in steroidi relativi tessuti (ad es., ghiandole) e con livelli intermedi visti nel cuore, reni e polmoni10. Tuttavia nel cervello sano, TSPO livelli sono bassi e limitato principalmente al glia6,11. Dopo un danno di un neurone, come quello osservato nel colpo, TSPO livelli nel sistema nervoso centrale (SNC) aumentano significativamente. Questo upregulation osservato di TSPO può essere sfruttato per immagine neuroinflammation in vivo, con livelli di espressione fornendo un accurato indicatore della severità di infiammazione. Quindi, l'obiettivo di questo metodo è quello di quantificare con precisione il contributoin vivo del neuroinflammation in un modello murino di colpo ischemico utilizzando TSPO-PET.
Più elementi traccianti TSPO sono stati sviluppati per l'imaging PET di neuroinflammation. Qui, imaging TSPO-PET è descritto usando [11C] DPA-71312, una promettente generazione secondo tracer TSPO, che ha mostrato maggiore segnale al rumore e abbassare il legame non specifico il più storicamente usato [11C] PK11195 13 . Ad esempio, il modello del mouse dMCAO del colpo è stato scelto per questo metodo14. Questo modello prevede craniotomy temporale e la legatura permanente dell'arteria cerebrale centrale distale, con conseguente ischemia focale della corteccia somatosensoriale. Questo è vantaggioso in ricerca pre-clinica dell'ictus dovuto l'alta riproducibilità del danno ischemico e tassi di mortalità bassi associati con questo modello. Ad oggi, studi di imaging TSPO-PET devono ancora essere riportati nel modello di roditore dMCAO. Tuttavia, precedenti studi PET imaging utilizzando il modello di occlusione (MCAO) dell'arteria cerebrale media, un modello del colpo più severa e variabile, in entrambi i topi e ratti, hanno segnalato espressione TSPO aumentare dal giorno 3 e picco intorno 7 ° giorno post-ictus15, 16,17,18. Quindi, abbiamo effettuato la PET imaging 6 giorni post-dMCAO in concomitanza con espressione TSPO elevata. [11C] DPA-713 assorbimento nel cervello è stata valutata in ipsilateral (colpito da infarto) e gli emisferi controlaterali. TSPO-PET è stato combinato con MRI strutturale, consentendo una precisa delineazione dell'infarto e controlaterale regioni di interesse (ROI). Qui descriviamo un Atlante-based e un approccio basato su MRI ROI per calcolare l'assorbimento di DPA-713 [11C]. L'assorbimento del radiotraccitore nella milza inoltre è stata valutata per indagare i livelli periferici di infiammazione tra gruppi. Questo metodo ha il potenziale per fornire approfondimenti critici la dinamica spazio-temporale e ruolo delle interazioni specifiche neuroimmune nell'ictus e altre malattie neurologiche.
Protocollo
Tutti gli studi sugli animali sono stati effettuati in conformità con il pannello amministrativo il laboratorio animale cura (APLAC) presso la Stanford University, un programma accreditato dall'associazione per la valutazione e l'accreditamento di laboratorio Animal Care. Prima di questa procedura, i topi femminili C57BL/6 three-month-old ha subito la chirurgia di dMCAO seguendo la procedura standard e condizioni sterili14.
1. strutturali MRI (2 giorni Post-dMCAO chirurgia)
- Aprire il software operativo (Vedi Tabella materiali) e set-up l'acquisizione mediante la creazione di un nuovo esame. Selezionare il localizzatore e sequenze T2 turborare in Esplora tavolozza e trascinare nella finestra di esame.
- Proteggere le vie respiratorie e calore sonde al letto del mouse utilizzando nastro morbido e posizionare una striscia di protezione assorbente imbottitura sopra entrambi per creare un ambiente sterile.
- Allegare un riscaldatore di aria al letto animale e accendere il ventilatore in modo che l'aria calda è su e mantenendo il mouse riscaldato. Utilizzare un sistema di monitoraggio automatico per garantire la temperatura corporea e la frequenza respiratoria sono mantenuti a livelli adeguati per tutta la durata della scansione.
-
Anestetizzare il mouse in una camera di induzione utilizzando isoflurano inizialmente, quindi mantenere il 3% a 1-2% (2 L/min, 100% O2). Assicurarsi che un termoforo è acceso sotto la camera di induzione per mantenere caldo il mouse durante l'induzione. Una volta anestetizzato, applicare del lubrificante occhio per il mouse per evitare la secchezza e la formazione di ulcere corneali.
- Accendere il sistema di anestesia (Isoflurane 1-2%, 2 L/min 100% O2) collegato allo scanner MRI e trasferire l'animale al letto del mouse.
- Posizione del mouse testa-inclini sul morso bar e correzione dell'orecchio bar in luogo, facendo attenzione che non sporgono di fuori del diametro del letto.
- Mettere la bobina di RF sopra la testa del mouse e spingere la bobina e il letto nel foro, ponendolo in modo specifico per isocenter.
- Acquisire il localizzatore per visualizzare la posizione del mouse in tutte le 3 dimensioni e utilizzare questa immagine per definire il volume per turborare T2 (TE: 33 ms, TR: 2.500 ms, 2 medie, 17 fette, risoluzione 0,083 x 0.92 mm, tempo totale 2 min 40 sec) acquisizione. risultati di chirurgia di dMCAO in un infarto nella corteccia somatosensoriale14; Pertanto, assicurarsi che questa regione è coperto in immagine di T2-weighted.
- Rimuovere i topi dallo scanner e recuperare i topi in una camera riscaldata.
2. PET/CT calibrazioni e installazione di Workflow (6 giorni Post-dMCAO chirurgia)
- Creare un flusso di lavoro di imaging nel software scanner-funzione per includere un'acquisizione di attenuazione di CT, acquisizione 60 minuti C-11 dinamico PET (350-650 keV livello discriminazione, 3.438 ns coincidenza finestra), istogramma (20 fotogrammi: 5 x 15 sec, 4 x 1 min, 11 x 5 min; con tempo morto di correzione) e una ricostruzione 3DOSEM-OP (2 iterazioni, 18 sottoinsiemi) per creare 128 x 128 x 159 immagini con 0,776 x 0,776 x dimensione del voxel di 0.96 mm.
- Eseguire la sorgente di raggi x condizionata tramite il pannello di calibrazione CT situato nell'angolo superiore sinistro dell'interfaccia. Questa taratura deve avvenire ogni settimana o prima della scansione se il sistema non è stato utilizzato nelle passate 48 ore.
-
Eseguire centro offset (c/o) calibrazioni e buio/luce (D/L).
- Pulsante di calibrazione premere il CT (X) in alto a sinistra dell'interfaccia.
- Selezionare D/L e c/o per il file di CT che verrà eseguita, è necessario rimuovere il letto dal cavalletto ed eseguire la taratura di D/L.
- Inserire il letto di strumento di calibrazione dello scanner ed eseguire la calibrazione c/o, facendo attenzione a passare la selezione sull'interfaccia a "strumento di calibrazione" anziché "tavolozza di 70 mm".
- Rimuovere lo strumento di calibrazione e restituire il letto PET standard, avendo cura di cambiare la selezione sull'interfaccia torna a «tavolozza di 70 mm».
- Garantire un letto di imaging 4-mouse sulla piattaforma dello scanner utilizzando il nastro e collegare il tubo di anestesia (Figura 1A). Garantire che isoflurano non scorre attraverso i tubi e che ci sono sia attorcigliato.
- Spingere il letto in avanti quindi è nel centro del campo visivo (FOV), chiudere la porta di CT e ottenere uno scout view del CT per garantire che il letto è nella posizione corretta.
-
Eseguire una calibrazione "standard" dello scanner PET/CT usando un fantasma fabbricato in-House che contiene una dose nota di soluzione di C-11 come una fonte di radiazione.
- Preparare una siringa da 20 mL riempita con la dose di tracciante equivalente a che ha amministrato per un mouse (~ 250-350 µ Ci/9 - 13 MBq di tracciante C-11 diluito in soluzione salina).
- Registrare l'attività nello standard utilizzando un calibratore di dose e prendere nota del tempo di misura.
- Effettuare una scansione PET/CT dello standard utilizzando gli stessi parametri esatti che serviranno ai topi di immagine (come descritto sopra). Fare questo settimanale per creare un fattore di correzione per lo scanner PET applicare i dati di imaging.
3. area di lavoro installazione per l'Imaging PET/CT
- Creare un ambiente sterile utilizzando un disinfettante con virucida (Vedi Tabella materiali) e immissione imbottitura assorbente protettiva su tutte le superfici.
- Garantire serbatoi isoflurano e ossigeno sono adeguatamente riempiti.
- Preparare coda vena cateteri da riempire una siringa da 1 mL (misura con una punta di spillo 27,5 G) con cloruro di sodio 0,9% (soluzione fisiologica sterile) e vampate di calore attraverso un 27,5 G, catetere di farfalla di 24 cm. Tagliare le ali del catetere prima di incannulamento per garantire che non bloccano la visualizzazione della vena della coda e consente con facilità di spostamento i topi nello scanner senza spostare il catetere.
- Garantire che tutte le attrezzature essenziali sono strutturata nella postazione di lavoro tra cui ricambio siringhe "a filo" (riempiti con soluzione fisiologica sterile), occhio lubrificante, tamponi di etanolo, lampade di calore, preparato cateteri (pre-riempiti con soluzione fisiologica), colla del tessuto, nastro chirurgico, siringhe di dose da 0,5 mL, forbici e un accendino per sigillare il catetere dopo posizionamento di successo nella vena caudale (Figura 1B).
4. inserimento di una canula e preparazione animale
- Pesare i topi per determinare il volume massimo consentito deve essere iniettato in ogni mouse (cioè, volume del tracciante e qualsiasi Salina somministrata deve non superi il 10% del peso corporeo).
- Anestetizzare topi in un'aula di induzione utilizzando 3% Isoflurane e mantenere a 1-2% (2 L/min 100% O2).
- Applicare il lubrificante occhio per ogni mouse e confermare amputate tramite pedale reflex (pizzico di punta). Se necessario, regolare i livelli di anestesia.
- Posizionare il mouse sul lettino riscaldato dotato di un cono di naso per consegnare isoflurano a 1-2% (2 L/min 100% O2).
-
Mentre il mouse è anestetizzato, eseguire incannulazione della vena della coda utilizzando il seguente protocollo:
- Posizionare il mouse su un lato per esporre una delle vene laterali, mentre la testa rimane nel cono di naso.
- Scaldare la coda utilizzando una lampada di calore, facendo attenzione a non surriscaldare o bruciare la coda e tamponare con un batuffolo imbevuto di alcool per dilatare la vena e sterilizzare il sito di iniezione.
- Tenere l'ago con la smussatura e allinearlo con la vena ad angolo acuto.
- Leggermente applicare pressione per forare la pelle e livellare l'ago, quindi è in linea con la vena.
- Spingere delicatamente avanti pochi millimetri passato la smussatura così l'ago entri la vena.
- Confermare che il catetere è amministrando un flush di piccole (10-20 µ l) di soluzione fisiologica. La soluzione salina dovrebbe lasciare la siringa senza intoppi e la vena dovrebbe cancellare. Se si osserva qualsiasi pressione resistenza o retro, è probabile il catetere non è in vena e ri-tentativo di inserimento di una canula è consigliabile. Se si osserva la coagulazione, uso di eparina (eparina di 1.000 unità per mL di soluzione salina) per installazione di inserimento di una canula e vampate di calore.
Nota: Abbiamo valutato l'inserimento di una canula con e senza eparina nel ceppo del mouse di interesse, e poiché nessuna coagulazione è stata osservata, soluzione salina da sola è stato usato per inserimenti di una canula. - Fissare il catetere alla coda utilizzando una piccola goccia di colla del tessuto, seguita da nastro chirurgico, per garantire che il catetere rimane immobile quando si trasferiscono i topi allo scanner.
- Rimuovere la siringa a filo alla fine del catetere e sigillare l'estremità con l'accendino, assicurando il ricercatore non è vicino a qualsiasi isoflurano o etanolo.
- Ripetere per 3 topi supplementari che 4 tutti i topi da sottoporre a scansione sono cannulati e preparati.
- Attivare il flusso di anestesia (2,5% Isoflurane, 2 L/minuto 100% O2) collegato al PET/CT e attentamente posizione i topi inclini in piano dello scanner, garantendo cateteri restano in vigore e testa di ogni mouse è dritto e sicuro all'interno del cono di naso. Nastro la testa e il corpo di ogni mouse al letto con morbido nastro chirurgico, garantendo la respirazione non è limitato dal posizionamento del nastro. Registrare la posizione di ogni mouse per consentire la corretta posizione e allocazione di gruppo per l'analisi di immagine.
- Tenere topi riscaldati durante tutta la procedura (ad esempio, utilizzando una lampada di calore o il sistema della pompa di aria calda per garantire topi vengono mantenuti caldi senza surriscaldamento). Monitorare la frequenza respiratoria di tutti i topi, visivamente se usando un cavalletto aperto o attraverso un sistema di monitoraggio remoto utilizzando tamponi respiratori e alterare i livelli di anestesia come necessario.
5. CT acquisizione
- Una volta che gli animali sono sicuri nel letto e la respirazione è stabile, accendere il laser Croce peli e spostare la scansione letto in modo che siano allineate con il cervello di tutti i quattro topi. Spostare il piano dello scanner nella posizione di acquisizione (posizione 3) con i cervelli dei topi come vicino al centro del FOV come possibile.
- Acquisire un'immagine di vista scout dei topi per verificare la loro posizione (uso un 200 mm FOV) e regolare la posizione trascinando la casella di FOV sull'interfaccia se necessario. Fare clic su "Avvia flusso di lavoro" il software dello scanner per iniziare l'esplorazione di CT, assicurandosi di selezionare "Visualizza le richieste di utente interattivo" così l'esplorazione dell'animale domestico può essere avviata manualmente prima dell'iniezione del tracciante.
6. [11C] DPA-713 Dose preparazione
- Sintetizzare [11C] DPA-713 come precedentemente descritto12, garantendo indossi appropriati dpi (dispositivi di protezione individuale) per la gestione di radioattività, tra cui un camice da laboratorio, guanti e dosimetri personali di dito e corpo. Assicurati di cambiare i guanti regolarmente per prevenire la contaminazione radioattiva e aumentare la distanza dalla sorgente radioattiva quando possibile.
- Utilizzare pinze per trasferire con cautela il flaconcino radiotraccitore dietro una schermatura al piombo.
- Preparare le siringhe con dose da 0,5 mL per ogni mouse che contiene circa 250-350 µ Ci/9-13 MBq in 100-200 µ l di volume per garantire una dose adeguata per una scansione PET dinamica di 60 minuti (dose somministrata deve essere determinato considerando l'emivita del isotopo e linea del tempo di studio design, con il volume a seconda del peso del mouse).
- Misura l'attività utilizzando un calibratore di dose impostata su C-11, situato in prossimità del sito di inserimento di una canula e registrare i tempi di misurazione e di iniezione per attivare la correzione di decadimento. Redigere le dosi poco prima le estremità di CT per limitare il degrado e garantire il livello desiderato di radioattività saranno iniettate in ogni mouse.
- Verificare che non siano senza bolle d'aria nella siringa dose prima misurazione dell'attività e iniettare ogni mouse.
7. PET acquisizione
- Una volta che i topi avanzano automaticamente da CT al PET, impostare sul retro dello scanner per l'iniezione di DPA-713 [11C] (Figura 1C). Posizionare imbottitura assorbente protettivo su una sporgenza e assicurarsi che le forbici e accendino sono a disposizione.
- Praticare il tubo del catetere sigillato con forbici, controllare catetere linee sono chiare di tutte le bolle e confermano che la cannula è ancora all'interno della vena eseguendo un 10-20 µ l di soluzione salina. Caricare le siringhe di dose misurata dal punto 6.4 in ciascuno dei 4 cateteri, tenere traccia di quale dose è stata data per ogni mouse.
- Fare clic su "OK" quando l'esplorazione dell'animale domestico è pronto per iniziare mentre simultaneamente a partire un timer di 10 secondi. Hanno in mano, due ricercatori sul retro dello scanner con le siringhe di dose da iniettare 4 tutti i topi simultaneamente al momento il timer raggiunge zero. Lavare ogni catetere con 50-100 µ l di soluzione fisiologica (a seconda della lunghezza del tubo del catetere — cioè, il volume morto) per assicurarsi che l'intera dose entra vena caudale e richiudere e sigillare il tubo ancora una volta utilizzando un accendino.
- Misurare le siringhe di dose utilizzando un calibratore di dose per ottenere un valore di radioattività residua (qualsiasi elemento tracciante nella siringa). Prendere nota dei valori e il tempo che sono stati registrati.
- Una volta completata la scansione, casa il domestico letto nella posizione originale usando il tasto "home" orizzontale all'interno del movimento pannello di controllo. Rimuovere i topi dallo scanner e rimuovere con cautela il catetere. Applicare una leggera pressione sul sito di inserimento di una canula per prevenire il sanguinamento eccessivo.
- Misurare l'attività residua nel catetere mediante un calibratore di dose come descritto in precedenza.
- Se i topi sono da recuperare garantire che ciò avvenga in un ambiente caldo (ad esempio, in una scatola con un pad riscaldato sotto o contenente un guanto riempito con acqua calda) per facilitare il recupero. Se il programma di eutanasia i topi, posizionare i topi in una camera di induzione contenente isoflurano, in modo che essi rimangono anestetizzati prima dell'eutanasia tramite aspersione.
- Per ricostruire i dati, aprire il software di gestione post-elaborazione (Vedi Tabella materiali), che ricostruirà automaticamente ogni scansione utilizzando i dati di istogramma che è stati generati dal file lst.
8. cervello autoradiografia
- Prima dell'esperimento, è necessario cancellare il film di autoradiografia digitale esponendolo al bianco luce per 10-15 min e mantenere in un ambiente privo di radioattività fino all'utilizzo.
- Preparare siringhe da 0,5 mL dose per ogni mouse contenente circa 1.0-1.5 mCi/37-56 MBq per garantire una dose adeguata per autoradiografia.
- Misurare la radioattività nella siringa dose, utilizzando un calibratore di dose, prima dell'iniezione per ottenere una lettura accurata dell'attività.
- Incannulare come descritto in precedenza e iniettare topi immediatamente in una zona adatta per la radioattività.
- Rimuovere il catetere dopo l'iniezione e misurare la radioattività residua.
- Lasciare i topi in una camera riscaldata induzione, in modo che rimangano anestetizzati prima di aspersione e l'eutanasia.
-
Eseguire l'eutanasia, mentre topi sono profondamente anestetizzati (inalazione continua di 4% Isoflurane, 2 L/min 100% O2) tramite aspersione di PBS e toracotomia bilaterale 30 min post-[11C] DPA-713 iniezione.
- Aprire la cavità addominale e tagliare attraverso il diaframma per esporre il cuore.
- Inserire un ago di infusione del catetere farfalla nel ventricolo sinistro del cuore, e snip l'atrio di destra e la vena cava inferiore.
- Irrorare lentamente con PBS (~ 20-30 mL) utilizzando una siringa da 20 mL.
- Rimuovere con cautela il cervello dal cranio utilizzando pinze e le forbici.
- Posto il cervello in uno stampo di congelamento riempito con temperatura ottimale di taglio liquido (OCT), facendo attenzione che al cervello è di livello e centrata all'interno dello stampo, con bulbi olfattivi orientati verso le tacche nello stampo (per fornire punti di riferimento e orientamento una volta il cervello viene rimosso dallo stampo).
- Muffa di posto sul ghiaccio secco per 10-15 min o fino a quando il OCT diventa opaco.
- Immediatamente posto ogni stampo nel criostato microtomo set a-18 ° C ed equilibrare per 10 min prima del montaggio.
- Togliere lo stampo congelamento e montare il cervello alla piattaforma microtomo usando una piccola quantità di fresco ottobre come il "collante".
- Lasciare il cervello montato nel microtomo per congelare per 2 min.
- Affettare attraverso il cervello fino a quando la posizione di corsa è esposta (cioè, ROI). Utilizzare l'immagine di MR per individuare l'infarto all'interno del cervello di ogni animale. Per dMCAO, questo dovrebbe essere costantemente nella corteccia somatosensoriale; Tuttavia, la lunghezza del tratto può variare leggermente.
- Sezione della regione del cervello che abbracciano l'infarto, immissione 20 µm di spessore sezioni su vetrini etichettati con il numero del mouse appropriato.
- Aprire la cassetta di autoradiografia e il fondo della cassetta con un foglio di pellicola trasparente. Organizzare le diapositive sezione rivolta verso l'alto in cima l'involucro di saran nel cassetto e prendono nota della posizione di ogni diapositiva. Facoltativamente, scattare una foto del collocamento diapositiva per assistere con un'analisi successiva.
- Delicatamente posto un altro strato di pellicola trasparente sulla parte superiore (dopo aver aspettato ~ 2 min dopo la raccolta dell'ultima sezione del cervello - permettendo che si asciughi e aderire alla diapositiva) e posizionare con attenzione la pellicola di autoradiografia digitale (lato bianco rivolto verso il basso) sopra le diapositive.
- Chiudere ermeticamente la cassetta e lasciare in un congelatore a-20 ° C, permettendo che le sezioni a decadere sul film per un tempo di esposizione adeguato (~ 5-10 emivite).
- Eseguire la scansione della pellicola dopo il tempo di esposizione utilizzando un imager di fosforo per generare un'immagine digitale per la successiva analisi.
9. dinamica immagine PET analisi
- Aprire il software di analisi di immagine (Vedi Tabella materiali) e fare clic sull'icona "open data" per caricare l'immagine di CT (come origine) e l'icona "Aggiungi dati" per caricare il PET dinamico (come riferimento).
- Eseguire un controllo visivo di qualità dei dati tramite l'operatore di serie temporali nel menu a discesa: selezionare il riferimento ("ref") e "globale" e applicare un appropriato min e max per la scala di colore. Visualizzare i dati dinamici di PET fotogramma per fotogramma, verificare l'assorbimento di radioattività e controllo per qualsiasi movimento confonde entro la scansione.
- Creare un'immagine PET media utilizzando il "operatore aritmetico".
- Scegliere "media selezionata", deseleziona "ref" e garantire l'ingresso 1 ("Inp1"), ingresso 2 ("ING2") e ingresso stella ("Inp *"-include il resto dei telai PET nella scansione) sono selezionati per creare una media di tutti i fotogrammi di PET.
- Vai alla scheda "gestione dati" (DM) e trascinare l'immagine media fino alla posizione di "input1" per scopi di visualizzazione. Ridistribuire la scala di colore facendo clic su calcolo automatico nello strumento "min-max".
- Registrare il CT per la media file PET utilizzando la funzione "3D automatica" nel menu a discesa di "re-orientation/registrazione".
- Selezionare "ref" e "Inp1" e scegli "rigida", "veloce", "Inp1 a Ref" registrazione. Controllare visivamente la registrazione in tutte le 3 dimensioni e regolare manualmente se necessario nella scheda "manuale 3D" utilizzando le funzioni di "traduzione" e la "rotazione".
- Quando siete soddisfatti con la registrazione, selezionare "ING2" e "Inp *" e si applicano a tutti i fotogrammi PET facendo clic sul segno di spunta. Fare clic con il pulsante destro sui file CT e PET in DM e salvare come crudo.
- Ritagliare il cervello di un topo in un momento per l'analisi del cervello usando il CT come guida: selezionare "ritaglio" dal menu a discesa e trascinare i contorni dell'immagine per ritagliare la testa del mouse sotto il tronco cerebrale. Ri-orientare le immagini PET e CT usando la funzione "riorientamento 3D manuale" come descritto sopra in modo che il cranio è dritto in tutte le dimensioni.
- Caricare l'immagine di MR per quel mouse (in formato DICOM) utilizzando il pulsante "Aggiungi dati" in alto a sinistra dell'interfaccia. Spostare il signor utilizzando il "riorientamento 3D manuale" e adattarsi al cranio all'interno dell'immagine di CT (assicurarsi che tutte le modalità sono nello stesso orientamento).
- Disegnare l'oggetto stroke ROI sull'immagine MR utilizzando il "3D ROI tool".
- Disattivare la visualizzazione di PET deselezionandolo all'interno della scheda controller di visual (VC) e utilizzare solo il signor e il CT per disegnare il ROI.
- Fare clic su "Aggiungi ROI" pulsante per creare un nuovo ROI e il nome "infarto". Selezionare lo "strumento spline", tasto sinistro del mouse per disegnare il bordo ROI e fare clic con il pulsante destro per chiuderla.
- Ripetere a tutte le sezioni che comprende il tratto, assicurandosi di non catturare qualsiasi del cranio nel ROI, con le migliori pratiche di lasciare uno spazio di voxel tra il confine di cranio e corsa ROI.
- Generare un ROI controlaterale utilizzando il volume di infarto.
- Creare un nuovo ROI ed etichettarlo "contralateral". Fare clic con il pulsante destro sul ROI Infarct e selezionare "Esporta". Trascinare il ROI in posizione 2 ("Inp1").
- Con solo "Inp1" selezionato, applicare un flip destro sinistro utilizzando la funzione di "operatore" all'interno del menu "riorientamento/registrazione". Barrare la casella "ROI", scegliere "Mostra solo" e spostare manualmente il nuovo ROI nella regione identici sul lato controlaterale. Selezionare operatore di "aritmetica" e applicare una moltiplicazione scalare di 2 per il nuovo ROI, permettendo indipendente quantificazione di ROIs.
- Tornare allo strumento ROI 3D. Vai alla scheda "esperti e sperimentale" e fare clic sul pulsante "Importa ROI". Selezionare Inp1 nella finestra di dialogo per caricare il nuovo volume come il ROI controlaterale.
- Fare clic con il pulsante destro sull'immagine PET medio e scaricatela e accendere il PET. Generare i risultati quantitativi assorbimento utilizzando l'icona "esportare risultati" all'interno dello strumento ROI 3D.
- Eseguire l'analisi del cervello di suddivisi aggiuntivi se lo si desidera (cioè, automatizzato ROI generazione di destra rispetto a regioni di emisfero sinistro del cervello utilizzando un mouse 3D cervello Atlante plugin modulo per Vivoquant software).
- Ri-caricare le immagini PET/CT registrate.
- Importare l'Atlante del cervello del mouse facendo clic sul menu "moduli avanzati" e selezionando lo strumento di Atlante del cervello 3D. Selezionare "tutte le regioni sinistra/destra" nelle "Impostazioni avanzate" e fare clic su "Esegui" per importare l'atlante 3D.
- Inserire manualmente l'atlante all'interno del cervello utilizzando il cranio come un confine.
- Eseguire nuovamente l'Atlante assicurandosi che che "importare ROI 3D" è selezionate per generare un foglio di calcolo di risultati per tutti i 14 emisfero destro e sinistro ROIs (midollo, cervelletto, mesencefalo, pons, corteccia, ippocampo, talamo, ipotalamo, striato, pallidum, bulbi olfattivi, callosum del corpus e della materia bianca).
- Quantificare l'assorbimento dell'elemento tracciante nella milza utilizzando lo scanner software operativo (Vedi tabella materiali).
- Caricare file di immagine PET e CT evidenziandoli nel database e cliccando su "analisi generale".
- Fare clic sulla scheda registrazione e co-registrare immagini PET e CT cliccando sull'icona "rigida registrazione".
- Fare clic sulla scheda di quantificazione di ROI, fare clic sull'icona "Crea ROI" e il nome della milza.
- Scegliere lo strumento di "sfera" disegnare milza ROIs utilizzando il file di CT per riferimento, garantendo che non vi siano sovrapposizioni con assorbimento renale (utilizzando l'immagine di PET e di segnale per evitare la ricaduta dai reni).
- Modificare il ROIs per mantenere consistenti volumi ROI tra animali.
- Calcolare un valore di correzione standard per la normalizzazione di assorbimento.
- Caricare i dati di PET/CT dalla scansione standard e creare un cilindro ROI che comprende la siringa da 20 mL utilizzando lo strumento "manuale 3D ROI".
- Ottenere il livello di radioattività contenuta all'interno lo standard utilizzando l'icona di foglio di calcolo.
- È possibile utilizzare questo risultato nCi/cc e la radioattività registrata originale per lo standard (cioè, la misura del calibratore di dose dello standard in nCi/cc) per creare un fattore di correzione per i valori di assorbimento di PET. Vale a dire dividere la radioattività dello standard registrati dal calibratore di dose di radioattività calcolata dall'immagine PET dello standard.
- È possibile utilizzare le attività di dose e tempo di misurazioni al decadimento corretto al momento dell'acquisizione di PET per tutti i topi (cioè calcolare l'attività della dose all'inizio della scansione PET).
- Ripetere per i valori residui e sottrarre la dose corretta di decadimento per calcolare l'esatta attività ogni animale ha ricevuto.
- Dopo aver applicato questa correzione di decadimento, anche applicare la correzione standard per assicurarsi che i dati siano al livello di attività giusto. Controllare che queste correzioni sono applicate manualmente disegnata ROI risultati e cervello Atlante ROI dati pertinenti regioni del cervello per la posizione di dMCAO (cioè, corteccia, ippocampo e striato).
- Calcolare il %ID/g Rois tutti utilizzando la seguente equazione: %ID/g = (radioattività ROI in nCi/cc / decadimento corretta dose ricevuta in nCi/cc) x 100. Trama %ID/g come funzione del tempo di utilizzo grafica software per generare le curve di attività di tempo per ogni ROI.
- Utilizzare software dello scanner per la generazione di visualizzazione e figura di immagine finale. Normalizzare le immagini secondo la dose corretta di decadimento ha ricevuto da ogni mouse al momento della scansione, assicurando tutte le immagini sono sulla stessa scala %ID/g.
Nota: ciò è necessario per consentire il confronto accurato delle immagini da diversi topi e/o immagini da studi effettuati in giorni diversi
10. autoradiografia Image Analysis
- Aprire l'immagine digitale (file .gel) nel software ImageJ. Regolare la luminosità e il contrasto alla soglia di visivamente l'immagine e applicare un colore appropriato "tabella di ricerca".
Nota: Royal assomiglia più accuratamente la scala dei colori utilizzata nella PET. - Utilizzare il gestore di ROI per disegnare manualmente ROIs intorno infarct e corrispondenti regioni controlaterali.
- Utilizzare la funzione di misura per quantificare l'intensità media pixel di ogni ROI ed esportare risultati. Stampare utilizzando il software statistico.
Risultati
Topi hanno subito MRI per verificare il successo colpo e [11C] DPA-713 PET è stato effettuato da scansione simultanea di 4 topi. PET, CT e il signor immagini erano co-registrati prima del disegno cervello ROIs manualmente e di eseguire l'analisi di Atlante del cervello Spalato semi-automatizzato, per studiare l'assorbimento dell'elemento tracciante nelle regioni omolaterale e controlaterale (Figura 2).
Immagini PET/CT e curve di tempo attività (attività di TAC-radiotraccitore come funzione del tempo) è possibile visualizzare l'assorbimento aumentato [11C] DPA-713 nell'ipsilaterale rispetto al controlaterali emisferi (Figura 3A). Quantificazione delle immagini dinamiche di cervello di PET, utilizzando Riassunto dati da 50-60 min, hanno rivelato un aumento significativo nell'assorbimento dell'elemento tracciante (% ID/g) nel ipsilateral (colpito da infarto) rispetto all'emisfero controlaterale in dMCAO, ma non nei topi di sham utilizzando manualmente disegnata Approccio ROI (Figura 3B). Assorbimento aumentato inoltre è stato osservato nell'emisfero ipsilateral tra topi dMCAO e falsità. Sono state osservate differenze significative tra gli emisferi ipsilaterale e controlaterale utilizzando l'approccio di Atlante, probabilmente dovuto l'Atlante ROIs è maggiore della dimensione dell'infarto (di solito limitato alla corteccia somatosensoriale), quindi diluire il segnale. Tuttavia, l'assorbimento aumentato complessiva in dMCAO rispetto al sham è stata osservata per tutti ROIs, che si allinea con i rapporti precedenti, utilizzando topi modello MCAO, dimostrando l'espressione TSPO aumentata nelle regioni di fuori del infarct19. Rapporti ipsilateral/controlaterale sono stati aumentati in dMCAO contro i topi di sham utilizzando entrambi gli approcci; Tuttavia, questa differenza era soltanto significativa nella corteccia utilizzando l'approccio di Atlante del cervello a causa delle grandi variazioni nell'approccio ROI. Questo può essere superato aumentando il numero dei topi in ogni gruppo. Quantificazione dell'assorbimento di DPA-713 [11C] nella milza hanno mostrato nessuna differenza significativa tra i gruppi (Figura 4).
Risultati di formazione immagine di cervello dMCAO mouse PET sono stati confermati da ex vivo ad alta risoluzione digitale autoradiografia (Figura 5). L'assorbimento aumentato [11C] DPA-713 è stata osservata nel tessuto colpito da infarto con segnale trascurabile nel tessuto cerebrale sano circostante. Quantificazione di queste immagini ha rivelato ipsilateral controlaterali rapporti che variano da 1,4 a 2,09 in topi dMCAO.

Figura 1: Scanner PET e set-up dell'area di lavoro. Tutte le aree di lavoro sono stati coperti in imbottitura protettiva assorbente per creare un ambiente sterile. (A) dopo le calibrazioni, un letto di mouse 3D-stampato, attrezzato per l'imaging 4 topi simultaneamente è stato fissato nello scanner e ogive per tutti 4 topi associati all'anestesia. (B) attrezzatura necessaria per l'imaging PET sono state preparate in anticipo, compreso i cateteri 27,5 G di soluzione salina, lubrificante occhio, tamponi di etanolo, lampade di calore, nastro chirurgico, colla tessuto, siringhe da 0,5 mL dose, forbici e un accendino. (C) iniettabile radiotraccitore, posizionare siringhe salino a filo e forbici sul retro dello scanner. Clicca qui per visualizzare una versione più grande di questa figura.
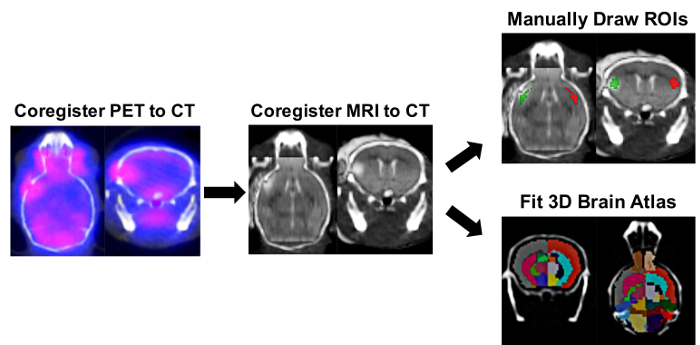
Figura 2: ROI ipsilateral/controlaterale ed emisfero di destra/sinistra-Split Brain Atlas immagine PET analisi processo. Analisi dell'immagine software è stato utilizzato per determinare l'assorbimento dell'elemento tracciante nelle regioni ipsilaterale e controlaterale di interesse (ROI) utilizzando manualmente disegnata ROIs e un approccio semi-automatico 3D Split-Brain atlas. Registrazione automatica di PET/CT 3D è stata effettuata a seguito di registrazione manuale del cervello MRI all'interno del cranio del mouse corrispondente definito nell'immagine di CT. Lo strumento ROI 3D è stato utilizzato per disegnare manualmente ipsilateral (rosso) e controlaterale ROIs (verde) utilizzando l'infarto sul MRI come riferimento. Per l'approccio "Split Brain", l'Atlante del cervello del mouse 3D di sinistra/destra-Spalato è stato caricato e inserito all'interno del cranio, come definito dall'immagine di CT. ROIs cervello utilizzato per quantificazione in questo Atlante del cervello del mouse 3D incluso corteccia sinistra (grigio scuro), ippocampo di sinistra (Cornflower Blue), sinistra striato (Deep Pink), corteccia destra (rosso pomodoro), ippocampo di destra (verde) e diritto Striatium (ciano). L'assorbimento di [11C] DPA-713 in ogni regione è stata ottenuta in nCi/cc e successivamente è stato convertito in %ID/g normalizzando alla dose di decadimento-corretta in fase di scansione per ogni mouse. Clicca qui per visualizzare una versione più grande di questa figura.
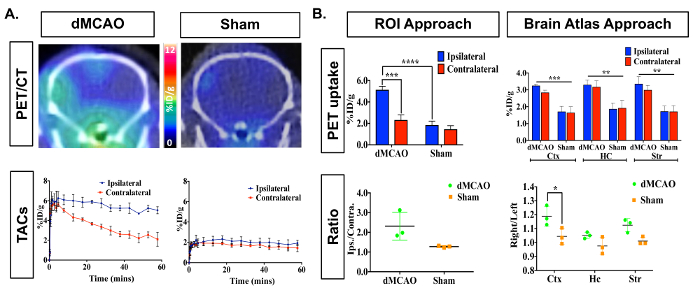
Figura 3 : Rappresentante In Vivo [11C] assorbimento DPA-713 del cervello nei topi di Sham e DMCAO. (A) immagini PET/CT dinamico e TAC dimostrano maggiore [11C] DPA-713 l'assorbimento nella corteccia ipsilateral dei topi che hanno subito DMCAO (n = 3) e un lieve aumento per sham (n = 3) operati topi, con i topi DMCAO dimostrando significativamente maggiore contrasto in percentuale dose iniettata tra l'infarto e l'arto controlaterale del cervello (%ID/g). (B) quantificazione PET (50-60 min sommati) ha rivelato l'assorbimento significativamente aumentato nel ROI ipsilateral utilizzando l'approccio ROI e nella corteccia (Ctx) utilizzando l'approccio di Split-Brain atlas. Nessuna differenza significativa sono stata trovata nell'ippocampo (HC) o striato (Str). Rapporti aumentati ipsilateral al controlaterale sono stati visti utilizzando sia analisi si avvicina ma solo era statisticamente significativa in Ctx utilizzando l'approccio di Atlante del cervello. * (p < 0,05), * * * (p < 0,001) Clicca qui per visualizzare una versione più grande di questa figura.
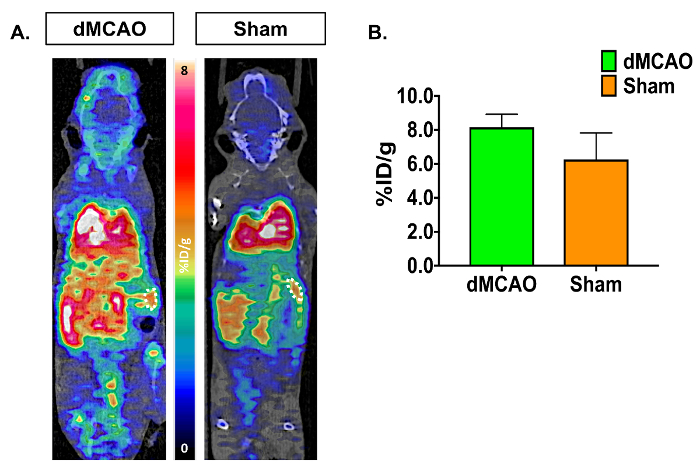
Figura 4: Rappresentante In Vivo [11C] DPA-713 milza assorbimento in dMCAO e topi di Sham. (A) [11C] immagini PET/CT dinamiche di DPA-713 risultati milza ROIs in dMCAO (n = 3) e sham (n = 3) topi. (B) risultati quantitativi non dimostrano alcun risultato significativo nell'assorbimento della milza fra i topi dMCAO e sham. Clicca qui per visualizzare una versione più grande di questa figura.
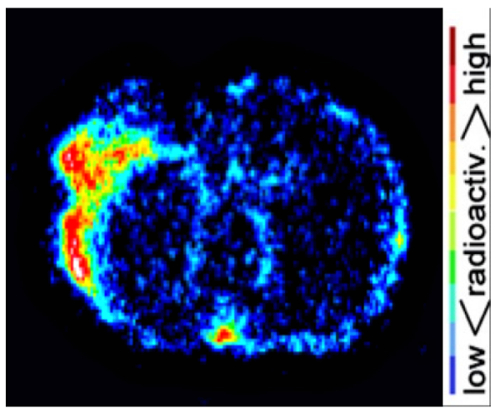
Figura 5 : Rappresentante autoradiografia risultati. Autoradiografia digitale immagini mostrano aumentata [11C] DPA-713 assorbimento nell'ipsilaterale rispetto all'emisfero controlaterale. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo presentato descrive un metodo per la quantificazione del neuroinflammation in topi dMCAO e sham usando [11C] DPA-713-PET. TSPO-PET è il più ampiamente studiato biomarcatore imaging per la visualizzazione e misurazione neuroinflammation in vivo fino ad oggi. L'espressione TSPO è aumentata su glia nel cervello durante l'infiammazione permettendo la rilevazione non invasiva e la quantificazione del neuroinflammation. Inoltre, è una tecnica altamente traducibile, che lo rende uno strumento prezioso nella ricerca pre-clinica e clinica. Questo protocollo e risultati rappresentativi evidenziano l'idoneità di utilizzo [11C] PET DPA-713 per rilevare e monitorare neuroinfiammatorie alterazioni nel colpo e altri disturbi neurologici in vivo.
In questo studio, dMCAO ambulatorio è stato effettuato utilizzando 3-mese-vecchi topi femminili C57BL/6. Questo modello è stato scelto in quanto dà luogo ad un infarto altamente riproducibile limitato alla corteccia somatosensoriale, fornendo un modello di ischemia focale permanente con bassa variabilità rispetto ad altri modelli di ictus (ad es., centrale cerebrale arterioso Metodo di occlusione (MCAO) filamento)14. PET imaging dei modelli di ictus ha il vantaggio di contenere un'area di riferimento interno nel cervello per ogni animale utilizzando ROIs all'interno dell'emisfero controlaterale. Dal momento che ci sarà qualche infiammazione che risultati dalla chirurgia da solo, è importante includere i topi che hanno subito la chirurgia di sham nel disegno dello studio, per cui il craniotomy e manipolazione dei meninges senza occlusione dell'arteria è stata realizzata. Craniotomia da solo può causare disagi alla sottostante tessuto neuronale e introduzione di agenti patogeni che conducono a risposte immunitarie indipendente di corsa20. Qualche infiammazione dopo l'intervento chirurgico sham prevede pertanto e dovrebbe essere valutati in parallelo con dMCAO per escludere la possibilità del segnale a causa della sola chirurgia. Per evitare di includere infiammazioni derivanti dalla chirurgia senza colpo in analisi di coorte dMCAO, risonanza magnetica deve essere condotta per confermare lo sviluppo di colpo riuscito ambulatorio e infarto. MRI fornisce anche un quadro di riferimento strutturale, che è essenziale per disegnare con precisione l'infarto e ROIs controlaterale. Sono inoltre necessari per garantire la quantificazione affidabile elaborazione immagine precisa compresa la registrazione di immagine e definizione di ROI.
Ulteriori limitazioni devono essere tenute presente quando si lavora con C-11 etichettato radiotraccianti per studi PET e autoradiografia. È indispensabile considerare la breve emivita (20,33 min) di C-11, con il suo uso limitato per istituti con accesso in loco ciclotrone di ricerca. Percorso di trasporto appropriato radioattività, somministrazione di una dose e tempo-punti di acquisizione deve essere determinati in anticipo con un pre-preparato piano dettagliato del flusso di lavoro dell'esperimento affinché il team possa lavorare rapidamente ed efficientemente. La progettazione e la realizzazione di questo studio è stato delineato per ospitare la formazione immagine di 4 topi simultaneamente per aumentare l'output di dati ottenibili quando si utilizza un tracciante C-11. Se possibile, si consiglia di avere tutti i topi cannulati e nel mezzo loro esplorazione di CT con il tempo il tracer C-11 arriva al centro di imaging per assicurare decadimento minimo radiotraccitore prima dell'iniezione. Questo protocollo passo-passo è anche meglio effettuato da un team che contiene almeno 3 ricercatori per consentire rapido inserimento di una canula, misura della dose, iniezione dell'elemento tracciante, scansione PET e cervello sezionamento prima del decadimento radioattivo significativo. Richiede due persone per condurre l'inizio della scansione PET e iniezione di tutti e 4 i topi simultaneamente. Il motivo per l'acquisizione di PET appena prima dell'iniezione di inizio è quello di garantire che la farmacocinetica e la dinamica della distribuzione dell'elemento tracciante nel sangue e aree di interesse sono esattamente e completamente catturati. Molti passi possono richiedere vigorosa formazione e pratica per garantire il regolare svolgimento dell'esperimento. In particolare, questo protocollo dipende dall'inserimento di una canula della vena coda successo dei topi C57BL/6, che può essere difficile a causa di peli presenti sulle loro code e possono diventare più impegnativo dopo ictus si è verificato o se stessi topi di imaging a intervalli di tempo più .
Un'altra considerazione per l'imaging PET comprende la registrazione accurata del radiotraccitore dose e residuo misure di attività, tra cui l'ora esatta di misura. Questo è essenziale per la correzione accurata decadimento della dose iniettata al momento della scansione e viene utilizzato per ottenere una misurazione accurata di assorbimento dell'elemento tracciante (cioè, % ID/g) per ogni ROI. È indispensabile conoscere l'esatta quantità di radioattività che era presente in ogni mouse al momento della scansione per garantire un'immagine precisa analisi. Pertanto, si consiglia di sincronizzare gli orologi dei computer scanner e calibratore di dose per evitare l'errore quando si utilizza isotopi di breve durata come C-11.
Quantificazione accurata di immagine PET può essere limitata anche dalla precisione lo scanner e il set-up. Quindi per garantire la quantificazione accurata di immagini PET/CT, è importante effettuare controlli di qualità per il CT e il PET componenti dello scanner. Controlli di qualità CT includono condizionata fonte di raggi x, buio/luce e centro off set calibrazioni. Queste calibrazioni misurano e corretta per mosto e rumore del sistema essere eseguito prima dell'acquisizione, come raccomandato dal produttore dello scanner. Tarature devono essere eseguite anche per la PET scan. Questo in genere comporta la scansione di una scansione "standard / PET fantasma", contenente una concentrazione nota di radioattività. Quando si prepara lo standard, è preferibile utilizzare il radioisotopo stesso utilizzato nello studio, una dose paragonabile a quello somministrato a un singolo topo in un volume simile al corpo di un topo e la stessa acquisizione parametri come animale imaging. Una siringa da 20 mL riempita con radiotraccitore diluito in acqua viene utilizzata per lo standard in questo protocollo, con i successivi risultati di imaging PET utilizzati per calcolare un fattore di correzione basato sulla dose effettiva misurata dal rilevatore di calibrazione. Il rapporto di correzione può essere applicato ai dati immagini acquisiti nell'esperimento per garantire accurata quantificazione di assorbimento dell'elemento tracciante nelle regioni di interesse in immagini PET. Questo account per la gamma di positroni del radionuclide oltre a considerare qualsiasi attività di fondo presente il giorno dell'esame. Come il calibratore di dose è parte integrante della generazione di questo fattore di correzione, è imperativo che questa apparecchiatura è anche calibrata regolarmente secondo le indicazioni del produttore.
Quando lo svolgimento di ex vivo autoradiografia è importante scegliere un tempo-punto ottimale per l'eutanasia dopo l'iniezione, per garantire il segnale--fondo alta in regione come area di interesse. Trenta minuti dopo l'iniezione è stato scelto per autoradiografia DPA-713 [11C] utilizzando i dati acquisiti durante la formazione immagine PET dinamica -cioè, l' in vivo TAC dinamico come guida, tenendo anche conto della breve emivita di C-11 e il tempo coinvolti per sezione ed esporre il tessuto cerebrale dopo l'estrazione. Considerando questo, autoradiografia DPA-713 [11C] deve essere eseguita su una coorte separata dei topi per consentire l'iniezione di una dose maggiore di DPA-713 [11C] e 30 minuti di tempo-punto per aspersione e l'eutanasia in anestesia. Eseguire un piccolo in vivo studio pilota dell'animale domestico con un 3-4 topi prima di svolgere ex vivo autoradiografia sarà utile per la determinazione del punto di tempo ottimale per autoradiografia. Un'ulteriore considerazione per ex vivo autoradiografia è se recuperare i topi dopo l'iniezione o tenerli anestetizzati fino ad eutanasia. Mantenendoli anestetizzati imita le condizioni della scansione e assicura la cinetica di distribuzione o l'escrezione del radiotraccitore non vengono alterate da recupero. Inoltre, questo impedisce ulteriore stress sui topi evitando recupero e successiva induzione. Infine, un'utile aggiunta al protocollo ex vivo sarebbe valutare il danno regionale le fettine di cervello utilizzato per autoradiografia tramite immunoistochimica (dopo il decadimento radioattivo) per generare un'immagine ad alta risoluzione della posizione di infarto e volume.
Come ci sono limitazioni con l'uso di un tracciante C-11 basato, questo protocollo può essere modificato facilmente per uso con un F-18 (emivita di 109,77 min) basato TSPO tracer, che può essere più applicabile alle posizioni senza un ciclotrone in loco. Inoltre, questo protocollo viene descritto l'utilizzo di un mouse 4 imaging set-up. Anche se questo metodo di rendimento elevato è ottimo quando si utilizza un tracciante C-11, questo protocollo può essere modificato anche per coloro che utilizzano il mouse singolo letti di imaging. Una pianificazione attenta e coerente formazione nelle tecniche descritte in questo protocollo porterà alla generazione di una ricchezza di dati utilizzando [11C] DPA-713, che può essere facilmente applicato a sondare il ruolo del neuroinflammation in manifestazione di malattia e progressione in altri modelli del roditore di disturbi neurologici. Inoltre, questa tecnica potrebbe essere usata per valutare la risposta in vivo per terapie immunomodulatorie mirate alle microglia/macrofagi.
Divulgazioni
Gli autori non dichiarano conflitti di interessi.
Riconoscimenti
Gli autori vorrei ringraziare il laboratorio Buckwalter (soprattutto Dr. Todd Peterson) per fornendo il modello del mouse ed eseguire gli interventi chirurgici dMCAO e sham. Inoltre, vorremmo ringraziare Thomas Liguori da Invicro per la sua assistenza tecnica con software di analisi di immagine VivoQuant, Dr. Tim Doyle, Dr. Laura Pisani, Dr. Frezghi Habte dall'animale piccolo SCi3 imaging facility a Stanford per i loro consigli e assistenza nello sviluppo di questo protocollo di imaging e la struttura di radiochimica (soprattutto Dr. Jun Park) per il loro aiuto con la sintesi del [11C] DPA-713.
Materiali
| Name | Company | Catalog Number | Comments |
| Inveon PET/CT scanner | Siemens | Version 4.2 | |
| MRI scanner | Varian | 7 Telsa | |
| ParaVision software | Bruker | Version 6.0.1 | MRI operating software |
| VivoQuant software | InVicro | Version 2.5 | Image analysis software |
| Inveon Research Workspace software | Siemens | Version 4.2 | Scanner operating software. Includes microQView, the post-processing managing software |
| Dose calibrator | Capintech | CRC-15 PET | |
| Typhoon phosphor imager 9410 | GE Healthcare | 8149-30-9410 | |
| Butterfly catheters | SAI Infusion Technologies | BFL-24 | 27.5 G needle |
| 1 mL syringes | BD | ||
| Insulin syringes | BD | 329461 | 0.5 mL insulin syringes with needle |
| 20 mL syringe | VWR | BD302831 | BD Syringe Slip Tip Graduated |
| Tissue glue | Santa Cruz Animal Health | sc-361931 | 3 mL |
| Heat lamp | Fluker | 27002 | 5.5" reptile heat lamp with clamp and switch |
| 0.9% sterile saline | Pfizer | 00409-4888-10 | 0.9% sodium chloride for injection, 10 mL |
| Eye lubricant | Watson Rugby | PV926977 | Artificial Tears Lubricant Eye Ointment, 1/8 oz |
| Chux absorbent sheets | ThermoFisher Scientific | 1420662 | Disposable absorbent padding |
| Iris scissors | World Precision Instruments | 503708-12 | 11.5 cm, Straight, 12-pack |
| Surgical tape | 3M Durapore | 1538-0 | 1/2" x 10 yard roll, silk, hypoallergenic |
| Mouse PET bed | In house | 4 mouse PET bed | |
| Lighter | Bic | UDP2WMDC | |
| Isoflurane | Henry Schein | NDC 11695-6776-2 | Isothesia, inhalation anesthetic, 250 mL |
| Oxygen | Praxiar | UN1072 | Compressed gas |
| Autoradiography cassette | Cole Palmer | EW-21700-34 | Aluminum, 8" x 10" |
| Autoradiography film | GE Life Sciences | 28-9564-78 | Storage Phosphor Screen BAS-IP SR 2025 E Super Resolution, 20 × 25 cm, screen only |
| Microtome blades | ThermoFisher Scientific | 30-508-35 | MB35 Premier Disposable, 34° cutting angle |
| Microtome | Microm | HM 550 | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost™ Plus Microscope Slides |
| OCT liquid | VWR | 25608-930 | Formulation of water-soluble glycols and resins for cryostat sectioning at temperatures of -10°C (14°F) and below |
| Freezing molds | Poly sciences | 18646A-1 | Disposable paraffin molds |
| Saran wrap | Saran | 25700001300 | |
| Disinfectant | Virkon S |
Riferimenti
- Benjamin, E. J., et al. Heart disease and stroke statistics-2017 update: A report from the american heart association. Circulation. 135 (10), 146-603 (2017).
- Jin, R., Yang, G., Li, G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells. J Leukoc Biol. 87 (5), 779-789 (2010).
- Wang, Q., Tang, X. N., Yenari, M. A. The inflammatory response in stroke. J Neuroimmunol. 184 (1-2), 53-68 (2007).
- Brown, R. C., Papadopoulos, V. Role of the peripheral-type benzodiazepine receptor in adrenal and brain steroidogenesis. Int Rev Neurobiol. 46, 117-143 (2001).
- Papadopoulos, V., Lecanu, L., Brown, R. C., Han, Z., Yao, Z. X. Peripheral-type benzodiazepine receptor in neurosteroid biosynthesis, neuropathology and neurological disorders. Neuroscience. 138 (3), 749-756 (2006).
- Scarf, A. M., Kassiou, M. The translocator protein. J Nucl Med. 52 (5), 677-680 (2011).
- Cerami, C., Perani, D. Imaging neuroinflammation in ischemic stroke and in the atherosclerotic vascular disease. Curr Vasc Pharmacol. 13 (2), 218-222 (2015).
- Stefaniak, J., O'Brien, J. Imaging of neuroinflammation in dementia: a review. J Neurol Neurosurg Psychiatry. 87 (1), 21-28 (2016).
- Gerhard, A. TSPO imaging in parkinsonian disorders. Clin Transl Imaging. 4, 183-190 (2016).
- Airas, L., Rissanen, E., Rinne, J. O. Imaging neuroinflammation in multiple sclerosis using TSPO-PET. Clin Transl Imaging. 3, 461-473 (2015).
- Fan, J., Lindemann, P., Feuilloley, M. G., Papadopoulos, V. Structural and functional evolution of the translocator protein (18 kDa). Curr Mol Med. 12 (4), 369-386 (2012).
- James, M. L., et al. Synthesis and in vivo evaluation of a novel peripheral benzodiazepine receptor PET radioligand. Bioorg Med Chem. 13 (22), 6188-6194 (2005).
- Boutin, H., et al. 11C-DPA-713: A novel peripheral benzodiazepine receptor PET ligand for in vivo imaging of neuroinflammation. J Nucl Med. 48 (4), 573-581 (2007).
- Doyle, K. P., Buckwalter, M. S. A mouse model of permanent focal ischemia: distal middle cerebral artery occlusion. Methods Mol Biol. 1135, 103-110 (2014).
- Wang, Y., et al. [(18)F]DPA-714 PET imaging of AMD3100 treatment in a mouse model of stroke. Mol Pharm. 11 (18), 3463-3470 (2014).
- Domercq, M., et al. PET Imaging with [(18)F]FSPG evidences the role of system xc(-) on brain inflammation following cerebral ischemia in rats. Theranostics. 6 (11), 1753-1767 (2016).
- Toth, M., et al. Acute neuroinflammation in a clinically relevant focal cortical ischemic stroke model in rat: longitudinal positron emission tomography and immunofluorescent tracking. Brain Struct Funct. 221 (3), 1279-1290 (2016).
- Walter, H. L., et al. In vivo analysis of neuroinflammation in the late chronic phase after experimental stroke. Neuroscience. 292, 71-80 (2015).
- Rojas, S., et al. Imaging brain inflammation with [(11)C]PK11195 by PET and induction of the peripheral-type benzodiazepine receptor after transient focal ischemia in rats. J Cereb Blood Flow Metab. 27 (12), 1975-1986 (2007).
- Glazier, S. S., O'Rourke, D. M., Graham, D. I., Welsh, F. A. Induction of ischemic tolerance following brief focal ischemia in rat brain. J Cereb Blood Flow Metab. 14 (4), 545-553 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon