Method Article
Analyse comportementale des grands c. elegans des Populations à l’aide d’un champ de vision large suivi plate-forme automatisée
Dans cet article
Résumé
Les auteurs décrivent des protocoles d’utilisation de la plate-forme de suivi de nématode large champ de vision (WF-NTP), qui permet la caractérisation phénotypique de haut débit de grandes populations de Caenorhabditis elegans. Ces protocoles peuvent être utilisés pour caractériser les subtils changements de comportement chez les souches mutantes ou en réponse à un traitement pharmacologique d’une façon hautement évolutive.
Résumé
Caenorhabditis elegans est un modèle animal bien établi dans la recherche biomédicale, largement utilisée dans les études de vieillissement et de génomique fonctionnelle. Pour évaluer la santé et l’aptitude des animaux à l’étude, un dépend généralement lectures de motilité, telles que la mesure du nombre de coudes de corps ou la vitesse du mouvement. Ces mesures nécessitent généralement le comptage manuel, rendant difficile d’obtenir la bonne signification statistique, comme du temps et de contraintes de travail souvent limiter le nombre d’animaux dans chaque expérience à 25 ou moins. Haute puissance statistique étant nécessaire pour obtenir des résultats reproductibles et limiter des résultats faussement positifs et négatifs lorsqu’on étudie les effets phénotypiques faibles, s’est efforcé récemment d’élaborer des protocoles automatisés afin d’accroître la sensibilité de détection de la motilité et le profilage comportemental multi paramétrique. Afin d’étendre la limite de détection pour le niveau nécessaire pour capturer les petits changements phénotypiques qui sont souvent cruciaux dans les études génétiques et la découverte de médicaments, nous décrivons ici un développement technologique qui permet l’étude des individus pouvant atteindre 5 000 en même temps, augmentant la puissance statistique des mesures par environ 1000 par rapport aux déterminations manuelles et environ 100 fois par rapport aux autres méthodes automatisées disponibles.
Introduction
Environ un demi-siècle, Sydney Brenner a présenté Caenorhabditis elegans (c. elegans) comme un système modèle pour étudier le développement et la neurobiologie, comme ce petit (1 mm de longueur), le ver nématode transparent est facile à manipuler génétiquement et de maintenir dans le laboratoire1. Aujourd'hui, c. elegans est utilisé pour étudier un large éventail de processus biologiques, y compris l’apoptose, la signalisation cellulaire, la nature du cycle cellulaire, régulation génique, métabolisme et de vieillissement2. En outre, la complexité cellulaire et tissulaire, de modèles d’expression de protéine et de la conservation des voies de la maladie entre le c. elegans et des organismes supérieurs (80 % des gènes de ver ont un orthologue humaine), lié à la simplicité et rentabilité de la culture, rendent un organisme efficace in vivo à haut débit génétique3,4,5,6,7, 8 , 9 , 10 , 11 , 12 , 13 et drogue14,15,16 séances. Pour toutes ces raisons, le c. elegans a été employé pour la caractérisation des mécanismes moléculaires normales et liée à la maladie ; dans le domaine de la neurodégénérescence, par exemple, il a permis l’exploration des effets du vieillissement sur l’agrégation des protéines3,4,7,15,17, 18et la caractérisation des promoteurs et inhibiteurs de la protéine agrégation3,4,5,6,7,14, 18.
La condition physique générale vers, qui est un paramètre important comportemental à définir dans ce type d’étude, peut être mesurée manuellement dans une variété de façons, comme en comptant le nombre de coudes du corps par minute (BPM)4,6, 19, ou en mesurant la vitesse de mouvement20,21,22, ainsi qu’en mesurant la durée de vie moyenne et le taux de paralysie. Bien que des mesures manuelles des replis du corps et la vitesse du mouvement ont mené à plusieurs idées importantes dans une variété de voies moléculaires et les mécanismes3,4,14,19, 20,23, manuels dosages restent actuellement bas-débit, très fastidieuse et chronophage tout en étant sujette aux erreurs et aux préjugés humaines. Ces questions présentent des défis considérables dans la collecte de données avec une puissance statistique suffisante pour distinguer les subtils changements de comportement. Cette limitation est particulièrement pertinente pour les drogues dépistage comme traitements avec le médicament potentiel molécules conduisent souvent à des petits changements phénotypiques24, exigeant par conséquent l’étude d’un grand nombre d’animaux afin d’obtenir des résultats reproductibles. Pour illustrer ce point, les études récentes ont montré qu’une forte puissance de détection (POD) est nécessaire pour définir avec confiance tout changement important dans le comportement et de limiter les faux positifs25. Cela a entraîné une forte motivation dans la communauté de c. elegans pour remplacer un comptage manuel avec des mesures reproductibles, automatisé, temps - et rapport coût - entrée. Pour répondre à cette demande, plusieurs laboratoires ont récemment développé des méthodes pour les mesures de haute sensibilité et suivi précis ver du plus grand nombre de vers22,26,27,28 ,29,30,31,32,33.
Afin d’élargir davantage le processus d’automatisation pour les grandes cohortes d’animaux nécessaire pour les mesures significatives, nous avons récemment développé un large champ de vision nématode suivi de plate-forme (WF-NTP)15,34 ,35,36, qui permet à l’enquête simultanée de multiples lectures phénotypiques sur les populations de très grand ver, un facteur clé dans la détection phénotypiques statistiquement pertinents25. Non seulement peut le WF-NTP actuellement surveiller jusqu'à 5 000 animaux en parallèle, mais les lectures phénotypiques comprennent également plusieurs paramètres, y compris le taux et l’amplitude des courbes du corps, la vitesse du mouvement, la fraction de la population qui est paralysée, et la taille des animaux. On peut donc facilement à l’écran des milliers de vers en parallèle et de combiner les différentes lectures dans une carte comportementale pour créer une empreinte multidimensionnelle36. Le logiciel open source associé est écrit en Python, qui est également nécessaire pour le faire fonctionner et est entièrement personnalisable. Une interface utilisateur graphique (GUI) est également fournie pour permettre aux utilisateurs d’adopter cette technologie.
Nous présentons ici une série de protocoles qui illustrent quelques-unes des applications possibles de la WF-NTP. En particulier, nous discutons l’administration de composés, allant de petites molécules de protéines thérapeutiques et décrire comment trier leurs effets directement sur grandes populations de worms, effectivement éliminant ainsi la nécessité de goûter petit certaines sous-populations. L’utilisation de la WF-NTP à cet effet a déjà apporté des avantages significatifs dans les procédures visant à concevoir des programmes de découverte de médicaments de la maladie d’Alzheimer (ma)15,34,35 et maladie de Parkinson (MP)18 à l’aide de données in vivo pour l’évaluation de candidats thérapeutiques35,37.
Protocole
1. préparation des matériaux pour les protocoles de c. elegans
-
Pour préparer une solution de tampon x M9 10, ajouter 30 g de phosphate de potassium monobasique, 60 g de phosphate dibasique de sodium et 50 g de chlorure de sodium à une bouteille de 1 L autoclavable.
- Ajouter 1 L d’eau purifiée et stériliser à env. 121 ° C pendant 15 min.
- Diluer 10 fois dans l’eau purifiée et stériliser à env. 121 ° C pendant 15 min.
- Lorsque refroidi, ajouter 1 mL d’une solution de sulfate de magnésium de 1 M.
NOTE : Seulement 1 x M9 (M9) doit être utilisé pour le ver de manutention dans les étapes suivantes.
-
Pour préparer le milieu de croissance nématode (Rich-NGM), mélanger 2,7 g de chlorure de sodium, 15,75 g d’agar, 5,75 g de caséine, 900 mL d’eau purifiée et à l’autoclave à 121 ° C pendant 15 min.
- Transférer le milieu de Rich-NGM à un réchaud (env. 70 ° C) si elle n’est pas utilisé immédiatement ; le Rich-NGM peut-être être maintenu fondu à environ 70 ° C pendant 12 h avant de devenir inutilisable.
- Le Rich-NGM mélanger, ajouter 900 µL d’une solution de chlorure de calcium 1 M, 900 µL d’une solution de sulfate de magnésium de 1 M et 900 µL d’une solution de cholestérol 5 mg/mL dans de l’éthanol absolu.
Remarque : Cholestérol ne nécessite autoclavage avant d’utiliser. - Pour préparer les plaques expérimentales qui maintiennent une population en âge de synchrone, ajouter 92 µL du 5-fluoro-2'-déoxyuridine (FUDR) à 812 µM à 900 mL de Rich-NGM.
Remarque : FUDR est toxique et cancérogène, il est donc essentiel de porter des gants de nitrile en plus des sarraus et des lunettes de sécurité. Ne pas laisser de déchets d’entrer dans les déchets généraux éliminer par incinération avec une postcombustion et de ruisseau. - Verser 20 mL de la Rich-NGM autoclavé dans une boîte de Petri stérile de 9 cm pour générer un cartilage de conjugaison (plaque de Rich-NGM). Verser 15 mL de l’autoclave Rich-NGM dans une boîte de Petri stérile de 9 cm pour faire une plaque de motilité (Mot plaque). Verser 20 mL de Rich-NGM avec FUDR dans une boîte de Petri stérile de 9 cm pour générer une plaque FUDR.
Remarque : Le volume de gélose bas de la plaque de Mot facilite la caméra se concentrer et à vis sans fin de suivi (voir étape 3.2.5).
-
Préparer la souche OP50 Escherichia coli , à l’autoclave 1 L de bouillon LB à 121 ° C pendant 15 min et ensemencer avec culture starter quand refroidi.
- Permettre la culture bactérienne de croître durant la nuit à 37 ° C et stériliser le tube à utiliser pour la centrifugation.
- Transférer les bactéries dans des tubes stériles et centrifuger à 4 600 x g pendant 15 min.
- Éliminer le surnageant et, à l’aide de l’eau stérile, suspension à 10 % du volume initial de créer 10 x (10 fois concentré) OP50 stock.
- Diluer 15 mL de l’étalon de x OP50 10 à 150 mL pour générer 1 x OP50, à l’aide de l’eau stérile, avant d’être utilisée pour amorcer les plaques Rich-NGM. Solution d’utiliser le x 10 reste aux plaques de semences FUDR.
Remarque : Les plaques de Mot resteront non ensemencées et serviront uniquement à l’étape d’acquisition image.
-
Aux plaques de graines avec des bactéries, séparer le Rich-NGM et plaques FUDR.
- Dans des conditions stériles, ajouter 350 µL de 1 x OP50 à Rich-NGM assiettes et répartir uniformément.
Remarque : Ne se propagent pas au bord de la plaque comme worms analysera les parois de la plaque et du moule. - Dans des conditions stériles, ajouter 350 µL de 10 x OP50 à FUDR assiettes et répartir uniformément.
- Laisser les plaques sécher et laisser incuber à 20 ° C pendant 2 jours avant utilisation.
- Dans des conditions stériles, ajouter 350 µL de 1 x OP50 à Rich-NGM assiettes et répartir uniformément.
2. préparation de c. elegans pour une utilisation avec le WF-NTP
- Maintenir le c. elegans sur Rich-NGM plaques ou en transférant une petite quantité d’agar contenant vers l’envers sur une nouvelle couche bactérienne. Maintenir les souches de c. elegans de cette manière avant d’amorcer les protocoles expérimentaux.
- En utilisant la technique de transfert (Voir l’étape 2.1), graine 20 plaques de chacun vers stade bien nourris, mélangé à l’aide de la souche et leur permettent de croître pendant 2 jours à 20 ° C.
- Laver 5 plaques contenant vers à l’aide de 15 mL de M9 et piscine dans un tube de 15 mL. Répéter pour toutes les plaques de 20 de chaque souche.
- Centrifuger les vers à 2 000 x g pendant 2 min, retirez le surnageant et suspendre dans 2 mL de solution de M9.
- Préparer 10 mL de solution de blanchiment en mélangeant les 13 % d’hypochlorite de sodium et hydroxyde de sodium de 4 M à un ratio de 3:2 vol/vol.
Remarque : Cette solution ne nécessite pas de passage à l’autoclave. Les composants et la solution résultante sont corrosifs et doivent être manipulées avec précaution à l’aide de gants en nitrile. Hydroxyde de sodium est légèrement corrosif pour le verre et doit être conservé dans des récipients en plastique. - Ajouter 1 mL de solution de blanchiment dans chaque tube à centrifuger et agiter vigoureusement pendant environ 3,5 min ou jusqu'à ce que la cuticule est entièrement dissous.
- Dans des conditions stériles, diluer les échantillons de 15 mL M9 et centrifuger à 2 000 x g pour 2 min. Retirez le surnageant et suspendre dans 15 mL de solution de M9.
- Répétez l’étape 2,7 6 fois, jusqu'à ce que les oeufs de ver demeurent, et la solution n’est plus a une odeur de chlore.
- Centrifuger les échantillons à 2 000 x g pendant 2 min, retirez le surnageant et suspendre dans 2 mL de solution de M9.
- Dans des conditions stériles, utiliser une pipette de verre stériles pour transférer 2 mL d’oeufs contenant M9 dans chaque puits d’une plaque de culture de tissu de 12 puits et incuber à 20 ° C pendant un minimum de 16 h.
Remarque : Des plaques séparées pour chaque souche permet d’éviter toute contamination croisée. L’étape de transfert provenant des tubes de centrifugeuse à l’aide de puits multiples pour éviter l’étouffement de ver. - Transférer les vers issus du jour au lendemain les plaques de 12 puits dans des tubes à centrifuger 15 mL. Prendre 3 gouttes de 5 µL de solution de ver et compter le nombre de vers présents au premier stade larvaire (L1).
- Calculer le nombre de vers par µL de solution.
- L1 de graine vers sur des plaques de Rich-NGM à 3 000 vers par plaque et laissez-les pousse pendant 2 jours à 20 ° C, avant d’avoir atteint le dernier stade larvaire (L4).
3. le général WF-NTP protocole
-
Ajouter 2,2 mL pour chaque médicament composé à la concentration appropriée (telle que 25 ou 10 mM pour les médicaments comme squalamine18 et bexarotène15, respectivement) à FUDR 6 plaques et laisser pour sécher dans des conditions stériles pour chaque désirée, souche de ver.
Remarque : Cette étape est répétée pour chaque composé en cours d’examen, pour chaque concentration et chaque solvant utilisé.- Laver les vers 5 plaques de Rich-NGM préparé à l’étape 2.13 à l’aide de 15 mL de tampon de M9 et passer les vers dans un tube à centrifuger.
- Centrifuger à 2 000 x g pendant 2 min, éliminer le surnageant et suspendre dans 3 mL de M9. Prendre 3 gouttes de 5 µL de la solution de M9 contenant vers et compter le nombre de vers présents au dernier stade larvaire L4.
- Calculer le nombre de vers par µL de tampon de M9.
-
Semences 700 L4 larves sur 6 des plaques sèches FUDR contenant une substance donnée, répétez cette opération pour chaque concentration de chaque composé et laisser pour sécher dans des conditions stériles.
- Incuber les vers à 24 ° C de L4 pour ces souches où la paralysie du ver est induite seulement en augmentant la température, comme la souche AD38. Compter du jour suivant le stade larvaire de L4 comme D0 de l’âge adulte.
-
Allumez les lumières de la scène pour le tracker.
- Nettoyer le verre translucide avec 70 % d’éthanol et veiller à ce qu’aucun résidu visible des restes, puis ne retirez bouchon d’objectif. Nettoyer la lentille d’imagerie à l’aide d’un souffleur d’air. S’assurer que l’appareil est correctement branché et installé et lancer l’enregistrement avec le logiciel de capture d’image.
- Ajuster les réglages de la caméra pour enregistrer 20 images/s, avec mono 16 enregistrement configuration paramètres ; enregistrer 1 200 images, enregistrement au format MJPEG à un taux de compression de 95 %. Utilisez un vide 9 cm boîte de Pétri pour veiller à ce que le décor est planté à la bonne hauteur et ajuster si nécessaire.
Remarque : Veiller à ce que les bords de la plaque sont visibles dans l’enregistrement, ce qui permettra l’algorithme « Gardez-morts » fonctionne correctement (Figure 1 a). - Dans des conditions stériles, prendre 2 plaques préalablement préparés à l’étape 3.2 avec les mêmes conditions et 1 Mot plaque préparée à l’étape 1.2.4 de dépistage. Ajouter 3 mL de la solution de M9 à la plaque de Mot. Utilisation autre 2 mL de M9 à laver 1/3 de la surface des 2 plaques préparé à l’étape 3.2 sur la plaque de Mot.
- Placer la plaque de Mot contenant environ 5 mL de la solution de M9 et environ 600 vers sur la scène du Traqueur. Concentrer la caméra à l’aide d’un ver individuel et commencer l’enregistrement.
- Lorsque l’enregistrement est terminé, enlevez la plaque de Mot avec les vers ; marquer les plaques FUDR comme étant utilisée une fois et retourner à l’incubateur.
- Répétez les étapes 3.3.3 à 3.3.5 pour chaque condition expérimentale.
- Répétez les étapes 3.3.3 à 3.3.6 pour chaque point dans le temps à la durée de vie adulte.
NOTE : Les procédures de dépistage peuvent se faire à n’importe quel point de la durée de vie adulte de la vis sans fin (environ 3 semaines). Ces protocoles de facilitent le dépistage jusqu'à 9 points dans le temps ; les auteurs recommandent le dépistage tous les 2 jours à partir du 1er jour de l’âge adulte.
4. optimisation des études à doses discrètes
-
Préparer les vers en répétant les étapes 3.1.1 à 3.1.3.
- Semences env. 1000 L4 worms dans 5 assiettes FUDR. Incuber les plaques à 24 ° C jusqu'à ce que le D3 de l’âge adulte, pour des expériences impliquant AD38 vers.
-
À l’aide d’une pipette de verre stériles, transfert vers préparé dans des conditions stériles de la plaque dans un tube à centrifuger 15 mL, centrifuger à 2 000 x g pendant 2 min et retirez le surnageant.
- Suspendre la solution vers dans 1 mL de tampon de M9. Transférer les vers dans un tube de microcentrifuge, centrifuger à 300 x g pendant 2 min et éliminer le surnageant.
-
Pour la transduction de la protéine, ajouter 40 µL de réactif de transfection de la livraison et 20 µL de protéine native à la concentration désirée (en général 40 µM) et incuber à température ambiante pendant 30 min.
- Dans des conditions stériles, utiliser une pipette de verre stériles pour transférer vers de l’étape 4.2.1 dans un tube de microcentrifuge contenant la protéine encapsulé pour donner un volume total de 1060 µL. tubes Place horizontalement et l’agiter à 60 t/mn dans un 24 ° C, secouant l’incubateur pendant 8 h.
-
Dans des conditions stériles, ajouter 4 mL de solution de M9 à une plaque de Mot et transférer un tube de microcentrifuge de vers plus de drogue sur la plaque de Mot.
- Mettre en place le tracker en répétant les étapes 3.3 à 3.3.2.
- Dans des conditions stériles, ajouter 4 mL de solution de M9 à une plaque de Mot et transférer un tube de microcentrifuge de vers plus de drogue sur la plaque de Mot.
- Placez la plaque de Mot sur la scène de traqueur, concentrer la caméra sur un ver individuel et commencer l’enregistrement. Lorsque vous avez terminé, étiquette de la Mot et mises de côté.
- Répétez les étapes 4.4.1 et 4.4.3 pour tous les échantillons.
- À l’aide d’une pipette en verre, transfert vers dans des conditions stériles de la plaque de Mot dans un tube à centrifuger 15 mL, centrifuger à 2 000 g pendant 2 min. enlever transfert surnageant, le culot sur une plaque de FUDR et laisser pour sécher dans des conditions stériles.
- Répétez l’étape 4.4.5 pour tous les échantillons.
- Incuber les vers à 24 ° C jusqu’au D6 de l’âge adulte.
Remarque : Des incubations d’anticorps multiples sont également possibles. -
Ajouter 3 mL du tampon M9 à la plaque de Mot et utiliser 2 mL de solution de M9 pour laver tous les vers d’une plaque FUDR sur la plaque de Mot.
- Mettre en place le tracker en répétant les étapes 3.3 à 3.3.2.
- Placez la plaque de Mot sur la scène de traqueur, concentrer la caméra selon les besoins et lancer l’enregistrement. Une fois l’enregistrement terminé, jetez la plaque Mot ou le récupérer pour le dépistage de plus si vous le souhaitez.
- Répétez les étapes 4,6 à 4.6.2 pour tous les échantillons.
5. analyse des données vidéo
-
Après avoir acquis les vidéos, sélectionnez les paramètres appropriés dans le logiciel GUI (Figure 2) pour l’analyse des données.
- Charger une ou plusieurs vidéos via la fonction de navigation . Sélectionnez un dossier de destination de sortie. Veiller à ce que 600 à 1 200 images sont utilisées pour une analyse s 30.
Remarque : N’importe quelle plage d’images peut être analysée. - Insérer un pixel à mm facteur de conversion, qui sera 0,029 d’imagerie un Pétri de 9 cm en pleine résolution. Sélectionnez l’algorithme de tracking « keep morts ».
Remarque : Le facteur de conversion dépend du champ de vue utilisée. Algorithme de la transformée en Z peut servir aussi comme alternative. - Complétez les paramètres dans la section de recherche (Figure 2) : Z utilisent des images = 100, rembourrage Z = 3, Pixel Std = 54, seuil = 9, ouverture = 1, fermeture = 2. Ajuster les paramètres de filtrage de taille Minimum = 20, taille maximale = 180, ver = 0,94.
- Régler les paramètres de trajectoires de formage : distance Maximum déplacer = 10 ; Longueur minimale = 150, mémoire = 10.
- Définir les paramètres de coudes et la vitesse . Utilisez 1.8 pour seuil de Bend, 0 pour les coudes Minimumet 150 pour les cadres pour estimer la vitesse.
- Accordez les statistiques ver morts. Utilisez 5.0 pour Maximum beat par minute et 1.0 pour la vitesse Maximum.
- Choisissez le dossier de sortie. Définissez le nombre d’images de sortie à 50. Taille de police la valeur 10.
Remarque : Vous pouvez sélectionner une ou plusieurs zones d’intérêt (ROIs).
- Charger une ou plusieurs vidéos via la fonction de navigation . Sélectionnez un dossier de destination de sortie. Veiller à ce que 600 à 1 200 images sont utilisées pour une analyse s 30.
- Tester les paramètres en utilisant la fonction d’exemple . Les images de l’exemple de sortie et de vérifier que les vers sont visibles dans l’ensemble les 8 étapes de seuillage (Figure 1).
- Utilisez la fonction de commencer le travail .
-
Analyser les fichiers de résultats de texte en combinant les résultats individuels pour le groupe de données entier. Utilisez l’exportation à tsv fonction dans l’interface GUI.
Remarque : Éventuellement, les métriques individuelles vers peuvent également considérer pour des études de population.- Analyser les données avec le progiciel de statistiques.
Résultats
La facilité d’exploitation, l’analyse multiparamétrique et haut débit du protocole NTP-WF illustré (Figures 1 et 2) permet de déterminer très petits changements dans le comportement de ver de manière très précise. La plate-forme d’imagerie est basée sur mesure opto-mécanique, et il peut être assemblé à l’aide d’une caméra monochrome de 6 MP combinée avec objectif haute résolution de longueur focale de 16 mm pour 1'' capteur, éclairée avec un 8'' par rétro-éclairage blanc de 8'' (voir Table des matières et aussi de référence36 pour plus de détails). Le logiciel associé de WF-NTP est écrit en Python et a été développé pour fonctionner sur les plates-formes Windows. Il s’exécute sur un ordinateur personnalisé assemblé avec octa-processeur 3,00 GHz et 64 Go de mémoire vive (RAM). Le logiciel a été également conçu pour paralléliser le travail et l’analyse vidéo basée sur la RAM et le processeur de l’ordinateur ; c'est-à-dire, une machine avec une puissance de calcul inférieure se traduira par moins vidéos s’exécuter en parallèle. L’installation que nous utilisons actuellement est optimisée pour fonctionner jusqu'à env. 16 vidéos en parallèle et peut effectuer une analyse de 100 vidéos ca. du jour au lendemain. Par ailleurs, le haut niveau de détails de personnalisation offert dans l’interface graphique de la WF-NTP permet de grande maîtrise de la qualité de l’analyse d’imagerie. L’interface graphique peut être utilisé pour télécharger directement les grands ensembles de données en parallèles ou individuels vidéos ; images spécifiques peuvent également être activées pour une analyse détaillée subsidiaire, ainsi qu’un facteur de conversion pixel, qui peut être utilisé pour estimer les paramètres comportementaux. L’un des deux algorithmes suivi différente (donjon morts et transformée en Z) peut être choisi en fonction de si oui ou non l’utilisateur souhaite examiner animaux paralysés dans l’analyse. Le paramètre seuil peut être accordée en conséquence avec la vidéo et expérimentale de qualité. L’ouverture et la fermeture paramètres permettent à l’utilisateur de supprimer le bruit et encore implémenté la fonctionnalité de seuillage. L’algorithme de skeletonizing offre une méthode alternative d’analyse. L’objet taille cut-off (filtrage) fournit un filtre supplémentaire pour bruit de fond et le paramètre de type ver permet à l’utilisateur d’examiner les vers seuls les objets de forme ellipsoïdale, donc distinguer des autres objets qui peuvent avoir la même taille de pixel de les vers. Après ces opérations de seuillage, toutes les régions marquées qui en résulte peuvent être identifiées comme worms individuels et les positions de ces régions sont ensuite stockées pour chaque trame pour une analyse ultérieure et le suivi. L’excentricité de chaque ver sur chenilles est utilisée pour estimer les métriques de vis sans fin comme l’étendue du ver en fonction du moment de flexion (BPM). Les utilisateurs sont autorisés à sélectionner le nombre d’images permettant de garder un ver dans la mémoire du logiciel après la collision, et le nombre de pixels qu’un ver peut se déplacer entre les cadres peut aussi être assemblé afin de distinguer les animaux contre le bruit. L’option de longueur de piste minimum permet à l’utilisateur de se défaire vers qui ont été suivis pendant seulement quelques images. Autres paramètres clés, tels que les coudes et la vélocité, permettent à l’utilisateur de sélectionner le degré de flexion nécessaire pour être considéré comme un coude de corps et le nombre d’images censées être nécessaires pour estimer la vitesse des animaux. Paramètres de seuil peuvent être ajustés plus loin pour l’inclusion des animaux paralysés. La sortie est automatiquement affichée dans les fichiers de résultats. Ces valeurs sont considérées comme des limites maximales pour l’évaluation de la fraction des animaux paralysés. L’utilisateur peut également choisir une ou plusieurs régions d’intérêt. Cette fonctionnalité est particulièrement utile pour analyser les sous-populations vers et la sortie est triée automatiquement dans les fichiers de résultats. L’option de sortie permet à l’utilisateur de sélectionner le dossier de sortie et le numéro de suivi de cadres qui seront produites pour elle. Divers ensembles d’outils permet également pour l’analyse des données supplémentaire, telles que l’outil de chemin tracé qui montre chaque ver les titres et l’outil de prise d’empreintes qui permet à l’utilisateur de créer des empreintes digitales des cartes.
Cette méthodologie permet de nouvelles approches à adopter, non seulement pour des études biologiques de c. elegans , mais aussi à des fins de recherche médicale et pharmacologique, comme le criblage à haut débit des modifications génétiques et les traitements médicamenteux. Nous avons illustré ce potentiel en décrivant la caractérisation des phénotypes pour les études de population grand (N > 1000) de divers modèles de ver de maladies neuro-dégénératives (fronto-temporale (DFT) la démence39, maladie de Parkinson (MP)7 , La maladie d’Alzheimer (ma)16,40et la sclérose latérale amyotrophique (SLA)19 (Figure 3 a) et caractériser les effets des molécules thérapeutiques potentielles à l’aide de modèles de ver de PD18 et AD 15,12 (figure 3 b). Deux petites molécules, squalamine18 et bexarotène15, ont été administrées à des concentrations atteignant 25 µM à PD (Figure 3 b) et 10 µM à AD38 (Figure 3 b) vers, respectivement. Les deux composés ont montré claires les effets dose-dépendante sur la gamme des concentrations testées. Nous avons montré que cette grande précision des mesures est obtenue en augmentant le nombre de vers qui peuvent être analysés par rapport aux méthodes traditionnelles (Figure 3C). Nous avons démontré l’importance de la taille de l’échantillon (Figure 3C) lors de dépistage moléculaire ainsi que dans la caractérisation des souches mutantes. L’augmentation de température de 20 ° C conduit à environ la moitié vers AD devient paralysés après 3 jours de l’âge adulte. Ver les populations ont été testées dans des conditions différentes, par exemple, , lorsque vers surexprimant la forme 42-résidu du peptide β-amyloïde (Aß1-42) (vers AD) ont été exposés aux variations de température subtile (Figure 3C, gauche Panel), lorsque Aβ1-42 a été exprimée dans tous les neurones (Figure 3C, panneau central), ou lorsque les vers AD étaient exposés au bexarotène (Figure 3C, panneau de droite). Les vers ont été analysés de petits ROIs choisis au hasard dans le champ de vision complet des vidéos acquises avec le WF-NTP (barres de < 50, jaune N) mettant en évidence la comparaison de la motilité de ces vers avec la motilité moyenne de la population entière de ver (N < 1 000). Dans tous les panneaux, la différence mesurée dans l’ensemble la population ver semble être statistiquement significative avec p ≤ 0,0001 (*).
Le protocole NTP-WF décrit ici permet également l’enregistrement simultané de plusieurs paramètres (Figure 1 b) à l’appui, de manière optimale, les validation interne et l’élaboration d’une empreinte complète d’un large éventail de conditions par rapport à un échantillon de contrôle, permettant des comparaisons significatives dans plusieurs études. Cette approche multi paramétrique comprend l’analyse simultanée de plusieurs fonctions comportementales, y compris le cintrage, fréquence, vitesse, taux de paralysie, taille, amplitude de la courbe et pliage déplacement36. Cela permet à des milliers d’animaux à surveiller de façon très détaillée et à une sensibilité très élevée et la signification statistique et offre des possibilités d’études de populations importantes. Cette procédure de suivi a également l’avantage de permettre des études de paralysie à exécuter en parallèle avec les autres mesures comportementales, un élément clé dans les études de dépistage moléculaire.
Les résultats obtenus jusqu'à présent dans AD15,34,35 et découverte de médicaments18 PD démontrent l’importance d’acquisition de données large champ de vision pour augmenter considérablement le nombre d’animaux qui peuvent être suivi en une seule expérience, diminuant considérablement les erreurs expérimentales et améliorant considérablement la validité statistique des études. Selon ces résultats, nous prévoyons que le protocole NTP-WF, qui nous fait facilement disponibles pour la communauté36, élargira considérablement l’utilisation de c. elegans.
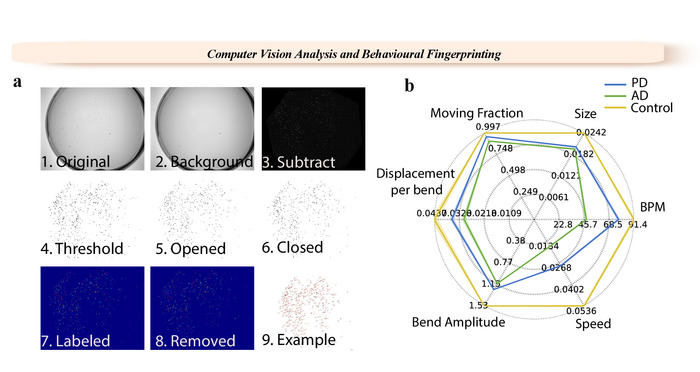
Figure 1 : étapes d’analyse WF-NTP et exemple d’une empreinte digitale. (a) 1. Vidéo originale. 2. background image. 3. contexte soustrait image. 4-6. étapes de seuillage. 7-9. étiquetage unique de worms. (b) plusieurs phénotypes sont signalés avec une empreinte digitale pour les vers de type sauvage et vis sans fin de modèles de PD et AD. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
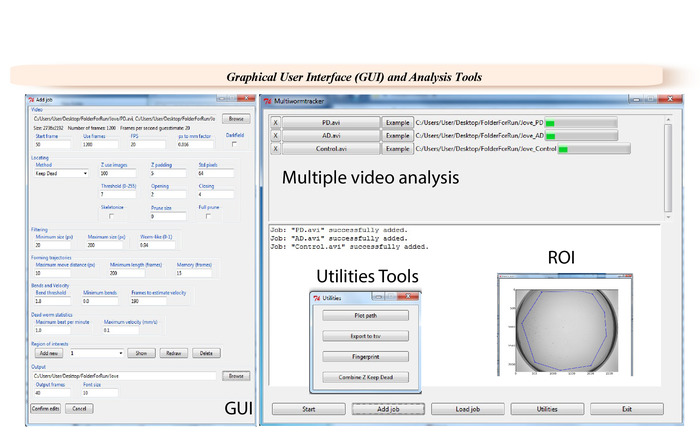
Figure 2 : l’interface utilisateur graphique (GUI) de la WF-NTP. Vidéos spécifiques et images sélectionnées peuvent être sélectionnés dans l’interface graphique pour l’analyse, et un facteur de conversion pixel peuvent être inséré, après lequel l’analyse est effectuée avec l’un des deux algorithmes suivi donné. Il est possible de sélectionner le degré de flexion nécessaire pour compter comme un coude du corps ainsi que le nombre d’images nécessaires pour estimer la vitesse des animaux. Courbes du corps et des seuils de vitesse peuvent déterminer les statistiques ver paralysés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
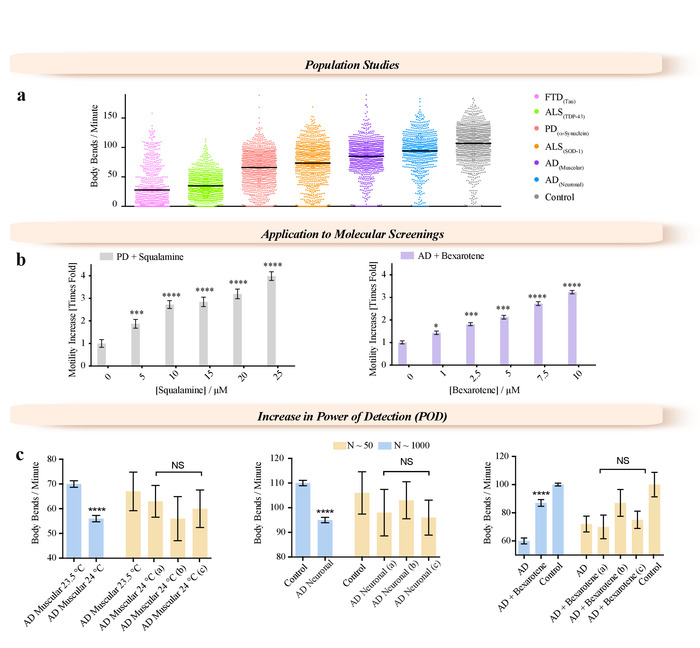
Figure 3 : exemples d’applications activées par la méthode de WF-NTP. (a) Application de WF-NTP dans les études de population importante (N > 1 000) des mesures de BPM pour les modèles d’une gamme de maladies neurodégénératives, y compris le FTD, PD, AD, c. elegans et ALS. (b) Application de WF-NTP dans la découverte de médicaments. (c) l’Importance des études de population dans la sensibilité à la température, l’efficacité du médicament et la caractérisation de la souche mutante. Phénotypes de sous-populations N < 50 (barres jaunes) sont comparées à celles de la population entière de ver (N < 1 000). Les barres d’erreur indiquent l’erreur-type de la moyenne (SEM). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Etant donné l’expansion rapide des techniques dans le domaine des sciences optiques, il est maintenant possible d’aborder la nécessité de méthodes automatisées dans les études de c. elegans sensiblement différemment. En conséquence, un certain nombre de digital plates-formes20,41,42,43,44,45,46 de suivi ont été conçus et mis à disposition sur ces dernières années afin de remplacer un comptage manuel des paramètres tels que la vitesse du mouvement, flexion, fréquence, taux de paralysie, ainsi que des formes plus complexes de comportements tels qu’omega tour à tour et les mesures de durée de vie. Dernières plates-formes automatisées ont grandement amélioré la reproductibilité et sensibilité de c. elegans études41 et a fourni des données de haute qualité sur petites cohortes ou même des animaux. Nous avons décidé d’étendre l’automatisation de l’analyse du comportement de ver à permettent également d’évaluer les phénotypes des cohortes de milliers d’animaux en parallèle. Le principal avantage de l’approche de l’étude de cohortes de ver, c’est qu’il permet pour la comptabilité de la forte variabilité intrinsèque de ver comportement24 et pour le fait que les études sur les traitements médicamenteux conduisent souvent à des subtiles variations phénotypiques, qui sont difficiles à détecter avec une signification statistique suffisante lors de l’utilisation d’un petit groupe d’animaux. Une forte puissance de détection (POD) est en effet nécessaire pour détecter avec certitude toute variation importante dans le comportement et de limiter les faux positifs25.
Ici, nous avons décrit une série de protocoles basés sur une méthode de dépistage automatisé récemment déclarés pour c. elegans, le large champ de vision de nématode suivi de plate-forme (WF-NTP)36. Le protocole décrit ici est divisé en 5 parties. Les parties 1 et 2 décrivent la préparation des populations de grand ver. Étapes critiques sont la stérilité des conditions de travail et la préparation des réactifs et des plaques nécessaires pour exécuter les expériences. Nous notons que, en raison de l’un débit plus élevé prévu par le présent protocole par rapport aux autres méthodes36de dépistage, il exige aussi une augmentation des quantités de réactifs ; ce facteur doit être examinée avec soin dans la conception expérimentale. Notons aussi que l’étape de blanchiment est essentielle et doit être testé à l’avance comme un grand nombre de œufs et les larves saines sont nécessaires à l’exécution de ces expériences. Partie 3 du présent protocole détaille comment libérer des médicaments solides ver médias et écran des populations. Nous notons que cette partie du protocole est fortement dépendante du nombre de médicaments et les concentrations de médicament à tester par l’utilisateur en parallèle. L’automatisation complète de la procédure d’examen préalable et d’acquisition de données rapide passer l’étape d’observation comportementale à la préparation des réactifs et de croissance et de synchronisation des populations de grand ver. Les étapes clés lors de la projection comportementale sont les timings de l’enregistrement et à n’importe quel ver manutention étapes (par exemple, le transfert vers des plaques NGM à la plate-forme de suivi). Le protocole décrit ici est un exemple conçu pour détecter les vers pendant 9 jours au cours de la durée de vie adulte ; Toutefois, le présent protocole peut être facilement adapté à l’écran autant de points que l’utilisateur désire, par exemple, 18 jours consécutifs36fois. Partie 4 illustre ensuite l’application du protocole de livrer des molécules de protéines (p. ex., les anticorps et les chaperons moléculaires) dans c. eleganset montre comment le protocole illustré dans les parties 1 à 3 peut être facilement personnalisé, selon la direction désirée demande. Nous montrons comment cette procédure peut être étendue non seulement à la livraison de drogue-comme des molécules, mais aussi pour l’administration d' anticorps ou chaperons moléculaires37. Les quatre premières étapes (pièces) sont réalisées dans des conditions stériles, sauf indication contraire. Tous les composants liquides doivent être autoclavés avant l’utilisation et les étapes d’incubation doivent être effectuées à 70 % d’humidité relative. Dans la partie 5, nous expliquent comment utiliser le progiciel en combinaison avec la phase de suivi. Ce logiciel a été personnalisé conçu pour l’analyse des données de WF-NTP concernant le comportement des populations de grand ver. Nous suggérons que l’utilisateur suit les directives fournies dans la partie 5 pour l’analyse des données ; Cependant, ces paramètres dépendent des caractéristiques spécifiques des vidéos enregistrées (fps, champ de vision, résolution vidéo, nombre d’images acquises). L’exemple de fonction fourni dans l’interface graphique a été conçu pour faciliter l’évaluation des paramètres corrects avant l’analyse.
Ces séries de protocoles permettent d’analyser les phénotypes de grandes populations de c. elegans (actuellement jusqu'à 5 000 vers individuels en parallèle) efficacement, réduction des artéfacts en raison de la variabilité intrinsèque du comportement des animaux , en accord avec les études préliminaires sur la puissance de détection nécessaire pour atteindre la signification statistique des études de c. elegans,25. La plateforme utilise un système de caméras haute résolution, capables d’enregistrer des images d’un grand nombre d’animaux à grande vitesse, tout en enregistrant simultanément plusieurs grandes cohortes. La haute performance et un débit élevé du protocole NTP-WF permet de déterminer très petits changements dans le comportement de ver de manière très précise. Par conséquent, cette méthodologie permet de nouvelles approches à prendre en considération non seulement pour l’étude de la biologie de c. elegans, mais en plus pour des recherches pharmacologiques et médicales, telles que le criblage à haut débit de modifications génétiques et de la drogue traitements. Cette procédure a également l’avantage de permettre des études de paralysie à exécuter en parallèle avec les autres mesures comportementales, un élément clé dans les études de dépistage moléculaire.
Les résultats obtenus jusqu'à présent dans les programmes de découverte de drogue de AD15,34,35 et PD18 démontrent l’importance de d’acquisition de données large champ de vision en augmentant sensiblement le nombre d’animaux pouvant être analysés en une seule expérience, diminuant ainsi considérablement les erreurs expérimentales et améliorant considérablement la validité statistique des études. Alors que l’approche actuelle décrite dans le présent protocole a porté sur les défis dans le domaine de découverte de médicaments, nous espérons que la méthodologie sera largement adoptée dans la Communauté, et que son application sera étendue à la génétique complexe et des études comportementales et augmenter le nombre de phénotypes actuellement détectables.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a aucun conflit d’intérêt.
Remerciements
Ce travail a été soutenu par le Centre pour la mauvais repliement des maladies (CMD). FAA est pris en charge par un Senior Research Fellowship award de l’Alzheimer Society, UK (Grant nombre 317, AS-SF-16-003). Les souches de c. elegans ont été prélevés le Caenorhabditis elegans Centre génétique (CGC).
matériels
| Name | Company | Catalog Number | Comments |
| Consumable reagents | |||
| monobasic potassium phosphate | Sigma Aldrich | P0662 | |
| dibasic sodium phosphate | Sigma Aldrich | S3264 | |
| sodium chloride | Sigma Aldrich | 13422 | |
| magnesium sulphate | Sigma Aldrich | M7506 | |
| Agar | Sigma Aldrich | A1296 | |
| Difco casein digest | Scientific Laboratory Supplies | 211610 | |
| calcium chloride dihydrate | Sigma Aldrich | C3881 | |
| cholesterol | Acros | 110190250 | |
| absolute ethanol | Vwr | 20821.33 | |
| 5-Fluoro-2'-deoxyuridine 98% | Alfa Aesar | L16497.ME | |
| LB medium capsules | MP biomedicals | 3002-031 | |
| 13% sodium hypochlorite | Acros Organics | AC219255000 | |
| Sodium hydroxide | Fisher Chemical | S/4880/53 | |
| Name | Company | Catalog Number | Comments |
| Strains | |||
| E. coli strain OP50 | Supplied by CGC | Op50 | E coli strain |
| C. elegans strain wild type | Supplied by CGC | N2 | C. elegans strain |
| C. elegans strain AD | Supplied by CGC | GMC101 | C. elegans strain |
| C. elegans strain PD | Supplied by CGC | NL5901 | C. elegans strain |
| C. elegans strain ALS | Supplied by CGC | AM725 | C. elegans strain |
| C. elegans strain Tau | Supplied by CGC | BR5485 | C. elegans strain |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Tactrol 2 Autoclave | Priorclave | ||
| 9 cm sterile Petri dishes | Fisher Scientific | 11309283 | |
| 2 L erlenmeyer flasks | Scientific Laboratory Supplies | FLA4036 | |
| Nalgene 1 L Centrifuge pots | Fisher Scientific | 3120-1000 | |
| RC5C plus floor mounted centrifuge | Sorvall | 9900884 | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| Heraeus Multifuge X3R | Thermofisher scientific | 75004515 | |
| Inoculating Spreaders | Fisher Scientific | 11821741 | |
| M4 multipette | Eppendorf | 4982000012 | |
| P1000 pipette | Eppendorf Research Plus | ||
| P200 pipette | Eppendorf Research Plus | 3123000055 | |
| P10 pipette | Eppendorf Research Plus | 3123000020 | |
| 1,000 μL low retention tips | Sarstedt | ||
| 300 μL low retention tips | Sarstedt | 70.765.105 | |
| 10 μL low retention tips | Sarstedt | 70.1130.105 | |
| pipeteboy 2 | VWR | 612-0927 | |
| 50 mL serological pipette | Appleton Woods | CC117 | |
| 25 mL serological pipette | Appleton Woods | CC216 | |
| 10 mL serological pipette | Appleton Woods | CC214 | |
| glass pipette 270 mm | Fisherbrand | FB50255 | Camera for videos recording |
| pulsin | Polyplus Transfection | 501-04 | Transduction reagent |
| Multitron Standard shaking incubator | Infors HT | INFO28573 | |
| air duster | Office Depot | 1511631 | |
| Name | Company | Catalog Number | Comments |
| WF-NTP Tracker Components and Image Capture Software | |||
| 8'' by 8'' Backlight | Edmond Optics | 88-508 | Tracker component |
| 16 mm FL high resolution lens for 1'' sensor | Edmond Optics | 86-571 | Tracker component |
| 6 Mpx camera | Edmond Optics | 33540 | Tracker component |
| FlyCapture Software | PointGrey | SDK v2.12 | Image capture software |
| WF-NTP Software | Cambridge Enterprise | v1.0 | Image analysis software |
| Office Package | Microsoft | Office 365 | Statistical analysis software |
Références
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature Reviews Drug Discovery. 5 (5), 387-399 (2006).
- Nollen, E. A. A., et al. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the USA. 101 (17), 6403-6408 (2004).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the USA. 99 (16), 10417-10422 (2002).
- Van der Goot, A. T., et al. Delaying aging and the aging-associated decline in protein homeostasis by inhibition of tryptophan degradation. Proceedings of the National Academy of Sciencesof the USA. 109 (37), 14912-14917 (2012).
- Van Ham, T. J., et al. Identification of MOAG-4/SERF as a regulator of age-related proteotoxicity. Cell. 142 (4), 601-612 (2010).
- Van Ham, T. J., et al. C. elegans model identifies genetic modifiers of α-synuclein inclusion formation during aging. PLoS Genetics. 4 (3), e1000027(2008).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes & Development. 19 (13), 1544-1555 (2005).
- Sarin, S., Prabhu, S., O'Meara, M. M., Pe'er, I., Hobert, O. Caenorhabditis elegans mutant allele identification by whole-genome sequencing. Nature Methods. 5 (10), 865-867 (2008).
- Kim, Y., Sun, H. Functional genomic approach to identify novel genes involved in the regulation of oxidative stress resistance and animal lifespan. Aging Cell. 6 (4), 489-503 (2007).
- Dillin, A., et al. Rates of Behavior and Aging Specified by Mitochondrial Function During Development. Science. 298 (5602), 2398-2401 (2002).
- Lee, S. S., Kennedy, S., Tolonen, A. C., Ruvkun, G. DAF-16 target genes that control C. elegans life-span and metabolism. Science. 300 (5619), 644-647 (2003).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nature Reviews. Genetics. 3 (5), 356-369 (2002).
- Alavez, S., Vantipalli, M. C., Zucker, D. J. S., Klang, I. M., Lithgow, G. J. Amyloid-binding compounds maintain protein homeostasis during ageing and extend lifespan. Nature. 472 (7342), 226-229 (2012).
- Habchi, J., et al. An anticancer drug suppresses the primary nucleation reaction that initiates the production of the toxic A 42 aggregates linked with Alzheimers disease. Science Advances. 2 (2), e1501244(2016).
- Wu, Y., et al. Amyloid- -Induced pathological behaviors are suppressed by ginkgo biloba extract EGb 761 and ginkgolides in transgenic caenorhabditis elegans. Journal of Neuroscience. 26 (50), 13102-13113 (2006).
- Link, C. D. Expression of human beta-amyloid peptide in transgenic Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the USA. 92 (20), 9368-9372 (1995).
- Perni, M., et al. A natural product inhibits the initiation of a-synuclein aggregation and suppresses its toxicity. Proceedings of the National Academy of Sciencesof the USA. 114 (6), E1009-E1017 (2017).
- Gidalevitz, T., Krupinski, T., Garcia, S., Morimoto, R. I. Destabilizing protein polymorphisms in the genetic background direct phenotypic expression of mutant SOD1 toxicity. PLoS Genetics. 5 (3), e1000399(2009).
- Nussbaum-Krammer, C. I., Neto, M. F., Brielmann, R. M., Pedersen, J. S., Morimoto, R. I. Investigating the spreading and toxicity of prion-like proteins using the metazoan model organism C. elegans. Journal of visualized experiments. (95), 52321(2015).
- Machino, K., Link, C. D., Wang, S., Murakami, H., Murakami, S. A semi-automated motion-tracking analysis of locomotion speed in the C. elegans transgenics overexpressing beta-amyloid in neurons. Frontiers in Genetics. 5, 202(2014).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Van der Goot, A. T., Nollen, E. A. A. Tryptophan metabolism: entering the field of aging and age-related pathologies. Trends in Molecular Medicine. 19 (6), 336-344 (2013).
- Lublin, A. L., Link, C. D. Alzheimer's disease drug discovery: in vivo screening using Caenorhabditis elegans as a model for β-amyloid peptide-induced toxicity. Drug Discovery Today: Technologies. 10 (1), e115-e119 (2013).
- Petrascheck, M., Miller, D. L. Computational analysis of lifespan experiment reproducibility. Frontiers in genetics. 8 (JUN), 92(2017).
- Yemini, E., Jucikas, T., Grundy, L. J., Brown, A. E. X., Schafer, W. R. A database of Caenorhabditis elegans behavioral phenotypes. Nature Methods. 10 (9), 877-879 (2013).
- Wang, S. J., Wang, Z. -W. Track-a-worm, an open-source system for quantitative assessment of C. elegans locomotory and bending behavior. PLoS ONE. 8 (7), e69653(2013).
- Faumont, S., et al. An image-free opto-mechanical system for creating virtual environments and imaging neuronal activity in freely moving Caenorhabditis elegans. PLoS ONE. 6 (9), e24666(2011).
- Tsibidis, G. D., Tavernarakis, N. Nemo: a computational tool for analyzing nematode locomotion. BMC Neuroscience. 8, 86(2007).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nature Methods. 8 (2), 153-158 (2011).
- Leifer, A. M., Fang-Yen, C., Gershow, M., Alkema, M. J., Samuel, A. D. T. Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans. Nature Methods. 8 (2), 147-152 (2011).
- Restif, C., et al. CeleST: computer vision software for quantitative analysis of C. elegans swim behavior reveals novel features of locomotion. PLoS Computational Biology. 10 (7), e1003702(2014).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The Parallel Worm Tracker: a platform for measuring average speed and drug-induced paralysis in nematodes. PLoS ONE. 3 (5), e2208(2008).
- Habchi, J., et al. Systematic development of small molecules to inhibit specific microscopic steps of Aβ42 aggregation in Alzheimer's disease. Proceedings of the National Academy of Sciences of the USA. 114 (2), E200-E208 (2017).
- Aprile, F. A., et al. Selective targeting of primary and secondary nucleation pathways in Aβ42 aggregation using a rational antibody scanning method. Science Advances. 3 (6), e1700488(2017).
- Perni, M., et al. Massively parallel C. elegans tracking provides multi-dimensional fingerprints for phenotypic discovery. Journal of neuroscience. 306, 57-67 (2018).
- Perni, M., et al. Delivery of Native Proteins into C. elegans Using a Transduction Protocol Based on Lipid Vesicles. Scientific Reports. 7 (1), 7380(2017).
- McColl, G., et al. Utility of an improved model of amyloid-beta (Aβ₋) toxicity in Caenorhabditis elegans for drug screening for Alzheimer's disease. Molecular Neurodegeneration. 7 (1), 7380(2012).
- Fatouros, C., et al. Inhibition of tau aggregation in a novel Caenorhabditis elegans model of tauopathy mitigates proteotoxicity. Human Molecular Genetics. 21 (16), 3587-3603 (2012).
- Fay, D. S., Fluet, A., Johnson, C. J., Link, C. D. In vivo aggregation of β-Amyloid peptide variants. Journal of Neurochemistry. 71 (4), 1616-1625 (1998).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook: the Online Review of C. elegans Biology. , 1-17 (2012).
- Hardaker, L. A., Singer, E., Kerr, R., Zhou, G. T., Schafer, W. R. Serotonin modulates locomotory behavior and coordinates egg-laying and movement in Caenorhabditis elegans. Journal of Neurobiology. 49 (4), 303-313 (2001).
- Tsechpenakis, G., Bianchi, L., Metaxas, D., Driscoll, M. A novel computational approach for simultaneous tracking and feature extraction of C. elegans populations in fluid environments. IEEE Transactions on Bio-medical Engineering. 55 (5), 1539-1549 (2008).
- Buckingham, S. D., Sattelle, D. B. Fast, automated measurement of nematode swimming (thrashing) without morphometry. BMC Neuroscience. 10, 84(2009).
- Feng, Z., Cronin, C. J., Wittig, J. H., Sternberg, P. W., Schafer, W. R. An imaging system for standardized quantitative analysis of C. elegans behavior. BMC Bioinformatics. 5, 115(2004).
- Stroustrup, N., et al. The caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon