Method Article
Analisi del comportamento di grande c. elegans popolazioni utilizzando un ampio campo di vista Monitoraggio piattaforma automatizzata
In questo articolo
Riepilogo
Descriviamo i protocolli per l'utilizzo della piattaforma di tracking del nematode ampio campo di vista (WF-NTP), che consente velocità effettiva elevata caratterizzazione fenotipica di grandi popolazioni di Caenorhabditis elegans. Questi protocolli possono essere utilizzati per caratterizzare i sottili cambiamenti comportamentali in ceppi mutanti o in risposta al trattamento farmacologico in modo altamente scalabile.
Abstract
Caenorhabditis elegans è un modello animale ben consolidato nella ricerca biomedica, largamente impiegata in genomica funzionale e studi di invecchiamento. Per valutare la salute e il benessere degli animali in fase di studio, uno in genere si basa su letture di motilità, quali la misurazione del numero di curve del corpo o la velocità di movimento. Queste misurazioni coinvolgono di solito conteggio manuale, rendendolo difficile da ottenere buona significatività statistica, come tempo e vincoli di lavoro spesso limitare il numero degli animali in ogni esperimento a 25 o meno. Alta potenza statistica, essendo necessaria per ottenere risultati riproducibili e limitare i risultati falsi positivi e negativi quando deboli effetti fenotipici sono studiati, recentemente sono stati compiuti sforzi per sviluppare protocolli automatizzati, incentrate sulla aumentando il sensibilità di rilevazione di motilità e multi-parametrico behavioral profiling. Al fine di estendere il limite di rilevazione al livello necessario per catturare i piccoli cambiamenti fenotipici che spesso sono fondamentali per gli studi genetici e scoperta di nuovi farmaci, descriviamo qui un'evoluzione tecnologica che consente lo studio di singoli fino a 5.000 animali simultaneamente, aumentando la potenza statistica delle misurazioni da circa 1.000 rispetto ai saggi manuale e circa 100 volte rispetto ad altri metodi automatizzati disponibili.
Introduzione
Circa mezzo secolo fa, Sydney Brenner introdotto Caenorhabditis elegans (c. elegans) come un sistema modello per studiare lo sviluppo e la neurobiologia, come questo piccolo (1 mm di lunghezza), vite senza fine del nematode trasparente è facile da manipolare geneticamente modificati e di mantenere nel laboratorio1. Oggi, c. elegans è usato per studiare una vasta gamma di processi biologici, tra cui l'apoptosi, la segnalazione delle cellule, la natura del ciclo cellulare, regolazione genica, metabolismo e invecchiamento2. Inoltre, la complessità cellulare e tessutale, modelli di espressione della proteina e la conservazione dei percorsi di malattia tra c. elegans e organismi superiori (80% dei geni di vite senza fine hanno un ortologo umano), collegata con la semplicità e rapporto costo-efficacia di coltivazione, renderlo un organismo di modello efficace in vivo suscettibili di alto-rendimento genetico3,4,5,6,7, 8 , 9 , 10 , 11 , 12 , 13 e droga proiezioni16 14,15,. Per tutte queste ragioni, c. elegans è stato impiegato per la caratterizzazione delle vie molecolari normale e relazione con la malattia; nel campo della neurodegenerazione, ad esempio, ha permesso l'esplorazione degli effetti dell'invecchiamento sulla proteina aggregazione3,4,7,15,17, 18e la caratterizzazione dei promotori e degli inibitori della proteina aggregazione3,4,5,6,7,14, 18.
La forma fisica generale dei vermi, che è un parametro importante del comportamento per essere definiti in questo tipo di studio, può essere manualmente misurato in una varietà di modi, come ad esempio contando il numero di curve del corpo per minuto (BPM)4,6, 19, o misurando la velocità di movimento20,21,22, come pure misurando la durata della vita media e tassi di paralisi. Sebbene misure manuali di corpo curve e velocità di movimento hanno portato a molti importanti intuizioni una varietà di meccanismi molecolari e meccanismi3,4,14,19, 20,23, analisi manuale rimangono attualmente a bassa velocità di trasmissione, altamente laborioso e che richiede tempo, pur essendo incline agli errori e ai pregiudizi umani. Questi problemi presentano notevoli sfide per la raccolta dei dati con potenza statistica sufficiente a distinguere sottili cambiamenti comportamentali. Questa limitazione è particolarmente rilevante per la droga di screening come trattamenti con farmaci potenziali molecole conducono spesso a piccoli cambiamenti fenotipici24, richiedendo quindi lo studio di un gran numero di animali al fine di acquisire risultati riproducibili. Per illustrare questo punto, recenti studi hanno dimostrato che un alto potere di rilevazione (POD) è necessario definire con fiducia qualsiasi cambiamento significativo nel comportamento e per limitare i risultati falsi positivi25. Ciò ha provocato una forte motivazione della comunità di c. elegans per sostituire il conteggio manuale con misurazioni riproducibili, automatizzato, tempo - e costi - effective. Per soddisfare questa richiesta, diversi laboratori hanno recentemente sviluppato metodi per misurazioni ad alta sensibilità e il verme accurato rilevamento di maggior numero di vermi22,26,27,28 ,29,30,31,32,33.
Al fine di espandere ulteriormente il processo di automazione per le larghe coorti di animali necessari per misurazioni statisticamente significativi, abbiamo recentemente sviluppato un ampio campo di vista nematode monitoraggio piattaforma (WF-NTP)15,34 ,35,36, che consente l'indagine simultanea di più letture fenotipiche sulle popolazioni molto grande verme, un fattore chiave nell'individuazione fenotipica statisticamente rilevanti25. Non solo può il WF-NTP attualmente monitorare fino a 5.000 animali in parallelo, ma le letture fenotipiche includono anche i parametri multipli, compreso il tasso e l'ampiezza delle curve del corpo, la velocità di movimento, la frazione della popolazione che è paralizzata, e la taglia degli animali. Pertanto è facilmente possibile allo schermo migliaia di vermi in parallelo e per combinare le diverse letture in una mappa del comportamento per creare un multidimensionale dell'impronta digitale36. Il software open-source associato è scritto in Python, che è anche necessaria per farlo funzionare ed è completamente personalizzabile. Un'interfaccia utente grafica (GUI) è a disposizione per consentire agli utenti di adottare questa tecnologia.
Qui, presentiamo una serie di protocolli che illustrano alcune delle applicazioni potenziali di WF-NTP. In particolare, discutiamo la somministrazione di composti, che vanno da piccole molecole a terapie proteiche e descrivono come schermo loro effetti direttamente sopra grandi popolazioni di vermi, efficacemente eliminando così la necessità di assaggiare piccole sub-popolazioni. L'utilizzo di WF-NTP per tale scopo già ha portato notevoli vantaggi nelle procedure finalizzate a progettare programmi di scoperta della droga del morbo di Alzheimer (annuncio)15,34,35 e malattia di Parkinson (MDP)18 utilizzando dati in vivo per la valutazione dei candidati terapeutico35,37.
Protocollo
1. preparazione dei materiali per i protocolli di c. elegans
-
Per preparare una soluzione di tampone x M9 10, aggiungere 30 g di fosfato di potassio monobasico, 60 g di fosfato di sodio bibasico e 50 g di cloruro di sodio per una bottiglia da 1 L autoclavabile.
- Aggiungere 1 L di acqua purificata ed autoclave a ca. 121 ° C per 15 min.
- Diluire 10 volte in acqua purificata e sterilizzare in autoclave a ca. 121 ° C per 15 min.
- Quando raffreddato, aggiungere 1 mL di una soluzione 1 M di solfato di magnesio.
Nota: Solo 1 x M9 (M9) dovrebbe essere usato per worm movimentazione nei passaggi seguenti.
-
Per preparare il terreno di coltura del nematode (Rich-NGM), mescolare 2,7 g di cloruro di sodio, 15,75 g di agar, 5,75 g di caseina, 900 mL di acqua purificata e sterilizzare in autoclave a 121 ° C per 15 min.
- Trasferire il mezzo di Rich-NGM un forno scaldavivande (ca. 70 ° C), se non utilizzato immediatamente; il Rich-NGM può rimanere fuso a ca. 70 ° C per fino a 12 h prima di diventare inutilizzabile.
- Per il Rich-NGM mescolare, aggiungere 900 µ l di una soluzione di cloruro di calcio, 900 µ l di una soluzione di solfato di magnesio di 1 M e 900 µ l di una soluzione di colesterolo 5 mg/mL 1 M in etanolo assoluto.
Nota: Colesterolo non è necessario utilizzare prima della sterilizzazione in autoclave. - Per preparare le piastre sperimentali che mantengono una popolazione sincrono di età, è necessario aggiungere µ l 92 del 5-fluoro-2'-deoxyuridine (FUDR) a 812 µM a 900 mL di Rich-NGM.
Nota: FUDR è sia tossiche e cancerogene, quindi è essenziale indossare guanti in nitrile oltre ai camici da laboratorio e occhiali di sicurezza. Non consentire rifiuti di entrare nei rifiuti generici streaming e smaltire mediante incenerimento con postbruciatore. - Versare 20 mL del Rich-NGM in autoclave in un piatto di Petri sterile cm 9 per generare una piastra di crescita (piastra di Rich-NGM). Versare 15 mL del Rich-NGM in autoclave in un piatto di Petri sterile 9cm per fare un piatto di motilità (piastra di Mot). Versare 20 mL di Rich-NGM con FUDR in un piatto di Petri sterile cm 9 per generare una piastra FUDR.
Nota: Il volume basso agar della piastra Mot facilita la fotocamera fuoco e vite senza fine di rilevamento (Vedi punto 3.2.5).
-
Preparare il ceppo OP50 Escherichia coli , in autoclave 1 L di brodo LB a 121 ° C per 15 min e inoculare con coltura starter quando raffreddato.
- Consentire la coltura batterica a crescere durante la notte a 37 ° C e sterilizzare il tubo deve essere utilizzato per centrifugazione.
- Trasferire i batteri alle provette sterili e centrifugare a 4.600 x g per 15 min.
- Decantare il supernatante e, utilizzando acqua sterile, sospendere nel 10% del volume originale di creare 10 x (10 volte concentrato) OP50 stock.
- Diluire 15 mL di stock x OP50 10 a 150 mL per generare 1 x OP50, usando acqua sterile, prima di essere usato per seminare piastre Rich-NGM. Utilizzare i rimanenti 10 x soluzione per piastre di FUDR seme.
Nota: Le piastre di Mot rimarranno non teste di serie e verranno utilizzate solo in fase di acquisizione immagine.
-
Per piastre di seme con batteri, segregare il Rich-NGM e piastre di FUDR.
- In condizioni di sterilità, aggiungere 350 µ l di 1x OP50 a Rich-NGM piastre e distribuire uniformemente.
Nota: Non si diffondono al bordo della piastra come vermi striscerà fino ai lati del piatto e morire. - In condizioni di sterilità, aggiungere 350 µ l di 10 x OP50 a FUDR piastre e distribuire uniformemente.
- Lasciate le piastre a secco ed incubare a 20 ° C per 2 d prima dell'uso.
- In condizioni di sterilità, aggiungere 350 µ l di 1x OP50 a Rich-NGM piastre e distribuire uniformemente.
2. preparazione di c. elegans per l'utilizzo con il WF-NTP
- Mantenere, c. elegans su piastre di Rich-NGM o trasferendo una piccola quantità di agar contenente vermi a faccia in giù su un nuovo strato batterico. Mantenere i ceppi di c. elegans in questo modo prima di iniziare i protocolli sperimentali.
- Utilizzando la tecnica di trasferimento (Vedi punto 2.1), 20 piastre di seme di ogni ceppo utilizzando ben nutriti, misto fase vermi e consentire loro di crescere per 2 d a 20 ° C.
- Lavare 5 piastre contenenti worm con 15 mL di M9 e piscina in una provetta da 15 mL. Ripetere per tutti i 20 piastre di ogni ceppo.
- Centrifugare i vermi a 2.000 x g per 2 min, rimuovere il supernatante e sospendere in 2 mL di soluzione di M9.
- Preparare 10 mL di soluzione sbiancante con 13% di ipoclorito di sodio e idrossido di sodio di 4 M con un rapporto di 3:2 vol/vol.
Nota: Questa soluzione non richiede trattamento in autoclave. Entrambe le componenti e la soluzione risultante sono corrosivi e devono essere maneggiati con cura usando guanti di nitrile. Idrossido di sodio è leggermente corrosivo al vetro e devono essere conservato in contenitori di plastica. - Aggiungere 1 mL di soluzione sbiancante per ogni provetta da centrifuga e agitare energicamente per circa 3,5 min o fino a quando la cuticola è completamente sciolto.
- In condizioni di sterilità, diluire i campioni di M9 da 15 mL e centrifugare a 2.000 x g per 2 minuti rimuovere il surnatante e sospendere in 15 mL di soluzione di M9.
- Ripetere il passaggio 2,7 6 volte, fino a quando rimangono solo uova di verme, e la soluzione non ha un odore di cloro.
- Centrifugare i campioni a 2.000 x g per 2 min, rimuovere il supernatante e sospendere in 2 mL di soluzione di M9.
- In condizioni di sterilità, è possibile utilizzare una pipetta di vetro sterile per trasferire 2 mL di M9 contenenti uova in ciascun pozzetto di una piastra di coltura del tessuto 12-pozzetti e incubare a 20 ° C per un minimo di 16 h.
Nota: Utilizzare piastre separate per ogni sforzo per evitare la contaminazione incrociata. Il passo trasferimento dalle provette da centrifuga per il multi-pozzi aiuta a evitare il soffocamento di verme. - Trasferire i vermi schiudendosi durante la notte dalle piastre 12-pozzetti in provette per centrifuga da 15 mL. Prendere 3 gocce di 5 µ l di soluzione di verme e contare il numero di vermi presenti al primo stadio larvale (L1).
- Calcolare il numero di vermi per µ l di soluzione.
- Seme L1 vermi sulle piastre di Rich-NGM a 3.000 worms per piastra e consentire loro di crescere per 2 giorni a 20 ° C, fino a quando non raggiungono l'ultimo stadio larvale (L4).
3. generale WF-NTP protocollo
-
Aggiungere 2,2 mL di ogni farmaco composto alla concentrazione (tali come 25 o 10 mM per le droghe come squalamina18 e bexarotene15, rispettivamente) a FUDR 6 piastre e lasciare per asciugare in condizioni sterili per ciascuno desiderati ceppo di vite senza fine.
Nota: Questo passaggio viene ripetuto per ogni composto in esame, per ciascuna concentrazione e ogni solvente utilizzato.- Lavare i vermi fuori 5 piastre di Rich-NGM preparati al punto 2.13 con 15 mL di buffer di M9 e trasferire i vermi in una provetta da centrifuga.
- Centrifugare a 2.000 x g per 2 min, rimuovere il surnatante e sospendere in 3 mL di M9. Prendere 3 gocce di 5 µ l di soluzione M9 contengono vermi e contare il numero di vermi presenti nell'ultima fase larvale L4.
- Calcolare il numero di vermi per µ l di tampone di M9.
-
Le larve L4 seme 700 sulla 6 delle piastre FUDR secche contenenti un determinato composto, ripetere l'operazione per ogni concentrazione di ciascun composto e lasciare per asciugare in condizioni sterili.
- Incubare i vermi a 24 ° C da L4 per quei ceppi dove la paralisi di verme è indotta solo alzando la temperatura, come ad esempio il ceppo AD38. Contare il giorno successivo la fase larvale L4 come D0 dell'età adulta.
-
Accendere le luci del palcoscenico per il tracker.
- Pulire la fase di vetro con etanolo al 70% e garantire che nessun residuo visibile rimane, quindi rimuovere il copriobiettivo. Pulire la lente imaging utilizzando un aspirapolvere. Assicurarsi che la fotocamera sia collegata correttamente e installata e avviare la registrazione con il software di acquisizione immagine.
- Regolare le impostazioni della fotocamera per registrare 20 fotogrammi/s, con 16 mono registrazione configurazione dei parametri; Registra 1.200 fotogrammi, salvataggio in formato MJPEG a un tasso di compressione del 95%. Utilizzare un vuoto 9cm di Petri per assicurare che la fase è fissata all'altezza corretta e regolare se necessario.
Nota: Assicurarsi che i bordi della piastra sono visibili nella registrazione, in modo che l'algoritmo di 'tenere-morto' funzionare correttamente (Figura 1a). - In condizioni di sterilità, prendere 2 piastre precedentemente preparati a passo 3.2 con le stesse condizioni e 1 Mot piastra preparata al punto 1.2.4 di screening. Aggiungere 3 mL di soluzione M9 alla piastra Mot. Uso altri 2 mL di M9 per lavare 1/3 della superficie di 2 piatti preparati presso passo 3.2 sulla piastra di Mot.
- Posizionare la piastra di Mot contenente circa 5 mL della soluzione M9 e circa 600 vermi sul palco Tracking. Mettere a fuoco la fotocamera utilizzando un singolo verme e iniziare la registrazione.
- Quando la registrazione è completa, scartare la piastra Mot con i vermi; contrassegnare le piastre FUDR come una volta utilizzato e restituirlo nell'incubatore.
- Ripetere i passaggi da 3.3.3 a 3.3.5 per ogni condizione sperimentale.
- Ripetere i passaggi 3.3.3 a 3.3.6 per ogni punto del tempo nella durata della vita adulta.
Nota: Le procedure di screening possono essere effettuate in qualsiasi punto del adulto durata della vita del verme (ca. 3 settimane). Questi protocolli facilitano fino a 9 punti di tempo; gli autori raccomandano lo screening ogni 2 giorni a partire dal 1 ° giorno dell'età adulta.
4. Ottimizzazione discreta Dose studi
-
Preparare vermi ripetendo i punti da 3.1.1 a 3.1.3.
- Seme ca. 1000 L4 vermi sulle 5 piastre FUDR. Incubare le piastre a 24 ° C fino a D3 dell'età adulta, per esperimenti che coinvolgono AD38 worm.
-
Utilizzando una pipetta di vetro sterile, trasferimento i vermi preparato in condizioni sterili dalla piastra di una provetta da centrifuga da 15 mL, centrifugare a 2.000 x g per 2 minuti e rimuovere il surnatante.
- Sospendere la soluzione di vermi in 1 mL di tampone di M9. Trasferire i vermi in un tubo del microcentrifuge, centrifugare a 300 x g per 2 minuti ed eliminare il surnatante.
-
Per la trasduzione della proteina, aggiungere 40 µ l di reagente di consegna la transfezione e 20 µ l di proteina nativa alla concentrazione desiderata (in genere 40 µM) e incubare a temperatura ambiente per 30 min.
- In condizioni di sterilità, è possibile utilizzare una pipetta di vetro sterile per trasferire vermi dal punto 4.2.1 in un tubo del microcentrifuge contenenti proteine incapsulata per dare un volume totale di 1060 µ l. tubi posto orizzontalmente e agitare a 60 rpm in un 24 ° C in agitazione incubatore per 8 h.
-
In condizioni di sterilità, aggiungere 4 mL di soluzione di M9 ad una piastra di Mot e trasferire un tubo del microcentrifuge di vermi più droga sulla piastra di Mot.
- Impostare il tracker ripetendo i passaggi 3.3 alla 3.3.2.
- In condizioni di sterilità, aggiungere 4 mL di soluzione di M9 ad una piastra di Mot e trasferire un tubo del microcentrifuge di vermi più droga sulla piastra di Mot.
- Posizionare la piastra di Mot sul palco Tracking, mettere a fuoco la fotocamera su un verme individuo e iniziare la registrazione. Al termine, etichettare la piastra Mot e impostato su un lato.
- Ripetere i passaggi 4.4.1 e 4.4.3 per tutti i campioni.
- Utilizzando una pipetta di vetro, trasferire una provetta da centrifuga da 15 mL, vermi in condizioni sterili dalla piastra Mot e centrifugare a 2.000 x g per 2 minuti trasferimento surnatante, Rimuovi il pellet su un piatto FUDR e lasciare per asciugare in condizioni sterili.
- Ripetere il passaggio 4.4.5 per tutti i campioni.
- Incubare i vermi a 24 ° C fino a D6 dell'età adulta.
Nota: Sono possibili anche più le incubazioni dell'anticorpo. -
Aggiungere 3 mL di tampone M9 alla piastra Mot e usare 2 mL di soluzione di M9 per lavare tutti i vermi da un piatto FUDR sulla piastra di Mot.
- Impostare il tracker ripetendo i passaggi 3.3 alla 3.3.2.
- Posizionare la piastra di Mot sul palco Tracking, mettere a fuoco la fotocamera come necessario e iniziare la registrazione. Quando la registrazione è completa, scartare la piastra Mot o recuperarlo per ulteriori controlli se lo si desidera.
- Ripetere i passaggi da 4.6 a 4.6.2 per tutti i campioni.
5. analisi dei dati dei Video
-
Dopo aver acquisito il video, è necessario selezionare i parametri appropriati nel software GUI (Figura 2) per l'analisi dei dati.
- Caricare uno o più video tramite la funzione di navigazione . Selezionare una cartella di destinazione di output. Garantire che 600 a 1.200 fotogrammi vengono utilizzati per un'analisi di s 30.
Nota: Qualsiasi intervallo di fotogrammi possa essere analizzato. - Inserire un pixel per mm fattore di conversione, che sarà 0,029 per imaging una capsule di Petri 9 cm a piena risoluzione. Selezionare l'algoritmo di rilevamento 'Mantieni morto'.
Nota: Il fattore di conversione dipenderà il campo visivo utilizzato. Algoritmo di Z-trasformazione è utilizzabile anche come alternativa. - Immettere i parametri nella sezione posizionamento (Figura 2): Z utilizzare immagini = 100, imbottitura Z = 3, Std pixel = 54, soglia = 9, apertura = 1, chiusura = 2. Regolare i parametri di filtro a dimensione minima = 20, dimensione massima = 180, vite senza fine-come = 0,94.
- Ottimizzare i parametri di traiettorie di formatura : distanza massima spostare = 10; Lunghezza minima = 150, memoria = 10.
- Impostare i parametri di velocità e curve . 1.8 per soglia di Bend, 0 per minimo si piegae 150 per i telaiutilizzare per stimare la velocità.
- Sintonizzare le statistiche di verme morto. Utilizzare 5.0 per massimo battito al minuto e 1.0 per velocità massima.
- Scegliere la cartella di output. Impostare il numero di fotogrammi di Output a 50. Impostare dimensione del carattere su 10.
Nota: Facoltativamente, selezionare una o più regioni di interesse (ROI).
- Caricare uno o più video tramite la funzione di navigazione . Selezionare una cartella di destinazione di output. Garantire che 600 a 1.200 fotogrammi vengono utilizzati per un'analisi di s 30.
- Verificare i parametri utilizzando la funzione di esempio . Le immagini di esempio e controllare che i vermi sono visibili durante le 8 fasi di soglia (Figura 1).
- Utilizzare la funzione di avviare il processo .
-
Analizzare i file di testo risultato combinando i singoli risultati per l'intero dataset. Utilizzare la funzione Esporta nel tsv nella GUI.
Nota: Facoltativamente, metriche individuali dei vermi può anche essere considerato per gli studi di popolazione.- Analizzare i dati con un pacchetto di software statistico.
Risultati
La facilità di funzionamento, analisi multiparametrica e alta velocità di trasmissione del protocollo illustrato WF-NTP (figure 1 e 2) rende possibile determinare molto piccoli cambiamenti nel comportamento di vite senza fine in maniera molto accurata. La piattaforma di imaging si basa sulla misura opto-meccanica, e può essere assemblato utilizzando una telecamera monocromatica di 6 MP combinato con obiettivo ad alta risoluzione da 16 mm lunghezza focale per 1 ' sensore, illuminato con un 8 ' da 8 ' bianco retroilluminazione (vedere la Tabella materiali e anche fare riferimento a36 per ulteriori dettagli). Il software associato WF-NTP è scritto in Python ed è stato sviluppato per funzionare su piattaforme Windows. Funziona su un computer assemblato personalizzato con processore octa-core 3.00 GHz e 64 GB di memoria ad accesso casuale (RAM). Il software è stato progettato anche per parallelizzare il lavoro e l'analisi video basato sulla RAM e la CPU del computer; cioè, una macchina con una potenza di calcolo inferiore si tradurrà in meno video eseguite in parallelo. Attualmente stiamo utilizzando il programma di installazione è ottimizzato per eseguire fino a ca. 16 video in parallelo e possa completare un'analisi di 100 video ca. durante la notte. Inoltre, l'elevato livello di dettaglio di personalizzazione fornito nella GUI di WF-NTP permette grande controllo della qualità dell'analisi imaging. La GUI può essere utilizzata per caricare direttamente i grandi set di dati in parallelo o singoli video; fotogrammi specifici possono essere selezionati anche per dettagliate sotto-analisi, insieme ad un fattore di conversione pixel, che può essere utilizzato per stimare metriche comportamentale. Uno dei due algoritmi di rilevamento differenti (tenere morto e Z-trasformata) può essere scelto a seconda o meno l'utente vorrebbe considerare animali paralizzati nell'analisi. Il parametro di soglia può essere qualità di conseguenza sintonizzate con il video e sperimentale. L'apertura e la chiusura parametri consentono all'utente di rimuovere il rumore e implementare ulteriormente la funzionalità di soglia. L'algoritmo skeletonizing offre un metodo alternativo di analisi. L'oggetto dimensione cut-off (filtraggio) forniscono un ulteriore filtro per rumore di fondo e il parametro di vite senza fine-come consente all'utente di considerare worm solo gli oggetti con forma ellissoidale, quindi distinguere da altri oggetti che possono avere la stessa dimensione di pixel di i vermi. Dopo queste operazioni di soglia, tutte le regioni etichettate risultante possono essere identificate come vermi individuali e le posizioni di quelle regioni vengono quindi memorizzate per ogni fotogramma per successive analisi e rilevamento. L'eccentricità di ogni verme cingolati viene utilizzato per stimare le metriche di vite senza fine come la misura del verme piegatura (BPM) come funzione del tempo. Gli utenti possono anche selezionare il numero di fotogrammi utilizzati per mantenere un verme nella memoria il software dopo gli scontri, e il numero di pixel che un worm può spostarsi tra i frame possa essere regolato anche per distinguere gli animali dal rumore. L'opzione lunghezza minima del brano permette all'utente di eliminare i vermi che sono stati monitorati per solo pochi fotogrammi. Altri parametri chiave, come curve e velocità, consentono all'utente di selezionare il grado di curvatura necessaria per essere considerato come una curva di corpo e il numero di fotogrammi considerati necessari per stimare la velocità degli animali. Parametri di cut-off possono essere ulteriormente ottimizzati per l'inclusione di animali paralizzati. L'output è mostrato automaticamente nel file dei risultati. Questi valori sono considerati come limiti massimi per la valutazione della frazione di animali paralizzati. L'utente può anche selezionare una o più regioni di interesse. Questa funzionalità è particolarmente utile per analizzare le sottopopolazioni dei vermi e l'output viene ordinato automaticamente nei file di risultati. L'opzione di uscita permette all'utente di selezionare la cartella di output e il numero di tracking frame che saranno prodotta per esso. Vari set di strumento utilizzabile anche per un'ulteriore analisi dei dati, come lo strumento tracciato di trama che mostra verme singole tracce e lo strumento di archiviazione delle impronte digitali che consente all'utente di creare impronte digitali mappe.
Questa metodologia consente nuovi approcci da adottare, non solo per gli studi biologici di c. elegans , ma anche per scopi di ricerca medica e farmacologica, come screening ad alta resa di modificazioni genetiche e trattamenti farmacologici. Abbiamo illustrato questo potenziale descrivendo la caratterizzazione dei fenotipi per grandi studi di popolazione (N > 1000) dei vari modelli di verme di malattia neurodegenerative (frontotemporal (FTD) demenza39, malattia di Parkinson (MDP)7 , Morbo di Alzheimer (annuncio)16,40e la sclerosi laterale amiotrofica (ALS)19 (Figura 3a) e che caratterizzano gli effetti di potenziali molecole terapeutiche mediante modelli di vite senza fine del PD18 e AD 15,12 (Figura 3b). Due piccole molecole, squalamine18 e bexarotene15, sono stati amministrati a concentrazioni fino a 25 µM a PD (Figura 3b) e 10 µM a annuncio38 (Figura 3b) worm, rispettivamente. Entrambi i composti hanno mostrato chiari effetti dose-dipendenti sopra l'intervallo di concentrazioni testate. Abbiamo dimostrato che questa alta precisione delle misurazioni si ottiene aumentando il numero di vermi che possono essere analizzati rispetto ai metodi tradizionali (Figura 3C). Abbiamo illustrato l'importanza della dimensione del campione (Figura 3C) nello screening molecolare così come nella caratterizzazione dei ceppi mutanti. L'aumento della temperatura da 20 ° C porta a circa la metà dei vermi AD diventare paralizzati dopo 3 giorni di età adulta. Popolazioni di vite senza fine sono stati proiettati in condizioni diverse, ad esempio, quando vermi che sovraesprimono la forma 42-residuo del peptide amiloide-β (Aβ1-42) (annuncio vermi) sono stati esposti a variazioni minime di temperatura (Figura 3C, sinistra pannello), quando Aβ1-42 è stato espresso in tutti i neuroni (Figura 3C, pannello centrale), o quando AD worm sono stati esposti a bexarotene (Figura 3C, pannello di destra). Vermi inoltre sono stati analizzati da piccolo ROIs scelti a caso dal campo di vista completo dei video acquisiti con il WF-NTP (N < 50, giallo barre) mettendo in evidenza il confronto della motilità di questi vermi con la motilità media della popolazione intera verme (N < 1.000). In tutti i pannelli, la differenza misurata nel complesso verme popolazione sembra essere statisticamente significativa con p ≤ 0,0001 (*).
Il protocollo di WF-NTP descritto qui inoltre permette la registrazione simultanea di più parametri (Figura 1b) a sostenere, in maniera ottimale, sia di validazione interna e lo sviluppo di un'impronta completa di una vasta gamma di condizioni relativa ad un campione di controllo, consentendo per confronti significativi tra gli studi multipli. Questo approccio multi-parametrico include l'analisi simultanea di molteplici funzioni comportamentali, compresi curvatrice frequenza, velocità, tasso di paralisi, dimensioni, ampiezza curvatura e piegatura cilindrata36. Questo permette a migliaia di animali da monitorare in dettaglio e a una sensibilità molto alta e la significatività statistica e fornisce opportunità per gli studi di grandi popolazioni. Questa procedura di rilevamento ha anche il vantaggio di permettere studi di paralisi da eseguire in parallelo con altre misure comportamentali, una caratteristica fondamentale negli studi di screening molecolare.
I risultati finora raggiunti AD15,34,35 e scoperta della droga PD18 dimostrano l'importanza dell'acquisizione dei dati ampio campo di vista di aumentare notevolmente il numero di animali che possono essere monitorati in un singolo esperimento, diminuendo notevolmente gli errori sperimentali e migliorando notevolmente la validità statistica degli studi. Basato su questi risultati, possiamo anticipare che il protocollo di WF-NTP, che abbiamo fatto prontamente disponibili per la comunità36, estenderà in modo significativo l'uso di c. elegans.
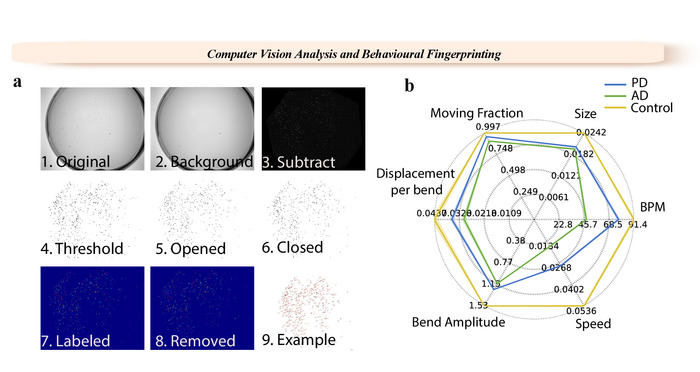
Figura 1: esempio di un'impronta digitale e punti di analisi di WF-NTP. (un) 1. Video originale. 2. background image. 3. contesto sottratto immagine. 4-6. passaggi di soglia. 7-9. etichettatura singolo di vermi. (b) fenotipi multipli sono segnalati con un'impronta digitale per i vermi di selvaggio-tipo e modelli della PD e annuncio a vite senza fine. Clicca qui per visualizzare una versione più grande di questa figura.
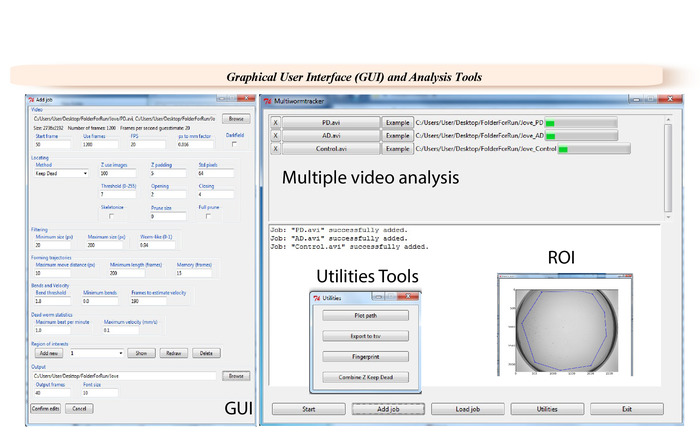
Figura 2: interfaccia utente grafica (GUI) di WF-NTP. Specifiche video e fotogrammi selezionati possono essere selezionati nella GUI per l'analisi, e un fattore di conversione pixel possono essere inserito, dopo di che l'analisi è condotta con uno dei due algoritmi di tracciatura fornito. È possibile selezionare il grado di curvatura necessaria per contare come una curva di corpo come pure il numero di fotogrammi necessari per stimare la velocità degli animali. Curve del corpo e soglie di velocità possono determinare le statistiche di verme paralizzato. Clicca qui per visualizzare una versione più grande di questa figura.
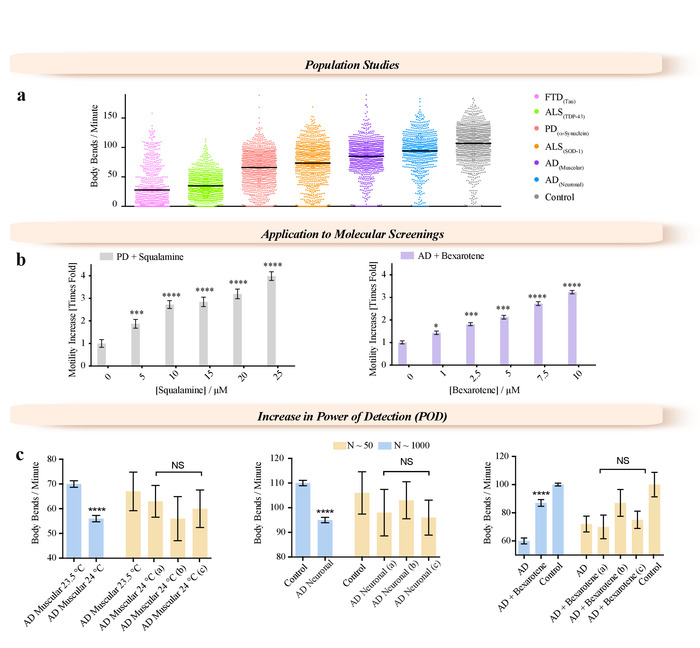
Figura 3: esempi di applicazioni abilitate per il metodo di WF-NTP. (a) applicazione di WF-NTP in grandi studi di popolazione (N > 1.000) delle misurazioni BPM per i modelli di una gamma di malattie neurodegenerative, tra cui FTD, PD, AD, c. elegans e ALS. (b) applicazione di WF-NTP nella scoperta della droga. (c) importanza gli studi di popolazione in sensibilità alla temperatura, l'efficacia dei farmaci e caratterizzazione del ceppo mutante. Fenotipi di sottopopolazioni N < 50 (barre gialle) vengono confrontati con quelli della popolazione intera verme (N < 1.000). Le barre di errore indicano l'errore standard della media (SEM). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
A causa della rapida espansione delle tecniche all'interno del campo di scienze ottiche, è ora possibile affrontare l'esigenza di metodi automatizzati negli studi di c. elegans in modo sostanzialmente nuovo. Di conseguenza, un numero di piattaforme20,41,42,43,44,45,46 di rilevamento digitale sono stati progettati e messi a disposizione sul ultimi anni al fine di sostituire il conteggio manuale dei parametri come la velocità di movimento, piegatura di frequenza, il tasso di paralisi, come pure le forme più complesse di comportamenti quali omega si trasforma e la misurazione di durata della vita. Più recenti piattaforme automatizzate hanno notevolmente migliorato la riproducibilità e sensibilità di c. elegans studi41 e fornito i dati di alta qualità su piccole coorti o anche singoli animali. Abbiamo deciso di estendere l'automazione dell'analisi del comportamento di vite senza fine per renderlo anche possibile valutare i fenotipi delle coorti di migliaia di animali in parallelo. Il vantaggio principale dell'approccio di studiare coorti di worm è che permette per la contabilità per l'elevata variabilità intrinseca del verme comportamento24 e per il fatto che gli studi di trattamento di droga spesso portano a sottili variazioni fenotipiche, che sono difficili da rilevare con sufficiente significatività statistica quando si utilizza un piccolo gruppo di animali. Un alto potere di rilevazione (POD) è infatti necessario per rilevare con fiducia alcuna variazione significativa nel comportamento e per limitare i risultati falsi positivi25.
Qui, abbiamo descritto una serie di protocolli basati su un metodo di screening automatizzato recentemente segnalati per c. elegans, il nematode ampio campo di vista Monitoraggio piattaforma (WF-NTP)36. Il protocollo descritto qui è diviso in 5 parti. Parti 1 e 2 descrivono la preparazione delle popolazioni di grande verme. Fasi critiche sono la sterilità delle condizioni di lavoro e preparazione di reagenti e piatti necessari per eseguire gli esperimenti. Notiamo che, a causa del maggiore throughput fornito dal presente protocollo rispetto ad altre metodologie36di screening, richiede anche una maggiore quantità di reagenti; Questo fattore deve essere considerato con attenzione nel disegno sperimentale. Notiamo anche che il passo d'imbianchimento è fondamentale e deve essere testato in anticipo come un gran numero di uova e larve sane sono necessari per eseguire questi esperimenti. Parte 3 del presente protocollo in dettaglio come consegnare i farmaci in tinta media e schermo verme popolazioni. Notiamo che questa parte del protocollo è fortemente dipenda dal numero di farmaci e concentrazioni di farmaco da testare da parte dell'utente in parallelo. La completa automazione della procedura di screening e acquisizione dati rapido spostare il passaggio limitante dall'osservazione del comportamento di preparazione dei reagenti e la crescita e la sincronizzazione delle popolazioni delle grande verme. I passaggi chiavi durante la proiezione del comportamento sono gli intervalli di tempo di registrazione e qualsiasi verme gestione passaggi (ad esempio, il trasferimento di vermi dalle piastre NGM per la piattaforma di tracking). Il protocollo descritto qui è un esempio progettato per schermare i vermi per fino a 9 giorni durante la durata della vita adulta; Tuttavia, questo protocollo può essere facilmente adattato a tutti i punti di tempo l'utente desideri, ad esempio, 18 giorni consecutivi36a schermo. Parte 4 viene illustrata l'applicazione del protocollo di fornire molecole proteiche (ad es., anticorpi e chaperoni molecolari) in c. eleganse Mostra come il protocollo illustrato nelle parti 1-3 può essere facilmente personalizzato, a seconda del desiderato applicazione. Dimostriamo come questa procedura può essere estesa non solo alla consegna di droga-come molecole, ma anche per l'amministrazione di chaperoni o anticorpi molecolare37. I primi quattro passaggi (parti) sono effettuati in condizioni sterili, se non diversamente specificato. Tutti i componenti liquidi dovrebbero essere sterilizzati in autoclave prima dell'uso e deve essere eseguita la procedura di incubazione a 70% di umidità relativa. Nella parte 5, descriviamo come utilizzare il pacchetto software fornito in combinazione con la fase di rilevamento. Questo software è stato progettato per l'analisi dei dati di WF-NTP relazionati al comportamento delle popolazioni di grande verme. Suggeriamo che l'utente segue le linee guida fornite in parte 5 per l'analisi dei dati; Tuttavia, questi parametri dipendono le caratteristiche specifiche dei video registrati (cioè, fps, campo di vista, risoluzione video, il numero di fotogrammi acquisiti). La funzione di esempio fornita nella GUI è stata progettata per facilitare la valutazione dei parametri corretti prima dell'analisi.
Queste serie di protocolli consentono di analizzare i fenotipi di grandi popolazioni di c. elegans (attualmente fino a 5.000 singoli vermi in parallelo) in modo efficace, ridurre artefatti a causa della variabilità intrinseca del comportamento degli animali , d'accordo con gli studi preliminari sul potere di rilevamento necessaria per raggiungere il significato statistico per gli studi di c. elegans25. La piattaforma utilizza un sistema di telecamere ad alta risoluzione, in grado di registrare immagini di un gran numero di animali ad alta velocità, registrando contemporaneamente più larghe coorti. Le elevate prestazioni e alta velocità di trasmissione del protocollo NTP WF rende possibile determinare molto piccoli cambiamenti nel comportamento di vite senza fine in maniera molto accurata. Pertanto, questa metodologia consente nuovi approcci vanno considerati non solo per lo studio della biologia di c. elegans, ma inoltre per ricerca medica e farmacologica, come ad esempio lo screening ad alta resa di modificazioni genetiche e droga trattamenti. Questa procedura ha anche il vantaggio di permettere studi di paralisi da eseguire in parallelo con altre misure comportamentali, una caratteristica fondamentale negli studi di screening molecolare.
I risultati finora raggiunti nei programmi di scoperta di droga AD15,34,35 e PD18 dimostrano l'importanza dell'acquisizione dei dati ampio campo di vista sostanzialmente aumentare il numero di animali che possono essere monitorati in un singolo esperimento, con una significativa diminuzione gli errori sperimentali e migliorando notevolmente la validità statistica degli studi. Mentre l'attuale approccio descritto in questo protocollo si è concentrata su come affrontare le sfide nel campo della scoperta di nuovi farmaci, speriamo che la metodologia sarà ampiamente adottata nella Comunità, e che l'applicazione sarà estesa al complesso genetico e studi comportamentali ed espandere il numero di fenotipi che sono attualmente rilevabili.
Divulgazioni
Gli autori dichiarano che non esistono senza conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto dal centro per malattie Misfolding (CMD). FAA è supportato da un Senior Research Fellowship award dal morbo di Alzheimer Society, UK (Grant numero 317, AS-SF-16-003). I ceppi di c. elegans sono stati ottenuti da Caenorhabditis elegans centro genetico (CGC).
Materiali
| Name | Company | Catalog Number | Comments |
| Consumable reagents | |||
| monobasic potassium phosphate | Sigma Aldrich | P0662 | |
| dibasic sodium phosphate | Sigma Aldrich | S3264 | |
| sodium chloride | Sigma Aldrich | 13422 | |
| magnesium sulphate | Sigma Aldrich | M7506 | |
| Agar | Sigma Aldrich | A1296 | |
| Difco casein digest | Scientific Laboratory Supplies | 211610 | |
| calcium chloride dihydrate | Sigma Aldrich | C3881 | |
| cholesterol | Acros | 110190250 | |
| absolute ethanol | Vwr | 20821.33 | |
| 5-Fluoro-2'-deoxyuridine 98% | Alfa Aesar | L16497.ME | |
| LB medium capsules | MP biomedicals | 3002-031 | |
| 13% sodium hypochlorite | Acros Organics | AC219255000 | |
| Sodium hydroxide | Fisher Chemical | S/4880/53 | |
| Name | Company | Catalog Number | Comments |
| Strains | |||
| E. coli strain OP50 | Supplied by CGC | Op50 | E coli strain |
| C. elegans strain wild type | Supplied by CGC | N2 | C. elegans strain |
| C. elegans strain AD | Supplied by CGC | GMC101 | C. elegans strain |
| C. elegans strain PD | Supplied by CGC | NL5901 | C. elegans strain |
| C. elegans strain ALS | Supplied by CGC | AM725 | C. elegans strain |
| C. elegans strain Tau | Supplied by CGC | BR5485 | C. elegans strain |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Tactrol 2 Autoclave | Priorclave | ||
| 9 cm sterile Petri dishes | Fisher Scientific | 11309283 | |
| 2 L erlenmeyer flasks | Scientific Laboratory Supplies | FLA4036 | |
| Nalgene 1 L Centrifuge pots | Fisher Scientific | 3120-1000 | |
| RC5C plus floor mounted centrifuge | Sorvall | 9900884 | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| Heraeus Multifuge X3R | Thermofisher scientific | 75004515 | |
| Inoculating Spreaders | Fisher Scientific | 11821741 | |
| M4 multipette | Eppendorf | 4982000012 | |
| P1000 pipette | Eppendorf Research Plus | ||
| P200 pipette | Eppendorf Research Plus | 3123000055 | |
| P10 pipette | Eppendorf Research Plus | 3123000020 | |
| 1,000 μL low retention tips | Sarstedt | ||
| 300 μL low retention tips | Sarstedt | 70.765.105 | |
| 10 μL low retention tips | Sarstedt | 70.1130.105 | |
| pipeteboy 2 | VWR | 612-0927 | |
| 50 mL serological pipette | Appleton Woods | CC117 | |
| 25 mL serological pipette | Appleton Woods | CC216 | |
| 10 mL serological pipette | Appleton Woods | CC214 | |
| glass pipette 270 mm | Fisherbrand | FB50255 | Camera for videos recording |
| pulsin | Polyplus Transfection | 501-04 | Transduction reagent |
| Multitron Standard shaking incubator | Infors HT | INFO28573 | |
| air duster | Office Depot | 1511631 | |
| Name | Company | Catalog Number | Comments |
| WF-NTP Tracker Components and Image Capture Software | |||
| 8'' by 8'' Backlight | Edmond Optics | 88-508 | Tracker component |
| 16 mm FL high resolution lens for 1'' sensor | Edmond Optics | 86-571 | Tracker component |
| 6 Mpx camera | Edmond Optics | 33540 | Tracker component |
| FlyCapture Software | PointGrey | SDK v2.12 | Image capture software |
| WF-NTP Software | Cambridge Enterprise | v1.0 | Image analysis software |
| Office Package | Microsoft | Office 365 | Statistical analysis software |
Riferimenti
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature Reviews Drug Discovery. 5 (5), 387-399 (2006).
- Nollen, E. A. A., et al. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the USA. 101 (17), 6403-6408 (2004).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the USA. 99 (16), 10417-10422 (2002).
- Van der Goot, A. T., et al. Delaying aging and the aging-associated decline in protein homeostasis by inhibition of tryptophan degradation. Proceedings of the National Academy of Sciencesof the USA. 109 (37), 14912-14917 (2012).
- Van Ham, T. J., et al. Identification of MOAG-4/SERF as a regulator of age-related proteotoxicity. Cell. 142 (4), 601-612 (2010).
- Van Ham, T. J., et al. C. elegans model identifies genetic modifiers of α-synuclein inclusion formation during aging. PLoS Genetics. 4 (3), e1000027(2008).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes & Development. 19 (13), 1544-1555 (2005).
- Sarin, S., Prabhu, S., O'Meara, M. M., Pe'er, I., Hobert, O. Caenorhabditis elegans mutant allele identification by whole-genome sequencing. Nature Methods. 5 (10), 865-867 (2008).
- Kim, Y., Sun, H. Functional genomic approach to identify novel genes involved in the regulation of oxidative stress resistance and animal lifespan. Aging Cell. 6 (4), 489-503 (2007).
- Dillin, A., et al. Rates of Behavior and Aging Specified by Mitochondrial Function During Development. Science. 298 (5602), 2398-2401 (2002).
- Lee, S. S., Kennedy, S., Tolonen, A. C., Ruvkun, G. DAF-16 target genes that control C. elegans life-span and metabolism. Science. 300 (5619), 644-647 (2003).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nature Reviews. Genetics. 3 (5), 356-369 (2002).
- Alavez, S., Vantipalli, M. C., Zucker, D. J. S., Klang, I. M., Lithgow, G. J. Amyloid-binding compounds maintain protein homeostasis during ageing and extend lifespan. Nature. 472 (7342), 226-229 (2012).
- Habchi, J., et al. An anticancer drug suppresses the primary nucleation reaction that initiates the production of the toxic A 42 aggregates linked with Alzheimers disease. Science Advances. 2 (2), e1501244(2016).
- Wu, Y., et al. Amyloid- -Induced pathological behaviors are suppressed by ginkgo biloba extract EGb 761 and ginkgolides in transgenic caenorhabditis elegans. Journal of Neuroscience. 26 (50), 13102-13113 (2006).
- Link, C. D. Expression of human beta-amyloid peptide in transgenic Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the USA. 92 (20), 9368-9372 (1995).
- Perni, M., et al. A natural product inhibits the initiation of a-synuclein aggregation and suppresses its toxicity. Proceedings of the National Academy of Sciencesof the USA. 114 (6), E1009-E1017 (2017).
- Gidalevitz, T., Krupinski, T., Garcia, S., Morimoto, R. I. Destabilizing protein polymorphisms in the genetic background direct phenotypic expression of mutant SOD1 toxicity. PLoS Genetics. 5 (3), e1000399(2009).
- Nussbaum-Krammer, C. I., Neto, M. F., Brielmann, R. M., Pedersen, J. S., Morimoto, R. I. Investigating the spreading and toxicity of prion-like proteins using the metazoan model organism C. elegans. Journal of visualized experiments. (95), 52321(2015).
- Machino, K., Link, C. D., Wang, S., Murakami, H., Murakami, S. A semi-automated motion-tracking analysis of locomotion speed in the C. elegans transgenics overexpressing beta-amyloid in neurons. Frontiers in Genetics. 5, 202(2014).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature Methods. 8 (7), 592-598 (2011).
- Van der Goot, A. T., Nollen, E. A. A. Tryptophan metabolism: entering the field of aging and age-related pathologies. Trends in Molecular Medicine. 19 (6), 336-344 (2013).
- Lublin, A. L., Link, C. D. Alzheimer's disease drug discovery: in vivo screening using Caenorhabditis elegans as a model for β-amyloid peptide-induced toxicity. Drug Discovery Today: Technologies. 10 (1), e115-e119 (2013).
- Petrascheck, M., Miller, D. L. Computational analysis of lifespan experiment reproducibility. Frontiers in genetics. 8 (JUN), 92(2017).
- Yemini, E., Jucikas, T., Grundy, L. J., Brown, A. E. X., Schafer, W. R. A database of Caenorhabditis elegans behavioral phenotypes. Nature Methods. 10 (9), 877-879 (2013).
- Wang, S. J., Wang, Z. -W. Track-a-worm, an open-source system for quantitative assessment of C. elegans locomotory and bending behavior. PLoS ONE. 8 (7), e69653(2013).
- Faumont, S., et al. An image-free opto-mechanical system for creating virtual environments and imaging neuronal activity in freely moving Caenorhabditis elegans. PLoS ONE. 6 (9), e24666(2011).
- Tsibidis, G. D., Tavernarakis, N. Nemo: a computational tool for analyzing nematode locomotion. BMC Neuroscience. 8, 86(2007).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nature Methods. 8 (2), 153-158 (2011).
- Leifer, A. M., Fang-Yen, C., Gershow, M., Alkema, M. J., Samuel, A. D. T. Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans. Nature Methods. 8 (2), 147-152 (2011).
- Restif, C., et al. CeleST: computer vision software for quantitative analysis of C. elegans swim behavior reveals novel features of locomotion. PLoS Computational Biology. 10 (7), e1003702(2014).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The Parallel Worm Tracker: a platform for measuring average speed and drug-induced paralysis in nematodes. PLoS ONE. 3 (5), e2208(2008).
- Habchi, J., et al. Systematic development of small molecules to inhibit specific microscopic steps of Aβ42 aggregation in Alzheimer's disease. Proceedings of the National Academy of Sciences of the USA. 114 (2), E200-E208 (2017).
- Aprile, F. A., et al. Selective targeting of primary and secondary nucleation pathways in Aβ42 aggregation using a rational antibody scanning method. Science Advances. 3 (6), e1700488(2017).
- Perni, M., et al. Massively parallel C. elegans tracking provides multi-dimensional fingerprints for phenotypic discovery. Journal of neuroscience. 306, 57-67 (2018).
- Perni, M., et al. Delivery of Native Proteins into C. elegans Using a Transduction Protocol Based on Lipid Vesicles. Scientific Reports. 7 (1), 7380(2017).
- McColl, G., et al. Utility of an improved model of amyloid-beta (Aβ₋) toxicity in Caenorhabditis elegans for drug screening for Alzheimer's disease. Molecular Neurodegeneration. 7 (1), 7380(2012).
- Fatouros, C., et al. Inhibition of tau aggregation in a novel Caenorhabditis elegans model of tauopathy mitigates proteotoxicity. Human Molecular Genetics. 21 (16), 3587-3603 (2012).
- Fay, D. S., Fluet, A., Johnson, C. J., Link, C. D. In vivo aggregation of β-Amyloid peptide variants. Journal of Neurochemistry. 71 (4), 1616-1625 (1998).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook: the Online Review of C. elegans Biology. , 1-17 (2012).
- Hardaker, L. A., Singer, E., Kerr, R., Zhou, G. T., Schafer, W. R. Serotonin modulates locomotory behavior and coordinates egg-laying and movement in Caenorhabditis elegans. Journal of Neurobiology. 49 (4), 303-313 (2001).
- Tsechpenakis, G., Bianchi, L., Metaxas, D., Driscoll, M. A novel computational approach for simultaneous tracking and feature extraction of C. elegans populations in fluid environments. IEEE Transactions on Bio-medical Engineering. 55 (5), 1539-1549 (2008).
- Buckingham, S. D., Sattelle, D. B. Fast, automated measurement of nematode swimming (thrashing) without morphometry. BMC Neuroscience. 10, 84(2009).
- Feng, Z., Cronin, C. J., Wittig, J. H., Sternberg, P. W., Schafer, W. R. An imaging system for standardized quantitative analysis of C. elegans behavior. BMC Bioinformatics. 5, 115(2004).
- Stroustrup, N., et al. The caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon