Method Article
Une Ivor Lewis Esophagectomy conçue pour minimiser les complications anastomotiques et optimiser la fonction De conduit
Dans cet article
Résumé
Nous décrivons une nouvelle technique anastomotique oesbiotique intrathoraccique conçue pour créer une anastomose de grand diamètre tout en maintenant simultanément l’approvisionnement en sang de conduit pour réduire au minimum l’incidence des fuites et des restrictions anastomotic. La construction et l’orientation du conduit d’estomac conçu pour optimiser la fonction supérieure gastro-intestinale de tractus est également décrite.
Résumé
Nous décrivons une nouvelle technique anastomotique oesophagogastique (« côte à côte : ligne de base sur ligne-sur-staple ligne », STS) pour les anastomoses intrathoraciques conçus pour créer une anastomose de grand diamètre tout en maintenant simultanément l’approvisionnement en sang de conduit. Cette technique vise à minimiser l’incidence des fuites et des restrictions anastomotiques, qui est une source fréquente de morbidité et de mortalité occasionnelle après l’œsophage. Nous analysons les résultats de cette technique stS sur 368 patients et avons comparé les résultats à 112 patients qui ont subi des anastomoses oesophagogastrices à l’aide d’un agrafeuse de bout en bout (EEE) sur un intervalle de temps de 8 ans à notre établissement.
La technique STS consiste à aligner l’oesophage intrathoracique restant sur la pointe de la ligne de base de courbe moindre d’un tube d’estomac, créé comme conduit de remplacement pour l’œsophage. Un dispositif linéaire d’alagage coupe et retame la ligne d’agrafe de conduit à la paroi latérale de l’œsophage d’une manière d’un côté à l’autre. Le lumen commun ouvert est alors fermé en deux couches de sutures.
Il y avait un total de 12 (3,8 %) fuites anastomotiques dans les patients qui ont subi l’anastomose oesophagogastrique stS. Deux des huit patients (25 %) ont eu des fuites anastomotiques après oesophagectomy pour l’achalasia de phase finale comparée à un taux de fuite de 2,8% (10/336) après oesophagectomy pour d’autres conditions. Dix-huit (5,2%) Les patients ont exigé une médiane de 2 dilatations pour la restriction anastomotic après l’anastomose de STS. Des alimentations supplémentaires de jejunostomy ont été exigées dans seulement 11.1% de patients subissant des anastomoses de STS suivant la décharge d’hôpital. En revanche, les patients subissant des anastomoses de l’EEE ont démontré des taux de fuite anastomotique et de restriction de 16,1 % et 14,3 % respectivement (p-lt;0.01). L’analyse de temps des études postopératoires de contraste suivant la technique de STS a typiquement démontré un conduit droit/uniforme de diamètre avec le contraste essentiellement complet vidant dans le petit intestin dans un délai de 3 minutes dans 88.4% de patients.
L’incidence des fuites et des restrictions anastomotic oesophagogastric étaient extrêmement basses utilisant cette technique anastomotic nouvelle. En outre, nous croyons que basé sur le temps et les analyses qualitatives des études de contraste postopératoire, cette technique semble optimiser la fonction postopératoire du tractus gastro-intestinal supérieur ; cependant, d’autres études comparatives sont nécessaires.
Introduction
Les fuites anastomotic oesophagogastricriques représentent une complication pas rare après l’œsophagtomie1. En outre, une fuite anastomotique a été associée à des résultats défavorables à long terme, y compris la réadmission à l’hôpital, la mortalité précoce, et parfois une mauvaise qualité de vie2,3,4. Une restriction anastomotique représente une complication à long terme, qui peut également être une conséquence d’une fuite anastomotique5. Les restrictions anastomotiques ont à la fois un impact négatif sur la qualité de vie et augmentent le coût des soins.
Comme plus de patients atteints de cancer de l’œsophage vivent plus longtemps à la suite de la détection endoscopique de l’adénocarcinome à un stade précoce et de la thérapie de chemoradiation d’induction pour les cancers plus localement avancés, l’optimisation de la fonction de conduit d’estomac devient également importante. La « fonction » gastrique de conduit s’appuie principalement sur la gravité pour le drainage. La construction et l’orientation des conduits gastriques peuvent affecter la fonction du tractus gastro-intestinal supérieur et, par conséquent, une mauvaise « fonction » de conduit peut être le résultat de problèmes techniques.
Nous avons utilisé une nouvelle technique de « ligne d’agrafe » (STS) pour l’anastomose oesophagogastique intrathoracique depuis 2009. Cette technique est conçue pour créer une anastomose de plus grand diamètre par rapport aux anastomoses faites avec des agrafeuses de bout en bout (EEE) tout en maintenant simultanément l’approvisionnement en sang de conduit pour réduire l’incidence des fuites et des restrictions anastomotic. Nous décrivons cette technique anastomotique nouvelle et en outre décrit la construction et l’orientation gastriques de conduit pour optimiser la fonction. Nous avons comparé les résultats de cette technique STS à des anastomoses réalisées avec des agrafeuses de l’EEE sur un intervalle de temps de 8 ans dans notre établissement.
Protocole
Cette étude a été approuvée par l’Université de l’Indiana-Purdue à Indianapolis comité d’examen institutionnel (1109006832). Ce procédé a été exécuté sur tous les patients exigeant la résection et la résection de l’oesophage intrathoracique distal pour des maladies malignes ou bénignes depuis 2009 à l’hôpital d’université d’Indiana.
1. Phase de préhèse-anesthésie
- Placer un cathéter épidural.
- Obtenez un accès artériel veineux et radial standard.
- Anesthésiquez et intubate à l’aide d’un tube endobronchial gauche double lumen pour la ventilation sélective de poumon pendant la phase thoracique de l’opération.
2. Phase initiale de laparotomie
- Effectuez une laparotomie médiane supérieure, y compris l’excision du processus zyphoid avec électrocautery. Placez un rétracteur de paroi abdominale auto-soutène pour l’exposition péritonéale de cavité.
- Effectuez une large manœuvre Kocher, qui mobilise tout le duodénum du rétroperitoneum. Cette manœuvre redresse non seulement le conduit gastrique, mais permet également de progresser des parties bien vascularisées du conduit de l’estomac au-dessus de l’arc des azygos.
- Placez temporairement une éponge laparotomie de taille standard sous le duodénum pour élever le conduit, qui est enlevé dans la phase finale de laparotomie.
- Diviser le ligament gastrocolique en cautérisant et en divisant les vaisseaux sanguins omentaux avec un dispositif énergétique standard. Évitez la manipulation des vaisseaux gastro-iploic droit en plaçant un tube nasogastric le long de la plus grande courbure, qui est utilisé comme une «poignée» rétractant l’estomac vers le haut.
- Marquez le péritoine circumferentiellement autour des crus diaphragmatiques avec l’électrocautery et placez temporairement un drain de Penrose autour de l’oesophage intraabdominal.
- Ligate les vaisseaux gastroepiploic gauches et gastriques courts avec une combinaison de suture et de clips chirurgicaux. Ensuite, divisez.
- Dans les cas de malignité, mobiliser les tissus lymphatiques coeliaques de l’aspect supérieur du pancréas, qui inclut la ligature et la division de l’artère et de la veine gastriques gauches.
- Effacer la courbe gastrique moindre de la graisse et des vaisseaux sanguins généralement 3 à 5 cm distal à la jonction gastroesophagienne avec endostaplers vasculaires. Dans les cas de malignité, planifiez les opérations pour réaliser l’estomac distal de tumeur libre de 3 à 5 cm et 5 à 7 cm des marges chirurgicales oesophagiques proximales. Comme les emplacements de tumeur s’étendent du milieu de l’œsophage au cardia gastrique, réalisant l’estomac distal et les marges oesophagiens proximales se traduit par des conduits de longueurs variables et des anastomos osophagogasiques intrathoraciques inférieurs ou supérieurs associés. Le site spécifique de la compensation de courbe moindre est donc quelque peu variable et dépendant de l’emplacement exact de tumeur.
- Cleave le fonds gastrique supérieur et le cardia du reste de l’estomac généralement en utilisant n’importe où de 3 à 5 60 mm agrafeuses endoscopiques commençant de la plus grande courbe gastrique dans la zone dégagée sur la courbe gastrique moindre.
- Création de conduit gastrique
- Débulk moins de graisse omentale autour des navires gastriques droit, ce qui permet au conduit d’être redressé ainsi que allongé. La division des navires gastriques droits qui s’insèrent dans la courbe inférieure à l’incisura permettra d’allonger davantage.
- Fixez l’estomac à trois points et fournissez une rétractation extérieure(figure 1).
- Créez un conduit de diamètre uniforme étroit (moyenne de 7-8 cm) avec un premier feu de l’agrafeuse de 100 mm, qui délivre deux rangées de agrafes de 4,8 mm visant juste en dessous de la ligne de base précédente. L’achèvement de la construction du conduit nécessite habituellement 2 ou 3 feux supplémentaires de l’endoscopique tri-stapler de 60 mm dans la zone défrichée sur la courbe gastrique moindre. Dans les cas de malignité, envoyez le défaut d’estomac comme « marge d’estomac distale » pour l’analyse pathologique congelée de section.
- Inspectez la pointe du conduit. Dans un délai de 3 à 5 minutes, le saignement rouge vif de punctate est habituellement vu par la ligne inférieure de base de courbe représentant la perfusion de bon conduit. Si aucun suintement rouge vif de punctate n’est présent, coupez légèrement la pointe de conduit avec un autre agrafeuse de 100 mm jusqu’à ce que le saignement de punctate soit vu. Les triathatistes ne sont pas utilisés pour le découpage du conduit, car il peut être difficile de couper et de réacupiller la pointe du conduit pendant l’anastomose intrathoracique.
- Effectuer une pyloroplastie Heineke-Mikulicz standard afin d’assurer une bonne vidange de conduit.
- Initialement estimer la hauteur dans la poitrine du conduit atteindra en étirant confortablement le conduit vers le cou sans tension excessive.
- Ouvrez la bonne pleura à travers les crus diaphragmatiques. Placez la pointe du conduit dans la poitrine droite en gardant la ligne de base de courbe inférieure orientée vers la droite.
- Fermez temporairement l’abdomen avec quelques sutures fascial interrompues et des agrafes cutanées.
3. Phase thoracique
- Placez le patient dans la position latérale gauche de decubitus.
- Effectuez un muscle serratus épargnant la thoracotomie droite à travers le5ème espace intercostal. Répartir le muscle intercostal sous l’incision dans un rayon de 3 à 5 cm du corps vertébral postérieurement et le sternum antérieurement, permettant un mouvement supplémentaire des 5e et 6e côtes avec un risque minimal de fracture ou d’ecchymoses.
- Accisez l’arc de la veine des azygos et divisez le ligament pulmonaire inférieur. Dans les cas de malignité, exécutez en dissection en bloc en mobilisant les deux tiers distal de l’oesophage intrathoracic avec tous les tissus mous environnants du péricarde antérieur aux vaisseaux sanguins postérieurement oesophagien d’aorta. Lymphatiques soigneusement occlude avec des clips chirurgicaux avant la division pendant cette dissection.
- Livrez le conduit dans la poitrine droite jusqu’à ce qu’il n’y ait pas de redondance, limitant la tension sur les pédicles vasculaires gastroepiploic droit et gastro-ipiploic droit pour déterminer l’étendue supérieure de la dissection oesophagienne nécessaire.
- Au niveau de la carina trachéale, disséquez la paroi oesophagienne des tissus mous mediastinal environnants supérieure à un niveau où la pointe du conduit atteint sans tension, qui est habituellement supérieure de 3 à 5 cm à la carina. Encore une fois cependant, donné des emplacements variables des tumeurs et la longueur des conduits d’estomac créés pendant la phase abdominale, établir des anastomoses plus bas près de la carina pour les tumeurs gastriques de cardia et plus haut à l’entrée thoracique pour des tumeurs impliquant l’oesophage intrathoracique moyen.
- Création de l’anastomose oesophagogastique
- Alignez l’aspect latéral gauche moyen du tiers supérieur de l’œsophage intrathoracic sur la ligne d’agrafe de courbe inférieure.
- Placer quatre sutures collantes à environ 2 à 3 cm l’une de l’autre afin de maintenir l’alignement(figure 2).
- Transect l’œsophage 1 cm distal à l’ensemble inférieur de sutures collantes. Dans les cas de malignité, envoyez un anneau d’oesophage à ce niveau comme « marge oesophagienne proximale » pour l’examen pathologique congelé de section avant de procéder.
- Créez une ouverture correspondante de 1 à 2 cm dans le conduit à travers la ligne de base de base de courbe inférieure.
- Placez les sutures interrompues dans les lumen communs, incorporant le conduit adjacent et les parois oesophagienne commençant au milieu à travers la ligne de base de courbe inférieure et progressant de chaque côté(figure 3).
- Placer l’enclume étroite d’un agrafe endoscopique de 45 mm avec une hauteur de base de 4,1 mm dans le lumen oesophagien et la grande enclume dans le conduit. Pour optimiser la longueur de la communication côte à côte entre l’œsophage et le conduit, couper 5 mm de la pointe plastique distale de la cartouche de stapler avec une scie oscillante.
- Incendier l’agrafeuse, qui coupe et restaples la ligne de base de courbe moindre (figure 4). La longueur de l’extrémité coupée de l’œsophage est généralement un peu plus longue que le bord du conduit gastrique, afin d’enlever une ellipse du conduit sur la ligne de base de courbe moindre plutôt que d’étendre le loyer latéralement, en préservant l’approvisionnement en sang collatéral(figure 4 encart).
- Fermez les lumen communs ouverts dans deux couches de sutures commençant par une couche intérieure de suture de polyglactine interrompue inversée 3-0 suivie d’une deuxième couche de soie interrompue 3-0 à l’aide d’une technique Lembert(figure 5).
- Sur coudre l’aspect supérieur de la ligne de base de conduit de courbe moindre avec des sutures de soie interrompues 3-0 dans une mode Lembert s’étendant inférieurement, jusqu’à ce que les récipients gastriques droit soient rencontrés.
- Demandez à l’anesthésiste de placer un tube nasogastric dans le conduit au niveau des crus par palpation.
- Pour les anastomoses créées près de l’entrée thoracique, utilisez un rabat pleural pour sceller l’anastomose dans le mediastinum postérieur. Pour les anastomoses dans l’aspect moyen du mediastinum postérieur, mobilisez un pat de graisse péricardique du mediastinum antérieur et lâchement enveloppé pour couvrir l’anastomose oesophagogastique(figure 6 et figure 7).
- Insérez et placez deux tubes thoraciques de 28 Français dans l’hémithorax droit, l’un antérieur et l’autre postérieur, à côté, mais pas attenant le conduit. Fermez l’incision de thoracotomie.
4. Re-laparotomie : phase « double flip »
- Retournez le patient à la position de supine et rouvrez l’incision de laparotomie de ligne moyenne.
- Inspectez la graisse gastroepiploïque droite et poussez soigneusement n’importe quel excès de graisse vers le haut par les crus de diaphragme gauche dans la poitrine.
- Fixez la graisse gastroepiploïque droite et le conduit aux crus diaphragmatiques avec des sutures de soie interrompues 2-0(figure 8). Placez un tube de jejunostomie d’alimentation dans certains patients, principalement chez les patients âgés ou les patients présentant des déficits nutritionnels préopératoires.
- Fermez formellement l’incision de laparotomie de ligne médiane.
- Gardez les patients intubés le soir de la chirurgie avec l’extubation prévue le lendemain matin.
- Fournir le contrôle de la douleur avec des cathéters épiduraux placés juste avant l’induction anesthésique pendant les 3 à 4 premiers jours, qui est complétée par des stupéfiants intraveineux.
- Obtenez la série gastro-intestinale supérieure de contraste 5 à 7 jours postopératoirement pour évaluer pour l’intégrité anastomotic.
- Si aucune fuite anastomotique n’est identifiée, retirez le tube nasogastric.
- Instruire les patients à passer à un régime régulier dans 2 à 3 semaines après la sortie comme toléré.
Résultats
De 2009 à 2017, un total de 368 patients ont été identifiés qui ont subi une anastomose oesophrogastique intrathoracique STS et de ces 12 (3,8%) avait des fuites anastomotiques. Cinq de ces patients ont démontré des fuites de catégorie I/II et n’ont eu besoin d’aucune intervention. Six patients et un patient ont respectivement éprouvé des fuites de grade III et iv exigeant l’endoscopique stenting et/ou l’intervention chirurgicale2. Un taux de fuite de 25% (2/8) a été observé après l’œsophagtomie pour l’achalasia de phase finale comparée à un taux de fuite de 2,8% (10/336) où l’oesophagectomy a été exécuté pour d’autres conditions. Il y en avait 4 (1,1 %) Patient qui est mort postopératoirement, aucun de qui n’a eu une complication anastomotic. Parmi les patients atteints de SST, 18 (5,0 %) besoin d’une médiane de 2 dilatations pour les restrictions anastomotic symptomatiques. Des alimentations supplémentaires de jejunostomy ont été exigées dans seulement 11.1% de ces patients suivant le décharge d’hôpital. En revanche, sur les 112 patients identifiés qui ont subi l’anastomose mécanique thoracoscopique de bout en bout (EEA) au cours de ce même intervalle de temps, 16,1 % et 14,3 % ont démontré des fuites anastomotiques et des restrictions symptomatiques respectivement (p-lt;0,01) malgré tous (100 %) de ces patients étant maintenus sur un régime limité avec des alimentations supplémentaires de tube de jejunostomy pendant au moins un mois suivant la chirurgie (tableau 1). Les données démographiques et les comorbidités des groupes STS et EEE étaient statistiquement similaires; cependant, il y avait une tendance vers plus de maladies cardiaques dans la cohorte stS (tableau 2). L’analyse temporelle des études de contraste postopératoire dans les 208 premiers patients qui ont subi une anastomose STS ont typiquement démontré un conduit droit/uniforme de diamètre avec essentiellement complet (-gt;95%) contraste se vidant dans les petites entrailles dans un délai de 3 min en 184 (88,4 %) Patients. Les 11,6 % restants étudiés avaient presque terminés (-95 %) contraste se vidant dans les petites entrailles dans les 5 minutes. Aucun patient étudié n’a eu le temps de transit de contraste au-delà de 5 minutes.

Figure 1 : Création du conduit de l’estomac. L’estomac est fixé à trois points, qui sont rétractés vers l’extérieur. Un conduit de diamètre relativement uniforme est créé avec des agrafeuses visant juste inférieure à la ligne de base précédente sur la courbe moindre. (Tiré avec la permission11.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
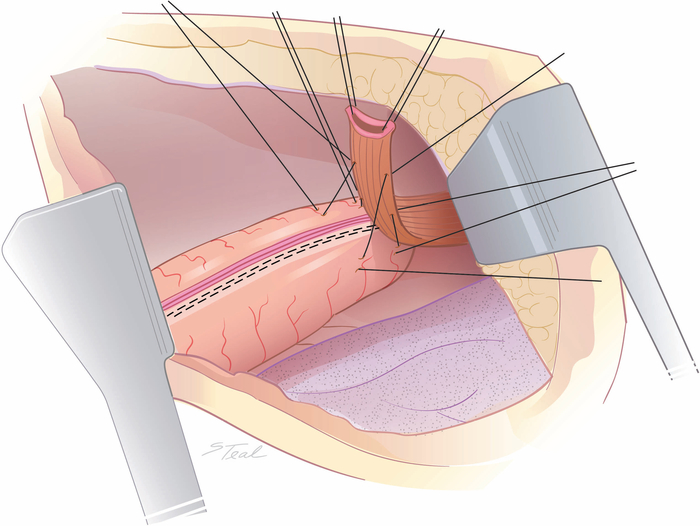
Figure 2 : Alignement de l’œsophage sur le conduit de l’estomac. L’aspect latéral gauche moyen du tiers supérieur de l’œsophage intrathoracic est aligné au-dessus de la ligne d’agrafe de courbe inférieure à la pointe du conduit avec 4 sutures initiales de tacking approximativement 2 à 3 cm d’intervalle. (Tiré avec la permission11.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3 : Préparation d’une communication latérale entre l’œsophage et le conduit de l’estomac. Un loyer de 1 à 2 cm est effectué dans le conduit de l’estomac à travers la ligne de base de courbe moindre. Des sutures collantes sont placées entre le conduit adjacent et les parois oesophagienne commençant au milieu par la ligne de base de courbe moindre, puis deux sutures de chaque côté. (Tiré avec la permission11.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
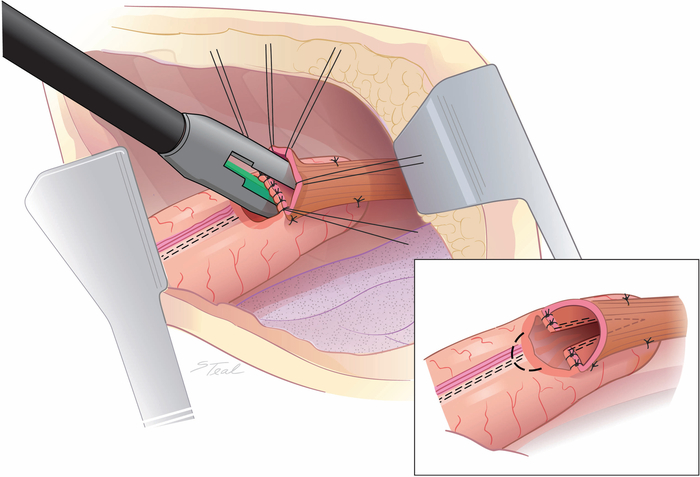
Figure 4 : Création d’une communication latérale entre l’œsophage et le conduit de l’estomac. Un agrafeuse endoscopique de 45 mm est tiré en coupant à travers et retaapling la ligne de base de courbe moindre. Typiquement, seulement 2/3rds de la longueur de l’agrafeuse est utilisé. Une ellipse de conduit est enlevée au-dessus de la ligne de base de courbe inférieure (ligne pointillée) plutôt que d’étendre le loyer latéralement pour égaliser la longueur de l’extrémité coupée de l’œsophage et de la gastrotomie. (encart) (Tiré avec la permission11.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5 : Fermeture des lumen communs ouverts. Les lumen communs ouverts sont fermés à la main en deux couches de sutures commençant par des sutures absorbables interrompues inversées. La première couche de suture est imbricée par une deuxième couche de sutures en soie Lembert plaçant la suture de l’estomac de quelques mm inférieure à la première couche de sutures. (encart) (Tiré avec la permission11.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
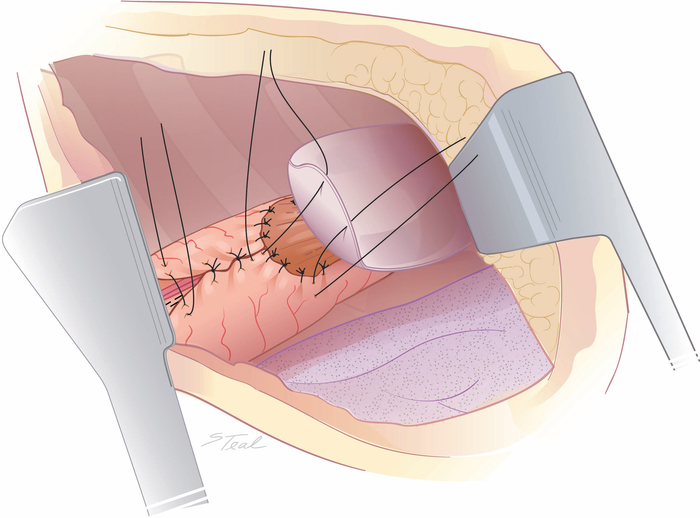
Figure 6 : Sur la couture de la ligne inférieure de base de courbe et de la contretraite pleurale de l’anastomose. L’aspect supérieur de la ligne de base de conduit de courbe inférieure peut être sur cousu à ce point avec des sutures de soie interrompues inférieurement jusqu’à ce que les récipients gastriques droit soient rencontrés. Pour les anastomoses établies près de l’entrée thoracique, un rabat de pleura mobilisé est cloué au conduit de l’estomac pour contenir de petites fuites anastomiques. (Tiré avec la permission11.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
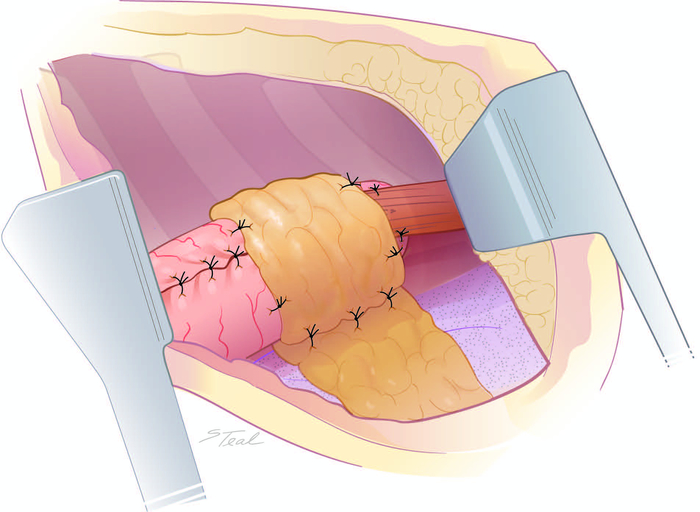
Figure 7 : La contretraite vascularisée des tissus mous de l’anastomose. La graisse péricardique est vaguement enroulée autour d’anastomoses créées dans l’aspect moyen du mediastinum postérieur pour contenir de petites zones de déhiscence anastomotique. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
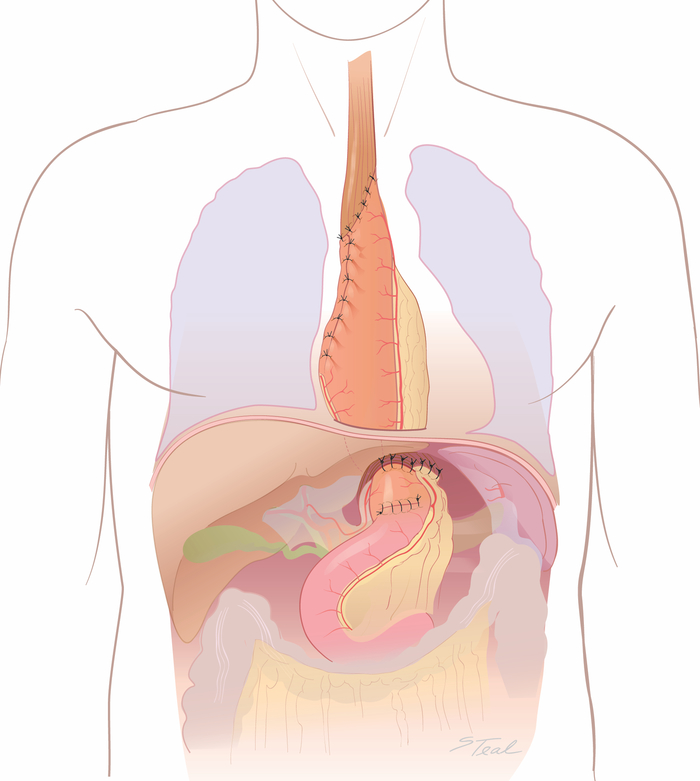
Figure 8 : Phase finale de laparotomie (« double flip »). L’incision de laparotomie est rouverte. La graisse gastro-ipiploic droit et conduit soigneusement attaché aux crus avec des sutures de soie 2-0. (Tiré avec la permission11.) S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| STS (N-368) | EEE (N-112) | |
| Fuites anastomotiques | 3.8%* | 16.1% |
| Restriction anastomotique | 5.2%* | 14.3% |
| Utilisation post-Op J-Tube | 11.0%* | 100.0% |
Tableau 1. Les fuites/restrictions anastomotiques et l’utilisation de la jejunostomie d’alimentation postopératoire (Post Op J-Tube Use) à la suite d’une sortie d’hôpital comparant les patients subissant des STS ouverts et des anastomos ésophagogatricaux thoraciques de l’EEE utilisant une approche Ivor Lewis réalisée au Simon Cancer Center de l’Université de l’Indiana de 2009 à 2017. (valeur p 'lt; 0.01, chi-square)
| STS (n 278) | EEE (n 82) | Valeur P | |
| Age at Diagnosis (yrs) | 60,3 à 11,4 (23-84) | 60,6 à 9,0 (38-80) | 0.80 |
| Sexe | |||
| Mâle | 228 (82.0%) | 69 (84.1%) | 0.66 |
| Femelle | 50 (18.0%) | 13 (15.9%) | |
| Cormorbidité | |||
| Cardiaque | 114 (41.0%) | 24 (29.3%) | 0.06 |
| Diabète Mellitus | 70 (25.2%) | 19 (23.2%) | 0.71 |
| Bpco | 32 (11.5%) | 12 (14.6% | 0.45 |
| Histologie | |||
| Adénocarcinome | 237 (85.3%) | 74 (90.2%) | 0.25 |
| Autres diagnostics | 41 (14.7%) | 8 (9.8%) | |
| Thérapie néoadjuvante | 200 (71.9%) | 59 (71.9%) | 0.99 |
Tableau 2 : Comparaison démographique et comorbidité ouverte STS et anastomoses thoracoscopiques de l’EEE à l’aide d’une approche Ivor Lewis réalisée au Centre de cancérologie Simon de l’Université de l’Indiana de 2009 à 2015. Déviation moyenne et standard avec la plage donnée pour les variables continues. Valeurs P pour les variables continues générées par le t-test de l’étudiant et le chi-square pour les variables discrètes.
Discussion
L’œsophagectomie représente une intervention chirurgicale très étendue. La qualité de vie défavorable à long terme a été liée aux patients souffrant de complications postopératoires, y compris les fuites anastomotiques3. Les facteurs de risque d’une fuite anastomotique comprennent principalement la création d’une anastomose avec un approvisionnement en sang médiocre. Une fuite anastomotique représente non seulement une source significative de morbidité postopératoire, mais peut également avoir comme conséquence généralement la restriction. Une restriction peut également être le résultat de problèmes techniques, y compris l’exécution d’une anastomose de petit diamètre. En plus d’avoir un impact sur la qualité de vie, les restrictions ajoutent aux coûts médicaux globaux lorsque la dilatation est nécessaire5. L’exécution précise de plusieurs étapes est de la plus haute importance pour minimiser les complications ainsi que d’atteindre de bons résultats fonctionnels oncologiques et gastro-intestinaux supérieurs.
L’anastomose oesophagogastique peut être accomplie par plusieurs méthodes, y compris les techniques cousues à la main, eEE, et les techniques linéaires d’agrafeuse représentant la majorité. Un rapport de la Société des chirurgiens thoraciques General Thoracic Database a cité un taux global de fuite de 9,3% chez les patients subissant des anastomoses oesophagogastriques intrathoraciques6. Alors que la mortalité postopératoire due à la fuite anastomotique semble diminuer, les taux de restriction ultérieures restent élevés, allant entre 10 et 56%7. Collard et Orringer ont décrit une technique linéaire d’agrafeuse pour créer une anastomose œsophagogastrique cervicale d’un côté à l’autre8,9. L’ouverture triangulée postérieure formée par l’agrafeuse linéaire a été démontrée pour avoir comme conséquence un faible taux de fuite aussi bien que la résistance à la restriction. Une étude rétrospective de la clinique mayo a rapporté un incident de 5,6% de la fuite anastomotique intrathoracique dans 177 patients où une technique agrafée linéaire a été employée contre un taux de fuite de 8,3% dans 48 patients qui ont subi une anastomose agrafée de l’EEE. Bien que cette différence n’ait pas atteint la différence statistique, la probabilité d’un an pour la restriction était de 32% après l’anastomose de l’EEE par rapport à seulement 8,6% avec les techniques agrafes linéaires, qui était significative5. Wang et ses collègues ont effectué un essai clinique prospectif impliquant 155 patients qui ont été randomisés dans l’une des trois méthodes anastomotic oesophagogastriciques10. Impressionnant, aucune restriction postopératoire ne s’est développée dans les patients subissant une technique linéaire d’agrafeuse comparée à 9.6% et 19.1% dans les cas cousus et circulaires agrafés circulaires respectivement, qui était statistiquement significatif. Des études antérieures impliquant des anastomoses linéatiques linéaires ont utilisé la paroi antérieure du conduit d’estomac pour le site anastomotic. Cette approche peut conduire à une bande ischémique de conduit entre la ligne de base de courbe moindre et l’anastomose prédisposant à fuir. Nouveau à notre technique, l’approvisionnement en sang collatéral à la pointe du conduit d’estomac est préservé en coupant et en réacupant la ligne de base de courbe inférieure.
L’étude est limite. Tout d’abord, il s’agit d’une analyse rétrospective. En dépit de la nature rétrospective cependant, nous avons employé cette approche de STS uniformément dans tous les patients subissant la chirurgie pour la pathologie mi-oesophagienne à proximale d’estomac au-dessus de l’intervalle d’étude comme « intention de traiter » comprenant des patients stables qui ont soutenu des perforations oesophagienne pendant la dilatation pour la restriction où la réparation n’était pas possible. Commun à n’importe quelle technique anastomotic intrathoracic d’un côté à l’autre est la nécessité de disséquer 3 à 4 cm supplémentaires d’œsophage proximale, diminuant potentiellement la longueur de la marge oesophagienne chirurgicale dans les cas de malignité et ayant également potentiellement pour résultat un certain degré de dévascularisation oesophagienne. Pour éviter la dévascularisation, un point critique est de ne pas disséquer l’œsophage intrathoracique plus largement vers le cou que la pointe du conduit d’estomac atteindra sans tension. Nous spéculons que le taux de fuite plus élevé observé à l’aide de cette technique pour les patients atteints d’achalasia en phase terminale peut être lié à une dévascularisation ultérieure d’un mur oesophagien épaississant après la mobilisation pour effectuer une anastomose STS où l’approvisionnement en sang préexistant peut être pauvre. La dilatation oesophagienne fréquemment vue dans les cas d’achalasia rend la couture à la main le lumen commun ouvert très difficile, qui peut également être un facteur. Sur la base de cette expérience, nous croyons maintenant que l’achalasia est une contre-indication pour effectuer des anastomoses intrathoraciques STS. Il est à noter que pour les cancers longs ou plus centraux où une anastomose oesophagogastique doit être créée près de l’entrée thoracique pour obtenir une marge oesophagienne proximale adéquate, nous avons utilisé une communication initiale un peu plus courte d’un côté à l’autre sans utiliser toute la longueur de l’GIA de 45 mm qui a cependant le potentiel d’être plus enclin à la formation de restriction.
Contrairement à l’œsophage, l’estomac est un conduit passif, dépendant de la gravité pour le drainage. Plusieurs variables, y compris le diamètre et la longueur du conduit ainsi que l’orientation du conduit, peuvent donc avoir un impact significatif sur la fonction du tractus gastro-intestinal supérieur. La nourriture ingérée a le potentiel de raccrocher dans trois endroits : l’anastomose oesophagogastique, le corps de l’estomac, et la sortie gastrique. Une mauvaise fonction de conduit peut être le résultat de problèmes techniques dans l’un de ces trois domaines. Une mauvaise vidange de conduit peut paradoxalement causer plus de « reflux », non seulement un impact négatif sur la qualité de vie, mais aussi parfois aboutissant à l’aspiration. Les approches « mini-invasives » (laparoscopiques/thoracoscopiques), qui utilisent un agrafeuse de l’EEE pour les anastomoses oesophagogastric, bien qu’elles représentent toujours la minorité des cas d’œsophagtomie exécutées, sont devenues de plus en plus populaires. Nous croyons cependant que notre technique ouverte telle que décrite permet non seulement aux créations d’anastomose oesophagogastique STS précise de réduire les taux de restriction, mais optimise en outre la construction et l’orientation des conduits avec un conduit d’estomac non redondant, y compris la pyloroplastie avec une tendance minimale pour les matériaux alimentaires ingérés à raccrocher dans ces zones par rapport aux approches thoracoscopiques. Les temps de transit contrastés mesurés de la bouche aux petites entrailles sur les études postopératoires de routine soutiendraient la fonction d’excellent conduit avec notre technique, cependant des études comparatives utilisant d’autres techniques sont nécessaires. Nos observations appuieraient des symptômes de « dumping » minimes et autolimitatifs chez la grande majorité des patients atteints de SST, mais des évaluations précises de la qualité de vie sont en cours. Enfin, avec l’approche de thoracotomy décrite, nous avons observé peu de différence en ce qui concerne l’inconfort postopératoire aigu et à long terme comparé aux patients subissant une approche thoracoscopic à notre établissement.
En résumé, nous croyons que cette nouvelle technique de STS peut réduire de manière significative la morbidité et la mortalité occasionnelle des complications anastomotic oesophagogastrices suivant l’oesophagectomy. La construction et l’orientation de conduit comme décrit optimisent en outre la fonction supérieure gastro-intestinale de tractus. Enfin, cette technique est facilement adaptée et reproductible.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| 100 mm Linear Stapler (ILA Autosuture, “green” cartridge, 4.8 mm staple height) | Covidien | 3973 | Surgical Stapler |
| 3-0 silk (Perma hand black, 8x18", SH needle, 1/2 circle 26 mm, C013) | Ethicon | C013D | Suture Material |
| 3-0 silk (Perma hand black, 8x30", SH needle, 1/2 circle 26 mm, C017) | Ethicon | C017D | Suture Material |
| 3-0 vicryl (Coated vicryl violet, 8x18", SH needle, 1/2 circle 26 mm, J774) | Ethicon | VCP774D | Suture Material |
| 3-0 vicryl (Coated vicryl violet, 8x27", SH needle, 1/2 circle 26 mm, J784) | Ethicon | VCP784D | Suture Material |
| 45 mm Endoscopic Stapler (Flex “green” cartridge, 4.1 mm staple height) | Ethicon | SC45A | Surgical Stapler |
| 60 mm Endoscopic Tristapler | Ethicon | SC60A | Surgical Stapler |
| Flex “green” cartridge, 4.1 mm staple height | Ethicon | GST45G | Surgical Stapler |
| Flex 60, “black” cartridge (for 60 mm Endoscopic Tristapler) | Ethicon | GST60T | Surgical Stapler |
| Foceps Debakey 7.75 inch | Jarit | 320-101 | Surgical Instrument |
| Forceps Debakey 12 inch | Jarit | 320-103 | Surgical Instrument |
| Forceps Debakey 9.5 inch | Jarit | 320-102 | Surgical Instrument |
| Needle Holder Mayo-Hegar 10 inch | Codman | 36-2019 | Surgical Instrument |
| Needle Holder Mayo-Hegar 7 inch | Codman | 36-2017 | Surgical Instrument |
| Needle Holder Mayo-Hegar 8 inch | Codman | 36-2018 | Surgical Instrument |
| Needle Holder Ryder 10 inch | Codman | 36-3005 | Surgical Instrument |
| Needle Holder Ryder 9 inch | Jarit | 121-164 | Surgical Instrument |
Références
- Cassivi, S. D. Leaks, strictures, and necrosis: a review of anastomotic complications following esophagectomy. Seminars in Thoracic and Cardiovascular Surgery. 16, 124-132 (2004).
- Low, D. E., et al. International consensus on standardization of data collection for complications associated with esophagectomy: Esophagectomy complication consensus group (ECCG). Annals of Surgery. 262, 286-294 (2015).
- Derogar, M., Orsini, N., Sadr-Azodi, O., Langergren, P. Influence of major postoperative complications on health-related quality of life among long-term survivors of esophageal cancer surgery. Journal of Clinical Oncology. 30, 1615-1619 (2012).
- Kofoed, S. C., et al. Intrathoracic anastomotic leakage after gastroesophageal cancer resection is associated with increased risk of recurrence. Journal of Thoracic and Cardiovascular Surgery. 150, 42-48 (2015).
- Price, T. N., et al. A comprehensive review of anastomotic technique in 432 Esophagectomies. Annals of Thoracic Surgery. 95, 1154-1160 (2013).
- Kassis, E. S., et al. Predictors of anastomotic leak after esophagectomy: an analysis of the Society of Thoracic Surgeons General Thoracic Database. Annals of Thoracic Surgery. 96, 1919-1926 (2013).
- Yuan, Y., Wang, K. N., Chen, L. Q. Esophageal anastomosis. Diseases of the Esophagus. 28, 127-137 (2015).
- Collard, J. M., Romagnoli, R., Goncette, L., Otte, J. B., Kestens, P. J. Terminalized semimechanical side-to-side suture technique for cervical esophagogastrostomy. Annals of Thoracic Surgery. 65, 814-817 (1998).
- Orringer, M. B., Marshall, B., Iannectoni, M. D. Eliminated the cervical esophagogastric anastomotic leak with a side-to-side stapled anastomosis. Journal of Thoracic and Cardiovascular Surgery. 119, 277-288 (2000).
- Wang, W. P., Gao, Q., Wang, K. N., Shi, H., Chen, L. Q. A prospective randomized controlled trial of semi-mechanical versus hand-sewn or circular stapled esophagogastrostomy for prevention of anastomotic stricture. World Journal of Surgery. 37, 1043-1050 (2013).
- Kesler, K. A. Outcomes of a novel intrathoracic esophagogastric anastomotic technique. The Journal of Thoracic and Cardiovascular Surgery. 156 (4), 1739-1745 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon