Method Article
Айвор Льюис эзофагектомия предназначена для минимизации анастомотических осложнений и оптимизации функции канала
В этой статье
Резюме
Мы описываем новый интраторакальный эзофагогастрический анастомотический метод, предназначенный для создания анастомоза большого диаметра, одновременно поддерживая источник крови, чтобы свести к минимуму частоту анастомотических утечек и строгих стриктор. Также описана конструкция и ориентация желудочного канала, предназначенного для оптимизации функции верхнего желудочно-кишечного тракта.
Аннотация
Мы описываем новую эзофагогастрическую анастомотическую технику ("из стороны в сторону: основная линия-на-штапельной линии", СТС) для интраторакальных анастомозов, предназначенных для создания анастомоза большого диаметра, одновременно поддерживая кровоснабжение канала. Этот метод направлен на минимизацию заболеваемости анастомотических утечек и стриктуры, которая является частым источником заболеваемости и случайных смертей после пищевода. Мы анализируем результаты этой методики STS на 368 пациентов и сравнили исходы с 112 пациентами, которые прошли пищевогадические анастомы с помощью сквозного степлера (EEA) в течение 8-летнего интервала времени в нашем учреждении.
Техника STS включает в себя выравнивание оставшихся интраторакального пищевода на кончике меньшей линии основной кривой желудка трубки, созданный в качестве замены канала для пищевода. Линейный скрепы устройство прорезает и restaples канал штапель линии боковой стенки в сторону к стороне моды. Открытый общий просвет затем закрывается двумя слоями швов.
Было в общей сложности 12 (3,8%) анастомотических утечек у пациентов, которые прошли STS эзофагогастрический анастомоз. Два из восьми пациентов (25%) были анастомотические утечки после пищевода к концу стадии ахалазия по сравнению с 2,8% скорость утечки (10/336) после пищевода к другим условиям. Восемнадцать (5.2%) пациенты требовали медианы 2 расширений для анастомотической строгости после анастомоза СТС. Дополнительные кормления jejunostomy были необходимы только в 11,1% пациентов, проходящих STS анастомозапосле после выписки из больницы. В отличие от этого, пациенты, проходящие Анастомос ЕАО, продемонстрировали анастомотические протечки и строгающие показатели 16,1% и 14,3% соответственно (п.т.;0.01). Анализ времени послеоперационных контрастных исследований после метода STS обычно демонстрировал прямой/равномерный диаметр канала с существенно полным опорожнением контраста в тонкой кишке в течение 3 минут у 88,4% пациентов.
Заболеваемость эзофагогастрических анастомотических утечек и стриктуры были чрезвычайно низкими, используя этот роман анастомотической техники. Кроме того, мы считаем, что на основе времени и качественного анализа послеоперационных контрастных исследований, этот метод, как представляется, оптимизировать послеоперационную функцию верхнего желудочно-кишечного тракта; однако необходимы дальнейшие сравнительные исследования.
Введение
Эзофагогастрические анастомотические утечки представляют собой не редкое осложнение после пищевода1. Кроме того, анастомотическая утечка была связана с неблагоприятными долгосрочными результатами, включая реадмиссию в больнице, раннюю смертность, а иногда и низкое качество жизни2,,3,4. Анастомотическая строгость представляет собой долгосрочное осложнение, которое также может быть следствием анастомотической утечки5. Анастомотические стриктуры как негативно влияют на качество жизни, так и обостряют стоимость медицинской помощи.
Поскольку все больше больных раком пищевода живут дольше в результате эндоскопического обнаружения аденокарциномы на ранней стадии и индукционной терапии хеморадиации для более локально продвинутых раковых заболеваний, оптимизация функции желудочного канала также становится важным. Однако желудочный канал «функции» в основном зависит от гравитации для дренажа. Конструкция желудочного канала и ориентация могут повлиять на работу верхних желудочно-кишечных путей, и поэтому плохая "функция" канала может быть результатом технических проблем.
Мы использовали новый "из стороны в сторону: основной линии на скобы" (STS) техника для интраторакального пищевогасастрического анастомоза с 2009 года. Этот метод предназначен для создания анастомоз большего диаметра по сравнению с анастомоза, сделанные с сквозными степлерами (EEA) при одновременном поддержании источника крови, чтобы уменьшить частоту анастомотических утечек и стриктуры. Мы описываем этот роман анастомотической техники и дополнительно описаны конструкции желудочного канала и ориентации для оптимизации функции. Мы сравнили результаты этой методики STS с анастомосами, выполненными с помощью степлеров EEA в течение 8-летнего промежутка времени в нашем учреждении.
протокол
Это исследование было одобрено Университетом Индианы-Пердью университета в Индианаполисе институционального совета по обзору (1109006832). Эта процедура была выполнена на всех пациентов, нуждающихся в резекции и резекции дистального инстраторального пищевода для злокачественных или доброкачественных заболеваний с 2009 года в больнице Университета Индианы.
1. Фаза преданестезии
- Поместите эпидуральный катетер.
- Получите стандартный центральный венозный и радиальный артериальный доступ.
- Анестезия и интубировать с помощью двойной просвет левой эндобронхиальной трубки для селективной вентиляции легких во время грудной фазы операции.
2. Начальная фаза лапаротомии
- Выполните верхнюю полотную лапаротомию, включая иссечение процессов зифоида с помощью электрокаутерии. Поместите самосохраняющийся взводной стенки ретрактор для воздействия брюшной полости.
- Выполните широкий маневр Кохера, который мобилизует весь двенадцатиператого несколько раз из ретроперитонеума. Этот маневр не только выпрямляет желудочный канал, но и позволяет хорошо васкуляризированные части желудочного канала быть продвинулись над аркой азигов.
- Временно поместите стандартный размер губки лапаротомии под двенадцатиперстной кишки, чтобы поднять канал, который удаляется в заключительной фазе лапаротомии.
- Разделите гастроколическую связку путем прижавания и деления кровеносных сосудов со стандартным энергетическим устройством. Избегайте манипуляций с правильными гастроэпиплоичными сосудами, поместив назогастральную трубку вдоль большей кривизны, которая используется в качестве «ручки», втягивающей желудок вверх.
- Оценка брюшной полости по окружной вокруг диафрагматической крест с электрокаутерией и временно место Пенроуз стока вокруг внутриабдоминального пищевода.
- Свагтите левые гастроэпиплоичные и короткие желудочные сосуды с сочетанием швов и хирургических зажимов. Затем разделите.
- В случаях злокачественности, мобилизовать целиакии лимфы подшипников тканей из высшего аспекта поджелудочной железы, которая включает в себя перевязку и деление левой желудочной артерии и вены.
- Очистите меньшую желудочную кривую жира и кровеносных сосудов обычно от 3 до 5 см дистальной гастроэзофагеальной стыковки с сосудистыми эндоспиллерами. В случаях злокачественности, план операций для достижения опухоли бесплатно от 3 до 5 см дистального желудка и от 5 до 7 см проксимальных пищевода хирургических полях. Как опухоли местах варьируются от середины пищевода желудочного кардиа, достижение адекватного дистального желудка и проксимальных пищевельных поля приводит к каналов различной длины и связанных ниже или выше внутрипищевой пищевода анастомоза. Специфический участок меньшей очистки кривой поэтому несколько переменной и зависит от точного местоположения опухоли.
- Расщепление верхнего желудочного фонда и кардиас аж из остатка желудка обычно используют где-то от 3 до 5 60 мм эндоскопических степлеров, начиная от большей кривой желудка в очищенной области на меньшей кривой желудка.
- Создание желудочного канала
- Debulk меньшей оментального жира вокруг правого желудочного сосудов, что позволяет канал, чтобы быть выпрямлены, а также удлинение. Разделение правых сосудов желудка, как они вставляют на меньшую кривую на резизура обеспечит дальнейшее удлинение.
- Закрепите желудок в трех точках и обеспечить внешнее опрокидывание(рисунок 1).
- Создайте узкий единый канал диаметра (в среднем 7-8 см) с первоначальным огнем 100-мм степлер, который обеспечивает два ряда 4,8 мм скобы, направленные чуть ниже предыдущей основной линии. Завершение строительства канала обычно требует 2 или 3 дополнительных пожаров 60 мм эндоскопической три-степлер в очищенной области на меньшей кривой желудка. В случаях злокачественности, отправить дефект желудка в качестве "дистальной желудка маржи" для замороженных раздел патологический анализ.
- Осмотрите кончик канала. В течение 3 до 5 минут, пунктуат ярко-красные кровотечения, как правило, видели через меньшую линию основной линии кривой, представляющих хорошую перфузию канала. Если нет пунктуации ярко-красный сочится присутствует, слегка обрезать кончик канала с другой 100 мм степлер до пунктуата кровотечение видно. Три-степлеры не используются для обрезки канала, как резки через и отдыха кончика канала во время интраторакального анастомоза может быть трудно.
- Выполните стандартный Хайнеке-Микулич пилолопастии для того, чтобы обеспечить хороший опорожнения канала.
- Первоначально оценить, насколько высоко в груди канал достигнет путем удобно растяжения канала к шее без чрезмерного напряжения.
- Откройте правый плевры через диафрагмальной крус. Поместите наконечник канала в правую грудь, удерживая меньшую линию скобы кривой, обращенную вправо.
- Временно закрыть живот с несколькими прерванные фасциальные швы и скобы кожи.
3. Торакальная фаза
- Поместите пациента в левое боковое положение декубита.
- Выполните serratus мышцы щадящие правой торакотомии через5-й межреберной пространстве. Разделите межреберную мышцу под разрезом в пределах 3-5 см тела позвонка задним и грудины передним, что позволяет дополнительное движение5-го и6-го ребер с минимальным риском перелома или кровоподтеков.
- Акциз арки азигосвени и разделить нижней легочной связки. В случаях злокачественности, выполнять ан блок вскрытия путем мобилизации дистальных две трети интраторакального пищевода со всеми окружающими мягких тканей из перикарда передняя аорта задний пищеветрины кровеносных сосудов. Тщательно окклюзии лимфатических с хирургическими клипами до деления во время этого вскрытия.
- Доставка канала в правую грудь, пока нет избыточности, ограничивая напряженность на правой желудочной и правой гастроэпплоисальной сосудистой pedicles, чтобы определить превосходный объем рассечения пищевода необходимо.
- На уровне трахеальной карины вскрыть стенку пищевода из окружающих средостенных мягких тканей в превосходном месте до уровня, где кончик канала достигает без напряжения, которое обычно на 3-5 см превосходит карину. Опять же, однако, учитывая различные места опухолей и длина желудочного канала, созданные во время брюшной фазы, установить анастомы ниже вблизи карины для опухолей желудка кардиаи и выше в грудной входе для опухолей с участием среднего интраторакального пищевода.
- Создание пищеводагастрономического анастомоза
- Выровнять середину левого бокового аспекта верхней трети интраторакального пищевода над меньшей линией основной линии кривой.
- Поместите четыре лавкинга швы примерно от 2 до 3 см друг от друга для того, чтобы сохранить выравнивание(рисунок 2).
- Перекрывай пищевод 1 см дистальный к нижнему набору лавирования швов. В случаях злокачественности, отправить кольцо пищевода на этом уровне, как "проксимальная пищевая маржа" для замороженных раздел патологического обследования до начала работы.
- Создайте соответствующее отверстие от 1 до 2 см в проводнике через меньшую линию скобы кривой.
- Место прерванные швы в рамках общего просвет, включая смежный канал и стены пищевода, начиная с середины через меньшую линию основной кривой и прогрессирует в обе стороны (Рисунок 3).
- Поместите узкую наковальню 45-мм эндоскопического степала с 4,1 мм основной высотой в просвет пищевода и большой наковальней в канале. Для оптимизации длины межстороннего общения между пищеводом и каналом обрезка 5 мм от дистального пластикового кончика картриджа с колеблющимися пилами.
- Пожар степлер, который прорезает и restaples меньшей линии основной кривой(рисунок 4). Длина разреза конце пищевода, как правило, несколько больше, чем край желудочного канала, так что удалить эллипс аплиса по меньшей линии основной кривой, а не расширение арендной платы боковой, сохраняя залоговое кровоснабжение (Рисунок 4 врезка).
- Закройте открытый общий просвет в два слоя швов, начиная с внутреннего слоя перевернутый прерван 3-0 полигектиновый шов с последующим вторым слоем прерванного 3-0 шелка с помощью техники Лемберта(рисунок 5).
- Над шить верхний аспект меньшей линии штапеля канала кривой с прерванными 3-0 шелковыми швами в способе Lembert удлиняя неполноценно, до тех порлей правые желудочные сосуды не навстречали.
- Пойтенец поставить анестезиолога наканал к уровню креста путем пальпации.
- Для анастомоза, созданного вблизи грудного входа, используйте плевральный лоскут, чтобы запечатать анастомоз в задней средостении. Для анастомозов в среднем аспекте заднего средостения, мобилизуй перикардиальный жир погладить из передней средостении и свободно завернутый для покрытия пищевогастрического анастомоза(Рисунок 6 и Рисунок 7).
- Вставьте и положение двух 28-французских грудных труб в правом гемиторакс, один передний и другой задний, рядом, но не примыкающий к каналу. Закройте разрез торакотомии.
4. Повторная лапаротомия: фаза "двойного флипа"
- Верните пациента в положение на спине и вновь откройте разрез лапаротомии средней линии.
- Осмотрите правый гастроэпиплойический жир и осторожно толкают лишний жир вверх через левую диафрагму в грудь.
- Закрепите правильный гастроэпиплойический жир и канал к диафрагмальной крус с прерванными 2-0 шелковыми швами(рисунок 8). Поместите трубку для кормления джеджуностомии у некоторых пациентов, в первую очередь у пожилых пациентов или пациентов с предоперационным дефицитом питания.
- Формально закрыть разрез лапаротомии средней линии.
- Держите пациентов интубированных вечером операции с экстубации планируется на следующее утро.
- Обеспечить обезболивание с эпидуральными катетерами, помещенными непосредственно перед анестетической индукцией в течение первых 3-4 дней, которая дополняется внутривенными наркотиками.
- Получить контраст верхней желудочно-кишечной серии от 5 до 7 дней после операции для оценки анастомотической целостности.
- Если не выявлена анастомотическая утечка, удалите назогастрическую трубку.
- Проинструктируйте пациентов перейти к регулярной диете через 2-3 недели после выписки в качестве допустимого.
Результаты
С 2009 по 2017 год было выявлено в общей сложности 368 пациентов, перенесших интраторакальный пищевогакный анастомоз СТС, из них 12 (3,8%) были анастомотические утечки. Пять из этих пациентов продемонстрировали утечки I/II класса и не требовали вмешательства. Шесть пациентов и один пациент соответственно опытных III и IV класса утечки, требующие эндоскопического стентирования и / или хирургического вмешательства2. Скорость утечки 25% (2/8) наблюдалась после пищевода для ахалазии конечной стадии по сравнению с 2,8% скорость утечки (10/336), где пищевода была выполнена для других условий. Их было 4 (1,1%) пациент, который умер после операции, ни один из которых имел анастомотическое осложнение. Из пациентов с СТС 18 (5,0%) требуется медиана 2 расширения для симптоматических анастомотических строков. Дополнительные кормления иеджуностомии были необходимы только в 11,1% из этих пациентов после выписки из больницы. В отличие от этого, из 112 выявленных пациентов, перенесших торакоскопический сквозной механический степлер (EEA) анастомоз за этот же промежуток времени, 16,1% и 14,3% продемонстрировали анастомотические утечки и симптоматические строки соответственно (p'lt;0.01), несмотря на все (100%) из этих пациентов поддерживается на ограниченной диете с дополнительными jejunostomy трубки кормления, по крайней мере один месяц после операции (Таблица 1). Демографические и сопутствующие ситуации как групп СТС, так и ЕЭП были статистически схожими; однако, была тенденция к более сердечной болезни в когорте STS (Таблица 2). Время анализа послеоперационных контрастных исследований в первых 208 пациентов, которые прошли анастомоз STS обычно продемонстрировали прямой / равномерный диаметр канала с существенно полным (No gt;95%) контрастозавая опорожнение в тонкой кишке в течение 3 мин в 184 (88,4%) Пациентов. Остальные 11,6% изученных пациентов, были почти полными (Nogt;95%) контрастосирования в тонкой кишке в течение 5 минут. Ни один из исследованных пациентов не имел контрастного времени транзита свыше 5 минут.

Рисунок 1: Создание желудочного канала. Желудок закреплен в трех точках, которые вытягиваются наружу. Относительно равномерного диаметра канал создается с степлерами, направленных только уступает предыдущей основной линии на меньшей кривой. (Взятые с разрешения11.) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
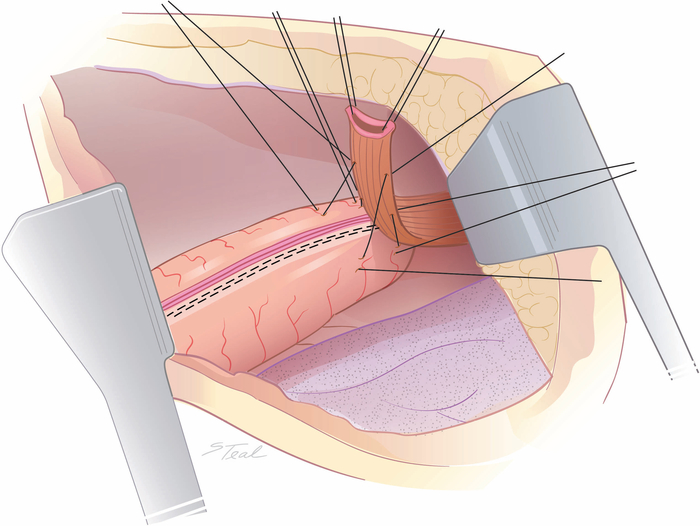
Рисунок 2: Выравнивание пищевода над желудочно-жидком. Середина левого бокового аспекта верхней трети интраторакального пищевода выровнена над меньшей линией основной кривой на кончике канала с 4 первоначальными лавковыми швами примерно на 2-3 см друг от друга. (Взятые с разрешения11.) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Подготовка к межстороннему общению между пищеводом и желудочным каналом. Аренда от 1 до 2 см производится в желудочном канале через меньшую линию основной линии кривой. Привязки швы расположены между соседним каналом и стенами пищевода, начиная с середины через меньшую линию основной кривой, то два шва по обе стороны. (Взятые с разрешения11.) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
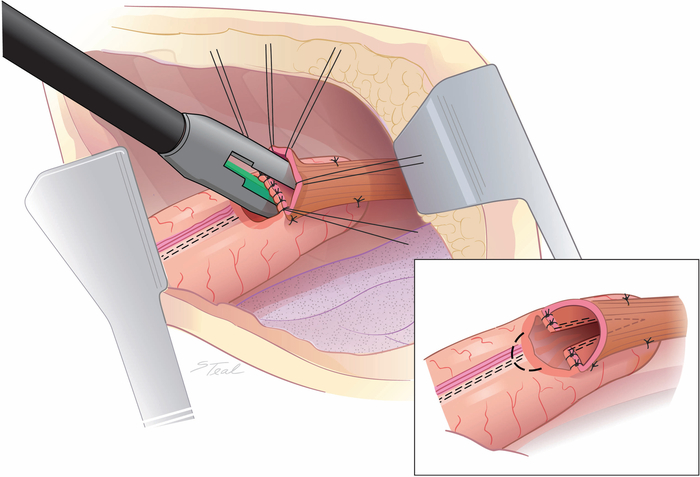
Рисунок 4: Создание межстороннего общения между пищеводом и желудочно-щал. 45 мм эндоскопический степлер выстрелил резки через и отдыха меньшей линии основной кривой. Обычно используется только 2/3rds длины степлера. Эллипс канала удаляется над меньшей линии основной кривой (пунктирная линия), а не расширение арендной платы боковой выравнивать длину разреза конце пищевода и гастротомии. (всет) (Взятые с разрешения11.) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Закрытие открытого общего просвета. Открытый общий просвет закрыт вручную в два слоя швов, начиная с перевернутых прерванных абсорбируемых швов. Первый шовный слой обезврежен вторым слоем шелковых швов Лемберта, положив на желудочный шов на несколько мм, уступая первому слою швов. (всет) (Взятые с разрешения11.) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
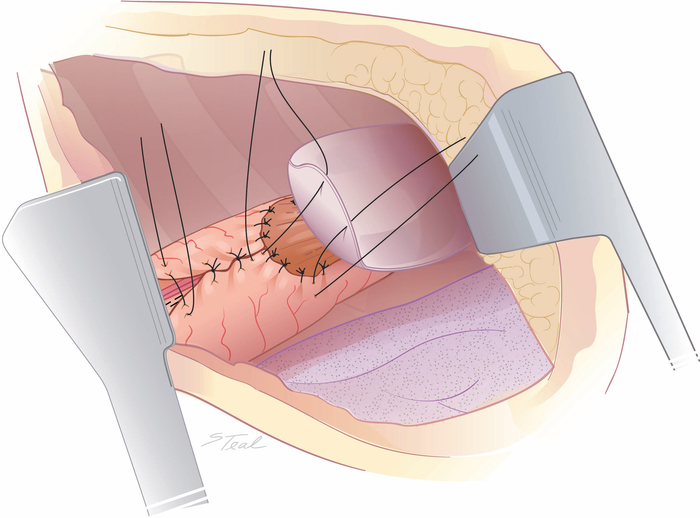
Рисунок 6: Над шитью меньшей линии основной кривой и плевральной опорой анастомоза. Превосходный аспект нижней линии основного контура меньшей кривой канала может быть более сшиты в этот момент с прерванными шелковыми швами неполноценно до тех пор, пока не будут обнаружены правые сосуды желудка. Для анастомозов, установленных в близившихся грудных впусков, лоскут мобилизованных плевры прикрепляются к желудочному каналу, чтобы содержать небольшие анастомотические утечки. (Взятые с разрешения11.) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
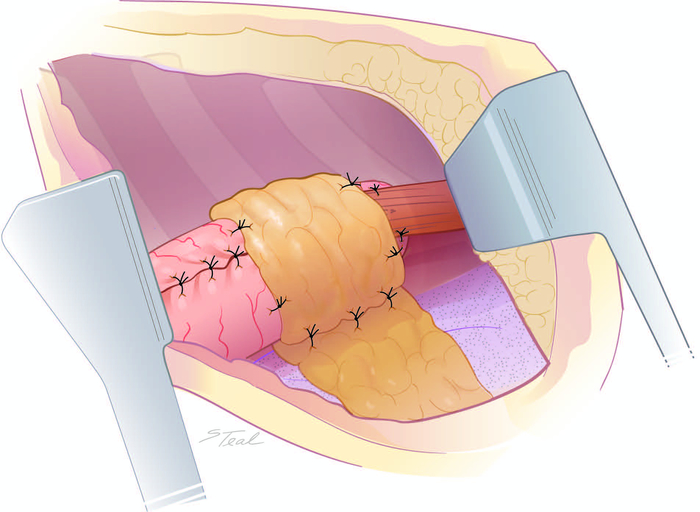
Рисунок 7: Васкуляризованная опорка мягких тканей анастомоза. Перикардиальный жир свободно обернут вокруг анастомоза, созданных в среднем аспекте заднего средостения, чтобы содержать любые небольшие участки анастомомной обезврежимости. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
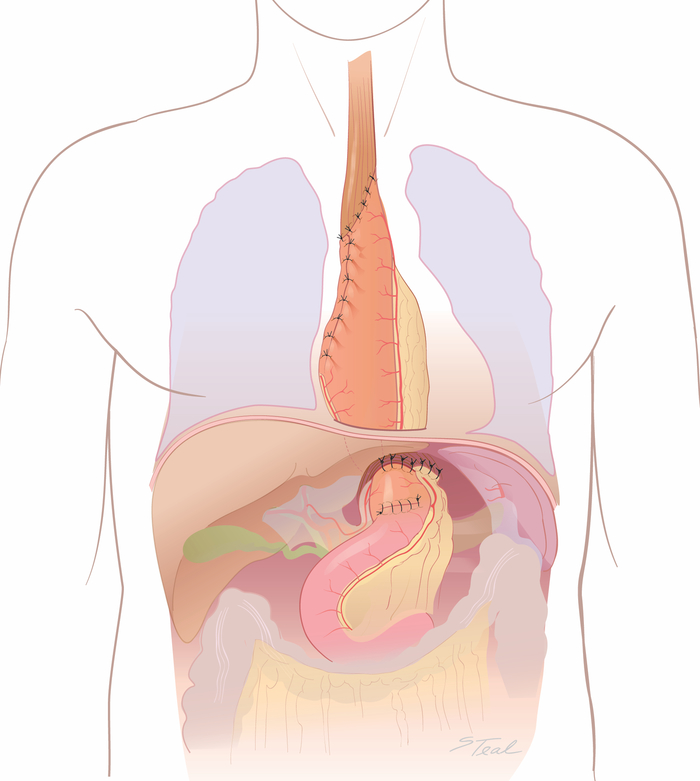
Рисунок 8: Заключительный ("двойной флип") фаза лапаротомии. Разрез лапаротомии вновь открыт. Правый гастроэпиплойический жир и канал тщательно прикрепил к кресту с 2-0 шелковыми швами. (Взятые с разрешения11.) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| STS (N-368) | Е.Е.А. (N-112) | |
| Анастомотические утечки | 3.8%* | 16.1% |
| Анастомотическая строгость | 5.2%* | 14.3% |
| Сообщение Op J-Tube использование | 11.0%* | 100.0% |
Таблица 1. Анастомотические утечки / строгие и использование послеоперационного кормления jejunostomy (Post Op J-Tube Usage) после выписки из больницы сравнения пациентов, проходящих открытые СТС и торакоскопических EEA эзофагогастрических анастомов с использованием подхода Айвор Льюис осуществляется в Университете Индианы Саймон онкологический центр с 2009 по 2017 год. (Значение злот; 0,01, чи-квадрат)
| СТС (n-278) | ЕАОС (n-82) | P-значение | |
| Возраст при постановке диагноза (yrs) | 60,3 и 11,4 (23-84) | 60,6 и 9,0 (38-80) | 0.80 |
| Гендерного | |||
| Мужской | 228 (82.0%) | 69 (84.1%) | 0.66 |
| Женский | 50 (18.0%) | 13 (15.9%) | |
| Кормовость | |||
| Сердечной | 114 (41.0%) | 24 (29.3%) | 0.06 |
| Сахарный диабет | 70 (25.2%) | 19 (23.2%) | 0.71 |
| Хобл | 32 (11.5%) | 12 (14.6% | 0.45 |
| Гистологии | |||
| Аденокарцинома | 237 (85.3%) | 74 (90.2%) | 0.25 |
| Другие диагнозы | 41 (14.7%) | 8 (9.8%) | |
| Неоадъювантная терапия | 200 (71.9%) | 59 (71.9%) | 0.99 |
Таблица 2: Демография и сопутствующие сравнения открытых СТС и торакоскопических анастомозаХ EEA с использованием подхода Айвора Льюиса, выполненного в Университете Индианы Саймон онкологический центр с 2009 по 2015 год. Среднее и стандартное отклонение с диапазоном для непрерывных переменных. Значения P для непрерывных переменных, генерируемых T-тестом студента и chi-квадратом для дискретных переменных.
Обсуждение
Эзофагектомия представляет собой очень обширную хирургическую процедуру. Неблагоприятное долгосрочное качество жизни было связано с пациентами, испытывающими послеоперационные осложнения, включая анастомотические утечки3. Факторы риска анастомотической утечки в первую очередь включают создание анастомоза с плохим кровоснабжением. Анастомотическая утечка не только представляет собой значительный источник послеоперационной заболеваемости, но и обычно может привести к стриктуре. Строгость также может быть результатом технических проблем, включая выполнение анастомоз малого диаметра. Помимо влияния на качество жизни, strictures добавить к общим медицинским расходам, когда расширение необходимо5. Точное выполнение нескольких шагов имеет первостепенное значение для минимизации осложнений, а также достижения хороших онкологических и верхних функциональных результатов желудочно-кишечного тракта.
Эзофагогастрический анастомоз может быть достигнуто несколькими методами, в том числе ручной сшитые, EEA, и линейные степлер методы, представляющие большинство. В докладе Общества торакальных хирургов Генеральной торакальной базы данных цитируется общая скорость утечки 9,3% у пациентов, проходящих внутриторакальный пищевогастр анастомы6. В то время как послеоперационная смертность из-за анастомотической утечки, кажется, снижается, последующие показатели строгости остаются высокими, в диапазоне от 10 до 56%7. Коллард и Оррингер описаллинейный метод степлера для создания бокового шейного пищевода анастомоз8,9. Заднее триангуляции открытия, образованного линейным степлером было продемонстрировано, чтобы привести к низкой скорости утечки, а также устойчивость к строю. Ретроспективное исследование клиники Майо сообщил5,6% инцидент интраторакальной анастомотической утечки в 177 пациентов, где линейный скрепленный метод был использован по сравнению с 8,3% утечек у 48 пациентов, которые прошли EEA скобы сапожого анастомоза. Хотя эта разница не достигла статистической разницы, годовая вероятность стриктуры составила 32% после анастомоза EEA по сравнению с только 8,6% с линейными скрепленными методами, что было значительным5. Ван и его коллеги провели проспективное клиническое исследование с участием 155 пациентов, которые были рандомизированы в один из трех эзофагогастрических анастомотических методов10. Впечатляюще, никаких послеоперационных строков, разработанных у пациентов, проходящих линейную методику степлеров, по сравнению с 9,6% и 19,1% в сшитых вручную и циркулярных скрепленных случаях соответственно, что было статистически значимым. Предыдущие исследования с участием линейных анастомы степлер использовали передней стенки желудочного канала для анастомотического сайта. Такой подход может привести к ишемической полосе канала между основной линией меньшей кривой и анастомозом, предрасполагаюющим к утечке. Роман к нашей технике, collateral кровоснабжение к кончику проводника живота сохранено путем резать до конца и restapling меньшая линия штапеля кривой.
Есть ограничения для исследования. Во-первых, это ретроспективный анализ. Несмотря на ретроспективный характер однако, мы использовали этот подход STS равномерно в всех пациентах, проходящих операцию для середины пищевода до проксимальной патологии желудка в течение исследуемого интервала, как "намерение лечить", включая стабильные пациенты, которые устойчивые перфорации пищевода во время расширения для стриктуры, где ремонт не был возможен. Общим для любой интраторакальной стороны в сторону анастомотической техники является необходимость вскрытия дополнительных 3 до 4 см проксимального пищевода, потенциально уменьшая длину хирургического пищевода в случаях злокачественности, а также потенциально приводит к некоторой степени деваскуляризации пищевода. Чтобы избежать деваскуляризации, критический момент не вскрыть интраторакальный пищевод дальше в высшей степени к шее, чем кончик желудочного канала достигнет без напряжения. Мы полагаем, что более высокая скорость утечки наблюдается с помощью этого метода для пациентов с конечной стадии ахалазия может быть связано с дальнейшей деваскуляризации гусевой стенки пищевода после мобилизации для выполнения анастомоз STS, где уже существующие кровоснабжения могут быть бедными. Расширение пищевода часто видели в случаях ахалазии делает ручной шитья открытый общий просвет очень трудно, что также может быть фактором. Основываясь на этом опыте, мы теперь считаем, что ахалазия является противопоказанием для выполнения СТС интраторакальных анастомос. Следует отметить, что для длинных или более центральных видов рака, где эзофагогастрический анастомоз должен быть создан вблизи грудного впуска для достижения адекватного проксимального пищевого поля, мы использовали несколько короче первоначальной боковой связи не используя всю длину 45 мм ГИА, который, однако, имеет потенциал, чтобы быть более склонными к сустрого образования.
В отличие от пищевода, желудок является пассивным каналом, гравитация зависит от дренажа. Несколько переменных, включая диаметр и длину канала, а также ориентацию канала могут, таким образом, значительно повлиять на работу верхних желудочно-кишечных путей. Попадает пища имеет потенциал, чтобы повесить в трех местах: эзофагогастрический анастомоз, тело желудка, и желудка розетки. Плохая функция канала может быть результатом технических проблем в любой из этих трех областей. Плохое опорожнение канала парадоксальным образом может привести к более "рефлюкс", не только негативно влияет на качество жизни, но и иногда приводит к устремлениям. "Минимально инвазивные" (лапароскопические/торакоскопические) подходы, которые используют степлер EEA для эзофагогастрических анастомозов, хотя и все еще представляющие меньшинство случаев пищеводактомии, становятся все более популярными. Мы считаем, однако, наша открытая техника, как описано не только позволяет творения точных STS эзофагогастрического анастомоза, чтобы уменьшить стойные ставки, но дополнительно оптимизирует конструкции трубопровода и ориентации с прямой неизлишним желудочного канала, включая пилопластику с минимальной тенденцией для попадает пищевых материалов, чтобы повесить в этих областях, как по сравнению с торакоскопикических подходов. Измеренный контраст времени транзита от рта до тонкой кишки на обычных послеоперационных исследований будет поддерживать отличную функцию канала с нашей техникой, однако сравнительные исследования с использованием других методов необходимы. Наши наблюдения будут поддерживать минимальные и самоограничения "демпинг" симптомы в подавляющем большинстве пациентов СТС однако конкретные оценки качества жизни в настоящее время ведется. Наконец, с торакотомии подход описан, мы наблюдали небольшую разницу в отношении острого и долгосрочного послеоперационного дискомфорта по сравнению с пациентами, проходящими торакоскопический подход в нашем учреждении.
Таким образом, мы считаем, что этот новый метод STS может значительно снизить заболеваемость и случайную смертность от пищеводных анастомотических осложнений после пищевода. Конструкция и ориентация канала, как описано дополнительно оптимизирует функцию верхнего желудочно-кишечного тракта. Наконец, этот метод легко адаптируется и воспроизводим.
Раскрытие информации
Авторы не раскрытии информации.
Благодарности
Ни один.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm Linear Stapler (ILA Autosuture, “green” cartridge, 4.8 mm staple height) | Covidien | 3973 | Surgical Stapler |
| 3-0 silk (Perma hand black, 8x18", SH needle, 1/2 circle 26 mm, C013) | Ethicon | C013D | Suture Material |
| 3-0 silk (Perma hand black, 8x30", SH needle, 1/2 circle 26 mm, C017) | Ethicon | C017D | Suture Material |
| 3-0 vicryl (Coated vicryl violet, 8x18", SH needle, 1/2 circle 26 mm, J774) | Ethicon | VCP774D | Suture Material |
| 3-0 vicryl (Coated vicryl violet, 8x27", SH needle, 1/2 circle 26 mm, J784) | Ethicon | VCP784D | Suture Material |
| 45 mm Endoscopic Stapler (Flex “green” cartridge, 4.1 mm staple height) | Ethicon | SC45A | Surgical Stapler |
| 60 mm Endoscopic Tristapler | Ethicon | SC60A | Surgical Stapler |
| Flex “green” cartridge, 4.1 mm staple height | Ethicon | GST45G | Surgical Stapler |
| Flex 60, “black” cartridge (for 60 mm Endoscopic Tristapler) | Ethicon | GST60T | Surgical Stapler |
| Foceps Debakey 7.75 inch | Jarit | 320-101 | Surgical Instrument |
| Forceps Debakey 12 inch | Jarit | 320-103 | Surgical Instrument |
| Forceps Debakey 9.5 inch | Jarit | 320-102 | Surgical Instrument |
| Needle Holder Mayo-Hegar 10 inch | Codman | 36-2019 | Surgical Instrument |
| Needle Holder Mayo-Hegar 7 inch | Codman | 36-2017 | Surgical Instrument |
| Needle Holder Mayo-Hegar 8 inch | Codman | 36-2018 | Surgical Instrument |
| Needle Holder Ryder 10 inch | Codman | 36-3005 | Surgical Instrument |
| Needle Holder Ryder 9 inch | Jarit | 121-164 | Surgical Instrument |
Ссылки
- Cassivi, S. D. Leaks, strictures, and necrosis: a review of anastomotic complications following esophagectomy. Seminars in Thoracic and Cardiovascular Surgery. 16, 124-132 (2004).
- Low, D. E., et al. International consensus on standardization of data collection for complications associated with esophagectomy: Esophagectomy complication consensus group (ECCG). Annals of Surgery. 262, 286-294 (2015).
- Derogar, M., Orsini, N., Sadr-Azodi, O., Langergren, P. Influence of major postoperative complications on health-related quality of life among long-term survivors of esophageal cancer surgery. Journal of Clinical Oncology. 30, 1615-1619 (2012).
- Kofoed, S. C., et al. Intrathoracic anastomotic leakage after gastroesophageal cancer resection is associated with increased risk of recurrence. Journal of Thoracic and Cardiovascular Surgery. 150, 42-48 (2015).
- Price, T. N., et al. A comprehensive review of anastomotic technique in 432 Esophagectomies. Annals of Thoracic Surgery. 95, 1154-1160 (2013).
- Kassis, E. S., et al. Predictors of anastomotic leak after esophagectomy: an analysis of the Society of Thoracic Surgeons General Thoracic Database. Annals of Thoracic Surgery. 96, 1919-1926 (2013).
- Yuan, Y., Wang, K. N., Chen, L. Q. Esophageal anastomosis. Diseases of the Esophagus. 28, 127-137 (2015).
- Collard, J. M., Romagnoli, R., Goncette, L., Otte, J. B., Kestens, P. J. Terminalized semimechanical side-to-side suture technique for cervical esophagogastrostomy. Annals of Thoracic Surgery. 65, 814-817 (1998).
- Orringer, M. B., Marshall, B., Iannectoni, M. D. Eliminated the cervical esophagogastric anastomotic leak with a side-to-side stapled anastomosis. Journal of Thoracic and Cardiovascular Surgery. 119, 277-288 (2000).
- Wang, W. P., Gao, Q., Wang, K. N., Shi, H., Chen, L. Q. A prospective randomized controlled trial of semi-mechanical versus hand-sewn or circular stapled esophagogastrostomy for prevention of anastomotic stricture. World Journal of Surgery. 37, 1043-1050 (2013).
- Kesler, K. A. Outcomes of a novel intrathoracic esophagogastric anastomotic technique. The Journal of Thoracic and Cardiovascular Surgery. 156 (4), 1739-1745 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены