Method Article
Une tâche d’association odeur-récompense peu coûteuse pour les tests d’apprentissage et de mémoire
Dans cet article
Résumé
Une tâche d’apprentissage associatif odor-récompense a été utilisée pour étudier les effets différentiels de la manipulation physiologique sur la mémoire à long terme et à court terme.
Résumé
Des paradigmes comportementaux robustes et simples de la mémoire appétitive et associative sont cruciaux pour les chercheurs qui s’intéressent aux mécanismes cellulaires et moléculaires de la mémoire. Dans cet article, un protocole comportemental efficace et peu coûteux chez la souris est décrit pour examiner les effets de la manipulation physiologique (comme l’infusion d’agents pharmacologiques) sur le taux d’apprentissage et la durée de la mémoire odeur-récompense. Des résultats représentatifs sont fournis à partir d’une étude examinant le rôle différentiel de l’activité des récepteurs de la tyrosine kinase dans la mémoire à court terme (STM) et la mémoire à long terme (LTM). Des souris mâles ont été conditionnées à associer une récompense (pastille de sucre) à l’une des deux odeurs, et leur mémoire pour l’association a été testée 2 ou 48 heures plus tard. Immédiatement avant l’entraînement, un inhibiteur du récepteur de la tyrosine kinase (Trk) ou des perfusions de véhicule ont été administrés dans le bulbe olfactif (OB). Bien qu’il n’y ait pas eu d’effet de la perfusion sur le taux d’apprentissage, le blocage des récepteurs Trk dans l’OB a altéré sélectivement la LTM (48 h), et non la mémoire à court terme (STM ; 2 h). La dégradation de la LTM a été attribuée à la diminution de la sélectivité des odeurs, mesurée par la durée du temps d’excavation. L’aboutissement des résultats de cette expérience a montré que l’activation du récepteur Trk dans l’OB est la clé de la consolidation de la mémoire olfactive.
Introduction
Les mécanismes de formation de la mémoire associative ont déjà été étudiés principalement sur la base d’études de conditionnement de la peur menées à un essai. Cependant, de nombreuses tâches banales ont généralement des modèles d’acquisition plus complexes et reposent sur des rencontres répétées. L’objectif de ce protocole est de fournir un paradigme comportemental rentable pour les rongeurs qui est utilisé pour comprendre les mécanismes cellulaires et moléculaires de l’apprentissage appétitif et de la mémoire multi-essais.
L’apprentissage des odeurs qui dépend du bulbe olfactif principal (OB) offre plusieurs avantages pour l’étude de la mémoire appétitive multi-essais. Tout d’abord, les souvenirs dépendants de l’OB ont des durées variables (STM, LTM et mémoire à moyen terme1) et reposent sur le même mécanisme moléculaire 2,3 et structurel qu’ailleurs dans le cerveau, y compris la neuromodulation4, la potentialisation à long terme5 et la neurogenèse adulte 6,7,8. Deuxièmement, contrairement aux régions d’ordre supérieur, comme l’hippocampe, les mémoires dépendantes de l’OB permettent d’observer une correspondance plus directe entre les manipulations de l’environnement perceptif par l’expérimentateur et les modifications des circuits neuronaux responsables de l’apprentissage 8,9,10,11 . Dans cet article, un paradigme d’apprentissage associatif et de mémoire dépendant de l’OB, qui peut être utilisé pour étudier les mécanismes moléculaires et structurels généraux, est détaillé. Il a été développé pour permettre aux chercheurs d’accéder aux avantages de l’apprentissage olfactif pour l’étude des mécanismes cellulaires et moléculaires de la mémoire.
Dans notre récente publication3, le protocole décrit ici a été utilisé pour démontrer que la consolidation de l’apprentissage appétitif des odeurs dépend de l’activation du récepteur Trk dans le BO. Dans le protocole ci-dessous, les domaines où le paradigme comportemental peut être ajusté à différents besoins expérimentaux sont également abordés.
Au total, 27 souris CD-1 mâles adultes, âgées de 8 semaines au moment de la canulation, ont été utilisées dans cette étude. Pour les distributions précises des groupes et l’utilisation des ensembles d’odeurs, voir la section méthodes de notre publication précédente3. Des souris mâles ont été utilisées pour éviter de grandes fluctuations des niveaux d’œstrogènes, car des recherches antérieuresont montré que la mémoire olfactive est améliorée par des niveaux d’œstrogènes accrus. Ces souris ont toujours été maintenues sur un cycle lumière/obscurité inversé de 12:12 h et avaient accès à de l’eau. Au cours des expériences comportementales, le régime alimentaire des souris a été restreint pour les maintenir à ~90 % de leur poids d’alimentation libre. La restriction alimentaire a commencé 3 jours avant le début de l’expérience comportementale. Comme nous le décrirons ci-dessous, le même ensemble de souris est présenté avec différents ensembles d’odeurs afin d’atteindre les niveaux appropriés de puissance statistique tout en minimisant l’utilisation des animaux. La section d’analyse statistique montre comment tenir compte de la variance aléatoire qui peut être introduite par cela.
Protocole
Le protocole ci-dessous est conforme aux directives de l’IACUC de l’Earlham College.
1. Canulation du bulbe olfactif
REMARQUE : Ces chirurgies ne nécessitent pas de technique stérile car elles ne nécessitent pas de grandes incisions à faire. Cependant, chaque institution peut différer dans ses exigences. Si les expérimentateurs effectuent cette chirurgie sur des souches de souris immunodéprimées, des considérations supplémentaires peuvent être nécessaires. Dans l’ensemble, les expérimentateurs sont encouragés à discuter de ce protocole avec leur vétérinaire et leur équipe de soins aux animaux avant l’utilisation et à nettoyer et désinfecter tous les outils entre chaque chirurgie.
- Pendant l’installation, faites tremper les canules et les vis dans un petit bécher ou une boîte de Pétri contenant 32 % de chlorhexidine pour les désinfecter.
- Anesthésie les souris avec de l’isoflurane gazeux à 4 % dans de l’oxygène pur et sécurise dans un appareil stéréotaxique. Pendant la chirurgie, assurez-vous que les souris sont maintenues sous une anesthésie isoflurane de 1,5 à 2 % fournie par un cône nasal. Surveillez la respiration tout au long de la chirurgie. Utilisez une pommade oculaire pour prévenir la sécheresse des yeux sous anesthésie.
- Une fois que la souris est sécurisée et ne répond plus à un pincement ferme de la patte arrière, utilisez de la chlorhexidine à 32 % pour frotter le haut de la tête afin de nettoyer la surface de l’incision.
- Ensuite, frottez le haut de la tête dans le sens rostral à caudal avec de la lidocaïne (analgésie topique).
- Appuyez fermement pour faire une seule incision sur la ligne médiane avec une lame de scalpel propre.
- A l’aide d’une perceuse fixée à la stéréotaxie, percer deux trous sur les bulbes olfactifs de la canule de guidage (26 G) en utilisant les coordonnées AP +5,0 mm, ML +/-0,75 mm par rapport à bregma.
- Percez deux trous sur la formation cérébelleuse.
REMARQUE : L’emplacement de ces vis n’a pas besoin d’être précis, assurez-vous qu’elles sont symétriques le long de la ligne médiane. - Placez des vis dans les deux trous sur la formation cérébelleuse et utilisez un adhésif pour tissu pour fixer ces vis au crâne.
- À l’aide du stéréotaxie, insérez la canule de guidage (26 G) dans les trous percés sur les bulbes olfactifs (étape 1.6). Abaissez la canule DV 1,0 mm.
- Mélangez le ciment dentaire dans une boîte de Pétri. À l’aide d’une petite cuillère métallique, empilez lentement le ciment dentaire autour de la canule. Laissez sécher pendant 5 s. Ensuite, retirez les bras de l’appareil stéréotaxique, en faisant attention de ne pas retirer la canule de guidage dans le processus. Continuez à empiler le ciment dentaire sur toute l’incision jusqu’à ce qu’un petit capuchon se forme (voir figure 1A).
- Placez les bouchons factices dans la canule de guidage à cet endroit pour éviter le blocage.
- Immédiatement après la chirurgie, injectez du kétoprofène (0,2 mg/kg) et une solution saline (200 μL) pour réduire la douleur et vous réhydrater. Fournissez de la nourriture ramollie ou de l’hydrogel aux souris après la chirurgie. Ne laissez pas les souris sans surveillance jusqu’à ce qu’elles aient repris conscience pour maintenir le décubitus sternal.
REMARQUE : Les souris sont également logées individuellement à partir de ce moment. - Injectez une solution saline (200 μL) et du kétoprofène (0,2 mg/kg) une fois par jour pendant deux jours après la chirurgie.
- Pendant 2 jours et jusqu’à 5 jours (au besoin) après la chirurgie, pesez les souris et surveillez leur poids. Si le poids ne revient pas aux niveaux d’avant la chirurgie dans les deux ou trois jours, consultez le vétérinaire au sujet de la méthode d’alimentation appropriée.
- Laissez les souris récupérer pendant au moins 7 jours avant de commencer l’entraînement comportemental.
2. Tâche de discrimination associative
- Infusions
- Administrer aux souris des perfusions spécifiques de l’inhibiteur du récepteur de la tyrosine kinase, K252a (50 μM ; 5 % de DMSO dans une solution saline) ou véhicule (5 % de DMSO dans une solution saline) comme suit.
- Administrez la perfusion dans l’OB des souris de manière bilatérale. Injectez un volume final de 2,0 μL par bulbe avec un débit d’infusion de 0,2 μL/min et un temps d’infusion total de 10 min à l’aide d’une pompe à injecteur double.
REMARQUE : Le moment de la manipulation peut être ajusté en fonction du type d’étude comportementale effectuée. Les étapes exactes de la perfusion sont spécifiques à chaque pompe d’injection et fournies dans le manuel du fabricant. - Assurez-vous de laisser les injecteurs à l’intérieur des canules pendant environ 5 minutes après l’administration pour inhiber le reflux et favoriser la diffusion. (c’est-à-dire prévoir un total de 15 minutes pour chaque perfusion).
- Administrez la perfusion dans l’OB des souris de manière bilatérale. Injectez un volume final de 2,0 μL par bulbe avec un débit d’infusion de 0,2 μL/min et un temps d’infusion total de 10 min à l’aide d’une pompe à injecteur double.
- Administrer aux souris des perfusions spécifiques de l’inhibiteur du récepteur de la tyrosine kinase, K252a (50 μM ; 5 % de DMSO dans une solution saline) ou véhicule (5 % de DMSO dans une solution saline) comme suit.
- Ensembles d’odeurs.
- Diluer tous les odorisants dans de l’huile minérale légère à une pression partielle de 1,0 Pa en utilisant un rapport précalculé basé sur la pression de vapeur (tableau 1).
- Utilisez les 5 paires d’odeurs distinctes du tableau 1 (les chiffres dans le tableau indiquent le volume en μL pour mélanger 50 mL d’huile minérale pour 1,0 Pa).
- Pour préparer le sable parfumé à utiliser pendant les étapes comportementales (sections 2.3 et 3), mélangez 400 μL de l’odorisant 1,0 Pa de l’étape 2.2.2 pour 100 g de sable de jeu.
- Façonnage
REMARQUE : Les souris doivent subir une mise en forme pendant une période de 10 jours comme décrit ci-dessous.- Amenez les souris dans la salle d’intervention et manipulez-les pendant 10 minutes par jour pendant les deux premiers jours suivant la récupération de la chirurgie.
- Le jour 3, placez une boîte de Pétri remplie de sable parfumé au (+)-limonène dans les cages domestiques des souris et remplie d’environ 10 pastilles de saccharose, chacune d’une masse de 5 mg.
REMARQUE : Utilisez 1,0 Pa (+)-limonène (mélanger 102 μL dans 50 ml d’huile minérale) comme odeur récompensée et de l’huile minérale ordinaire (l’agent diluant pour tester les odeurs) comme odeur non récompensée. Il est également recommandé de choisir des odorisants monomoléculaires, car ils sont plus susceptibles d’être nouveaux pour les souris. - Faites le plein de sable et de granulés le jour 4.
- Les jours 5 et 6, acclimatez les souris à l’appareil comportemental sur mesure, en les plaçant dans l’appareil et en les laissant explorer l’espace (Figure 1B,C). Fabriquez l’appareil à l’aide d’une cage domestique standard et de poly (méthacrylate de méthyle) pour construire deux couvercles et un séparateur central noir. Assurez-vous que les couvercles et le séparateur central sont 1 à 2 cm plus grands que la cage de la maison.
- Préparez une boîte de Pétri de sable parfumé au limonène et une autre avec du sable contenant de l’huile minérale. Après l’acclimatation les jours 5 et 6, placez les deux plats de sable dans la chambre d’essai et mélangez 10 pastilles de saccharose dans le plat parfumé au limonène pour servir de récompense. Placez chaque souris dans la chambre de test pendant 10 min et laissez-la explorer et consommer librement les pastilles de récompense.
- Le jour 7, introduisez les souris dans une version abrégée de la procédure de test finale, en plaçant les plats contenant du sable parfumé au limonène et à l’huile minérale dans l’appareil comportemental. Cette fois, incluez le séparateur central.
- Placez une seule récompense sur le sable parfumé au limonène et placez la souris dans la chambre de repos.
- Une fois que la souris a été placée dans la chambre de repos, soulevez le séparateur central pour permettre à la souris d’entrer dans la chambre d’essai pour enquêter et creuser dans les plats remplis de sable. Remettez la souris dans la chambre de repos après qu’elle ait récupéré la pastille de récompense ou après que 5 minutes se soient écoulées.
- Répétez ce processus pour un total de 10 essais pour chaque souris individuelle. Contrebalancez le placement du plat récompensé sur le côté gauche ou le côté droit en utilisant un générateur de nombres aléatoires. Il n’y a pas de périodes de repos entre les essais.
- Le jour 8, répétez les épreuves du jour 7, mais enfouissez aussi progressivement la pastille de plus en plus profondément dans le sable.
REMARQUE : La plupart des souris devraient creuser pour la pastille de récompense invisible d’ici le 10e essai le jour 8. - Le jour 9, augmentez le nombre d’essais à 20 pour chaque souris avec l’enfouissement complet et profond de pastilles de saccharose et introduisant les souris dans la chambre d’essai pendant 1 minute par essai. Laissez les souris creuser dans les deux plats pour la récompense.
- Le jour 10, répétez les 20 épreuves pour chaque souris, mais si elles creusent dans le plat non récompensé avant de creuser dans le plat récompensé, puis commencez l’épreuve suivante. Laissez les souris qui ont d’abord creusé dans le plat récompensé (parfumé au limonène) récupérer la pastille de récompense avant de les renvoyer dans la chambre de repos.
3. Formation et tests
REMARQUE : Une fois que les souris ont commencé à creuser de manière fiable pour les pastilles de récompense invisibles et odorantes, l’expérience peut commencer.
- Formation
REMARQUE : La phase d’entraînement commence deux jours après la fin du façonnage et consiste en 20 essais pour chaque souris. Avant la formation, administrez immédiatement les perfusions intrabulbaires (voir la section 2.1 pour les détails de la perfusion) et commencez la formation immédiatement après les perfusions.- Placez une souris dans la chambre de repos.
- Placez deux plats de sable parfumés avec une nouvelle paire d’odeurs dans la chambre d’essai, où une pastille de récompense est enterrée dans l’un des plats.
- Une fois que la chambre d’essai est prête, soulevez la barrière opaque et introduisez la souris dans la chambre d’essai. Remettez immédiatement la souris dans la chambre de repos, si la souris creuse en premier dans le plat non récompensé (notez ces épreuves comme un « 0 »). Si la souris creuse d’abord l’odeur gratifiante, laissez-la récupérer la pastille et renvoyez-la dans la chambre de repos. Enregistrez ces épreuves comme un « 1 ». Si l’épreuve dure 1 minute sans que la souris ne récupère la récompense, renvoyez-la dans la chambre de repos.
- Nettoyez et remplissez la vaisselle et commencez le prochain essai. Répétez la même chose pendant 20 essais.
- Test
REMARQUE : Les tests de mémoire peuvent être effectués à n’importe quelle durée d’intérêt pour le chercheur. Dans cette expérience, deux groupes distincts de souris ont été testés 2 h (STM) ou 48 h (LTM) suite à l’entraînement compte tenu de l’intérêt pour l’influence différentielle de K252a sur STM et LTM.- Effectuer les tests en utilisant les mêmes odeurs et la même procédure que celles décrites pour la formation (section 3.1).
REMARQUE : Selon la question de recherche, le chercheur peut avoir besoin d’inclure des groupes témoins. Par exemple, dans l’expérience précédemment publiée, les effets du blocage du récepteur Trk sur la consolidation de la mémoire ont été étudiés3. Par conséquent, un groupe témoin a reçu une perfusion de K252a avant le test de 48 heures pour montrer que les effets n’étaient pas dus à une interférence avec la récupération.
- Effectuer les tests en utilisant les mêmes odeurs et la même procédure que celles décrites pour la formation (section 3.1).
- Analyse statistique
REMARQUE : la syntaxe SPSS 22.0 pour chaque étape est fournie sous forme de fichier supplémentaire à titre d’exemple.- Effectuez une analyse statistique à l’aide de l’analyse linéaire à effets mixtes. Contrairement aux ANOVA, les modèles linéaires à effets mixtes peuvent mieux tenir compte des effets aléatoires et des mesures répétées.
- Calculez la mesure dépendante : « proportion correcte ». Rappelez-vous de la section 3.1.3 qu’un « 1 » a été attribué aux essais dans lesquels la souris a d’abord absorbé l’odeur gratifiante, et un « 0 » si la souris a creusé en premier dans l’odeur non gratifiante. Faites la moyenne des essais tous les cinq pour créer quatre blocs d’essai (tuberculose ; par exemple, le bloc d’essai 1 ou TB1 était la moyenne des essais 1 à 5, le bloc d’essai 2 ou TB 2 était la moyenne des essais 6 à 10 et ainsi de suite).
- Définir les variables indépendantes ou les effets fixes en tant que groupes de médicaments (K252a ou Véhicule ; Section 2.1.1) et les blocs d’essai (à partir de 3.3.1). Dans les résultats représentatifs ci-dessous, les variables utilisées pour chaque analyse sont spécifiées.
- Incluez la souris individuelle et l’ensemble d’odeurs imbriqués dans la souris en tant qu'« effets aléatoires » afin de compenser les différences comportementales intrinsèques chez les souris et les effets de l’utilisation de plusieurs ensembles d’odeurs.
- Effectuez une transformation logit sur la proportion correcte.
REMARQUE : La proportion correcte n’est pas une variable dépendante continue et non liée. Ainsi, il viole deux hypothèses pour les modèles linéaires. Par conséquent, la transformation logit est effectuée. - Utiliser des moyens marginaux estimés pour effectuer des tests post-hoc sur les interactions significatives identifiées par le modèle complet ; Les comparaisons multiples par paires doivent être corrigées dans les tests post-hoc. Bonferroni ou Šidák sont généralement utilisés.
Résultats
Comme décrit, ce protocole permet aux chercheurs d’évaluer l’influence de certaines manipulations sur l’apprentissage, la STM et la LTM. Des exemples de résultats de Tong et al, 20183 sont présentés ici. Les résultats soutiennent l’hypothèse selon laquelle le blocage du récepteur Trk inhibe sélectivement la LTM, mais pas l’apprentissage ou la STM.
La figure 2A montre les schémas de l’entraînement, du test STM et du test LTM. Tout d’abord, il a été démontré que les perfusions de K252a n’affectaient pas le taux d’apprentissage d’une association odeur-récompense. La figure 2B (section 3.1) montre le taux d’apprentissage du K252a et des groupes de véhicules de la formation. L’analyse statistique à l’aide d’un modèle linéaire mixte a été effectuée avec deux effets fixes, le groupe de médicaments et le bloc d’essai (TB) ; La souris et l’ensemble d’odeurs imbriquées dans la souris étaient des effets aléatoires. Les données des essais (section 3.2) n’ont pas été incluses dans l’analyse. Un effet principal significatif a été observé dans le bloc d’essai (F(3, 183,692) = 43,735, p < 0,001), mais aucun effet dans le groupe de médicaments (F(1, 85,685) = 0,132, p = 0,717) et aucune interaction significative (F(3, 183,692) = 0,111, p = 0,954). Des tests a posteriori, effectués à l’aide de l’ajustement de Šidák, ont confirmé que le K252a et les groupes de véhicules ne différaient sur aucun des blocs d’essai pendant la formation (p > 0,05 pour toutes les comparaisons). TB2, TB3 et TB4 étaient significativement plus élevés que TB1 pour toutes les comparaisons (p ≤ 0,001 dans tous les cas), démontrant que les deux groupes ont réussi à apprendre l’association odeur-récompense à la fin de 20 essais d’entraînement.
Ensuite, pour examiner les effets de la perfusion sur la STM et la LTM, la même analyse a été effectuée et a inclus les données des tests (section 3.2). Il a montré une interaction significative entre le groupe de médicaments et le bloc d’essai (F(2, 77,558) = 4,043, p = 0,021), sans effets principaux significatifs du groupe de médicaments (F(1, 55,629) = 1,438, p = 0,236) ou du bloc d’essai (F(2, 69,979) = 1,360, p = 0,263). Afin d’examiner spécifiquement la mémoire, des comparaisons post-hoc par paires avec la correction de Šidák, ont comparé les différences entre le dernier bloc d’essai de l’entraînement (section 3.1) et le premier bloc d’essai de test (section 3.2) soit 2 (STM) ou 48 heures (LTM) plus tard. Pour les souris ayant été injectées dans un véhicule, les comparaisons ont montré une rétention de la mémoire associative à la fois 2 et 48 h après l’entraînement (p > 0,05 pour toutes les comparaisons avec la performance d’entraînement). Pour les souris perfusées au K252a, le premier bloc d’essai du test de 2 heures (STM) ne différait pas du dernier bloc d’essai de l’entraînement (p > 0,05) ; Cependant, leurs performances de mémoire étaient significativement plus faibles après 48 h (p = 0,018). De plus, la mémoire à l’essai de 48 heures a été significativement réduite par rapport à la mémoire de l’essai de 2 heures (p = 0,009) et à la performance du groupe de véhicules lors de l’essai de 48 heures (p = 0,006). Il n’y avait pas de différence de STM entre les souris perfusées avec véhicule et K252a (p = 0,356). Ensemble, les résultats montrent que l’inhibition K252a des récepteurs Trk dans le bulbe olfactif perturbe sélectivement la mémoire des odeurs à long terme, mais pas à court terme (Figure 3).
| Set d’odeurs | Odeur 1 | Odeur 2 |
| 1 | Acide pentanoïque | Acide butanoïque |
| 225.1 | 63.6 | |
| 2 | hexanal | heptanal |
| 11.1 | 35.3 | |
| 3 | acétate de propyle | acétate de butyle |
| 3.1 | 10.9 | |
| 4 | 2-octanone | 2-heptanone |
| 87.4 | 28.7 | |
| 5 | Pentanol | hexanol |
| 37.2 | 127.3 |
Tableau 1 : Volumes de mélange pour les ensembles d’odeurs. Chaque rangée montre deux odeurs qui peuvent être utilisées par paire pour les étapes comportementales. Par exemple, pour utiliser le premier « ensemble d’odeurs », faites les mélanges d’acide pentanoïque et d’acide butanoïque. Les chiffres dans le tableau indiquent le volume en μL à mélanger dans 50 mL d’huile minérale pour une concentration de 1,0 Pa de chaque odeur. Pendant la formation et les tests, une boîte de Pétri était parfumée à l’acide pentanoïque, l’autre à l’acide butanoïque.

Figure 1 : Placement de la canulation et appareil comportemental. (A) Montre la position relative de la canule, du capuchon de ciment dentaire et des vis par rapport à la tête de la souris. Notez que les aiguilles de la canule atteignent les deux bulbes olfactifs, le piédestal lui-même est encastré dans le capuchon de ciment dentaire. Les vis sont placées dans deux trous percés dans le crâne au-dessus de la formation cérébelleuse. Les vis ne touchent pas le cerveau lui-même, mais elles agissent comme une ancre caudale pour le capuchon de ciment dentaire. La figure montre la taille relative pour fabriquer le capuchon de ciment. (B) Montre l’appareil comportemental assemblé. Le corps est une cage domestique typique de souris. Les couvercles avec des trous pour l’air étaient en plexiglas. Le séparateur central est également en plexiglas noir. Les couvercles doivent être en plexiglas suffisamment lourd pour qu’ils puissent servir de tractus pour que le séparateur central soit soulevé et posé pendant les essais. (C) Montre un côté de l’appareil comportemental. Notez que le séparateur central est légèrement plus haut que la cage pour faciliter le levage. Des boîtes de Pétri de sable peuvent être placées le long du bord. Veuillez cliquer ici pour voir une version agrandie de cette figure.
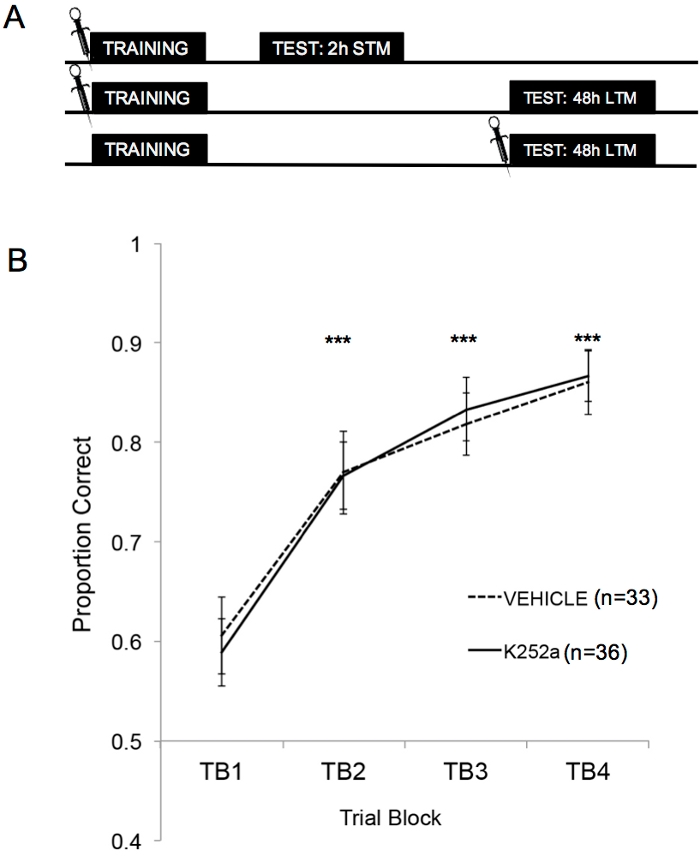
Figure 2 : Conception de l’étude et résultats de l’apprentissage. (A) Montre le schéma de la conception de l’étude. Notez que les groupes STM et LTM étaient indépendants (c’est-à-dire différents groupes de souris). Les symboles au début des blocs indiquent l’heure à laquelle les infusions étaient données. (B) Indique la proportion correcte pour les épreuves 1 à 20 pendant l’entraînement. Les résultats indiquent que les groupes K252a et véhicules ne différaient pas dans leur taux d’apprentissage (pente des lignes). Les barres d’erreur représentaient l’erreur type de la moyenne (SEM). Les astérisques montrent des augmentations significatives en proportion correcte par rapport à TB1 pour les cohortes véhicule et K252a (p ≤ 0,001 pour toutes les comparaisons). Cette figure est adaptée de Tong et al. 2018 avec la permission3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
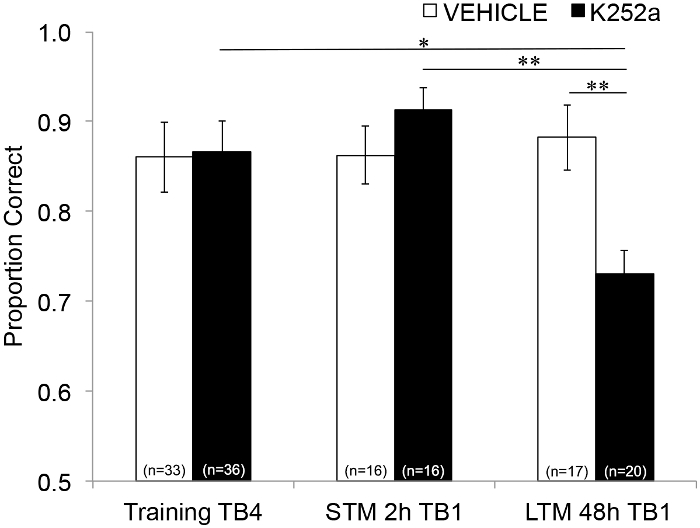
Figure 3 : Effets différentiels du blocage du récepteur Trk sur STM et LTM. Montre la proportion correcte pour le bloc d’essai 4 de la formation et le bloc d’essai 1 des tests STM et LTM. C’est-à-dire qu’un modèle mixte linéaire est utilisé pour comparer la proportion correcte au cours du dernier bloc d’essai de la phase d’entraînement (Figure 2 ; Training-TB4) à ceux lors des premiers blocs d’essai (Testing-TB1) de test de mémoire à court terme (test de 2 heures) et à long terme (test de 48 heures). Le modèle mixte linéaire a eu deux effets fixes : le groupe de médicaments et le bloc d’essai (Training-TB4, STM-TB1, LTM-TB1). Les effets aléatoires étaient la souris et l’ensemble d’odeurs imbriquées dans la souris. Des comparaisons a posteriori ont révélé que les souris K252a présentaient une LTM significativement altérée (comparaison avec l’entraînement TB4 ; p = 0,018) mais pas STM (p > 0,05). La performance LTM des souris infusées au K252a était également significativement inférieure à celle des souris injectées au K252a (p = 0,009) et inférieure à celle des souris véhicules (p = 0,006). Les barres d’erreur représentaient le MEB. Cette figure est adaptée de Tong et al. 2018 avec la permission3. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Fichier supplémentaire : Syntaxe utilisée pour l’analyse statistique. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le conditionnement de la peur à un essai est un protocole comportemental puissant pour étudier la dynamique moléculaire et cellulaire de la mémoire, mais une grande partie de l’apprentissage naturel est incrémentale et mieux modélisée à travers un paradigme comme celui décrit ci-dessus. L’inhibition des récepteurs Trk dans l’OB a empêché la consolidation de la mémoire olfactive dans un paradigme d’apprentissage appétitif multi-essais, comme montré précédemment par notre groupe3. Cette découverte ouvre de nouvelles voies pour la recherche sur le timing différentiel des mécanismes moléculaires, comme les neurotrophines, dans l’apprentissage appétitif et aversif.
Cette expérience comprenait deux parties essentielles : (1) la canulation et (2) la tâche de discrimination associative (subdivisée en mise en forme, entraînement et test). Les expérimentateurs peuvent adapter ce protocole à leur question de recherche spécifique. Par exemple, nous nous sommes principalement intéressés à l’OB et ce protocole établi peut être facilement appliqué à d’autres études OB. Pour les expérimentateurs ayant d’autres régions d’intérêt, il sera important de valider les sites de perfusion dans une étude pilote. Les expérimentateurs peuvent également avoir besoin de tenir compte du taux de diffusion, de la pénétration spatiale et de la durée de bioactivité de ce qu’ils infusent.
Les étapes de façonnage décrites dans le protocole ont été largement utilisées par les auteurs de ce protocole. Leur respect tel que décrit semble être important pour que les souris apprennent la tâche en temps opportun. En utilisant d’autres chronologies, les auteurs ont observé une plus grande variance entre les souris dans leur familiarité avec la tâche, ce qui signifiait une formation supplémentaire pour amener toutes les souris à un critère de test avec des odeurs expérimentales. Pour la formation et les tests, le chercheur dispose d’une certaine flexibilité, en fonction de ses intérêts de recherche, en ce qui concerne le nombre d’essais, la concentration des odeurs expérimentales et la similitude des odeurs les unes avec les autres. Nous recommandons l’utilisation de plusieurs ensembles d’odeurs lorsque cela est possible, comme nous l’avons décrit, afin de réduire le nombre d’animaux utilisés pour l’expérience. Voir la section Analyse statistique pour obtenir des conseils sur la façon de tenir compte de l’utilisation de plusieurs ensembles d’ordres dans l’analyse finale. En principe, la similitude de la paire d’odeurs peut être modifiée pour ajuster la difficulté de la discrimination. Dans l’étude précédemment publiée de notre groupe3, les paires d’odeurs sont constituées de deux odorisants du même groupe fonctionnel mais différant l’un de l’autre par une longueur de carbone. Ces discriminations sont plus difficiles que les paires qui diffèrent de deux longueurs de carbone ou plus, mais plus faciles que les énantiomères (par exemple, (+)-limonène et (-)-limonène). Les odorisants de différents groupes fonctionnels sont très différents sur le plan perceptuel. Cleland et al13 discutent d’autres variations de stimulus et de leur effet sur des paramètres d’apprentissage spécifiques.
L’une des principales limites de ce protocole est qu’il prend beaucoup plus de temps à réaliser par rapport aux tâches d’apprentissage associatif automatisées où plusieurs animaux pourraient être testés en parallèle. Pour un test donné, il faudrait au moins 20 minutes à un chercheur pour effectuer 20 essais pour une souris. Cependant, c’est ce manque d’automatisation qui signifie que le protocole est plus accessible financièrement, une priorité pour de nombreuses institutions. Il est important de noter que, dans le cas de cette expérience, il a été constaté que ce protocole est très facile à traiter et efficace pour former des chercheurs de premier cycle qui s’intéressent aux neurosciences comportementales. En particulier, ces étudiants développent de solides compétences en manipulation d’animaux en plus des avantages habituels de la participation à la recherche.
Les chercheurs qui souhaitent adopter ce paradigme peuvent faire varier plusieurs paramètres. Apparemment, les manipulations pharmacologiques des mécanismes sont diverses, et ce protocole comportemental peut être utilisé avec des techniques chimiogénétiques ou diverses autres façons de manipuler les voies moléculaires et cellulaires (par exemple, l’optogénétique). Le paradigme lui-même peut être ajusté pour varier le type d’apprentissage et de mémoire testé. Par exemple, les chercheurs peuvent ajuster la similitude des deux odeurs présentées afin de contrôler le taux d’apprentissage. Dans notre étude3, les paires d’odeurs sont constituées de deux odorisants du même groupe fonctionnel mais différant l’un de l’autre par une longueur de carbone. Ces discriminations sont plus difficiles que les paires qui diffèrent de deux longueurs de carbone ou plus, mais plus faciles que les énantiomères (par exemple (+)-limonène et (-)-limonène). Les odorisants de différents groupes fonctionnels sont très différents sur le plan perceptuel. Cleland et al13 discutent d’un plus grand nombre de variations de stimuli et de leur effet sur des paramètres d’apprentissage spécifiques, concluant que des odeurs plus similaires sont plus difficiles à discriminer et prennent donc plus de temps à apprendre14. Ces manipulations affecteraient également la force des souvenirs. Dans le même ordre d’idées, les chercheurs pourraient être intéressés à tester la mémoire à différents moments après l’apprentissage. Par exemple, deux études 15,16 ont examiné le rôle du BDNF dans la persistance LTM pour une tâche d’apprentissage aversif d’un essai. BDNF est un ligand de TrkB. Les études ont montré que la perfusion d’oligonucléotides antisens anti-BDNF dans l’hippocampe 12 heures après l’apprentissage bloquait le LTM 7 jours plus tard, mais pas 2 jours plus tard. Cette étude montre que l’échelle de temps des mécanismes moléculaires après l’apprentissage initial joue des rôles intéressants, et encore à comprendre, dans la LTM. Cet article décrit un protocole comportemental qui permettrait d’étudier ces échelles de temps. D’autres paramètres d’intérêt pour une application future incluent le modèle de souris utilisé. Par exemple, il serait intéressant de remplacer les souris mâles (qui ont une neurobiologie nettement mieux étudiée)17 par des souris femelles dans les études futures afin d’examiner les variations du taux d’apprentissage, du STM et du LTM, car les mammifères femelles ont une sensibilité et une sélectivité plus élevées aux odeurs que les mammifères mâles18. Bien sûr, les modèles de maladies chez les rongeurs peuvent également être utilisés efficacement avec ce protocole.
Déclarations de divulgation
Les auteurs de cet article n’avaient pas d’intérêts financiers concurrents.
Remerciements
Le projet a été soutenu par le Scantland Summer Collaborative Research Gift et le Stephen and Sylvia Tregidga Burges Endowed Research Fund. Les auteurs tiennent à remercier leurs collègues du Département de psychologie et du programme de neurosciences du Collège Earlham pour leur soutien et leurs conseils.
matériels
| Name | Company | Catalog Number | Comments |
| Double guide cannula | PlasticsOne | C235GS-5-1.5/SPC | Custom order |
| (-)-limonene | Sigma-Aldrich | 218367-50G | |
| (+)-limonene | Sigma-Aldrich | 183164-100ML | |
| 2-hetanone | Sigma-Aldrich | 537683 | |
| 2-octanone | Sigma-Aldrich | O4709 | |
| 5mg sucrose pellets | Test Diet | 1811560 | Custom size. Used for rewards |
| Butanoic acid | Sigma-Aldrich | B103500 | |
| butyl acetate | Sigma-Aldrich | 402842 | |
| Dental Cement Powder (Coral) | A-M Systems | 525000 | |
| Dental Cement Solvent | A-M Systems | 526000 | |
| Double connector assembly | PlasticsOne | C232C | |
| Double dummy cannula | PlasticsOne | C235DCS-5/SPC dummy dbl | Custom order |
| Double injector | PlasticsOne | C235IS-5/SPC | Custom order |
| Drill | Kopf Instruments | Model 1474 High Speed Stereotaxic Drill | This drill requires an additional "adaptor" piece in order to fit certain drill bits. We get by this problem by wrapping the drill bit with lab tape to increase the circumference of the drill it to fit. This may not be an option for surgeries requiring sterile technique. |
| Eye Ointment | Purchase from local pharmacy | ||
| Figure 1 illustration software | BioRender | ||
| heptanal | Sigma-Aldrich | W254002 | |
| hexanal | Sigma-Aldrich | 115606 | |
| hexanol | Sigma-Aldrich | H13303 | |
| Infusion pump model 11 | Harvard Apparatus | 4169D | Used pumps available via American Instrument Exchange |
| Isoflurane | Santa Cruz Animal Health | sc-363629Rx | Vet prescription needed for order |
| K252a | Sigma-Aldrich | K2015 | Mixed to 50uM in DMSO (5%) |
| Ketoprofen | Allivet | 25920 | Vet prescription needed for order |
| Lidocaine | Aspercreme | Purchased from Amazon | |
| Mounting Screws | PlasticsOne | 00-96 X 3/32 | |
| Mouse Anesthesia Mask | Kopf Instruments | Model 907 Mouse Anesthesia Mask | Used with the stereotaxic to allow oxygen and anesthesia while mouse in stereotax |
| Mouse Nose Adaptor | Kopf Instruments | Model 926 Mouse Adaptor | Used with the stereotaxic to allow for head of mouse to be secured. |
| Novalsan | Jeffers | 41375 | |
| Pentanoic acid | Sigma-Aldrich | 240370 | |
| pentanol | Sigma-Aldrich | 138975 | |
| Petri dish glass bottoms | VWR | 10754-804 | |
| Polycarbonate Café bottoms | Ancare | N10PCSEC | Use normal housing cages and custom fit a track in the middle to act as the track for an opaque plexiglass divider |
| propyl acetate | Sigma-Aldrich | 537438 | |
| Quikrete Premium Play Sand | Purchase from local hardware store | ||
| Saline | Insight Needles | N/A | Sterile saline for drug mixing |
| Stereotaxic apparatus | Kopf Instruments | Model 902 Small Animal Stereotaxic Instrument | |
| Testing chamber | Ancare | N10PCSEC | Our testing chambers are modified using the regular mouse housing cage. The manuscript details what was done. |
| Vetbond Tissue Adhesive | 3M | Purchased from Amazon |
Références
- Grimes, M. T., Smith, M., Li, X., Darby-King, A., Harley, C. W., Mclean, J. H. Mammalian Intermediate-Term Memory: New Findings in Neonate Rat. Neurobiology of Learning and Memory. 95 (3), 385-391 (2011).
- Grimes, M. T., Harley, C. W., Darby-King, A., Mclean, J. H. PKA Increases in the Olfactory Bulb Act as Unconditioned Stimuli and Provide Evidence for Parallel Memory Systems: Pairing Odor with Increased PKA Creates Intermediate- and Long-Term, but not Short-Term, Memories. Learning and Memory. 19 (3), 107-115 (2012).
- Tong, M. T., Kim, T. Y. P., Cleland, T. A. Kinase Activity in the Olfactory Bulb is Required for Odor Memory Consolidation. Learning & Memory. 25 (5), 198-205 (2018).
- Devore, S., Lee, J., Linster, C. Odor Preferences Shape Discrimination Learning in Rats. Behavioral Neuroscience. 127 (4), 498-504 (2013).
- Gao, Y., Strowbridge, B. W. Long-Term Plasticity of Excitatory Inputs to Granule Cells in the Rat Olfactory Bulb. Nature Neuroscience. 12 (6), 731-733 (2009).
- Bath, K. G., Mandairon, N., et al. Variant Brain-Derived Neurotrophic Factor (Val66Met) Alters Adult Olfactory Bulb Neurogenesis and Spontaneous Olfactory Discrimination. Journal of Neuroscience. 28 (10), 2383-2393 (2008).
- Lazarini, F., Lledo, P. M. Is Adult Neurogenesis Essential for Olfaction. Trends in Neurosciences. 34 (1), 20-30 (2011).
- Mandairon, N., Peace, S., Karnow, A., Kim, J., Ennis, M., Linster, C. Noradrenergic Modulation in the Olfactory Bulb Influences Spontaneous and Reward-Motivated Discrimination, but not the Formation of Habituation Memory. European Journal of Neuroscience. 27 (5), 1210-1219 (2008).
- Guérin, D., Peace, S. T., Didier, A., Linster, C., Cleland, T. A. Noradrenergic Neuromodulation in the Olfactory Bulb Modulates Odor Habituation and Spontaneous Discrimination. Behavioral Neuroscience. 122 (4), 816-826 (2008).
- Moreno, M. M., Bath, K., Kuczewski, N., Sacquet, J., Didier, A., Mandairon, N. Action of the Noradrenergic System on Adult-Born Cells Is Required for Olfactory Learning in Mice. Journal of Neuroscience. 32 (11), 3748-3758 (2012).
- Vinera, J., Kermen, F., Sacquet, J., Didier, A., Mandairon, N., Richard, M. Olfactory Perceptual Learning Requires Action of Noradrenaline in the Olfactory Bulb: Comparison with Olfactory Associative Learning. Learning and Memory. 22 (3), 192-196 (2015).
- Dillon, T. S., Fox, L. C., Han, C., Linster, C. 17β-estradiol Enhances Memory Duration in the Main Olfactory Bulb in CD-1 Mice. Behavioral Neuroscience. 127 (6), 923 (2013).
- Cleland, T. A., Narla, V. A., Boudadi, K. Multiple Learning Parameters Differentially Regulate Olfactory Generalization. Behavioral Neuroscience. 123 (1), 26 (2009).
- Cleland, T. A., Morse, A., Yue, E. L., Linster, C. Behavioral Models of Odor Similarity. Behavioral Neuroscience. 116 (2), 222-231 (2002).
- Bekinschtein, P., Cammarota, M., Igaz, L., Bevilaqua, L., Izquierdo, I., Medina, J. Persistence of Long-Term Memory Storage Requires a Late Protein Synthesis- and BDNF- Dependent Phase in the Hippocampus. Neuron. 53 (2), 261-277 (2007).
- Bekinschtein, P., et al. BDNF is Essential to Promote Persistence of Long-Term Memory Storage. Proceedings of the National Academy of Sciences. 105 (7), 2711-2716 (2008).
- Andreano, J., Cahill, L. Sex influences on the neurobiology of learning and memory. Learning and Memory. 16 (2009), 248-266 (2009).
- Kass, M. D., Czarnecki, L. A., Moberly, A. H., Mcgann, J. P. Differences in Peripheral Sensory Input to the Olfactory Bulb Between Male and Female Mice. Scientific Reports. 7 (1), (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon