Method Article
Un'attività di associazione odore-ricompensa a basso costo per test di apprendimento e memoria
In questo articolo
Riepilogo
Un compito di apprendimento associativo che premia gli odori è stato utilizzato per studiare gli effetti differenziali della manipolazione fisiologica sulla memoria a lungo e breve termine.
Abstract
Paradigmi comportamentali robusti e semplici della memoria appetitiva e associativa sono cruciali per i ricercatori interessati ai meccanismi cellulari e molecolari della memoria. In questo articolo, viene descritto un protocollo comportamentale del topo efficace e a basso costo per esaminare gli effetti della manipolazione fisiologica (come l'infusione di agenti farmacologici) sul tasso di apprendimento e sulla durata della memoria odore-ricompensa. I risultati rappresentativi sono forniti da uno studio che esamina il ruolo differenziale dell'attività del recettore della tirosin-chinasi nella memoria a breve termine (STM) e a lungo termine (LTM). I topi maschi sono stati condizionati ad associare una ricompensa (pellet di zucchero) con uno dei due odori, e la loro memoria per l'associazione è stata testata 2 o 48 ore dopo. Immediatamente prima dell'addestramento, un inibitore del recettore della tirosin-chinasi (Trk) o infusioni di veicoli sono stati somministrati nel bulbo olfattivo (OB). Sebbene non vi sia stato alcun effetto dell'infusione sulla velocità di apprendimento, il blocco dei recettori Trk nell'OB ha compromesso selettivamente LTM (48 ore) e non la memoria a breve termine (STM; 2 ore). La compromissione dell'LTM è stata attribuita alla ridotta selettività degli odori, misurata dalla lunghezza del tempo di scavo. Il culmine dei risultati di questo esperimento ha mostrato che l'attivazione del recettore Trk nell'OB è la chiave nel consolidamento della memoria olfattiva.
Introduzione
I meccanismi di formazione della memoria associativa sono stati precedentemente studiati prevalentemente sulla base di studi di condizionamento della paura in un solo processo. Tuttavia, molte attività banali hanno in genere modelli di acquisizione più complessi e si basano su incontri ripetuti. L'obiettivo di questo protocollo è quello di fornire un paradigma comportamentale dei roditori economicamente vantaggioso che viene utilizzato per comprendere i meccanismi cellulari e molecolari dell'apprendimento appetitivo e della memoria multi-trial.
L'apprendimento degli odori che dipende dal bulbo olfattivo principale (OB) offre diversi vantaggi per lo studio della memoria appetitiva multi-trial. In primo luogo, le memorie OB-dipendenti hanno durate variabili (STM, LTM e memoria a medio termine1) e si basano sullo stesso meccanismo molecolare 2,3 e strutturale di altre parti del cervello, tra cui la neuromodulazione4, il potenziamento a lungo termine5 e la neurogenesi adulta 6,7,8. In secondo luogo, a differenza delle regioni di ordine superiore, come l'ippocampo, le memorie dipendenti dall'OB consentono di osservare una corrispondenza più diretta tra le manipolazioni dello sperimentatore dell'ambiente percettivo e i cambiamenti nei circuiti neurali responsabili dell'apprendimento 8,9,10,11 . In questo articolo, viene descritto in dettaglio un paradigma di apprendimento e memoria associativa dipendente dall'OB, che può essere utilizzato per studiare i meccanismi molecolari e strutturali generali. È stato sviluppato per consentire ai ricercatori di accedere ai vantaggi dell'apprendimento olfattivo per lo studio dei meccanismi cellulari e molecolari della memoria.
Nella nostra recente pubblicazione3, il protocollo qui descritto è stato utilizzato per dimostrare che il consolidamento dell'apprendimento degli odori appetitivi dipende dall'attivazione del recettore Trk all'interno dell'OB. Nel protocollo seguente, vengono discusse anche le aree in cui il paradigma comportamentale può essere adattato per diverse esigenze sperimentali.
In questo studio sono stati utilizzati un totale di 27 topi maschi adulti CD-1, di 8 settimane di età al momento dell'incannulamento. Per le distribuzioni precise dei gruppi e l'uso del set di odori, vedere la sezione sui metodi della nostra precedente pubblicazione3. I topi maschi sono stati utilizzati per evitare grandi fluttuazioni nei livelli di estrogeni perché ricerche precedentihanno dimostrato che la memoria olfattiva è migliorata dall'aumento dei livelli di estrogeni. Questi topi sono sempre stati mantenuti su un ciclo inverso luce/buio di 12:12 h e avevano accesso all'acqua. Durante gli esperimenti comportamentali, le diete dei topi sono state limitate per mantenerli a ~90% del loro peso libero di alimentazione. La restrizione dietetica è iniziata 3 giorni prima dell'inizio dell'esperimento comportamentale. Come verrà descritto di seguito, lo stesso gruppo di topi viene presentato con diversi set di odori al fine di raggiungere i livelli appropriati di potenza statistica riducendo al minimo l'uso da parte dell'animale. La sezione di analisi statistica mostra come tenere conto della varianza casuale che può essere introdotta da questo.
Protocollo
Il protocollo seguente aderisce alle linee guida per la cura degli animali dell'IACUC dell'Earlham College.
1. Incannulamento del bulbo olfattivo
NOTA: Questi interventi chirurgici non richiedono una tecnica sterile poiché non richiedono l'esecuzione di grandi incisioni. Tuttavia, ogni istituzione può differire nelle proprie esigenze. Se gli sperimentatori stanno eseguendo questo intervento chirurgico su ceppi di topo immunocompromessi, potrebbero essere necessarie ulteriori considerazioni. Nel complesso, gli sperimentatori sono incoraggiati a discutere questo protocollo con il proprio veterinario e il team di cura degli animali prima dell'uso e a pulire e disinfettare tutti gli strumenti tra un intervento chirurgico e l'altro.
- Durante l'installazione, immergere le cannule e le viti in un piccolo becher o in una piastra di Petri contenente il 32% di clorexidina per mantenerle disinfettate.
- Anestetizzare i topi con isoflurano gassoso al 4% in ossigeno puro e fissarli in un apparato stereotassico. Durante l'intervento chirurgico, assicurarsi che i topi siano mantenuti sotto anestesia con isoflurano all'1,5-2% fornita attraverso un cono nasale. Monitorare la respirazione durante l'intervento. Usa un unguento per gli occhi per prevenire la secchezza degli occhi durante l'anestesia.
- Dopo che il mouse è stato fissato e non risponde più a un pizzico deciso del piede posteriore, utilizzare il 32% di clorexidina per strofinare la parte superiore della testa al fine di pulire la superficie dell'incisione.
- Quindi, strofinare la parte superiore della testa in direzione rostrale o caudale con lidocaina (analgesia topica).
- Premere con decisione per praticare una singola incisione lungo la linea mediana con una lama di bisturi pulita.
- Utilizzando un trapano fissato allo stereotassico, praticare due fori sui bulbi olfattivi per la cannula guida (26 G) utilizzando le coordinate AP +5,0 mm, ML +/-0,75 mm rispetto al bregma.
- Praticare due fori sulla formazione cerebellare.
NOTA: La posizione di queste viti non deve essere precisa, assicurarsi che siano simmetriche lungo la linea mediana. - Posiziona le viti nei due fori sopra la formazione cerebellare e usa un adesivo tissutale per fissare queste viti al cranio.
- Utilizzare lo stereotassico per inserire la cannula guida (26 G) nei fori praticati sopra i bulbi olfattivi (passaggio 1.6). Abbassare la cannula DV di 1,0 mm.
- Mescolare il cemento dentale in una capsula di Petri. Usa una piccola paletta di metallo per impilare lentamente il cemento dentale attorno alla cannula. Lasciare asciugare per 5 s. Quindi, rimuovere i bracci del dispositivo stereotassico, facendo attenzione a non estrarre la cannula guida durante il processo. Continuare ad accumulare il cemento dentale su tutta l'incisione fino a formare un piccolo tappo (vedere la Figura 1A).
- A questo punto, posizionare i tappi ciechi nella cannula guida per evitare l'ostruzione.
- Immediatamente dopo l'intervento, iniettare ketoprofene (0,2 mg/kg) e soluzione salina (200 μL) per ridurre il dolore e reidratare. Fornire cibo ammorbidito o idrogel ai topi dopo l'intervento chirurgico. Non lasciare i topi incustoditi fino a quando non hanno ripreso conoscenza per mantenere la decubito sternale.
NOTA: Da questo momento in poi anche i mouse vengono alloggiati singolarmente. - Iniettare soluzione salina (200 μL) e ketoprofene (0,2 mg/kg) una volta al giorno per due giorni dopo l'intervento.
- Per 2 giorni e fino a 5 giorni (se necessario) dopo l'intervento, pesare i topi e monitorare il loro peso. Se il peso non torna ai livelli pre-operatorio entro due o tre giorni, consultare il veterinario sul metodo di alimentazione appropriato.
- Lasciare che i topi si riprendano per almeno 7 giorni prima di iniziare l'allenamento comportamentale.
2. Compito di discriminazione associativa
- Infusioni
- Somministrare ai topi infusioni specifiche per l'ostetricia dell'inibitore del recettore tirosin-chinasico, K252a (50 μM; 5% DMSO in soluzione fisiologica) o veicolo (5% DMSO in soluzione fisiologica) come segue.
- Erogare l'infusione nell'ostetrica dei topi bilateralmente. Iniettare 2,0 μl di volume finale per bulbo con una velocità di infusione di 0,2 μl/min e 10 min di tempo di infusione totale utilizzando una pompa a doppio iniettore.
NOTA: I tempi della manipolazione possono essere regolati a seconda del tipo di studio comportamentale eseguito. Le fasi esatte dell'infusione sono specifiche per ciascuna pompa dell'iniettore e fornite nel manuale del produttore. - Assicurarsi di lasciare gli iniettori all'interno delle cannule per circa 5 minuti dopo l'erogazione per inibire il riflusso e favorire la diffusione. (cioè, pianificare un totale di 15 minuti per ogni infusione).
- Erogare l'infusione nell'ostetrica dei topi bilateralmente. Iniettare 2,0 μl di volume finale per bulbo con una velocità di infusione di 0,2 μl/min e 10 min di tempo di infusione totale utilizzando una pompa a doppio iniettore.
- Somministrare ai topi infusioni specifiche per l'ostetricia dell'inibitore del recettore tirosin-chinasico, K252a (50 μM; 5% DMSO in soluzione fisiologica) o veicolo (5% DMSO in soluzione fisiologica) come segue.
- Set di odori.
- Diluire tutti gli odorizzanti in olio minerale leggero a una pressione parziale di 1,0 Pa utilizzando un rapporto precalcolato basato sulla pressione di vapore (Tabella 1).
- Utilizzare le 5 coppie di odori separate della Tabella 1 (i numeri nella tabella indicano il volume in μL da miscelare in 50 ml di olio minerale per 1,0 Pa).
- Per preparare la sabbia profumata da utilizzare durante le fasi comportamentali (Sezione 2.3 e 3), miscelare 400 μL dell'odorizzante 1,0 Pa della Fase 2.2.2 per ogni 100 g di sabbia da gioco.
- Sagomatura
NOTA: I topi devono essere modellati per un periodo di 10 giorni come descritto di seguito.- Porta i topi in sala operatoria e maneggiali per 10 minuti al giorno per i primi due giorni dopo il recupero dall'intervento chirurgico.
- Il giorno 3, metti una capsula di Petri riempita con sabbia profumata al (+)-limonene nelle gabbie domestiche dei topi e riempita con circa 10 pellet di saccarosio, ciascuno in massa di 5 mg.
NOTA: Utilizzare 1,0 Pa (+)-limonene (mescolare 102 μL in 50 ml di olio minerale) come odore ricompensato e olio minerale semplice (l'agente diluente per gli odori di prova) come odore non ricompensato. Si consiglia anche di scegliere odori monomolecolari poiché è molto probabile che questi siano nuovi per i topi. - Rifornisci sia la sabbia che i pellet il giorno 4.
- Nei giorni 5 e 6, acclimatare i topi all'apparato comportamentale personalizzato, inserendoli nell'apparato e lasciandoli esplorare lo spazio (Figura 1B, C). Realizzare l'apparecchio utilizzando una gabbia domestica standard e polimetilmetacrilato per costruire due coperchi e un divisore centrale nero. Assicurati che sia i coperchi che il divisorio centrale siano 1-2 cm più grandi della gabbia domestica.
- Preparare una capsula di Petri di sabbia profumata al limonene e un'altra con sabbia contenente olio minerale. Dopo l'acclimatazione, sia il giorno 5 che il giorno 6, posiziona entrambi i piatti di sabbia nella camera di prova e mescola 10 pellet di saccarosio nel piatto profumato al limonene per fungere da ricompensa. Posiziona ogni topo nella camera di prova per 10 minuti e lascia che esplori e consumi liberamente i pellet di ricompensa.
- Il giorno 7, introdurre i topi a una versione ridotta della procedura di test finale, posizionando le piastre contenenti sabbia profumata al limonene e all'olio minerale nell'apparato comportamentale. Questa volta includi il divisore centrale.
- Posiziona una singola ricompensa sopra la sabbia profumata al limonene e posiziona il topo nella camera di riposo.
- Una volta che il topo è stato posizionato nella camera di riposo, sollevare il divisore centrale per consentire al topo di entrare nella camera di prova per indagare e scavare nei piatti pieni di sabbia. Rimetti il mouse nella camera di riposo dopo che ha recuperato la pallina della ricompensa o dopo che sono trascorsi 5 minuti.
- Ripetere questo processo per un totale di 10 prove per ogni singolo topo. Controbilancia il posizionamento del piatto premiato sul lato sinistro o destro utilizzando un generatore di numeri casuali. Non ci sono periodi di riposo tra le prove.
- Il giorno 8, ripeti le prove del giorno 7, ma seppellisci anche progressivamente il pellet sempre più in profondità nella sabbia.
NOTA: La maggior parte dei topi dovrebbe scavare alla ricerca del pellet di ricompensa invisibile entro ladecima prova del giorno 8. - Il giorno 9, aumentare il numero di prove a 20 prove per ogni topo con l'interramento completo e profondo del pellet di saccarosio e l'introduzione dei topi nella camera di prova per 1 minuto per prova. Lascia che i topi scavino in entrambi i piatti per la ricompensa.
- Il giorno 10, ripeti le 20 prove per ogni topo, ma se scavano nel piatto non ricompensato prima di scavare nel piatto ricompensato, quindi inizia la prova successiva. Consenti ai topi che per primi hanno scavato nel piatto ricompensato (profumato al limonene) di recuperare la pallina della ricompensa prima di rimandarli nella camera di riposo.
3. Formazione e test
NOTA: Una volta che i topi hanno iniziato a scavare in modo affidabile per i pellet di ricompensa invisibili e odorosi, l'esperimento può iniziare.
- Formazione
NOTA: La fase di formazione inizia due giorni dopo il completamento della sagomatura e consiste in 20 prove per ogni topo. Prima della formazione, somministrare immediatamente le infusioni intrabulbari di farmaco/veicolo (vedere la Sezione 2.1 per i dettagli sull'infusione) e iniziare la formazione immediatamente dopo le infusioni.- Metti un topo nella camera di riposo.
- Metti due piatti di sabbia profumati con una nuova coppia di odori nella camera di prova, dove una pallina di ricompensa è sepolta in uno dei piatti.
- Una volta che la camera di prova è pronta, sollevare la barriera opaca e introdurre il mouse nella camera di prova. Rimetti immediatamente il topo nella camera di riposo, se il topo scava per primo nel piatto non ricompensato (registra queste prove come uno "0"). Se il topo scava per primo nell'odore gratificante, lasciagli recuperare il pellet e rimetterlo nella camera di riposo. Registra queste prove come "1". Se la prova dura 1 minuto senza che il topo recuperi la ricompensa, rimanda il topo nella camera di riposo.
- Pulisci e riempi i piatti e inizia la prova successiva. Ripeti lo stesso per 20 prove.
- Collaudo
NOTA: Il test della memoria può essere eseguito in qualsiasi momento di interesse per il ricercatore. In questo esperimento, due gruppi separati di topi sono stati testati 2 ore (STM) o 48 ore (LTM) dopo l'addestramento, dato l'interesse per l'influenza differenziale di K252a su STM e LTM.- Eseguire il test utilizzando gli stessi odori e la stessa procedura descritti per l'addestramento (Sezione 3.1).
NOTA: A seconda della domanda di ricerca, il ricercatore potrebbe dover includere gruppi di controllo. Ad esempio, nell'esperimento precedentemente pubblicato, sono stati studiati gli effetti del blocco del recettore Trk sul consolidamento della memoria3. Pertanto, un gruppo di controllo è stato infuso con K252a prima del test di 48 ore per dimostrare che gli effetti non erano dovuti all'interferenza con il recupero.
- Eseguire il test utilizzando gli stessi odori e la stessa procedura descritti per l'addestramento (Sezione 3.1).
- Analisi statistica
NOTA: la sintassi SPSS 22.0 per ogni passaggio viene fornita come file supplementare come esempio.- Esegui analisi statistiche utilizzando l'analisi lineare degli effetti misti. A differenza degli ANOVA, i modelli lineari a effetti misti possono tenere meglio conto degli effetti casuali e delle misure ripetute.
- Calcola la misura dipendente: "proporzione corretta". Ricordiamo da 3.1.3 che un "1" è stato assegnato alle prove in cui il topo ha scavato per primo nell'odore gratificante, e uno "0" se il topo ha scavato per primo nell'odore non gratificante. Media ogni cinque prove per creare quattro blocchi di prova (TB; ad esempio, il blocco di prova 1 o TB1 era la media delle prove 1-5, il blocco di prova 2 o TB 2 era la media delle prove 6-10 e così via).
- Impostare le variabili indipendenti o gli effetti fissi come gruppi di farmaci (K252a o Vehicle; Sezione 2.1.1) e blocchi di prova (da 3.3.1). Nei risultati rappresentativi riportati di seguito, sono specificate le variabili utilizzate per ciascuna analisi.
- Includi il singolo topo e il set di odori nidificati all'interno del topo come "effetti casuali" al fine di compensare le differenze comportamentali intrinseche nei topi e gli eventuali effetti dell'utilizzo di più set di odori.
- Eseguire una trasformazione logit sulla proporzione corretta.
NOTA: La proporzione corretta non è una variabile dipendente continua e non associata. Pertanto, viola due assunzioni per i modelli lineari. Pertanto, viene eseguita la trasformazione logit. - Utilizzare mezzi marginali stimati per eseguire test post hoc sulle interazioni significative identificate dal modello completo; I confronti multipli a coppie devono essere corretti nei test post hoc. Tipicamente si usano Bonferroni o Šidák.
Risultati
Come descritto, questo protocollo consente ai ricercatori di valutare l'influenza di alcune manipolazioni sull'apprendimento, STM e LTM. I risultati di esempio di Tong et al, 20183 sono presentati qui. I risultati supportano l'ipotesi che il blocco del recettore Trk inibisca selettivamente l'LTM, ma non l'apprendimento o l'STM.
La Figura 2A mostra gli schemi dell'addestramento, del test STM e del test LTM. In primo luogo, è stato dimostrato che le infusioni di K252a non hanno influenzato il tasso di apprendimento di un'associazione odore-ricompensa. La Figura 2B (Sezione 3.1) mostra il tasso di apprendimento sia del K252a che dei gruppi di veicoli dall'addestramento. L'analisi statistica utilizzando un modello misto lineare è stata eseguita con due effetti fissi, il gruppo di farmaci e il blocco di prova (TB); mouse e set di odori annidati all'interno del mouse erano effetti casuali. I dati dei test (Sezione 3.2) non sono stati inclusi nell'analisi. Un effetto principale significativo è stato osservato dal blocco di prova (F(3, 183,692) = 43,735, p < 0,001), ma nessun effetto dal gruppo di farmaci (F(1, 85,685) = 0,132, p = 0,717) e nessuna interazione significativa (F(3, 183,692) = 0,111, p = 0,954). I test post hoc, utilizzando la regolazione di Šidák, hanno confermato che il K252a e i gruppi di veicoli non differivano in nessuno dei blocchi di prova durante l'allenamento (p > 0,05 per tutti i confronti). TB2, TB3 e TB4 erano significativamente più alti di TB1 per tutti i confronti (p ≤ 0,001 in tutti i casi), dimostrando che entrambi i gruppi hanno appreso con successo l'associazione odore-ricompensa entro la fine di 20 prove di formazione.
Successivamente, per esaminare gli effetti dell'infusione su STM e LTM, è stata eseguita la stessa analisi e ha incluso i dati dei test (Sezione 3.2). Ha mostrato un'interazione significativa tra il gruppo di farmaci e il blocco di sperimentazione (F(2, 77,558) = 4,043, p = 0,021), senza effetti principali significativi del gruppo di farmaci (F(1, 55,629) = 1,438, p = 0,236) o del blocco di prova (F(2, 69,979) = 1,360, p = 0,263). Al fine di esaminare in modo specifico la memoria, i confronti a coppie post hoc con la correzione di Šidák, hanno confrontato le differenze tra l'ultimo blocco di prova di Training (Sezione 3.1) e il primo blocco di prova di Testing (Sezione 3.2) 2 (STM) o 48 ore (LTM) dopo. Per i topi infusi con veicolo, i confronti hanno mostrato la ritenzione della memoria associativa sia a 2 che a 48 ore dopo l'allenamento (p > 0,05 per tutti i confronti con le prestazioni di allenamento). Per i topi infusi con K252a, il primo blocco di prova del test di 2 ore (STM) non differiva dall'ultimo blocco di prova di Training (p > 0,05); Tuttavia, le prestazioni della memoria erano significativamente inferiori dopo 48 ore (p = 0,018). Inoltre, la memoria durante il test di 48 ore è stata significativamente ridotta rispetto alla memoria durante il test di 2 ore (p = 0,009) e alle prestazioni del gruppo di veicoli durante il test di 48 ore (p = 0,006). Non c'era differenza nell'STM tra topi infusi con veicolo e K252a (p = 0,356). Insieme, i risultati mostrano che l'inibizione K252a dei recettori Trk nel bulbo olfattivo interrompe selettivamente la memoria degli odori a lungo termine, ma non a breve termine (Figura 3).
| Set di odori | Odore 1 | Odore 2 |
| 1 | acido pentanoico | acido butanoico |
| 225.1 | 63.6 | |
| 2 | esanale | eptanale |
| 11.1 | 35.3 | |
| 3 | acetato di propile | acetato di butile |
| 3.1 | 10.9 | |
| 4 | 2 ottani | 2-eptanone |
| 87.4 | 28.7 | |
| 5 | pentanolo | esanolo |
| 37.2 | 127.3 |
Tabella 1: Volumi di miscelazione per set di odori. Ogni riga mostra due odori che possono essere utilizzati in coppia per le fasi comportamentali. Ad esempio, per utilizzare il primo "set di odori", prepara le miscele di acido pentanoico e butanoico. I numeri nella tabella indicano il volume in μL da miscelare in 50 mL di olio minerale per una concentrazione di 1,0 Pa di ciascun odore. Durante l'addestramento e i test, una capsula di Petri veniva profumata con acido pentanoico, l'altra con acido butanoico.

Figura 1: Posizionamento dell'incannulamento e apparato comportamentale. (A) Mostra la posizione relativa della cannula, del tappo di cemento dentale e delle viti sulla testa del mouse. Si noti che gli aghi della cannula raggiungono i due bulbi olfattivi, il piedistallo stesso è incorporato nel cappuccio di cemento dentale. Le viti vengono inserite in due fori praticati nel cranio sopra la formazione cerebellare. Le viti non toccano il cervello stesso, ma fungono da ancoraggio caudale per il tappo di cemento dentale. La figura mostra la dimensione relativa per realizzare il tappo di cemento. (B) Mostra l'apparato comportamentale assemblato. Il corpo è una tipica gabbia domestica per topi. I coperchi con fori per l'aria erano realizzati in plexiglass. Anche il divisorio centrale è realizzato in plexiglass nero. I coperchi devono essere realizzati in plexiglass abbastanza pesante da poter fungere da tratto per il divisore centrale da sollevare e posizionare durante le prove. (C) Mostra un lato dell'apparato comportamentale. Si noti che il divisore centrale è leggermente più alto della gabbia per facilitare il sollevamento. Le piastre di Petri di sabbia possono essere posizionate lungo il bordo. Clicca qui per visualizzare una versione più grande di questa figura.
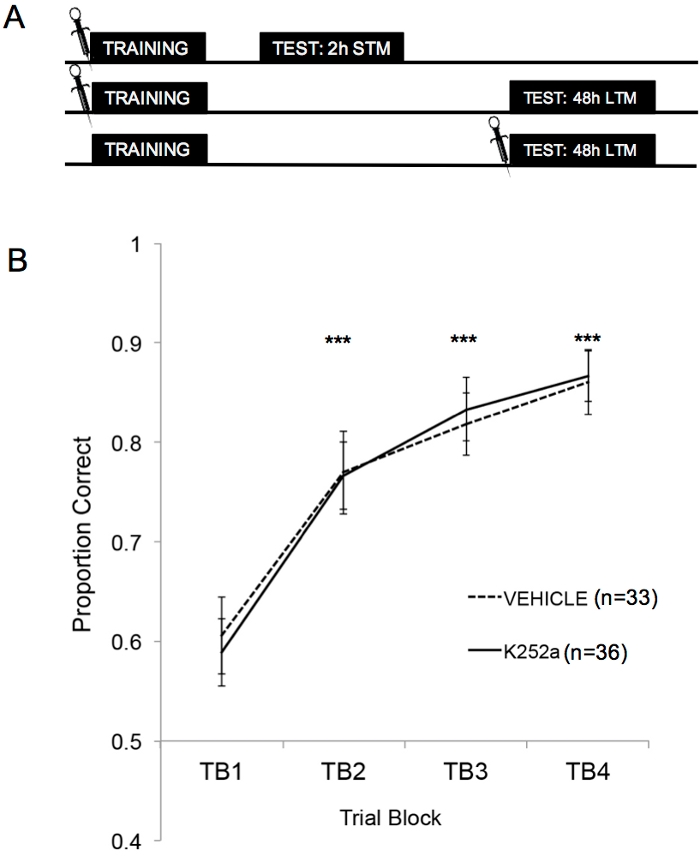
Figura 2: Disegno dello studio e risultati dell'apprendimento. (A) Mostra lo schema del disegno dello studio. Si noti che i gruppi STM e LTM erano indipendenti (cioè diversi gruppi di topi). I simboli all'inizio dei blocchi indicano l'ora in cui sono state somministrate le infusioni. (B) Mostra la proporzione corretta per le prove da 1 a 20 durante l'allenamento. I risultati indicano che il K252a e i gruppi di veicoli non differivano nel loro tasso di apprendimento (pendenza delle linee). Le barre di errore rappresentavano l'errore standard della media (SEM). Gli asterischi mostrano aumenti significativi della proporzione corretta rispetto a TB1 sia per il veicolo che per le coorti K252a (p ≤ 0,001 per tutti i confronti). Questa figura è adattata da Tong et al. 2018 con il permesso3. Clicca qui per visualizzare una versione più grande di questa figura.
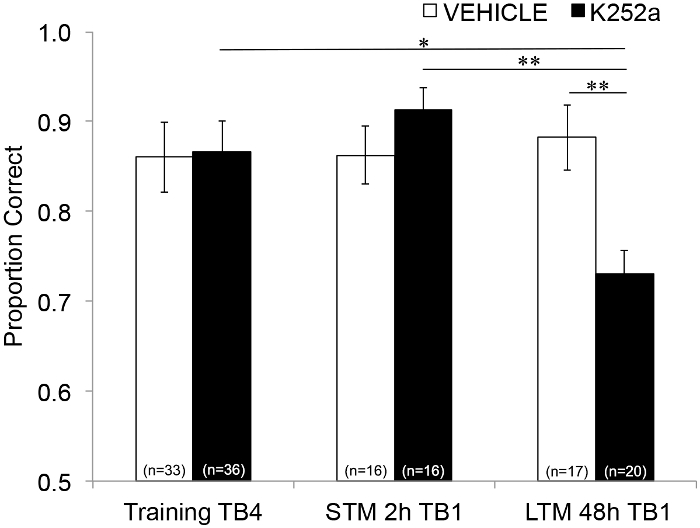
Figura 3: Effetti differenziali del blocco del recettore Trk su STM e LTM. Mostra la proporzione corretta per il blocco di prova 4 dell'addestramento e il blocco di prova 1 di entrambi i test STM e LTM. Ovvero, un modello misto lineare viene utilizzato per confrontare la proporzione corretta durante l'ultimo blocco di prova della fase di addestramento (Figura 2; Training-TB4) a quelli durante i primi blocchi di prova (Testing-TB1) di test di memoria a breve termine (test di 2 ore) e a lungo termine (test di 48 ore). Il modello misto lineare ha avuto due effetti fissi: gruppo di farmaci e blocco di prova (Training-TB4, STM-TB1, LTM-TB1). Gli effetti casuali erano il mouse e l'odore nidificati all'interno del mouse. Confronti post hoc hanno rilevato che i topi K252a avevano una LTM significativamente compromessa (confronto con l'addestramento TB4; p = 0,018) ma non STM (p > 0,05). Le prestazioni LTM dei topi infusi con K252a erano anche significativamente inferiori rispetto all'STM dei topi infusi con K252a (p = 0,009) e inferiori rispetto all'LTM dei topi veicolo (p = 0,006). Le barre di errore rappresentavano il SEM. Questa figura è adattata da Tong et al. 2018 con il permesso3. Clicca qui per visualizzare una versione più grande di questa figura.

File supplementare: sintassi utilizzata per l'analisi statistica. Clicca qui per scaricare questo file.
Discussione
Il condizionamento della paura a una prova è un potente protocollo comportamentale per studiare le dinamiche molecolari e cellulari della memoria, ma gran parte dell'apprendimento naturale è incrementale e meglio modellato attraverso un paradigma come quello descritto sopra. L'inibizione dei recettori Trk nell'OB ha impedito il consolidamento della memoria olfattiva in un paradigma di apprendimento appetitivo multi-trial, come mostrato in precedenza dal nostro gruppo3. La scoperta apre nuove strade per la ricerca sulla tempistica differenziale dei meccanismi molecolari, come le neurotrofine, nell'apprendimento appetitivo e avversivo.
Questo esperimento consisteva in due parti critiche: (1) l'incannulamento e (2) il compito di discriminazione associativa (suddiviso in modellamento, allenamento e test). Gli sperimentatori possono adattare questo protocollo alla loro specifica domanda di ricerca. Ad esempio, eravamo principalmente interessati all'ostetricia e questo protocollo consolidato può essere facilmente applicato ad altri studi di ostetricia. Per gli sperimentatori con altre regioni di interesse, sarà importante convalidare i siti di infusione in uno studio pilota. Gli sperimentatori potrebbero anche dover considerare la velocità di diffusione, la penetrazione spaziale e la durata della bioattività di ciò che stanno infondendo.
Le fasi di modellazione descritte nel protocollo sono state ampiamente utilizzate dagli autori di questo protocollo. Aderire ad essi come descritto sembra essere importante per far sì che i topi imparino il compito in modo tempestivo. Utilizzando altre linee temporali, gli autori hanno osservato una maggiore varianza tra i topi nella loro familiarità con il compito e questo ha comportato un ulteriore addestramento per portare tutti i topi a un criterio per i test con gli odori sperimentali. Per la formazione e i test, il ricercatore ha flessibilità, a seconda dei propri interessi di ricerca, con il numero di prove, la concentrazione degli odori sperimentali e la somiglianza degli odori tra loro. Si consiglia l'uso di più set di odori quando possibile, come abbiamo descritto, al fine di ridurre il numero di animali utilizzati per l'esperimento. Vedere la sezione Analisi statistica per le indicazioni su come tenere conto dell'uso di più set di ordini nell'analisi finale. In linea di principio, la somiglianza della coppia di odori può essere variata per regolare la difficoltà della discriminazione. Nello studio precedentemente pubblicato del nostro gruppo3, le coppie di odori sono costituite da due odori dello stesso gruppo funzionale ma differivano l'uno dall'altro per una lunghezza di carbonio. Queste discriminazioni sono più difficili delle coppie che differiscono di due o più lunghezze di carbonio, ma più facili degli enantiomeri (ad esempio, (+)-limonene e (-)-limonene). Gli odoranti di diversi gruppi funzionali sono molto diversi percettivamente. Cleland et al13 discute più variazioni di stimolo e il loro effetto su specifici parametri di apprendimento.
Uno dei principali limiti di questo protocollo è che richiede molto più tempo per l'esecuzione rispetto alle attività di apprendimento associativo automatizzato in cui più animali potrebbero essere testati in parallelo. Per un dato test, un ricercatore impiegherebbe almeno 20 minuti per completare 20 prove per un topo. Tuttavia, è questa mancanza di automazione che significa che il protocollo è più accessibile dal punto di vista finanziario, una priorità per molte istituzioni. È importante sottolineare che, nel caso di questo esperimento, è stato riscontrato che questo protocollo è altamente trattabile ed efficace per la formazione di ricercatori universitari con interessi nelle neuroscienze comportamentali. In particolare, questi studenti sviluppano forti capacità di gestione degli animali oltre ai consueti benefici della partecipazione alla ricerca.
I ricercatori interessati ad adottare questo paradigma possono variare diversi parametri. Più apparentemente, le manipolazioni farmacologiche dei meccanismi sono diverse e questo protocollo comportamentale può essere utilizzato con tecniche chemiogenetiche o vari altri modi di manipolare percorsi molecolari e cellulari (ad esempio l'optogenetica). Il paradigma stesso può essere regolato per variare il tipo di apprendimento e memoria testati. Ad esempio, i ricercatori possono regolare la somiglianza dei due odori presentati per controllare il tasso di apprendimento. Nel nostro studio3, le coppie di odori sono costituite da due odoranti dello stesso gruppo funzionale ma differivano l'uno dall'altro per una lunghezza di carbonio. Queste discriminazioni sono più difficili delle coppie che differiscono di due o più lunghezze di carbonio, ma più facili degli enantiomeri (ad esempio (+)-limonene e (-)-limonene). Gli odoranti di diversi gruppi funzionali sono molto diversi percettivamente. Cleland et al13 discute più variazioni di stimolo e il loro effetto su specifici parametri di apprendimento, concludendo che odori più simili sono più difficili da discriminare e quindi richiedono più tempo per essere appresi14. Queste manipolazioni influenzerebbero anche la forza dei ricordi. In questo senso, i ricercatori potrebbero essere interessati a testare la memoria in diversi momenti dopo l'apprendimento. Ad esempio, due studi 15,16 hanno esaminato il ruolo del BDNF nella persistenza LTM per un compito di apprendimento avversivo a prova singola. BDNF è un ligando di TrkB. Gli studi hanno dimostrato che l'infusione di oligonucleotidi antisenso anti-BDNF nell'ippocampo 12 ore dopo l'apprendimento ha bloccato la LTM 7 giorni dopo, ma non 2 giorni dopo. Questo studio mostra che la scala temporale dei meccanismi molecolari dopo l'apprendimento iniziale gioca un ruolo interessante e ancora da comprendere nella LTM. Questo articolo descrive un protocollo comportamentale che consentirebbe l'indagine di queste scale temporali. Altri parametri di interesse per applicazioni future includono il modello murino utilizzato. Ad esempio, sarebbe interessante sostituire i topi maschi (che hanno una neurobiologia significativamente meglio studiata)17 con topi femmine in studi futuri per esaminare le variazioni nel tasso di apprendimento, STM e LTM, poiché i mammiferi femmine hanno una maggiore sensibilità e selettività agli odori rispetto ai mammiferi maschi18. Naturalmente, anche i modelli di malattie dei roditori possono essere utilizzati efficacemente con questo protocollo.
Divulgazioni
Gli autori di questo articolo non avevano interessi finanziari concorrenti.
Riconoscimenti
Il progetto è stato sostenuto dallo Scantland Summer Collaborative Research Gift e dallo Stephen and Sylvia Tregidga Burges Endowed Research Fund. Gli autori desiderano ringraziare i colleghi del Dipartimento di Psicologia e del Programma di Neuroscienze dell'Earlham College per il loro sostegno e guida.
Materiali
| Name | Company | Catalog Number | Comments |
| Double guide cannula | PlasticsOne | C235GS-5-1.5/SPC | Custom order |
| (-)-limonene | Sigma-Aldrich | 218367-50G | |
| (+)-limonene | Sigma-Aldrich | 183164-100ML | |
| 2-hetanone | Sigma-Aldrich | 537683 | |
| 2-octanone | Sigma-Aldrich | O4709 | |
| 5mg sucrose pellets | Test Diet | 1811560 | Custom size. Used for rewards |
| Butanoic acid | Sigma-Aldrich | B103500 | |
| butyl acetate | Sigma-Aldrich | 402842 | |
| Dental Cement Powder (Coral) | A-M Systems | 525000 | |
| Dental Cement Solvent | A-M Systems | 526000 | |
| Double connector assembly | PlasticsOne | C232C | |
| Double dummy cannula | PlasticsOne | C235DCS-5/SPC dummy dbl | Custom order |
| Double injector | PlasticsOne | C235IS-5/SPC | Custom order |
| Drill | Kopf Instruments | Model 1474 High Speed Stereotaxic Drill | This drill requires an additional "adaptor" piece in order to fit certain drill bits. We get by this problem by wrapping the drill bit with lab tape to increase the circumference of the drill it to fit. This may not be an option for surgeries requiring sterile technique. |
| Eye Ointment | Purchase from local pharmacy | ||
| Figure 1 illustration software | BioRender | ||
| heptanal | Sigma-Aldrich | W254002 | |
| hexanal | Sigma-Aldrich | 115606 | |
| hexanol | Sigma-Aldrich | H13303 | |
| Infusion pump model 11 | Harvard Apparatus | 4169D | Used pumps available via American Instrument Exchange |
| Isoflurane | Santa Cruz Animal Health | sc-363629Rx | Vet prescription needed for order |
| K252a | Sigma-Aldrich | K2015 | Mixed to 50uM in DMSO (5%) |
| Ketoprofen | Allivet | 25920 | Vet prescription needed for order |
| Lidocaine | Aspercreme | Purchased from Amazon | |
| Mounting Screws | PlasticsOne | 00-96 X 3/32 | |
| Mouse Anesthesia Mask | Kopf Instruments | Model 907 Mouse Anesthesia Mask | Used with the stereotaxic to allow oxygen and anesthesia while mouse in stereotax |
| Mouse Nose Adaptor | Kopf Instruments | Model 926 Mouse Adaptor | Used with the stereotaxic to allow for head of mouse to be secured. |
| Novalsan | Jeffers | 41375 | |
| Pentanoic acid | Sigma-Aldrich | 240370 | |
| pentanol | Sigma-Aldrich | 138975 | |
| Petri dish glass bottoms | VWR | 10754-804 | |
| Polycarbonate Café bottoms | Ancare | N10PCSEC | Use normal housing cages and custom fit a track in the middle to act as the track for an opaque plexiglass divider |
| propyl acetate | Sigma-Aldrich | 537438 | |
| Quikrete Premium Play Sand | Purchase from local hardware store | ||
| Saline | Insight Needles | N/A | Sterile saline for drug mixing |
| Stereotaxic apparatus | Kopf Instruments | Model 902 Small Animal Stereotaxic Instrument | |
| Testing chamber | Ancare | N10PCSEC | Our testing chambers are modified using the regular mouse housing cage. The manuscript details what was done. |
| Vetbond Tissue Adhesive | 3M | Purchased from Amazon |
Riferimenti
- Grimes, M. T., Smith, M., Li, X., Darby-King, A., Harley, C. W., Mclean, J. H. Mammalian Intermediate-Term Memory: New Findings in Neonate Rat. Neurobiology of Learning and Memory. 95 (3), 385-391 (2011).
- Grimes, M. T., Harley, C. W., Darby-King, A., Mclean, J. H. PKA Increases in the Olfactory Bulb Act as Unconditioned Stimuli and Provide Evidence for Parallel Memory Systems: Pairing Odor with Increased PKA Creates Intermediate- and Long-Term, but not Short-Term, Memories. Learning and Memory. 19 (3), 107-115 (2012).
- Tong, M. T., Kim, T. Y. P., Cleland, T. A. Kinase Activity in the Olfactory Bulb is Required for Odor Memory Consolidation. Learning & Memory. 25 (5), 198-205 (2018).
- Devore, S., Lee, J., Linster, C. Odor Preferences Shape Discrimination Learning in Rats. Behavioral Neuroscience. 127 (4), 498-504 (2013).
- Gao, Y., Strowbridge, B. W. Long-Term Plasticity of Excitatory Inputs to Granule Cells in the Rat Olfactory Bulb. Nature Neuroscience. 12 (6), 731-733 (2009).
- Bath, K. G., Mandairon, N., et al. Variant Brain-Derived Neurotrophic Factor (Val66Met) Alters Adult Olfactory Bulb Neurogenesis and Spontaneous Olfactory Discrimination. Journal of Neuroscience. 28 (10), 2383-2393 (2008).
- Lazarini, F., Lledo, P. M. Is Adult Neurogenesis Essential for Olfaction. Trends in Neurosciences. 34 (1), 20-30 (2011).
- Mandairon, N., Peace, S., Karnow, A., Kim, J., Ennis, M., Linster, C. Noradrenergic Modulation in the Olfactory Bulb Influences Spontaneous and Reward-Motivated Discrimination, but not the Formation of Habituation Memory. European Journal of Neuroscience. 27 (5), 1210-1219 (2008).
- Guérin, D., Peace, S. T., Didier, A., Linster, C., Cleland, T. A. Noradrenergic Neuromodulation in the Olfactory Bulb Modulates Odor Habituation and Spontaneous Discrimination. Behavioral Neuroscience. 122 (4), 816-826 (2008).
- Moreno, M. M., Bath, K., Kuczewski, N., Sacquet, J., Didier, A., Mandairon, N. Action of the Noradrenergic System on Adult-Born Cells Is Required for Olfactory Learning in Mice. Journal of Neuroscience. 32 (11), 3748-3758 (2012).
- Vinera, J., Kermen, F., Sacquet, J., Didier, A., Mandairon, N., Richard, M. Olfactory Perceptual Learning Requires Action of Noradrenaline in the Olfactory Bulb: Comparison with Olfactory Associative Learning. Learning and Memory. 22 (3), 192-196 (2015).
- Dillon, T. S., Fox, L. C., Han, C., Linster, C. 17β-estradiol Enhances Memory Duration in the Main Olfactory Bulb in CD-1 Mice. Behavioral Neuroscience. 127 (6), 923(2013).
- Cleland, T. A., Narla, V. A., Boudadi, K. Multiple Learning Parameters Differentially Regulate Olfactory Generalization. Behavioral Neuroscience. 123 (1), 26(2009).
- Cleland, T. A., Morse, A., Yue, E. L., Linster, C. Behavioral Models of Odor Similarity. Behavioral Neuroscience. 116 (2), 222-231 (2002).
- Bekinschtein, P., Cammarota, M., Igaz, L., Bevilaqua, L., Izquierdo, I., Medina, J. Persistence of Long-Term Memory Storage Requires a Late Protein Synthesis- and BDNF- Dependent Phase in the Hippocampus. Neuron. 53 (2), 261-277 (2007).
- Bekinschtein, P., et al. BDNF is Essential to Promote Persistence of Long-Term Memory Storage. Proceedings of the National Academy of Sciences. 105 (7), 2711-2716 (2008).
- Andreano, J., Cahill, L. Sex influences on the neurobiology of learning and memory. Learning and Memory. 16 (2009), 248-266 (2009).
- Kass, M. D., Czarnecki, L. A., Moberly, A. H., Mcgann, J. P. Differences in Peripheral Sensory Input to the Olfactory Bulb Between Male and Female Mice. Scientific Reports. 7 (1), (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon