Method Article
Génération de tumeurs pancréatiques orthopiques et caractérisation ex vivo de la cytotoxicité des cellules T infiltrantes
Dans cet article
Résumé
Ce protocole décrit la génération chirurgicale des tumeurs pancréatiques orthopiques et la digestion rapide des tumeurs pancréatiques murines fraîchement isolées. Après la digestion, les populations viables de cellules immunitaires peuvent être employées pour l'analyse plus en aval, y compris la stimulation ex vivo des cellules de T pour la détection intracellulaire de cytokine par cytométrie d'écoulement.
Résumé
Les modèles in vivo du cancer du pancréas fournissent des outils inestimables pour étudier la dynamique des maladies, l'infiltration immunitaire et de nouvelles stratégies thérapeutiques. Le modèle orthotopic de murine peut être exécuté sur de grandes cohortes de souris immunocompétentes simultanément, est relativement peu coûteux et préserve le microenvironnement de tissu cognate. La quantification de l'infiltration de cellule T et de l'activité cytotoxique dans les tumeurs orthotopiques fournit un indicateur utile d'une réponse antitumorale.
Ce protocole décrit la méthodologie pour la génération chirurgicale des tumeurs pancréatiques orthopiques par injection d'un petit nombre de cellules syngeneic de tumeur rechargées dans la membrane de sous-sol de 5 l directement dans le pancréas. Les souris portant des tumeurs orthotopiques prennent approximativement 30 jours pour atteindre le point final, à quel point les tumeurs peuvent être moissonisées et traitées pour la caractérisation de l'activité de cellule T tumeur-infiltrante. La digestion enzymatique rapide utilisant la collagène et le DNase permet d'extraire une suspension à cellule unique des tumeurs. La viabilité et les marqueurs de surface cellulaire des cellules immunitaires extraites de la tumeur sont préservés ; par conséquent, il est approprié pour les applications en aval multiples, y compris le tri des cellules immunitaires assistées par flux pour la culture ou l'extraction de l'ARN, l'analyse de cytométrie de flux des populations de cellules immunitaires. Ici, nous décrivons la stimulation ex vivo des populations de lymphocytes T pour la quantification intracellulaire de cytokine (IFNMD et TNFMD) et l'activité de dégranulation (CD107a) comme mesure de cytotoxicité globale. Des digests entiers-tumoral ont été stimulés avec l'acétate de myristate de phorbol et l'ionomycine pendant 5 h, en présence de l'anticorps anti-CD107a afin de surréglementer la production et la dégranulation de cytokine. L'addition de brefeldin A et de monensine pour les 4 h finaux a été effectuée pour bloquer le transport extracellulaire et maximiser la détection de cytokine. La coloration extra- et intra-cellulaire des cellules a ensuite été effectuée pour l'analyse de cytométrie du débit, où la proportion de cellules IFNMD, TNFet et CD107a, CD4 et CD8et T ont été quantifiées.
Cette méthode fournit une base de départ pour effectuer l'analyse complète du microenvironnement de tumeur.
Introduction
Cette méthode détaille, du début à la fin, la procédure chirurgicale pour produire des tumeurs pancréatiques orthopiques utilisant une quantité minimale de matériel cellulaire et la dissociation rapide suivante des tumeurs établies pour l'analyse complète de cytométrie de flux des populations immunisées de cellules, y compris l'analyse ex vivo de la fonction de cellule T.
L'adénocarcinome canalaire pancréatique (PDAC) est un carcinome agressif avec seulement 8 % des patients survivant 5 ans1. Comme moins de 20 % des patients sont admissibles à la résection chirurgicale2,les échantillons de patients frais ne sont pas facilement accessibles pour la recherche et, par conséquent, les modèles in vivo fournissent des outils essentiels pour étudier cette maladie. Il existe plusieurs modèles murins de PDAC : orthotopic, sous-cutané, transgénique, intraveineux et patient-dérivé xénogreffe (PDX), largement décrit ici3. Le modèle orthotopic décrit ici permet l'injection de cellules PDAC syngéniques dans le pancréas des souris immunocompétentes. Cela peut être effectué dans de grandes cohortes de souris sauvages ou mutantes, et fournit ainsi un modèle rentable et cohérent pour la comparaison des agents thérapeutiques. Fait important, le modèle orthotopic fournit le microenvironnement cognat pour la croissance des cellules tumorales et métastases dans nos mains et d'autres4 à des sites cliniquement pertinents (par exemple, le foie), ce qui le rend plus cliniquement pertinent que les modèles sous-cutanés ou induits chimiquement. Les tumeurs orthotopiques affichent les caractéristiques clés de PDAC, telles qu'une forte réaction desmoplastique avec une abondance de fibroblastes et de dépôt de matrice extracellulaire5. Les modèles transgéniques de PDAC sont l'étalon-or du modèle de la murine et le plus couramment utilisé est le modèle KPC, qui exprime mutant KrasG12D / et Trp53R172H / sous le pancréas spécifique Pdx-1-Cre promoteur6. D'autres modèles KPC et autres PDAC in vivo sont examinés ici7. Les souris de KPC développent spontanément des tumeurs pancréatiques avec une progression de la maladie qui reproduit fidèlement des dispositifs de PDAChumain 6. Cependant, comme pour tous les modèles transgéniques, le programme de reproduction est coûteux, la progression tumorale est variable et nécessite donc souvent de grandes cohortes de souris. Les modèles PDX utilisent des cellules tumorales ou des morceaux dérivés du patient qui sont ensuite cultivés soit orthotopiquement ou plus souvent sous-cutanéechez chez des souris immunodéprimées. Les modèles de xénogreffe fournissent des outils utiles pour le dépistage des composés thérapeutiques et tiennent compte de l'hétérogénéité du patient. Cependant, ils ne fournissent pas un microenvironnement immunitaire complet, limitant ainsi leurs applications8,9.
Une fois établies, les tumeurs orthotopiques prennent typiquement environ 1 mois ou plus pour se développer (selon la ligne cellulaire utilisée) et forment de grandes tumeurs qui peuvent être facilement imaged par ultrason ou MRI pour suivre la progression et déterminer l'efficacité de traitement4,5,10. Cependant, une fois dans la croissance exponentielle, la dernière phase de la croissance de tumeur peut être rapide, ainsi la plupart des régimes de traitement sont commencés relativement tôt (par exemple, 14 jours)11,12. Le système immunitaire joue un rôle critique dans le développement de tumeur, y compris dans PDAC, qui est caractérisé par une tumeur immunosuppressive s'infiltrer avec le manque relatif des cellules De et la présence fréquente des cellules myéloïdes13. Une forte présence de lymphocytes T dans pDAC confère un meilleur pronostic14,15. Cependant, en tant qu'agents simples, les inhibiteurs de point de contrôle immunitaire qui soulagent l'immunosuppression de cellules T, tels que l'anti-CTLA-416 et anti-PD-L117,n'ont pas montré l'avantage clinique dans les patients de PDAC, probablement parce que la réactivité globale de cellule T est très basse. Cependant, les agents que les réponses principales de cellules T, telles que le vaccin anti-CD40, peuvent surmonter la résistance anti-PD-L1/CTLA-418,19 et la vaccination avec le vaccin allogeneic de PDAC de GM-CSF-sécrétant (GVAX) peut augmenter l'immunogénicité des tumeurs de PDAC20,indiquant que l'amélioration des réponses de cellules de T forme l'avenue thérapeutique importante.
Critique à une réponse antitumorale de cellule De est la reconnaissance des antigènes tumeur-dérivés par l'intermédiaire du récepteur de T-cell (TCR) et de la production suivante des cytokines et des granules cytotoxiques. Bien que la reconnaissance de l'antigène des lymphocytes T puisse être déterminée par le séquençage du TCR, cette approche est coûteuse et prend beaucoup de temps. Cependant, la quantification des sous-ensembles de cellules T infiltrants de tumeur fournit une bonne indication d'une réponse antitumoral. Un examen plus approfondi de l'activité des lymphocytes T ex vivo en termes de dégranulation, de production de cytokine et d'autres facteurs cytotoxiques fournit une analyse fonctionnelle plus approfondie. Ces essais peuvent être exécutés sur des échantillons frais de tumeur et beaucoup de paramètres de fonction de cellule T peuvent être mesurés rapidement par cytométrie de flux.
Les cellules CD8et CD4et T produisent des cytokines telles que les IFNMD et les TNMD pour potentialiser une réponse immunitaire21. IFN - induit la régulation MHCI sur les cellules cibles, induit la différenciation et le recrutement des cellules immunitaires et aide la mort cellulaire. La production d'IFNpar par les cellulesT CD8 est bien caractérisée pour faire partie d'une réponse antitumorale et est en corrélation avec la régression tumorale22,23. TNF est une autre cytokine proinflammatoire produite par les lymphocytes CD8et CD4T. Il améliore l'activation TCR-dépendante et la prolifération des lymphocytes T, aidant la réponse anti-tumorale. Lors de l'engagement TCR, cytotoxiques CD8- lymphocytes T peuvent subir la dégranulation, où les lysosomes sécréteurs préformés contenant des molécules cytotoxiques sont libérés dans la synapse immunologique pour causer la dégradation des cellules cibles21. Ces molécules comprennent la perforine, une protéine qui se lie à la membrane cellulaire cible, formant des pores qui perturbent ensuite l'intégrité de la membrane et permettent la diffusion21 ou l'endocytose24 d'autres molécules cytotoxiques, telles que Granzyme B, directement dans le cytoplasme de la cellule cible. Granzyme B est une protéase qui édicte la dégradation de protéines multiples dans la cellule cible, conduisant à la mort cellulaire21. La libération de ces molécules nécessite l'exocytose des endosomes à la surface cellulaire, où le marqueur endosomal CD107a (également connu sous le nom DE LAMP-1) est incorporé transitoirement dans la membrane cellulaire25.
La mesure de la sécrétion de cytokine par les lymphocytes T nécessite leur isolement par le tri des cellules assistées par le flux ou des tests de séparation à base de perles, qui ne peuvent pas être facilement effectués sur un grand nombre d'échantillons simultanément. Cependant, la mesure des cytokines intracellulaires ne nécessite aucune étape de pré-isolement et peut être facilement effectuée sur plusieurs échantillons à la fois, permettant une approche à haut débit. Comme les cytokines sont rapidement sécrétées par les lymphocytes T, les niveaux intracellulaires peuvent être indétectables et donc la cellule T nécessite une stimulation pour augmenter la production de cytokine basale. Pour évaluer la production de cytokine à l'antigène, l'antigène reconnu par le TCR doit être présenté à la cellule T par un APC apprêté in vitro. Dans les cas où la spécificité de l'antigène n'est pas connue, une approche de stimulation large est nécessaire. La stimulation de TCR peut être imitée utilisant des perles anti-CD3/28 qui fournissent l'activation et la costimulation de TCR, qui induit la production et la prolifération de cytokine. Cependant, une alternative plus rentable est l'utilisation de la PMA et de l'ionomycine, qui, ensemble, activent largement les voies de signalisation qui mènent à la synthèse et à la libération des cytokines intracellulaires. Plus précisément, la PMA active la protéine kinase C (PKC) et l'ionomycine soulève des ions intracellulaires Ca2, ce qui augmente la signalisation cellulaire. Afin de préserver le contenu intracellulaire des cytokines, cette stimulation peut être efficacement combinée avec des inhibiteurs du transport de protéines brefeldin A et monensine, qui bloquent les protéines dans le Golgi et empêchent ainsi la libération extracellulaire. L'utilisation de LA PMA/ionomycine est une méthode bien établie pour stimuler les lymphocytes T et il existe une forte corrélation entre les cytokines extracellulaires et intracellulaires26. La stimulation des lymphocytes T avec PMA et ionomycine augmente également le trafic de lysosome à la membrane cellulaire et ainsi CD107a devient transitoirement intégré sur la surface de la cellule avant d'être recyclé dans la cellule. En incluant un anticorps anti-CD107a pendant la stimulation, il est possible de l'utiliser comme marqueur de l'activité de dégranulation25.
Cette méthode digère rapidement les tumeurs pour fournir une suspension unicellulaire. À ce stade, les populations individuelles peuvent être directement tachées pour la cytométrie du débit ou purifiées par des méthodes en aval : tri cellulaire assisté par flux ou séparation des perles magnétiques. La préparation d'une suspension unicellulaire pour l'analyse de cytométrie de flux permet l'analyse à haut débit des populations de cellules immunitaires multiples et de leurs marqueurs phénotypiques, fournissant une quantification précise du nombre de cellules immunitaires et du phénotype.
Enfin, le protocole de digestion décrit ici empêche la perte de marqueurs de surface cellulaire et maintient la viabilité des cellules immunitaires, permettant aux cellules immunitaires de subir d'autres étapes de purification cellulaire et de la culture au besoin. Cependant, cette méthode n'a pas été testée pour dériver les cellules épithéliales de cette digestion.
Protocole
Des tumeurs pancréatiques orthopiques ont été produites comme précédemmentdécrites 10 conformément à la loi de 1986 sur les procédures animales et scientifiques du Home Office du Royaume-Uni et à la directive européenne 2010/63/UE. Toutes les souris ont été surveillées perioperatively pour des signes de douleur ou de souffrance, y compris mais pas limité à la perte de poids (-gt; 15 % dans 72 h ou 20 % dans n'importe quelle période donnée), piloerection, rétrécissement des yeux, démarche augmentée, aspect voûté, aussi bien des signes d'infection de blessure comprenant le saignement, la rougeur et l'ulcération. La croissance de tumeur a été surveillée par palpation, et des signes cliniques additionnels tels que la respiration laborieuse, l'ictère et les extrémités froides ont été également surveillés afin d'évaluer si des signes de point final avaient été atteints. Toutes les procédures doivent être effectuées dans des conditions stériles. Tous les réactifs utilisés avant la coloration cytométrie d'écoulement doivent être préparés dans des conditions stériles.
1. Préparation des cellules tumorales pour l'injection
- Prendre un aliquot de membrane de sous-sol à partir de -20 oC et placer sur la glace à 4 oC pendant la nuit.
REMARQUE : La concentration de membrane de sous-sol peut varier d'un lot à l'autre; par conséquent, les lots spécifiques de membrane de sous-sol de lot doivent être examinés in vivo pour assurer la reproductibilité. Un nouveau lot de membrane de sous-sol est décongelé sur la glace à 4 oC pendant la nuit, puis aliquoted dans les aliquots définis par l'utilisateur, sur la glace, puis stocké dans -20 oC jusqu'à ce que nécessaire. Cela minimise le tuyauterie et le gel-dégel lors de l'utilisation de la membrane du sous-sol.- Placer le PBS stérile à 4 oC pendant la nuit pour refroidir.
- Placer les pointes stériles de 200 l et de 1 000 l de pipette à -20 oC pendant la nuit pour vous détendre.
- Utilisez des cellules tumorales exemptes de mycoplasme, cultivées pendant au moins 2 à 10 passages après le dégel et en phase de croissance avant la récolte. Ce protocole utilise la lignée cellulaire femelle c57BL/6 dérivée du KPC : TB32048 fournie comme un don généreux par le laboratoire de David Tuveson.
- Lorsque les cellules tumorales sont nécessaires à la récolte, retirer le milieu du flacon et laver les cellules deux fois en PBS (pré-chauffée à 37 oC).
- Ajouter 2x trypsine (pré-chauffée à 37 oC) sur le flacon pendant 10 min à 37 oC (à un flacon T175, ajouter 5 ml).
- Après 10 min, ajouter un volume égal de milieu complet (10% FBS, 1x pénicilline, 1x streptomycine dans DMEM) à la fiole et dissocier les cellules en tapant doucement le flacon et en se rechachant bien dans le milieu.
- Transférer les cellules dans un tube et une centrifugeuse pendant 5 min à 300 x g et à température ambiante (RT).
- Retirez le supernatant et resuspendez les cellules dans un milieu complet pour le comptage cellulaire.
- Centrifugeant les cellules à nouveau pendant 5 min à 300 x g et RT, et enlever le supernatant.
- Resuspendre les cellules dans le PBS pré-réfrigéré pour atteindre une concentration de 1x106 cellules/mL.
REMARQUE : Cette concentration de stock est préparée pour réaliser une concentration finale d'injection de 1000 cellules dans 5 'l. Nous avons constaté l'injection d'un nombre inférieur de cellules dans un faible volume d'injection a minimisé la fuite de cellules et donc augmenté la reproductibilité cependant, la croissance de tumeur peut être dépendante de cellule-ligne donc les utilisateurs devraient optimiser chaque ligne de cellules.
- À côté de cela, placez un aliquot de membrane de sous-sol pré-aliquoted, sur la glace, dans le capot.
- Le rapport de la solution finale de la membrane de sous-sol, pbS et cellules de tumeur dans PBS préparépour l'injection est 5:3:2. Par conséquent, à un aliquot de 500 L de membrane de sous-sol ajouter 300 L de PBS pré-réfrigéré à l'aide d'une pointe pré-réfrigérée 1000 l pipette.
- Ajouter le PBS directement à la membrane du sous-sol aliquot pour minimiser le tuyauterie.
- Gardez le p1000 réglé à 300 L et suspendez à nouveau la membrane PBS et sous-sol, en veillant à garder le tube sur la glace pour préserver la membrane du sous-sol à l'état liquide.
- Lorsque vous avez terminé d'éjecter toute la membrane du sous-sol de l'extrémité p1000, laissez la pointe dans le tube pour permettre à n'importe quelle membrane de sous-sol / PBS de descendre la pointe de la pipette.
- Après 5-10 min, éjecter plus de membrane de sous-sol de la pointe p1000 dans le tube et laisser le tube pour s'asseoir sur la glace.
- Prenez 200 L de cellules tumorales en suspension dans le PBS et ajoutez directement à la membrane du sous-sol à l'aide d'une pointe de pipette préréfrigérée de 200 l.
- Prenez une pointe de pipette p1000 fraîche préréfrigérée, fixez la pipette à 300 l et suspendez 30-40 fois. Une plus grande pointe de pipette, réglé sur un faible volume, est préférable car la membrane de sous-sol peut voyager vers le haut de la pointe et toucher le filtre de pointe de pipette pendant la résuspension.
- Les cellules tumorales sont prêtes pour l'injection. Gardez la membrane de cellule de tumeur/sous-sol sur la glace pendant la chirurgie.
2. Injection orthotopic de cellules tumorales
- Acclimater les souris dans l'établissement animalier pendant 7 jours.
- Autour de 2 h avant la chirurgie, raser le côté gauche de l'abdomen et du dos, puis administrer subcutanément des analgésiques préopératoires sous le éraflure du cou (Buprenorphine à 50-100 g/kg).
- Préparer le champ chirurgical, avec un tapis chauffi pour poser la souris et des rideaux pour l'équipement environnant et sur la souris. Stériliser tous les outils chirurgicaux; préparer suffisamment d'ensembles d'outils pour chaque souris.
- Placer la souris dans un isoflurane de 5% avec la chambre O2 jusqu'à ce qu'elle soit inconsciente.
- Transférer la souris, couchée sur le dos, sur un tapis chauffant et maintenir l'anesthésie à l'aide d'un masque, généralement à un isoflurane inférieur de 2-3%.
- Confirmer l'anesthésie profonde; comme identifié par la perte du réflexe de la pédale-retrait quand la patte arrière est pincée et le taux de respiration de moniteur reste constant.
- Couvrir le corps dans un drapé, avec seulement la partie rasée exposée. Assurez-vous que la souris est solidement dans le masque d'anesthésie.
- À l'aide d'un coton stérile, ajouter la solution d'iode dans un mouvement circulaire au-dessus de la zone rasée : en commençant par le centre et en encerclant jusqu'au bord. Répéter le processus avec le coton frais et l'iode.
- Utilisez le scalpel pour faire une incision de 1 cm directement au-dessus de l'emplacement du pancréas/rate (quadrant supérieur gauche). Des ciseaux stériles peuvent également être utilisés pour faire l'incision, si on le préfère.
- Retirez la peau à l'aide de forceps. Avec de nouveaux forceps, localiser la paroi péritonéale et utiliser des ciseaux pour faire une autre incision de 1 cm à travers la paroi péritonéale.
- Extraire le pancréas, qui peut venir avec la rate, du corps en utilisant la deuxième paire de forceps.
- Inverser doucement le flacon des cellules tumorales/membrane de sous-sol plusieurs fois pour mélanger.
- Préparer la seringue en verre avec 5 L contenant 1000 cellules tumorales dans la membrane du sous-sol et placer sur le tapis chauffante pendant quelques secondes pour lui permettre de se réchauffer.
REMARQUE : Le bref réchauffement de la seringue permettra à la membrane du sous-sol de commencer à se solidifier, afin de faciliter l'injection sans fuite. Cependant, ceci doit être gardé bref, si laissé trop longtemps la membrane de sous-sol se solidifiera complètement et ne sera pas injectée. L'utilisation d'une seringue en verre permet d'injecter avec précision un faible volume. - Maintenez le pancréas à la queue pour l'étendre et insérez l'aiguille directement dans le centre du pancréas, parallèle au pancréas lui-même avec un effort pour éviter les vaisseaux sanguins visibles.
REMARQUE: Le centre du pancréas a une grande surface et il est plus facile à injecter. Cependant, la tête ou la queue du pancréas peut également être spécifiquement injectée si elle est préférée. - Injectez lentement 5 ll de membrane de sous-sol dans le pancréas et maintenez l'aiguille stable dans le pancréas pendant au moins 30 s après injection pour permettre à la membrane du sous-sol de se solidifier et d'éviter les fuites. La membrane du sous-sol doit être visible comme une petite bulle claire se sera formée; cependant, il peut ne pas être visible.
REMARQUE : De plus grands volumes de cellules de tumeur/membrane de sous-sol peuvent être injectés ; cependant, le volume exact doit être testé pour s'assurer que la fuite ne se produit pas. - Retirez l'aiguille du pancréas et attendez de confirmer qu'aucun saignement ne s'est produit. Insérez doucement le pancréas dans la cavité abdominale, en prenant soin de ne pas toucher la bulle de membrane du sous-sol.
- Tirez le mur péritonéal ensemble et effectuez une seule suture, ou deux sutures interrompues si nécessaire.
- Tirez les deux côtés de l'incision de la peau ensemble et effectuer de multiples sutures interrompues au besoin ou insérer deux clips chirurgicaux.
- Administrer une autre injection sous-cutanée de buprénorphine dans les éraflures.
- Transférer la souris dans une cage chauffée de 37 oC pendant au moins 30 minutes après la chirurgie afin de maintenir la température corporelle avant de la transférer dans une cage fraîche.
- Préparer un régime de purée disponible dans la cage, pour assurer la réhydratation et le poids corporel.
- Réadministrez l'analgésie postopératoire comme recommandé et surveillez de près les signes d'ouverture de la plaie, de douleur ou d'infection et de perte de poids. Si vous utilisez des clips chirurgicaux, ceux-ci peuvent être enlevés 7-10 jours plus tard à l'aide d'un démaquillant.
- Après environ 14 jours, le tissu cicatriciel aura guéri suffisamment pour commencer à palper l'abdomen. Surveillez la taille de la tumeur de près par palpation jusqu'à ce que les souris atteignent le point final.
- Au point d'extrémité, la souris est éliminée par dislocation cervicale suivie d'une décapitation. La peau et la cavité péritonéale sont ouvertes à l'aide de ciseaux et la tumeur du pancréas excisée à l'aide de forceps pour tenir la tumeur, et des ciseaux pour enlever les tissus environnants.
3. Digestion des tumeurs pancréatiques
- Placez la tumeur pancréatique disséquée, les tumeurs métastatiques de site, ou le tissu pancréatique sain dans le PBS glacé, et entreposez sur la glace.
- Utilisez des forceps pour transférer la tumeur sur un plat Petri.
- Ajouter 5,0 ml de milieu de digestion (2 mg/mL de collagène, 0,025 mg/mL DNase RPMI) dans un tube de 50 ml; conserver sur la glace pour prévenir l'activité enzymatique à partir de l'année.
REMARQUE: Ce protocole utilise Collagenase Type V, qui a une activité de 1 unités / mg FALGPA et 125 unités de digestion de collagène (CDU)/mg solide. Les aliquots de collagène et de DNase peuvent être stockés à -20 oC et décongelés sur la glace avant utilisation. Lorsque les deux sont complètement solubilisés dans le RPMI stérile, ils peuvent être passés à travers un filtre de 0,2 m pour éliminer les contaminants. La collagène doit être complètement solubilisée avant de filtrer pour éviter la perte de matière. - Prenez un petit aliquot de cette solution pour couvrir la tumeur sur le plat Petri.
- Utilisez le scalpel et les forceps stériles pour couper la tumeur en petits morceaux, soit environ moins de 3 mm de longueur.
- Gratter les morceaux de tumeur dans le tube et inverser doucement le tube jusqu'à ce que toutes les pièces sont immergées dans le support de digestion. Conserver sur la glace si d'autres échantillons de tumeurs doivent être préparés dans un lot.
- Transférer sur un dispositif de secousse pendant 20 min à 37 oC. Assurez-vous que tous les morceaux de tumeur sont submergés et ne sont pas collés au bord du tube. Si il n'est pas possible de secouer, vortex l'échantillon toutes les 5 min pour faciliter la digestion.
4. Préparation de la suspension unicellulaire de la tumeur digérée
- Immédiatement après l'étape de digestion, placez le tube sur la glace pour ralentir l'activité enzymatique.
- Ajouter EDTA pour obtenir une concentration finale de 20 mM et brièvement l'échantillon de vortex pour mélanger. Cela ralentira encore l'activité enzymatique.
- Ouvrez le tube et rincez n'importe quelle tumeur digérer le couvercle du tube avec le milieu frais de RPMI.
- Préparer une passoire de 70 m (la taille de la passoire peut être modifiée comme désiré) sur un tube ouvert de 50 ml, sur glace.
- Prémouiller le filtre avec le milieu.
- Resuspendre les cellules digérées et laver les côtés du tube à l'aide d'une strip-teaseuse de 25 ml, ou plus. L'ouverture plus large de la stripette est importante pour permettre au digest épais de passer facilement.
- Transférer tout le digest, à l'aide de la stripette de 25 ml, sur la passoire.
- Écraser la tumeur sur le dessus du filtre à l'aide d'un piston à seringues de 1 ml. Écraser seulement directement de haut en bas pour minimiser le stress de cisaillement aux cellules.
- Laver continuellement les cellules à travers la passoire avec RPMI. Assurez-vous de laver avec assez de force pour pousser les cellules à travers.
- S'il y a encore du matériel à écraser, mais que le RPMI cesse de rincer, la passoire sera saturée. Par conséquent, transférez l'échantillon dans un nouveau filtre et continuez.
REMARQUE : Finalement, seuls les composants de la matrice extracellulaire resteront dans le filtre, toutes les cellules individuelles auraient dû passer.
- Centrifuger le tube pendant 5 min à 300 x g et 4 oC.
- Resuspendre soigneusement la pastille cellulaire dans le RPMI complet et passer directement à travers un autre filtre pour enlever toute matrice extracellulaire ou de grandes amas cellulaires qui ne peuvent pas être correctement suspendus.
- À ce stade, si aucune stimulation n'est nécessaire, tacher immédiatement les cellules isolées pour l'analyse de cytométrie de flux en sautant à l'étape 6.1. Alternativement, les suspendre dans un milieu de congélation (10% de DMSO dans FBS) et les stocker à -80 oC suivis d'un stockage à long terme dans l'azote liquide.
REMARQUE : L'étape de congélation peut permettre la purification des cellules immunitaires à une date ultérieure ; cependant, la quantification des sous-ensembles de cellules immunitaires peut nécessiter une optimisation pour confirmer que le nombre de cellules et le phénotype ne sont pas affectés par le processus de gel/dégel. La stimulation ex vivo des lymphocytes T est mieux réalisée sur des échantillons de tumeurs fraîches. À ce stade, l'échantillon peut être purifié par l'ablation des cellules mortes à base de perles ou des tests d'enrichissement des cellules immunitaires si nécessaire.
5. Préparation des cellules pour la stimulation ex vivo
- Compter les cellules pour atteindre une concentration de 2 x 106/ 100 L dans le milieu complet (RPMI 10 % FBS, 1X pénicilline et 1X streptomycine).
REMARQUE : Le nombre élevé de cellules totales plaquées garantit qu'il y aura des lymphocytes T adéquats dans cet échantillon à analyser. Cependant, le nombre peut être augmenté ou réduit en fonction de la disponibilité de l'échantillon et de la nature rare des sous-ensembles d'intérêt des lymphocytes T.- Plaque de 100 l de cellules dans une plaque de 96 puits à fond U.
- Ajouter 100 l de milieu complet contenant une préparation 2x de PMA/ionomycine (pour atteindre une concentration finale de 0,081 M et 1,34 M, respectivement, comme recommandé par le fabricant).
REMARQUE: Si la mesure de la dégranulation / exocytose, aussi inclure ici un fluorescent conjugué anti-souris CD107a dans les médias. Un échantillon de contrôle qui ne contient pas de CD107a doit également être effectué. - Placer dans un incubateur de 37 oC avec 5 % de CO2 pour 1 h.
- Ajouter 20 l d'une préparation 10x de brefeldin A et de monensine (pour atteindre une concentration finale de 1,06 M et 2,0 M, respectivement (comme recommandé par le fabricant) dans un support complet.
REMARQUE : La brefeldine A et la monensine sont des inhibiteurs du transport de protéines et bloquent ainsi la libération extracellulaire des cytokines, etc., permettant leur détection par cytométrie de flux. Si la mesure de la libération de cytokine dans le supernatant par ELISA ou des méthodes similaires - alors cette étape peut être ignorée. - Placer la plaque dans un incubateur de 37 oC avec 5 % de CO2 pour 4 h supplémentaires.
6. Coloration extracellulaire et intracellulaire pour la cytométrie du flux
- Retirer la plaque et resuspendre chaque puits pour transférer tout le matériel dans une plaque à fond V, placée sur la glace.
REMARQUE : Les cellules épithéliales, les macrophages et les autres cellules adhérentes peuvent ne pas être entièrement récupérées en respendant. Cependant, comme l'analyse en aval est uniquement sur les lymphocytes T, ce n'est pas un problème.- 6.1.1 Centrifuger la plaque pendant 5 min à 300 x g et 4 oC (utiliser ces conditions pour les étapes suivantes sauf indication).
- Retirez le supernatant en faisant glisser la plaque à l'envers en un seul mouvement brusque.
- Resuspendre dans 50 L d'un colorant de viabilité réparable, préparé dans du PBS glacé. Lors de la remise en suspension, configurez la pipette à un volume inférieur pour éviter de faire des bulles.
- Incuber pendant 20 min à 4 oC, dans l'obscurité.
- Étape de lavage : Ajouter 100 l de tampon FACS, centrifugeuse et retirer le supernatant.
- Resuspendre chaque puits avec 50 OL d'anti-CD16/CD32 (2,5 g/mL) dans la mémoire tampon FACS (0,5 % De BSA, 2,0 mM EDTA en PBS) pour bloquer la liaison non spécifique des anticorps de détection aux récepteurs Fc.
- Incuber pendant 15 min à 4 oC, dans l'obscurité.
- Ajoutez directement à chaque puits un mastermix 2x de CD45, CD3, CD3, CD4 et CD8 (d'autres marqueurs extracellulaires peuvent être ajoutés comme désiré) dans le tampon FACS.
- Incuber pendant 30 min à 4 oC, dans l'obscurité.
- Étape de lavage : Ajouter 100 l de tampon FACS, centrifugeuse et retirer le supernatant.
- Ajouter 100 l de 1x tampon de fixation intracellulaire (IC) et couver pendant 30 min à RT, dans l'obscurité.
- Préparer la centrifugeuse à RT.
- Ajouter 100 l de tampon FACS, centrifugeuse pendant 5 min à 300 x g et RT et retirer le supernatant. Répéter l'opération avec 1x tampon de perméabilisation et centrifugeuse pendant 5 min à 300 x g; puis retirez le supernatant.
- Ajoutez 50 L de mastermix 1x d'ifNMD, de TNMD et d'autres marqueurs intracellulaires préparés dans un tampon de perméabilisation 1x.
- Incuber pendant 1 h à RT, dans le noir.
- Ajouter 100 l'tampon de perméabilisation pour le laver. Puis centrifugeuse pendant 5 min à 300 x g et RT et retirer le supernatant.
- Ajouter 100 l de tampon FACS pour laver, centrifugeuse rauquerif pendant 5 min à 300 x g et RT et retirer le supernatant.
- Après cette centrifugation finale, resuspendre les cellules dans un volume compatible pour le cytomètre de flux. Il peut varier en fonction de la taille des tubes FACS.
- Transférer ce volume dans des tubes FACS appropriés pour l'acquisition.
- Couvrir de la lumière et conserver au réfrigérateur et acquérir les échantillons dans les 24 h.
Résultats
Après l'injection de 1000 cellules TB32048 dans le pancréas, les tumeurs orthotopiques prennent environ 30 jours à se développer (Figure 1A,B). Les fuites de membrane de sous-sol pendant la chirurgie peuvent causer la formation de grandes tumeurs directement sur la paroi péritonéale, qui sont bien visibles à travers la peau (Figure 1C). Nous retirerions ces souris de l'étude. Cependant, avec de bonnes qualifications chirurgicales l'incidence de la fuite est réduite au minimum. Les tumeurs orthotopiques récoltées au point final peuvent atteindre une taille substantielle chez les souris de type sauvage C57BL/6 (Figure 1D). Les tumeurs orthotopiques récoltées nécessitent une digestion en collagène/DNase pendant 20 min afin d'obtenir une suspension unicellulaire (figure 2). À ce stade, les cellules dérivées de tumeur peuvent être plaquées dans une plaque U-bottomed à 2 x 106 cellules/puits. Le nombre de cellules plaquées peut être modifié en fonction de la prévalence des lymphocytes T dans l'échantillon; le nombre de cellules peut être abaissé si les lymphocytes T sont à haute densité. Des échantillons de rate de contrôle ou de ganglion lymphatique peuvent également être plaqués à ce stade pour la stimulation. Chaque puits est stimulé par PMA et ionomycine pendant 5 h et après 1 h d'incubation, la brefeldine A et la monensine sont ajoutées afin de bloquer la libération extracellulaire de cytokines (Figure 2). Après l'incubation, les échantillons sont tachés pour les épitopes extracellulaires et les cytokines intracellulaires pour analyse par cytométrie du débit (Figure 2).
Des échantillons de rate et de tumeurs des souris portant des tumeurs orthotopiques ont été analysés par cytométrie de flux. La stratégie de gating utilisée dans l'analyse de cytométrie de flux pour les tumeurs de rate et orthotopic exclut des débris utilisant FSC-A, SSC-A, doublets par FSC-A/FSC-H et SSC-A/SSC-W, alors morts ou cellules apoptotic comme positif pour le colorant de viabilité réparable (figure 3A). Les cellules immunitaires sont ensuite fermées sous le régime de CD45, et les lymphocytes T sont plus fermés sous le cD3, à partir desquels les sous-ensembles CD4 et CD8 sont définis ( Figure 3A). Une fluorescence moins un (FMO) est effectuée pour déterminer la fluorescence de fond pour le gating et un contrôle de brefeldin A/monensin seulement est exécuté pour déterminer la production basale des cytokines (figure 3B-D).
Pour l'IFN, l'incubation avec de la brefeldine A/monensin n'a eu comme conséquence aucune augmentation d'IFNMD au-dessus du contrôle de FMO dans les échantillons de rate et de tumeur. Cependant, l'ajout de PMA et d'ionomycine a augmenté le % de l'IFN intracellulaire, détectable dans les cellules CD4 spléniques et dérivées de tumeurs.
Les lymphocytes Splenic CD4et CD8T, utilisés comme un contrôle positif, ont une production d'IFN relativement plus élevée que les sous-ensembles de lymphocytes T infiltrants par tumeur, avec une moyenne de 6,60 à 1,5 % et 12,97 à 3,4 % contre 4,81 à 1,0 % et 4,13 à 1,3 %, indiquant que l'immunosuppression se produit dans la tumeur(Figure 3B et 4A). En utilisant la même stratégie pour le TNMD, nous avons visualisé qu'un pourcentage élevé de cellules CD4et T spléniques sont positifs pour le TNF intracellulaire (65,93 - 2,3 %), comparativement aux cellules CD4et T infiltrants par tumeur (22,45 à 5,4 %). Les cellules CD8et T spléniques et infiltrantes par les tumeurs produisent des niveaux similaires de TNFMD (25,15 à 3,7 % et 19,91 à 5,1 %, respectivement) (Figure 3C, Figure 4B).
Enfin, CD107a est un marqueur endosomal qui s'exprime transitoirement sur la surface cellulaire pendant l'exocytose des granules cytotoxiques et des cytokines, en tant que tel, il est utilisé comme marqueur de substitution pour la cytotoxicité. L'avantage de la coloration pour CD107a pendant la stimulation est que tous les CD107a exprimés par la surface cellulaire transitoire seront capturés par l'anticorps fluorescent. Les niveaux basaux de CD107a sont montrés dans les cellules traitées de brefeldin A/monensin seulement. Pour les cellules Splenic CD8et T, la stimulation par PMA/ionomycine augmente le niveau de CD107a détecté, avec la plus forte upregulation dans les cellules CD8- qui étaient 23,95 - 3,5% CD107a, par rapport à 5,8 - 1,9 % dans lescellules CD8 infiltrant la tumeur, indiquant splenic CD8- avait un taux plus élevé de degranulation. D'autre part, cD4 splénique et infiltrant la tumeur- exprimé des niveaux comparables de CD107a 9,37 - 1,5 % et 11,50 - 1,8 % (Figure 3D et 4C).
Dans l'ensemble, ces résultats soulignent que les tumeurs orthotopiques peuvent être générées par l'injection d'un très faible nombre (1000) de cellules tumorales dans le pancréas. Ces tumeurs peuvent être rapidement digérées pour l'isolement des lymphocytes T pour la stimulation ex vivo. La détection des cytokines intracellulaires est possible et accentue le niveau basal d'immunosuppression des lymphocytes T infiltrants, comparéaux aux cellules T dans les organes lymphoïdes secondaires.
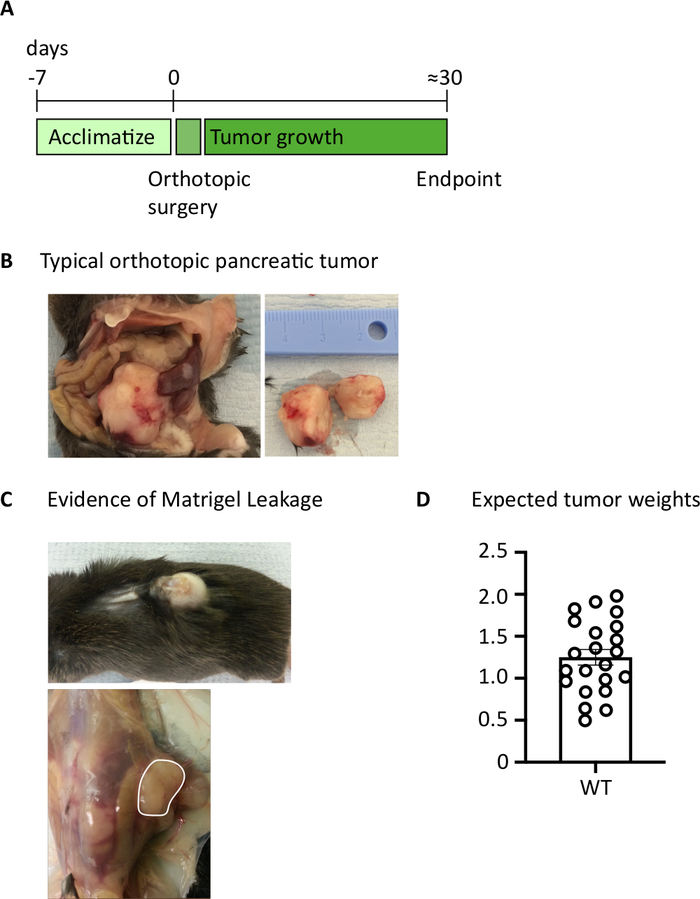
Figure 1 : Génération de tumeurs pancréatiques orthopiques. (A) Calendrier d'expériences in vivo. (B) L'aspect macroscopique des tumeurs orthopiques dans la cavité abdominale (à gauche) et après l'excision (à droite) où la tumeur montrée a été coupée en deux. (C) L'évidence de la fuite de membrane de sous-sol pendant la chirurgie peut causer des tumeurs pour se développer qui sont visibles par la peau (photo supérieure) et forment sur la paroi péritonéale (photo inférieure). (D) Poids pancréatiques orthopiques de tumeur moissonné s'est produit des souris qui avaient atteint le point final (n-22). Chaque point de données représente une souris individuelle, graphique à barres montre moyenne - SEM. Les données de ce chiffre ont été modifiées à partir de l'ouvrage publié précédemment10. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
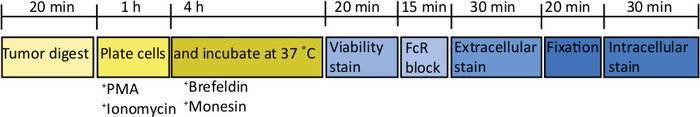
Figure 2 : Schématique de traitement des tumeurs orthotopiques pour la stimulation ex vivo de cellule T. Après la récolte, les tumeurs pancréatiques sont rapidement digérées dans la collagène (2 mg/mL) et le DNase (0,025 mg/mL) pendant 20 min à 37 oC. Par la suite, les cellules sont suspendues à 2 x 106/mL dans un support RPMI complet et plaquées dans une plaque à fond U. Un cocktail de stimulation de PMA et d'ionomycine est ajouté pour 5 h, à quel point l'anticorps anti-souris CD107a peut également être ajouté à la culture. Après 1 h d'incubation, les bloqueurs de transport intracellulaires, la brefeldine A et la monensine, sont ajoutés. Après la stimulation ex vivo, les cellules sont transférées dans une plaque à fond En V pour la coloration avec le colorant réparable de viabilité (en PBS) pendant 20 min 4 oC. Les cellules sont lavées dans le tampon FACS et incubées en anti-CD16/32 (bloc FcR) pendant 15 minutes (dans le tampon FACS) puis incubées avec des anticorps extracellulaires conjugués fluorescents pendant 30 min supplémentaires (dans le tampon FACS). Les cellules sont lavées à nouveau dans le tampon FACS et resuspend dans le tampon de fixation intracellulaire pendant 20 min. Après cela, les cellules sont lavées une fois dans le tampon FACS et une fois dans le tampon de perméabilisation 1x. Les cellules sont suspendues pendant 1 h à RT dans les anticorps intracellulaires conjugués fluorescents pendant 1 h (dans le tampon de perméabilisation de 1x). Les cellules sont lavées une fois dans le tampon de perméabilisation 1x et une fois dans le tampon FACS avant de se resuspendre dans le tampon FACS pour l'acquisition sur le cytomètre de flux dans les 24 h. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
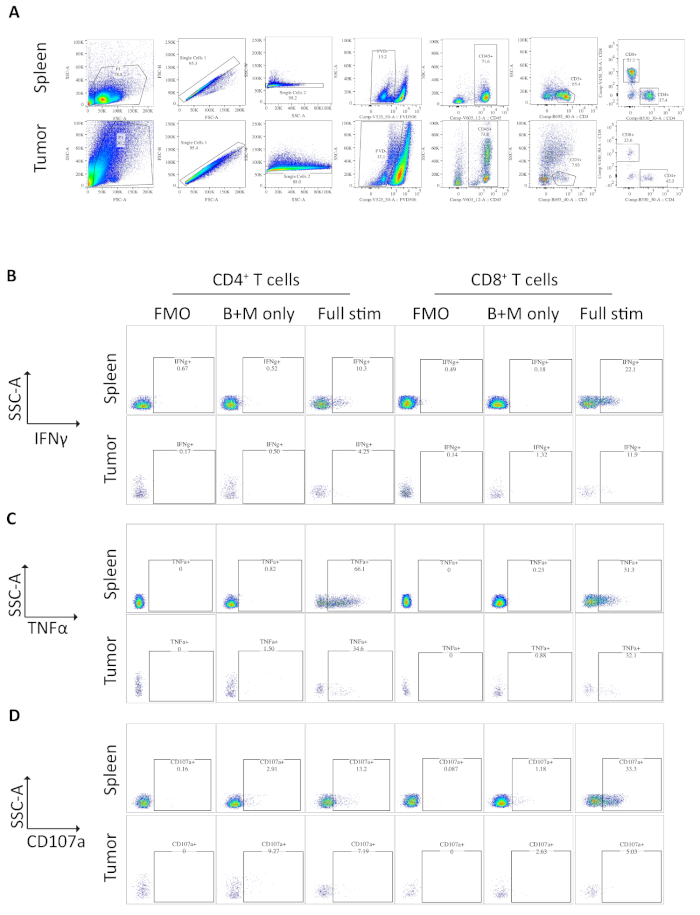
Figure 3 : Analyse de cytométrie de flux des cellules T ex vivo stimulées par la rate et la tumeur. (A) Stratégie de gating de cytométrie de flux utilisée pour les échantillons de rate (contrôle positif) et de tumeurs orthotopiques. Les cellules sont discriminées à partir des débris utilisant FSC-A/SSC-A et les cellules individuelles sont plus isolées à l'aide de FSC-A/FSC-H et SSC-A/SSC-W. Les cellules mortes ou apoptotiques sont exclues à l'aide du colorant de viabilité réparable -FVD506 et les cellules immunitaires sont fermées par CD45. Suite à cela CD3et les sous-ensembles CD4et CD8et CD8 sont définis. Les données ont été acquises sur un BD Fortessa. (B) La stratégie de gating utilisée pour quantifier les cellulesIFNMD, CD4 et CD8et T. Un contrôle fluorescent moins un (FMO) est utilisé sur des échantillons entièrement stimulés (PMA/ionomycine/brefeldin A/monensin) pour déterminer la fluorescence de fond. Un contrôle de brefeldin A/monensin seulement (B-M seulement) est employé pour déterminer la production basale de cytokine. L'échantillon entièrement stimulé est ensuite utilisé pour calculer le % des cellulesT IFNMD. (C) La stratégie de gating utilisée pour quantifier les cellules TNFMDet CD4 et CD8 et T. Un contrôle FMO est utilisé sur des échantillons entièrement stimulés (PMA/ionomycine/brefeldin A/monensin) pour déterminer la fluorescence de fond. Un contrôle de brefeldin A/monensin seulement (B-M seulement) est employé pour déterminer la production basale de cytokine. L'échantillon entièrement stimulé est ensuite utilisé pour calculer le % de lymphocytesT DeNMD. (D) La stratégie de gating utilisée pour définir les cellules CD107aet CD4 et CD8et T. Un contrôle FMO est utilisé sur des échantillons entièrement stimulés (PMA/ionomycine/brefeldin A/monensin) pour déterminer la fluorescence de fond. Un contrôle de brefeldin A/monensin seulement (B-M seulement) est employé pour déterminer la dégranulation basale. L'échantillon entièrement stimulé est ensuite utilisé pour calculer le % de cellules CD107aet T. Toutes les données de cytométrie de flux ont été analysées sur FlowJo Version 10.6.1. Les données de ce chiffre ont été modifiées à partir de l'ouvrage publié précédemment10. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
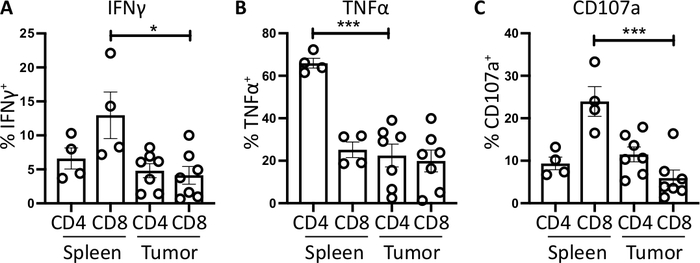
Figure 4 : Quantification de l'activité des lymphocytes T dérivées de la rate ex vivo et de la tumeur. La proportion de CD4et de CD8- lymphocytes T positifs pour (A)IFNMD (B) TNFet et (C) CD107a- a été quantifiée dans la rate (n -4) et la tumeur (n -7) des souris porteuses orthotopic-tutoltopiques. Chaque point de données représente une moyenne d'affichage de souris et d'erreurs individuelles - SEM. Importance statistique a été testée à l'aide d'un test t non apparié où le p-lt;0,05 et le p-lt;0,001. Toutes les données ont été analysées à l'aide de Prism 8. Les données de ce chiffre ont été modifiées à partir de l'ouvrage publié précédemment10. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Les modèles in vivo du cancer du pancréas fournissent des outils inestimables pour comprendre la progression de la maladie et évaluer de nouvelles cibles thérapeutiques3. Le modèle orthotopic en particulier est un modèle rentable et reproductible qui peut être appliqué dans de grandes cohortes de souris simultanément4,27. Le modèle orthotopic fournit également le microenvironnement cognat et le système immunitaire intact pour la croissance de tumeur, le rendant plus approprié que les sous-cutanés et Les modèles de PDX. Cependant, nous avons constaté que certains éléments de l'infiltration immunitaire peuvent différer entre le modèle orthotopic et les souris KPC, le modèle murine de référenceor 10. Une raison pour ceci pourrait être la croissance accélérée de tumeur vue dans le modèle orthotopic. D'autres différences dans la densité des sous-ensembles de cellules immunitaires ont été décrites entre les modèles orthotopiques et sous-cutanés3,28. Par conséquent, bien que le modèle transgénique de KPC soit plus coûteux et variable6,les résultats principaux devraient être vérifiés dans une petite cohorte de souris de KPC si possible.
La préparation des cellules tumorales pour la chirurgie orthotopique est une étape critique dans le protocole. Les cellules doivent toujours être dans la phase de journal de la croissance et mycoplasma- et sans infection. La chirurgie orthotopic devrait être reportée s'il y a n'importe des soucis au-dessus de la croissance de cellules de tumeur. L'utilisation de la membrane de sous-sol améliore le taux d'incidence de tumeur au-dessus des cellules d'injection sans elle29 et réduit la fuite de cellules et ainsi la propagation péritonéale27. Cependant, une fois suspendues dans la membrane de sous-sol, les cellules de tumeur devraient être rapidement injectées (dans un délai de 2 heures) pour éviter n'importe quelle perte de cellules. Le nombre de cellules tumorales nécessaires pour générer des tumeurs est susceptible d'être dépendant de la lignée cellulaire, et une gamme de numéros de cellules doivent être testés (par exemple, de 100 à 100 000) qui peuvent également déterminer le temps d'atteindre le point final. Il est probable qu'il y aura une marge d'erreur lors de la préparation de 1000 cellules par souris pour l'injection; par conséquent, si plusieurs jours de chirurgie sont nécessaires, le traitement des groupes devrait être réparti également sur plusieurs jours pour contrôler les effets des lots. La plupart des étapes chirurgicales peuvent être modifiées en fonction des préférences; cependant, il faut prendre soin de ne pas déranger la membrane du sous-sol lors du remplacement du pancréas dans la cavité abdominale ou de la fermeture de la paroi péritonéale. La fuite de membrane de sous-sol peut causer la croissance de cellules de tumeur sur la paroi péritonéale, qui se forment rapidement et peuvent avoir à devoir sacrifier l'animal plus tôt.
Idéalement, les tumeurs pancréatiques devraient être rapidement digérées après la récolte et préparées pour la stimulation ex vivo immédiatement. Cependant, ceci pourrait ne pas être possible s'il y a un grand lot de tumeurs à récolter, dans ce cas les tumeurs devraient être maintenues sur la glace et digérées dans des lots. Le type, la concentration et la durée de l'exposition aux enzymes digestives ont tous été montrés pour affecter un grand nombre de molécules de surface sur les cellules immunitaires30,31,32. Le temps de digestion est également délibérément court pour limiter la mort cellulaire33. Les cellules digérées peuvent être congelées dans un milieu de congélation pour un stockage à long terme; cependant, une certaine perte de cellules se produira lors de la décongélation. Le processus de digestion peut être moins qu'optimal si les morceaux de tumeur ne sont pas suffisamment coupés en dés avant l'incubation de collagène et ceci sera évident car les morceaux durs de tumeur resteront dans le filtre après digestion. La concentration de collagène peut être abaissée si vous travaillez avec le pancréas sain ou les tumeurs à un stade précoce; rapports sur l'extraction des cellules canalaires pancréatiques saines emploient des concentrations significativement plus basses34. Un degré élevé de mort épithéliale de cellules est à prévoir pendant la digestion ; cependant, les cellules immunitaires devraient tolérer le processus bien. D'autres méthodes existent pour isoler les cellules épithéliales viables pour la croissance organoïde35 ou pour préserver l'architecture tissulaire36.
Les modifications au protocole de stimulation peuvent être apportées facilement, selon la lecture souhaitée et la cellule immunitaire analysée (par exemple, les macrophages ou les cellules B). L'utilisation de réactifs pan-stimulation PMA / ionomycine ne discrimine pas pour la spécificité TCR-antigène, ce qui le rend utile lorsque l'antigène n'est pas connu. Cependant, la production d'IFN est étroitement associée à l'engagement de TCR37 et la production d'IFN et de TNFMD sont essentielles dans les réponses antitumorales pDAC38. La stimulation de PMA/ionomycine reflète la capacité maximale des lymphocytes T pour produire des cytokines, qui pourraient ou pourraient ne pas être produites par les cellules T dans le microenvironnement de tumeur. La production endogène peut être mesurée sans besoin de stimulation; cependant, les niveaux peuvent être beaucoup plus bas ou indétectables. Il existe d'autres méthodes pour stimuler les lymphocytes T : les perles enduites d'anti-CD3/28, qui ne nécessitent pas non plus d'antigène ou même d'autres populations de cellules immunitaires. L'avantage de cette méthode est de permettre la quantification de la production de cytokine par des sous-ensembles spécifiques de cellules T sans avoir besoin de méthodes de séparation. D'autres marqueurs de cytotoxicité (granzyme B et Perforin A), d'activité (IL-2) ou d'immunosuppression (IL-10) peuvent également être ajoutés21. Cependant, les anticorps de cytométrie de flux de haute qualité ne sont pas disponibles pour détecter toutes les cytokines et les facteurs d'intérêt. Par conséquent, s'il existe d'autres applications telles que ELISA nécessaire la stimulation peut être effectuée sans l'inclusion de la brefeldine A / monensine, permettant la libération de cytokine dans le supernatant. Cependant, il convient de noter que cela permettra la libération totale de cytokine cellulaire et il ne sera pas possible de déterminer quelles populations cellulaires ont contribué.
La production d'IFN est une caractéristique dominante d'une réponse antitumorale de cellule T, souvent employée comme substitut à la reconnaissance de TCR-antigène37,38. D'autres méthodes in vivo qui définissent plus précisément les réponses spécifiques à l'antigène utilisent des cellules tumorales exprimant un antigène connu, comme l'Ovalbumin ou le SV40. L'antigène universel peut ensuite être utilisé ex vivo pour tester la reconnaissance des lymphocytes T ou en combinaison avec une souris hôte tCR-restreinte. Alternativement, lorsque l'antigène est inconnu, la quantification de l'expansion clonale des lymphocytes T peut être effectuée par séquençage en vrac-TCR, ou plus récemment un séquençage de TCR à cellule unique39,40. Pour bien comprendre l'état de la réponse intratumorale des lymphocytes T, les marqueurs indicatifs d'épuisement ou de récepteurs inhibiteurs doivent également être mesurés, y compris : CTLA-4, PD-1, LAG-3, TIM3, 2B4. Ainsi que des marqueurs de lymphocytes T effecteurs (CD44salut, CD62lo) et l'activité proliférante, Ki67ou CSFE dilution41,42,43,44. Dans l'ensemble, le modèle orthotopic fournit une plate-forme utile pour tester rapidement des stratégies thérapeutiques, en particulier qui peuvent moduler la réponse antitumorale de T-cell, qui peut ensuite être validée sur une plus petite cohorte de transgéniques, KPC, souris.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous tenons à remercier le Animal Technician Service et le Dr Alzbeta Talarovicova (Barts Cancer Institute, Queen Mary University of London, Londres, Royaume-Uni) pour leur aide lors de la chirurgie orthotopique. Nous tenons également à remercier la Dre Jennifer Morton (Beatson Institute for Cancer Research, Glasgow, Royaume-Uni) pour ses conseils en technique chirurgicale, la Dre Cristina Ghirelli (Barts Cancer Institute, Queen Mary University of London, Londres, Royaume-Uni) pour ses conseils sur la digestion tumorale et la Dre Fabienne McClanahan (Barts Cancer Institute, Queen Mary University of London, Londres, Royaume-Uni) pour ses conseils concernant les protocoles de stimulation des cellules T ex vivo. Nous tenons également à remercier le Conseil de recherches médicales (CRM), le Fonds de recherche sur le cancer du pancréas (PCFR) et L'Action contre le cancer de l'ovaire qui a financé cette recherche.
matériels
| Name | Company | Catalog Number | Comments |
| 6/0 gauge coated vicryl absorbable sutures | Ethicon | W9500T | |
| 70 μm pore-size cell strainer | Fisher Scientific | 11597522 | |
| 9 mm Clay Adams clips | VetTech Solutions | IN015A | |
| anti-CD107a PE (clone 1D4B) | Biolegend | 121612 | 1:100 to culture media |
| anti-CD16/CD32 | BD Biosciences | 553142 | Use at final dilution 1:200 |
| anti-CD3 PerCP eFluor710 (clone 17A2) | Biolegend | 46-0032 | Use at final dilution 1:50 |
| anti-CD4 FITC (clone GK1.5) | eBioscience | 11-0041 | Use at final dilution 1:100 |
| anti-CD45 Brilliant Violet 605 (clone 30-F11) | Biolegend | 103140 | Use at final dilution 1:200 |
| anti-CD8 Brilliant Violet 421 (clone 53-6.7) | Biolegend | 100738 | Use at final dilution 1:100 |
| anti-IFN-gamma PE/Cy7 (clone XMG1.2) | Biolegend | 505826 | Use at final dilution 1:50 |
| anti-TNF-alpha Alexa Fluor 647 (clone MP6-X) | Biolegend | 506314 | Use at final dilution 1:50 |
| BD Matrigel Basement Membrane Matrix High Concentration | BD Biosciences | 354248 | Aliquot on ice and store in -20 °C |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| Cell Stimulation Cocktail (500x) (phorbol 12-myristate 13-acetate (PMA) and ionomycin) | eBioscience | 00-4970-03 | 1x Final concentration PMA 0.081 μM, ionomycin 1.34 μM |
| Clay Adams Autoclip Applier | VetTech Solutions | IN015B | |
| Clay Adams Autoclip remover | VetTech Solutions | IN015B | |
| Collagenase Type V from Clostridium histolyticum | Sigma-Aldrich | C9263 | 2 mg/mL in media |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D2650-100mL | |
| DMEM High glucose (4.5 g/L) with L-Glutamine | PAA | E15-810 | |
| DNase (Deoxyribonuclease I from bovine pancreas Type II-S) stock 10 mg/mL in 0.15 M NaCl | Sigma-Aldrich | D4513 | Final concentration in digestion media 0.025 mg/mL |
| Fixable Viability Dye 506 (FVD506) | eBioscience | 65-0866 | Use at 1:200 in PBS |
| Foetal calf-serum (FCS) | GE Healthcare | A15-104 | 10% in RPMI |
| Hamilton syringe 700 series, 25 μL volume, 22s gauge needle bevel tip | Fisher Scientific | 10100332 | |
| Intracellular Fixation buffer and Intracellular Permeabilisation Buffer | eBioscience | 88-8824-00 | Dilute permeabilisation buffer to 1x in H2O |
| Penicillin/streptomycin | PAA | 15140122 | 100 units/mL Penicillin, 100 μg/mL Streptomycin |
| Protein transport inhibitor cocktail (500x) (brefeldin A and monesin) | eBioscience | 00-4980-03 | 1x Final concentration Brefeldin A 10.6 μM, monensin 2 μM |
| RPMI-1640 (containing 0.3 g/L Glutamine) | Sigma-Aldrich | R8758 | |
| Surgical Scalpel Blade No.10 | Swann-Morton | 0501 | |
| Trypsin-EDTA Solution 10x | Sigma-Aldrich | 594-18C | Trypsin (0.1%) EDTA (0.4%) final concentration |
| U-bottomed 96 microwell plate | VWR | 734-2080 | |
| Universal Cotton Tipped Applicators - 6 inch x 100 | Medisave | UN982 | |
| V-bottomed 96 microwell plate | VWR | 735-0184 |
Références
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Conroy, T., et al. Current standards and new innovative approaches for treatment of pancreatic cancer. European Journal of Cancer. 57, 10-22 (2016).
- Lee, J. W., Komar, C. A., Bengsch, F., Graham, K., Beatty, G. L. Genetically engineered mouse models of pancreatic cancer: The KPC model (LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre), its variants, and their application in immuno-oncology drug discovery. Current Protocols in Pharmacology. 2016, (2016).
- Tseng, W. W., et al. Development of an Orthotopic Model of Invasive Pancreatic Cancer in an Immunocompetent Murine Host. Clinical Cancer Research. 16 (14), 3684-3695 (2010).
- Majumder, K., et al. A Novel Immunocompetent Mouse Model of Pancreatic Cancer with Robust Stroma: a Valuable Tool for Preclinical Evaluation of New Therapies. Journal of Gastrointestinal Surgery. 20 (1), 53-65 (2016).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Herreros-Villanueva, M., Hijona, E., Cosme, A., Bujanda, L. Mouse models of pancreatic cancer. World Journal of Gastroenterology. 18 (12), 1286-1294 (2012).
- Witkiewicz, A. K., et al. Integrated Patient-Derived Models Delineate Individualized Therapeutic Vulnerabilities of Pancreatic Cancer. Cell Reports. , (2016).
- Nicolle, R., et al. Pancreatic Adenocarcinoma Therapeutic Targets Revealed by Tumor-Stroma Cross-Talk Analyses in Patient-Derived Xenografts. Cell Reports. , (2017).
- Spear, S., et al. Discrepancies in the Tumor Microenvironment of Spontaneous and Orthotopic Murine Models of Pancreatic Cancer Uncover a New Immunostimulatory Phenotype for B Cells. Frontiers in Immunology. 10, 542(2019).
- Zhu, Y., et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models. Cancer Research. , (2014).
- Lee, J. J., Huang, J., England, C. G., McNally, L. R., Frieboes, H. B. Predictive Modeling of In vivo Response to Gemcitabine in Pancreatic Cancer. PLoS Computational Biology. , (2013).
- Clark, C. E., et al. Dynamics of the Immune Reaction to Pancreatic Cancer from Inception to Invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Fukunaga, A., et al. CD8+ tumor-infiltrating lymphocytes together with CD4+ tumor-infiltrating lymphocytes and dendritic cells improve the prognosis of patients with pancreatic adenocarcinoma. Pancreas. 28 (1), 26-31 (2004).
- Tewari, N., et al. The presence of tumor-associated lymphocytes confers a good prognosis in pancreatic ductal adenocarcinoma: an immunohistochemical study of tissue microarrays. BMC Cancer. 13 (1), 436(2013).
- Royal, R. E., et al. Phase 2 Trial of Single Agent Ipilimumab (Anti-CTLA-4) for Locally Advanced or Metastatic Pancreatic Adenocarcinoma. Journal of Immunotherapy. 33 (8), 828-833 (2010).
- Brahmer, J. R., et al. Safety and Activity of Anti–PD-L1 Antibody in Patients with Advanced Cancer. New England Journal of Medicine. 366 (26), 2455-2465 (2012).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Beatty, G. L., et al. CD40 Agonists Alter Tumor Stroma and Show Efficacy Against Pancreatic Carcinoma in Mice and Humans. Science. 331 (6024), 1612-1616 (2011).
- Lutz, E. R., et al. Immunotherapy converts nonimmunogenic pancreatic tumors into immunogenic foci of immune regulation. Cancer Immunology Research. 2 (7), 616-631 (2014).
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews. Immunology. 2 (6), 401-409 (2002).
- Mojic, M., Takeda, K., Hayakawa, Y. The dark side of IFN-γ: Its role in promoting cancer immunoevasion. International Journal of Molecular Sciences. , (2018).
- Castro, F., Cardoso, A. P., Gonçalves, R. M., Serre, K., Oliveira, M. J. Interferon-gamma at the crossroads of tumor immune surveillance or evasion. Frontiers in Immunology. , (2018).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nature Immunology. , (2011).
- Betts, M. R., et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. Journal of Immunological Methods. 281 (1-2), 65-78 (2003).
- Schuerwegh, A. J., De Clerck, L. S., Bridts, C. H., Stevens, W. J. Comparison of intracellular cytokine production with extracellular cytokine levels using two flow cytometric techniques. Cytometry. 55 (1), 52-58 (2003).
- Partecke, L. I., et al. A syngeneic orthotopic murine model of pancreatic adenocarcinoma in the C57/BL6 mouse using the panc02 and 6606PDA cell lines. European Surgical Research. , (2011).
- An, X., et al. Immunophenotyping of Orthotopic Homograft (Syngeneic) of Murine Primary KPC Pancreatic Ductal Adenocarcinoma by Flow Cytometry. Journal of Visualized Experiments. (140), (2018).
- Jiang, Y. J., et al. Establishment of an orthotopic pancreatic cancer mouse model: Cells suspended and injected in Matrigel. World Journal of Gastroenterology. , (2014).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. , (2017).
- Liu, Q., et al. Effects of enzymatic digestion, cell culture and preservation conditions on surface CD62L expression of primary murine CD3+CD4+T cells. Biomedical Research (India). 29 (10), 2153-2159 (2018).
- Seaman, S. A., Tannan, S. C., Cao, Y., Peirce, S. M., Lin, K. Y. Differential effects of processing time and duration of collagenase digestion on human and murine fat grafts. Plastic and Reconstructive Surgery. , (2015).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. EMBO Journal. , (2013).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. , (2015).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Scientific Reports. , (2019).
- Moran, A. E., Polesso, F., Weinberg, A. D. Immunotherapy Expands and Maintains the Function of High-Affinity Tumor-Infiltrating CD8 T Cells In Situ. The Journal of Immunology. , (2016).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. , (2015).
- Singh, M., et al. High-throughput targeted long-read single cell sequencing reveals the clonal and transcriptional landscape of lymphocytes. Nature Communications. 10 (1), 3120(2019).
- Jiang, N., Schonnesen, A. A., Ma, K. Y. Opinion Ushering in Integrated T Cell Repertoire Profiling in Cancer. Trends in Cancer. 5, 85-94 (2019).
- Schietinger, A., et al. Tumor-Specific T Cell Dysfunction Is a Dynamic Antigen-Driven Differentiation Program Initiated Early during Tumorigenesis. Immunity. 45 (2), 389-401 (2016).
- Raghav, S. K., et al. Exhaustion of tumor-specific CD8+ T cells in metastases from melanoma patients. Journal of Clinical Investigation. , (2011).
- Gros, A., et al. PD-1 identifies the patient-specific in filtrating human tumors. The Journal of Clinical Investigation. , (2014).
- Miller, B. C., et al. Subsets of exhausted CD8 + T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. , (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon