Method Article
Generazione di tumori pancreatici ortotopici e caratterizzazione ex vivo della citotossicità delle cellule T infiltranti di tumore
In questo articolo
Riepilogo
Questo protocollo descrive la generazione chirurgica di tumori pancreatici ortotopici e la rapida digestione di tumori pancreatici del murino appena isolati. Dopo la digestione, le popolazioni di cellule immunitarie vitali possono essere utilizzate per ulteriori analisi a valle, tra cui la stimolazione ex vivo delle cellule T per il rilevamento della citochina intracellulare mediante citometria di flusso.
Abstract
I modelli in vivo del cancro al pancreas forniscono strumenti inestimabili per studiare le dinamiche della malattia, l'infiltrazione immunitaria e nuove strategie terapeutiche. Il modello murino ortotopico può essere eseguito su grandi coorti di topi immunocompetenti contemporaneamente, è relativamente poco costoso e conserva il microambiente tissutale cognato. La quantificazione dell'infiltrazione delle cellule T e dell'attività citototossica all'interno dei tumori ortotopici fornisce un indicatore utile di una risposta antitumorale.
Questo protocollo descrive la metodologia per la generazione chirurgica di tumori pancreatici ortotopici mediante iniezione di un basso numero di cellule tumorali singeniche risospese in 5 - la membrana del seminterrato direttamente nel pancreas. I topi che portano tumori ortotopici richiedono circa 30 giorni per raggiungere il punto finale, a quel punto i tumori possono essere raccolti ed elaborati per la caratterizzazione dell'attività delle cellule T che infiltrano tumori. La digestione enzimatica rapida con collagenasi e DNase consente di estrarre una sospensione unicellulare dai tumori. La vitalità e i marcatori di superficie cellulare delle cellule immunitarie estratte dal tumore sono conservati; pertanto, è appropriato per molteplici applicazioni a valle, tra cui lo smistamento delle cellule immunitarie assistite dal flusso per la coltura o l'estrazione dell'RNA, l'analisi della citometria del flusso delle popolazioni di cellule immunitarie. In questo caso, descriviamo la stimolazione ex vivo delle popolazioni di cellule T per la quantificazione intracellulare delle citochine (IFN e TNF) e l'attività di degranulazione (CD107a) come misura della citotossicità complessiva. I digerito del tumore intero sono stati stimolati con acetato di forno e ionomycina per 5 h, in presenza di anticorpi anti-CD107a al fine di upregolare la produzione di citochine e degranalazione. L'aggiunta di brefeldin A e monensina per gli ultimi 4 h è stata eseguita per bloccare il trasporto extracellulare e massimizzare il rilevamento di citochine. La colorazione extra- e intracellulare delle cellule è stata quindi eseguita per l'analisi della citometria di flusso, in cui è stata quantificata la percentuale di celluleIFN,TNFe CD107a eCD4 e CD8.
Questo metodo fornisce una base iniziale per eseguire un'analisi completa del microambiente tumorale.
Introduzione
Questo metodo descrive in dettaglio, dall'inizio alla fine, la procedura chirurgica per la generazione di tumori pancreatici ortotopici utilizzando una quantità minima di materiale cellulare e la successiva rapida dissociazione dei tumori stabiliti per l'analisi della citometria a flusso completa delle popolazioni di cellule immunitarie, compresa l'analisi ex vivo della funzione delle cellule T.
L'adenocarcinoma duttale pancreatico (PDAC) è un carcinoma aggressivo con solo l'8 % dei pazienti sopravvissuti 5 anni1. Poiché meno del 20 % dei pazienti ha diritto alla resezione chirurgica2,i campioni di pazienti freschi non sono facilmente accessibili per la ricerca e quindi i modelli in vivo forniscono strumenti essenziali per studiare questa malattia. Ci sono più modelli murini di PDAC: ortotopico, sottocutaneo, transgenico, endovenoso e paziente-derivato xenotrapianto (PDX), ampiamente descritto qui3. Il modello ortotopico qui descritto consente l'iniezione di cellule PDAC singeniche nel pancreas di topi immunocompetenti. Questo può essere eseguito in grandi coorti di topi selvatici o mutanti, e quindi fornisce un modello conveniente e coerente per il confronto di agenti terapeutici. È importante sottolineare che il modello ortotopico fornisce il microambiente cognato per la crescita delle cellule tumorali e metastatizza nelle nostre mani e altri4 a siti clinicamente rilevanti (ad esempio, fegato), rendendolo clinicamente più rilevante rispetto ai modelli subous o chimicamente indotti. I tumori ortotopici mostrano caratteristiche chiave del PDAC, come una forte reazione desmoplastica con un'abbondanza di fibroblasti e deposizione di matrice extracellulare5. I modelli transgenici del PDAC sono lo standard d'oro del modello murino e il più comunemente usato è il modello KPC, che esprime il modello mutante KrasG12D / e Trp53R172H / s sotto il pancreas-specifico Pdx-1-Cre promotore6. Ulteriori KPC e altri modelli PDAC in vivo sono recensiti qui7. I topi KPC sviluppano spontaneamente tumori pancreatici con una progressione della malattia che replica fedelmente le caratteristiche delPDAC6 umano . Tuttavia, come per tutti i modelli transgenici, il programma di allevamento è costoso, la progressione del tumore è variabile e quindi spesso richiede grandi coorti di topi. I modelli PDX utilizzano cellule tumorali derivate dal paziente o pezzi che vengono poi coltivati ortotopicamente o più spesso sottocutanei in topi immunocompromessi. I modelli di Xenotrapianto forniscono strumenti utili per lo screening di composti terapeutici e tengono conto dell'eterogeneità del paziente. Tuttavia, non forniscono un microambiente immunitario completo, limitando così le loro applicazioni8,9.
Una volta stabilito, tumori ortotopici in genere prendono circa 1 mese o più a crescere (a seconda della linea cellulare utilizzata) e formano grandi tumori che possono essere facilmente immagine da ultrasuoni o risonanza magnetica per monitorare la progressione e determinare l'efficacia del trattamento4,5,10. Tuttavia, una volta in crescita esponenziale, l'ultima fase della crescita tumorale può essere rapida, quindi la maggior parte dei regimi di trattamento sono iniziati relativamente presto (ad esempio, 14 giorni)11,12. Il sistema immunitario svolge un ruolo critico nello sviluppo del tumore, anche nel PDAC, che è caratterizzato da un tumore immunosoppressivo infiltrarsi con relativa scarsità di cellule T e la frequente presenza di cellule mieloidi13. Un'alta presenza di cellule T nel PDAC conferisce una prognosi migliore14,15. Tuttavia, come singoli agenti, gli inibitori del checkpoint immunitario che alleviano l'immunosoppressione delle cellule T, come anti-CTLA-416 e anti-PD-L117, non hanno mostrato benefici clinici nei pazienti PDAC, molto probabilmente perché la reattività complessiva delle cellule T è molto bassa. Tuttavia, gli agenti che innescano le risposte delle cellule T, come l'anti-CD40, possono superare la resistenza anti-PD-L1/CTLA-418,19 e la vaccinazione con il vaccino PDAC allogenico di morsetto GM-CSF (GVAX) può aumentare l'immunogenicità dei tumori PDAC20, indicando che il miglioramento delle risposte delle cellule T forma un'importante viale terapeutica.
Critico per una risposta delle cellule T antitumorali è il riconoscimento di antigeni di derivazione da tumore attraverso il recettore delle cellule T (TCR) e la successiva produzione di citochine citototossiche e granuli. Mentre il riconoscimento dell'antigene delle cellule T può essere determinato dal sequenziamento TCR, questo approccio è costoso e richiede molto tempo. Tuttavia, la quantificazione dei sottoinsiemi di cellule T che infiltrano tumori fornisce una buona indicazione di una risposta anti-tumorale. Un ulteriore esame dell'attività delle cellule T ex vivo in termini di degranulazione, produzione di citochine e altri fattori citotossici fornisce un'analisi funzionale più profonda. Questi saggi possono essere eseguiti su campioni di tumore fresco e molti parametri della funzione delle cellule T possono essere misurati rapidamente dalla citometria di flusso.
Le cellule TCD8 e CD4producono citochine come IFN e TNF per potenziare una risposta immunitaria21. L'IFN induce l'accresciuta della MHCI sulle cellule bersaglio, induce la differenziazione e il reclutamento di cellule immunitarie e aiuta la morte delle cellule. Produzione di IFN , da parte di CD8- cellule T è ben caratterizzata per essere parte di una risposta antitumorale e correla con regressione tumorale22,23. La TNF è un'altra citochina infiammatoria prodotta sia dalle celluleCD8 che CD4e T. Migliora l'attivazione dipendente da TCR e la proliferazione delle cellule T, aiutando la risposta anti-tumorale. Al momento dell'impegno del TCR, le cellule ctotototossici CD8- T possono subire degranature, dove i lisosomi segreti sotterranei preformati contenenti molecole citotossiche vengono rilasciati nella sinapsi immunologica per causare la degradazione delle cellule bersaglio21. Queste molecole includono Perforin, una proteina che si lega alla membrana cellulare bersaglio, formando pori che poi interrompono l'integrità della membrana e consentono la diffusione21 o endocytosi24 di altre molecole citotossiche, come Granzyme B, direttamente nel citoplasma della cellula bersaglio. Granzyme B è una proteasi che mette in atto la degradazione di più proteine all'interno della cellula bersaglio, portando alla morte cellulare21. Il rilascio di tali molecole richiede esocitosi degli endosomi sulla superficie cellulare, dove il marcatore endosomico CD107a (noto anche come LAMP-1) è tradotto nella membrana cellulare25.
La misurazione della secrezione di citochine da parte delle cellule T richiede il loro isolamento mediante lo smistamento delle cellule assistite dal flusso o i saggi di separazione basati sul tallone, che non possono essere facilmente eseguiti su un gran numero di campioni contemporaneamente. Tuttavia, la misurazione delle citochine intracellulari non richiede alcuna procedura di pre-isolamento e può essere eseguita facilmente su più campioni contemporaneamente, consentendo un approccio a velocità effettiva più elevata. Poiché le citochine vengono rapidamente secrete dalle cellule T, i livelli intracellulari possono essere inosservabili e quindi la cellula T richiede stimolazione per aumentare la produzione di citochine basali. Per valutare la produzione di citochine guidate da antigeni, l'antigene riconosciuto dal TCR deve essere presentato alla cellula T da un APC innescato in vitro. Nei casi in cui la specificità dell'antigene non è nota, è necessario un approccio di stimolazione ampio. La stimolazione TCR può essere mimicked utilizzando perline anti-CD3/28 che forniscono sia l'attivazione TCR che la costimolazione, che induce la produzione e la proliferazione di citochine. Tuttavia, un'alternativa più conveniente è l'uso di PMA e ionomycina, che attivano insieme percorsi di segnalazione che portano alla sintesi e al rilascio di citochine intracellulari. In particolare, la PMA attiva la chinasi c, la proteina C (PKC) e la ionomycina solleva ioni intracellulari ca2, portando ad un aumento della segnalazione cellulare. Al fine di preservare il contenuto intracellulare delle citochine, questa stimolazione può essere efficacemente combinata con gli inibitori del trasporto delle proteine brefeldin A e monensina, che bloccano le proteine nel Golgi e quindi impediscono il rilascio extracellulare. L'uso di PMA/ionomycin è un metodo ben consolidato per stimolare le cellule T e c'è una forte correlazione tra citochine extracellulari e citochine intracellulari26. La stimolazione delle cellule T con PMA e ionomicina aumenta anche il traffico lisosomico verso la membrana cellulare e quindi CD107a diventa transitoriamente integrato sulla superficie cellulare prima di essere riciclato nella cellula. Includendo un anticorpo anti-CD107a durante la stimolazione, è possibile utilizzarlo come marcatore di attività di degranulazione25.
Questo metodo digerisce rapidamente i tumori per fornire una sospensione unicellulare. A questo punto, le singole popolazioni possono essere macchiate direttamente per la citometria di flusso o purificate con metodi a valle: smistamento delle cellule assistite dal flusso o separazione magnetica delle perline. La preparazione di una sospensione unicellulare per l'analisi della citometria del flusso consente l'analisi ad alto throughput di più popolazioni di cellule immunitarie e dei loro marcatori fenotipici, fornendo una quantificazione accurata del numero di cellule immunitarie e del fenotipo.
Infine, il protocollo di digestione descritto qui previene la perdita di marcatori di superficie cellulare e mantiene la vitalità delle cellule immunitarie, consentendo alle cellule immunitarie di sottoporsi a ulteriori passaggi e coltura di purificazione delle cellule, se necessario. Tuttavia, questo metodo non è stato testato per derivare le cellule epiteliali da questa digestione.
Protocollo
I tumori pancreatici ortotopici sono stati generati come descritto in precedenza10 in conformità con il U.K. Home Office Animal and Scientific Procedures Act 1986 e la direttiva europea 2010/63/UE. Tutti i topi sono stati monitorati perioperatoriamente per segni di dolore o sofferenza, tra cui, ma non limitato alla perdita di peso (> 15 % in 72 h o 20 % in un dato periodo), piloerezione, restringimento degli occhi, andatura sollevata, aspetto curvo, nonché di segni di infezione della ferita tra cui sanguinamento, arrossamento e ulcera. La crescita del tumore è stata monitorata dalla palpazione e sono stati monitorati anche ulteriori segni clinici come la respirazione laboriosa, l'ittero e le estremità fredde per valutare se fossero stati raggiunti segni di endpoint. Tutte le procedure devono essere eseguite in condizioni sterili. Tutti i reagenti utilizzati prima del flusso di colorazione citometria devono essere preparati in condizioni sterili.
1. Preparazione delle cellule tumorali per l'iniezione
- Prendere un'aliquota di membrana seminterrato da -20 gradi centigradi e posizionare sul ghiaccio a 4 gradi durante la notte.
NOTA: La concentrazione della membrana del basamento può variare da lotto a lotto; pertanto, i lotti di membrana seminterrato specifici devono essere testati in vivo per garantire la riproducibilità. Un nuovo lotto di membrana sotterranea viene scongelato sul ghiaccio a 4 gradi durante la notte, poi in aliquote definite dall'utente, su ghiaccio, e poi ulteriormente immagazzinato in -20 gradi fino a quando richiesto. Questo riduce al minimo il tubo e lo scongelamento del congelamento quando si utilizza la membrana del seminterrato.- Mettere il PBS sterile a 4 gradi centigradi durante la notte per raffreddare.
- Mettete a -20 gradi durante la notte le punte sterili da 200 a L e 1000 l pipette a -20 gradi durante la notte.
- Utilizzare le cellule tumorali che sono mycoplasma libero, coltivato per almeno 2- 10 passaggi post-scongelamento e in fase di log-fase di crescita prima del raccolto. Questo protocollo utilizza il murino femminile C57BL/6 KPC-derivato linea cellulare: TB32048 fornito come un dono generoso dal laboratorio di David Tuveson.
- Quando le cellule tumorali sono necessarie per il raccolto, togliere il mezzo dal pallone e lavare le cellule due volte in PBS (preriscaldato a 37 gradi centigradi).
- Aggiungere 2x trypsin (preriscaldato a 37 gradi centigradi) al flacone per 10 min a 37 gradi (a un flacone T175, aggiungere 5 mL).
- Dopo 10 minuti, aggiungere un volume uguale di mezzo completo (10% FBS, 1x penicillina, 1x streptomicina in DMEM) al pallone e dissociare le cellule toccando delicatamente il pallone e riavvolgendo bene in mezzo.
- Trasferire le cellule in un tubo e centrifugare per 5 min a 300 x g e temperatura ambiente (RT).
- Rimuovere il supernatante e risospendere le cellule in mezzo completo per il conteggio delle cellule.
- Centrifugare nuovamente le cellule per 5 min a 300 x g e RT, e rimuovere il supernatante.
- Risospendere le cellule in PBS pre-raffreddato per ottenere una concentrazione di 1x106 cellule/mL.
NOTA: Questa concentrazione di scorte è preparata per raggiungere una concentrazione di iniezione finale di 1000 cellule in 5 . Abbiamo scoperto che l'iniezione di un numero inferiore di cellule in un basso volume di iniezione ha ridotto al minimo la perdita delle cellule e quindi ha aumentato la riproducibilità, tuttavia, la crescita tumorale può essere dipendente dalla linea cellulare, quindi gli utenti dovrebbero ottimizzare ogni linea cellulare.
- Accanto a questo, mettere una membrana seminterrato pre-aliquota, sul ghiaccio, nel cofano.
- Il rapporto tra la soluzione finale della membrana seminterrato, PBS e cellule tumorali in PBS preparati per l'iniezione è 5:3:2. Pertanto, a una 500 aliquote di membrana sotterranea aggiungere 300 -L di PBS pre-freddo utilizzando una punta pre-fredda da 1000 pipette l.
- Aggiungere il PBS direttamente alla membrana del seminterrato per ridurre al minimo la pipettatura.
- Mantenere il p1000 impostato su 300 l e risospendere la membrana PBS e seminterrato, assicurandosi di mantenere il tubo sul ghiaccio per preservare la membrana seminterrato in stato liquido.
- Al termine dell'espulsione di tutta la membrana del seminterrato dalla punta del p1000, lasciare la punta nel tubo per consentire a qualsiasi membrana del seminterrato/PBS di scendere dalla punta della pipetta.
- Dopo 5-10 min, espellere più membrana seminterrato dalla punta p1000 indietro nel tubo e lasciare il tubo a sedersi sul ghiaccio.
- Prendere 200 - L di cellule tumorali risospese in PBS e aggiungere direttamente alla membrana seminterrato utilizzando una punta pre-fredda 200 da 200 l pipette.
- Prendere una punta di pipetta p1000 pre-raffreddata fresca, impostare la pipetta a 300 -L e risospendere 30-40 volte. Una punta pipetta più grande, impostata a basso volume, è preferibile in quanto la membrana del seminterrato può viaggiare lungo la punta e toccare il filtro della punta della pipetta durante la sospensione.
- Le cellule tumorali sono pronte per l'iniezione. Mantenere la membrana delle cellule tumorali/basement sul ghiaccio durante l'intervento chirurgico.
2. Iniezione ortotopica delle cellule tumorali
- Acclimatare i topi nell'impianto animale per 7 giorni.
- Circa 2 h prima dell'intervento, rasare il lato sinistro dell'addome e della schiena, quindi somministrare sottolatolonia analgesica pre-operatoria sotto la mischia del collo (Buprenorphina a 50-100g/kg).
- Preparare il campo chirurgico, con un tappetino di calore per posare il mouse e tende per le attrezzature circostanti e sopra il mouse. Sterilizzare tutti gli strumenti chirurgici; preparare un numero sufficiente di set di strumenti per ogni mouse.
- Posizionare il topo in un 5% isoflurane con O2 camera fino a quando incosciente.
- Trasferire il topo, sdraiato sulla schiena, su un tappetino di calore e mantenere l'anestesia utilizzando una maschera, di solito a un 2-3% di isoflurane inferiore.
- Confermare l'anestesia profonda; come identificato dalla perdita del riflesso di prelievo del pedale quando la zampa posteriore viene pizzicato e la frequenza respiratoria del monitor rimane costante.
- Coprire il corpo in drappo, con solo la porzione rasata esposta. Assicurarsi che il mouse sia saldamente nella maschera di anestesia.
- Utilizzando un batuffolo di cotone sterile, aggiungere una soluzione di iodio in un movimento circolare sopra l'area rasata: partendo dal centro e girando verso il bordo. Ripetere il processo con cotton fioc fresco e iodio.
- Utilizzare il bisturi per fare un'incisione di 1 cm direttamente sopra la posizione del pancreas/smussa (quadrante superiore sinistro). Le forbici sterili possono anche essere utilizzate per fare l'incisione, se lo si preferisce.
- Tirare la pelle a parte con pinze. Con le nuove pinze, individuare la parete peritoneale e utilizzare le forbici per fare altri 1 cm attraverso l'incisione attraverso l'incisione.
- Estrarre il pancreas, che può venire con la milza, dal corpo utilizzando la seconda coppia di pinze.
- Invertire delicatamente la fiala delle cellule tumorali / membrana seminterrato più volte per mescolare.
- Preparare la siringa di vetro con 5.l contenente 1.000 cellule tumorali nella membrana del seminterrato e posizionarla sul tappeto di calore per alcuni secondi per consentirle di riscaldarsi.
NOTA: Il breve riscaldamento della siringa permetterà alla membrana del seminterrato di iniziare a solidificarsi, al fine di rendere più facile l'iniezione senza perdite. Tuttavia, questo deve essere tenuto breve, se lasciato troppo a lungo la membrana seminterrato si solidificherà completamente e non sarà iniettato. L'uso di una siringa di vetro permette di iniettare con precisione un basso volume. - Tenere il pancreas alla coda per estenderlo e inserire l'ago direttamente al centro del pancreas, parallelo al pancreas stesso con uno sforzo per evitare i vasi sanguigni visibili.
NOTA: Il centro del pancreas ha una vasta area ed è più facile da iniettare. Tuttavia, la testa o la coda del pancreas possono anche essere iniettati in modo specifico se si preferisce. - Iniettare lentamente 5 -L di membrana seminterrato nel pancreas e tenere l'ago fermo nel pancreas per almeno 30 s dopo l'iniezione per consentire alla membrana del seminterrato di solidificare e prevenire perdite. La membrana seminterrato dovrebbe essere visibile come una piccola bolla chiara si sarà formata; tuttavia, potrebbe non essere visibile.
NOTA: Possono essere iniettati volumi maggiori di cellule tumorali/membrana del seminterrato; tuttavia, il volume esatto deve essere testato per garantire che non si verifichino perdite. - Rimuovere l'ago dal pancreas e attendere di confermare che non si è verificato alcun sanguinamento. Inserire delicatamente il pancreas nella cavità addominale, facendo attenzione a non toccare la bolla della membrana del seminterrato.
- Tirare insieme la parete peritoneale ed eseguire una singola sutura, o due suture interrotte, se necessario.
- Tirare insieme i due lati dell'incisione cutanea ed eseguire più suture interrotte secondo necessità o inserire due clip chirurgiche.
- Somministrare un'altra iniezione sottocutanea di buprenorfina nella mischia.
- Trasferire il topo in una gabbia riscaldata a 37 gradi centigradi per almeno 30 min post-chirurgia per mantenere la temperatura corporea prima di trasferirsi di nuovo in una gabbia fresca.
- Preparare una dieta purè disponibile in gabbia, per garantire la reidratazione e il peso corporeo.
- Ri-somministrare analgesia post-operatoria come raccomandato e guardare attentamente per i segni di apertura della ferita, dolore o infezione e perdita di peso. Se si utilizzano clip chirurgiche, queste possono essere rimosse 7-10 giorni dopo utilizzando un ritaglio di clip.
- Dopo circa 14 giorni il tessuto cicatriziale sarà guarito sufficientemente per iniziare a palpare l'addome. Monitorare le dimensioni del tumore da vicino tramite palpazione fino a quando i topi raggiungono l'endpoint.
- Al punto finale il topo viene abbattuto tramite lussazione cervicale seguita da decapitazione. La pelle e la cavità peritoneale vengono aperte con le forbici e il tumore al pancreas asformato usando pinze per tenere il tumore e le forbici per rimuovere il tessuto circostante.
3. Digestione di tumori pancreatici
- Posizionare il tumore pancreatico sezionato, tumori del sito metastatico, o tessuto pancreatico sano in PBS ghiacciato, e conservare sul ghiaccio.
- Utilizzare le pinze per trasferire il tumore su un piatto Petri.
- Aggiungere 5,0 mL di mezzo di digestione (2 mg/mL Collagenase, 0,025 mg/mL DNase RPMI) in un tubo da 50 mL; sull'imbottitura per evitare l'apice dell'attività degli enzimi.
NOTA: Questo protocollo utilizza Collagenase Type V, che ha un'attività di unità da 1 usd/mg FALGPA e > 125 unità di digestione del collagene (CDU)/mg solide. L'agrilla e le DNane possono essere conservate a -20 gradi centigradi e scongerate sul ghiaccio prima dell'uso. Quando entrambi sono completamente solubilinelizzati in RPMI sterile, possono essere passati attraverso un filtro di 0,2 m per rimuovere i contaminanti. Il collagenedeve deve essere completamente solubilita prima di filtrare per evitare la perdita di materiale. - Prendere una piccola aliquota di questa soluzione per coprire il tumore sul piatto Petri.
- Utilizzare bisturi sterili e pinze per tagliare il tumore in piccoli pezzi, circa meno di 3 mm di lunghezza.
- Raschiare i pezzi tumorali nel tubo e invertire delicatamente il tubo fino a quando tutti i pezzi sono immersi nel supporto di digestione. Conservare sul ghiaccio se altri campioni di tumore devono essere preparati in un lotto.
- Trasferire su un dispositivo di agitazione per 20 min a 37 gradi centigradi. Assicurarsi che tutti i pezzi di tumore sono sommersi e non attaccato al bordo del tubo. Se lo scuotimento non è possibile, quindi vorticare il campione ogni 5 min per aiutare la digestione.
4. Preparazione della sospensione unicellulare dal tumore digerito
- Subito dopo la fase di digestione, posizionare il tubo sul ghiaccio per rallentare l'attività enzimatica.
- Aggiungere EDTA per ottenere una concentrazione finale di 20 mM e un campione di vortice brevemente da mescolare. Questo rallenterà ulteriormente l'attività degli enzimi.
- Aprire il tubo e risciacquare qualsiasi tumore digerire dal coperchio del tubo con un nuovo supporto RPMI.
- Preparare un colino di 70 m (la dimensione m del colino può essere modificato come desiderato) su un tubo aperto da 50 ml, sul ghiaccio.
- Pre-bagnato il filtro con mezzo.
- Risospendere le cellule digerite e lavare i lati del tubo utilizzando una stripette da 25 mL, o più grande. L'apertura più ampia della stripette è importante per consentire al digest spesso di passare facilmente.
- Trasferire tutto il digest, utilizzando la stripette da 25 mL, sul colino.
- Mash il tumore sulla parte superiore del filtro utilizzando uno stantuffo di siringa da 1 mL. Mash solo direttamente su e giù per ridurre al minimo lo stress di taglio alle cellule.
- Lavare continuamente le cellule attraverso il colino con RPMI. Assicurati di lavare con abbastanza forza per spingere le cellule attraverso.
- Se c'è ancora materiale da schiacciare, ma il RPMI smette di lavare, il colino sarà saturo. Pertanto, trasferire il campione in un nuovo filtro e continuare.
NOTA: Alla fine solo i componenti della matrice extracellulare rimarranno nel filtro, tutte le singole celle dovrebbero essere passate.
- Centrifugare il tubo per 5 min a 300 x g e 4 gradi centigradi.
- Risospendere con attenzione il pellet cellulare in RPMI completo e passare direttamente attraverso un altro filtro per rimuovere qualsiasi matrice extracellulare o grandi grumi di celle che non possono essere adeguatamente risospese.
- A questo punto, se non è necessaria alcuna stimolazione, macchiare immediatamente le cellule isolate per l'analisi della citometria del flusso saltando al passaggio 6.1. In alternativa, risospende il sistema nel mezzo di congelamento (10% DMSO in FBS) e conservarli a -80 gradi centigradi seguiti dall'immagazzinamento a lungo termine in azoto liquido.
NOTA: La fase di congelamento può consentire la purificazione delle cellule immunitarie in un secondo momento; tuttavia, la quantificazione dei sottoinsiemi di cellule immunitarie può richiedere l'ottimizzazione per confermare che i numeri delle cellule e il fenotipo non sono influenzati dal processo di congelamento/scongelamento. La stimolazione delle cellule T ex vivo è meglio eseguita su campioni di tumore freschi. A questo punto il campione può essere ulteriormente purificato dalla rimozione delle cellule morte a base di perline o dai saggi di arricchimento delle cellule immunitarie, se necessario.
5. Preparazione delle cellule per la stimolazione ex vivo
- Contare le cellule per raggiungere una concentrazione di 2 x 106/ 100 l nel mezzo completo (RPMI 10 % FBS, 1X penicillina e 1X streptomicina).
NOTA: L'elevato numero di cellule totali placcate assicura che ci saranno cellule T adeguate all'interno di questo campione da analizzare. Tuttavia, il numero può essere scalato verso l'alto o verso il basso a seconda della disponibilità del campione e della natura rara dei sottoinsiemi di cellule T di interesse.- Piastra 100 -L di cellule in una piastra di 96 pozzetto con fondo U.
- Aggiungete 100 l di mezzo completo contenente una preparazione 2x di PMA/ ionomycin (per ottenere una concentrazione finale rispettivamente di 0,081 e 1,34 M, come raccomandato dal produttore).
NOTA: Se si misura degranate/esocitosi, includere qui nei media anche un CD107a anticoniugato fluorescentmente. È inoltre necessario eseguire un campione di controllo che non contiene CD107a. - Mettere in incubatrice a 37 gradi centigradi con il 5% di CO2 per 1 h.
- Aggiungete 20 di una preparazione di 10 pollici di brefeldina A e monensina (per ottenere una concentrazione finale rispettivamente 1,06 e 2,0 M, come raccomandato dal produttore) in supporti completi.
NOTA: Brefeldin A e monensina sono inibitori del trasporto proteico e quindi bloccano il rilascio extracellulare di citochine, ecc. permettendo loro di rilevare la citometria di flusso. Se la misurazione della citochina rilascia nel supernatante con ELISA o metodi simili - allora questo passaggio può essere saltato. - Collocare la piastra in un'incubatrice a 37 gradi centigradi con il 5% di CO2 per ulteriori 4 h.
6. Colorazione extracellulare e intracellulare per citometria di flusso
- Rimuovere la piastra e risospendere ogni pozzo per trasferire tutto il materiale in una piastra con fondo a V, posta sul ghiaccio.
NOTA: le cellule epiteliali, i macrofagi e altre cellule aderenti potrebbero non essere recuperati completamente mediante la resospensione. Tuttavia, poiché l'analisi a valle è solo su cellule T, questo non è un problema.- 6.1.1 Centrifugare la piastra per 5 min a 300 x g e 4 gradi centigradi (utilizzare queste condizioni per i passaggi successivi, salvo quanto non indicato).
- Rimuovere il supernatante facendo scorrere la piastra a testa in giù in un movimento tagliente.
- Risospendere in 50 gradi di un coloranti di vitalità fissabile, preparato in PBS ghiacciato. Quando si esegue la resuma, impostare la pipetta su un volume inferiore per evitare di creare bolle.
- Incubare per 20 min a 4 gradi centigradi, al buio.
- Passo di lavaggio: Aggiungere 100 l di tampone FACS, centrifugare e rimuovere il supernatante.
- Risospendere ogni pozzo con 50 sL di anti-CD16/CD32 (2,5 g/mL) nel buffer FACS (0,5 % BSA, 2,0 mM EDTA in PBS) per bloccare l'associazione non specifica degli anticorpi di rilevamento ai recettori Fc.
- Incubare per 15 min a 4 gradi centigradi, al buio.
- Aggiungere direttamente ad ogni pozzo un mastermix 2x di CD45, CD3, CD4 e CD8 (ulteriori marcatori extracellulari possono essere aggiunti come desiderato) nel buffer FACS.
- Incubare per 30 min a 4 gradi centigradi, al buio.
- Passo di lavaggio: Aggiungere 100 l di tampone FACS, centrifugare e rimuovere il supernatante.
- Aggiungere 100 l of 1x buffer di fissaggio intracellulare (IC) e incubare per 30 min a RT, al buio.
- Preparare la centrifuga a RT.
- Aggiungere 100 l di tampone FACS, centrifugare per 5 min a 300 x g e RT e rimuovere il supernatante. Ripetere con 1x buffer di permeabilizzazione e centrifuga per 5 min a 300 x g; quindi rimuovere il super-natante.
- Aggiungete 50 l di 1x di mastermix fluorocromatico dell'IFNz, TNF e altri marcatori intracellulari preparati in 1x buffer di permeabilizzazione.
- Incubare per 1 h a RT, al buio.
- Aggiungere 100 l di tampone di permeabilizzazione da lavare. Quindi centrifugare per 5 min a 300 x g e RT e rimuovere il supernatante.
- Aggiungere 100 l di tampone FACS per lavare, centrifugare per 5 min a 300 x g e RT e rimuovere il supernatante.
- Dopo questa centrifugazione finale, risospendere le cellule in un volume compatibile per il citometro di flusso. Può variare a seconda delle dimensioni dei tubi FACS.
- Trasferire questo volume in tubi FACS appropriati per l'acquisizione.
- Coprire dalla luce e conservare in frigorifero e acquisire i campioni entro 24 ore.
Risultati
Dopo aver iniettato 1000 cellule TB32048 nel pancreas, i tumori ortotopici richiedono circa 30 giorni per svilupparsi (Figura 1A,B). Perdita di membrana seminterrato durante l'intervento chirurgico può causare grandi tumori si formano direttamente sulla parete peritoneale, che sono ben visibili attraverso la pelle (Figura 1C). Toglieremmo questi topi dallo studio. Tuttavia, con buone abilità chirurgiche l'incidenza di perdite è ridotta al minimo. I tumori ortotopici raccolti all'endpoint possono crescere fino a raggiungere una dimensione sostanziale nei topi di tipo selvatico C57BL/6 (Figura 1D). I tumori ortotopici raccolti richiedono digestione nel collagene/ DNase per 20 min al fine di ottenere una sospensione unicellulare (Figura 2). A questo punto, le cellule derivate dal tumore possono essere placcate in una piastra con fondo U a 2 x 106 cellule /bene. Il numero di cellule placcate può essere modificato a seconda della prevalenza delle cellule T all'interno del campione; il numero di cellulare può essere abbassato se le cellule T sono ad alta densità. Anche i campioni di milza di controllo o linfonodo possono essere placcati a questo punto per la stimolazione. Ogni pozzo viene stimolato con PMA e ionomycin per 5 h e dopo 1 h incubazione, brefeldin A e monensin vengono aggiunti al fine di bloccare il rilascio extracellulare di citochine (Figura 2). Dopo l'incubazione, i campioni vengono macchiati per epitopi extracellulari e citochine intracellulari per l'analisi per citometria di flusso (Figura 2).
Campioni di milza e tumori da topi che portano tumori ortotopici sono stati analizzati dalla citometria di flusso. La strategia di gating utilizzata nell'analisi della citometria di flusso per la milza e i tumori ortotopici esclude i detriti utilizzando FSC-A, SSC-A, doppietti di FSC-A/FSC-H e SSC-A/SSC-W, quindi cellule morte o apoptotiche come positivo per il colorante di vitalità fissabile (Figura 3A). Le cellule immunitarie vengono quindiattivate come cellule CD45 e T ulteriormente gated on come CD3- da cui sono definiti isottoinsiemi CD4 e CD8 (Figura 3A). Viene eseguita una fluorescenza meno uno (FMO) per determinare la fluorescenza di fondo per l'gating e viene eseguito solo un controllo di brefeldin A/monensin per determinare la produzione basale di citochine (Figura 3B-D).
Per l'IFN, l'incubazione con brefeldin A/ monensin non ha portato ad alcun aumento dell'IFN, per il controllo delle FMO sia nella milza che nei campioni di tumore. Tuttavia, l'aggiunta di PMA e ionomycina ha aumentato la percentuale di IFN intracellulare rilevabile sia nelle cellule mlenica che derivate dal tumore CD4e CD8.
Le celluleT di Splenic CD4e CD8, utilizzate come controllo positivo, hanno una produzione relativamente più elevata di IFNz rispetto ai sottoinsiemi di cellule T che infiltrano tumori, con una media di 6,60 % e 12,97 % e 12,97 x 3,4 % rispetto al 4,81 % e al 4,13 % che indicano che l'immunosoppressione si verifica all'interno del tumore (Figura 3B e 4A). Utilizzando la stessa strategia per il TNF, abbiamo visualizzato che un'alta percentuale di cellule sputare CD4- T sono positive per la TNF , 65,93 x 2,3%), rispetto all'infiltrazione di tumore CD4- cellule T (22,45 x 5,4%). Le celluleT splenica e infiltranti da tumore producono livelli simili di TNF, rispettivamente (25,15 x 3,7 % e 19,91 x 5,1 %), (Figura 3C, Figura 4B).
Infine, CD107a è un marcatore endosomico che viene espresso transitoriamente sulla superficie cellulare durante l'esocitosi di granuli e citochine citototossici, in quanto tale, viene utilizzato come marcatore surrogato per la citotossicità. Il vantaggio della colorazione per CD107a durante la stimolazione è che tutte le superfici cellulari espresse CD107a saranno catturate dall'anticorpo fluorescente. I livelli basali di CD107a sono mostrati nelle cellule trattate solo da brefeldin A/monensin. Per le cellule T splenicoCD8 - T, la stimolazione con PMA/ ionomycin aumenta il livello di CD107a rilevato, con la più forte aumento della regolazione nel CD8- cellule che erano 23,95 - 3,5% CD107a , rispetto al 5,8 - 1,9 % nelCD8 infiltrato da tumore , indicando cd8 splenico, che indicava un maggiore tasso di degranatura. D'altra parte, ilCD4 in filtrazione da milgino e da tumore, esprimeva livelli comparabili di CD107a 9,37 % e 11,50 x 1,8 % (Figura 3D e 4C).
Nel complesso questi risultati evidenziano che i tumori ortotopici possono essere generati dall'iniezione di un numero molto basso (1.000) delle cellule tumorali nel pancreas. Questi tumori possono essere rapidamente digeriti per l'isolamento delle cellule T per la stimolazione ex vivo. La rilevazione di citochine intracellulari è possibile e mette in evidenza il livello basale di immunosoppressione delle cellule T infiltranti, rispetto alle cellule T negli organi linfoidi secondari.
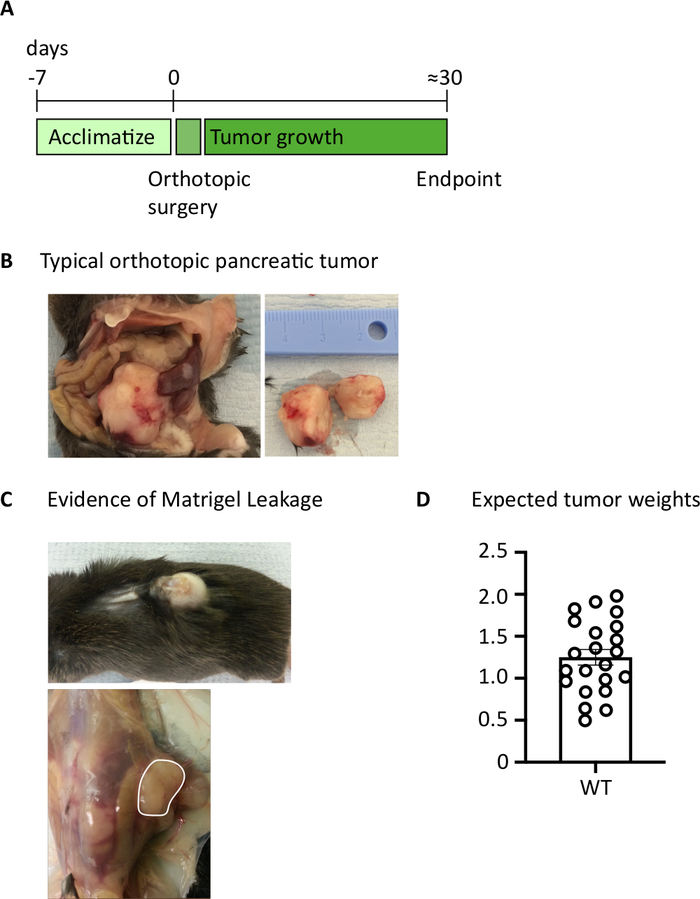
Figura 1: Generazione di tumori pancreatici ortotopici. (A) Programma di esperimenti in vivo. (B) L'aspetto macroscopico dei tumori ortotopici all'interno della cavità addominale (a sinistra) e dopo l'escissione (a destra) dove il tumore mostrato è stato tagliato a metà. (C) Le prove della perdita della membrana seminterrato durante l'intervento chirurgico possono causare lo sviluppo di tumori che sono visibili attraverso la pelle (foto superiore) e la forma sulla parete peritoneale (foto inferiore). (D) Pesi tumorali pancreatici ortotopici raccolti da topi che avevano raggiunto l'endpoint (n. 22). Ogni punto dati rappresenta un singolo mouse, grafico a barre mostra media SEM. I dati di questa cifra sono stati modificati dal lavoro pubblicato in precedenza10. Fare clic qui per visualizzare una versione più grande di questa figura.
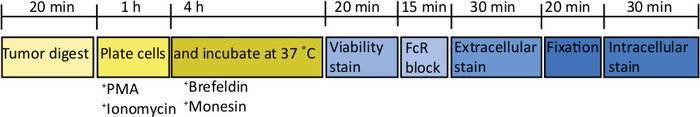
Figura 2: Schematico dell'elaborazione dei tumori ortotopici per la stimolazione delle cellule T ex vivo. Dopo la raccolta, i tumori pancreatici vengono rapidamente digeriti in Collagenase (2 mg/mL) e DNase (0,025 mg/mL) per 20 min a 37 . In seguito, le celle vengono risospese a 2 x 106/mL in supporti RPMI completi e placcate in una piastra u-bottomed. Un cocktail di stimolazione di PMA e ionomycina viene aggiunto per 5 h, a quel punto l'anticorpo anti-top CD107a può anche essere aggiunto alla coltura. Dopo 1 h incubazione vengono aggiunti gli bloccanti del trasporto intracellulare, brefeldin A e monensin. Dopo la stimolazione ex vivo le cellule vengono trasferite in una piastra con fondo a V per la colorazione con il colorante di vitalità fissabile (in PBS) per 20 min 4 gradi centigradi. Le cellule vengono lavate nel buffer FACS e incubate in anti-CD16/32 (blocco FcR) per 15 min (nel buffer FACS) e poi incubate con anticorpi extracellulari coniugati a fluorescenza per altri 30 min (nel buffer FACS). Le cellule vengono lavate nuovamente nel buffer FACS e risomono nuovamente nel buffer di fissazione intracellulare per 20 min. Dopo questo, le cellule vengono lavate una volta nel buffer FACS e una volta in 1x buffer permeabilizzazione. Le cellule vengono risospese per 1 h a RT in anticorpi coniugati fluorescenti intracellulari per 1 h (in buffer di permeabilizzazione 1x). Le cellule vengono lavate una volta in 1x buffer di permeabilizzazione e una volta nel buffer FACS prima di resudare nel buffer FACS per l'acquisizione sul citometro di flusso entro 24 h. Fare clic qui per visualizzare una versione più grande di questa cifra.
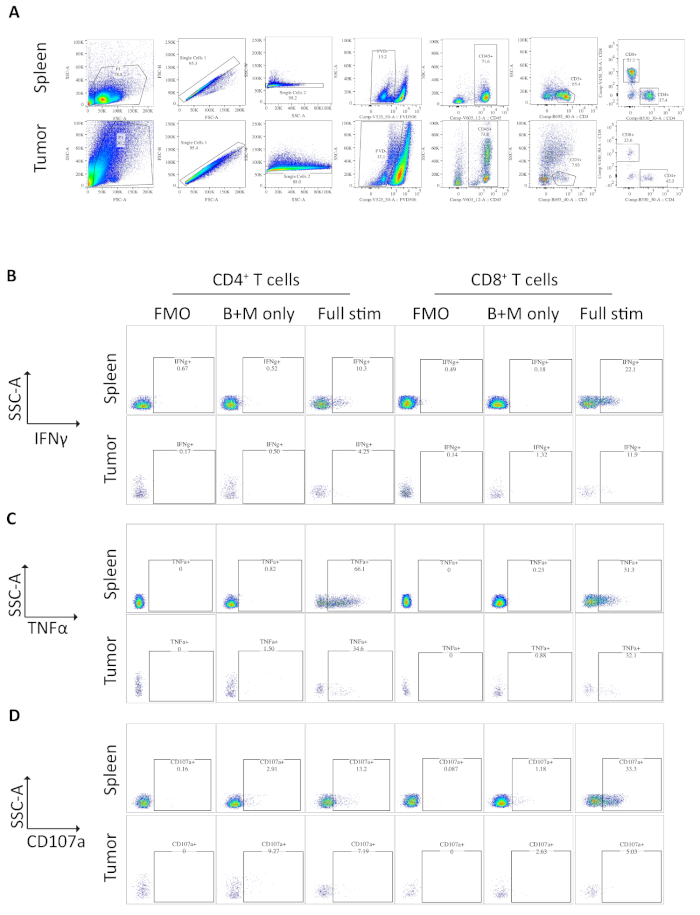
Figura 3: Analisi della citometria di flusso delle cellule T derivate dalla milza e dal tumore, ex vivo. (A) Strategia di attometria di citometria di flusso utilizzata per campioni di milza (controllo positivo) e tumori ortotopici. Le cellule vengono discriminate dai detriti utilizzando FSC-A/SSC-A e le singole cellule sono ulteriormente isolate utilizzando FSC-A/FSC-H e SSC-A/SSC-W. Le cellule morte o apoptotiche sono escluse utilizzando il coloranti di vitalità fissabile -FVD506 e le cellule immunitarie sono gated on daCD45. In seguito a questo CD3 sono definiti isottoinsiemi di immagini CD3, cellule T e CD4e CD8. I dati sono stati acquisiti su un BD Fortessa. (B) La strategia di gating utilizzata per quantificare le cellule IFN- Un controllo fluorescente meno uno (FMO) viene utilizzato su campioni completamente stimolati (PMA/ionomycin/brefeldin A/monensin) per determinare la fluorescenza di fondo. Per determinare la produzione di citochine basale viene utilizzato un controllo dell'A/monensina brefeldin (solo B) . Il campione completamente stimolato viene quindi utilizzato per calcolare le cellule % IFN . (C) La strategia di gating utilizzata per quantificare le cellule TNF ,CD4 e CD8, utilizzate per quantificare le cellule T. Un controllo FMO viene utilizzato su campioni completamente stimolati (PMA/ionomycin/brefeldin A/monensin) per determinare la fluorescenza di fondo. Per determinare la produzione di citochine basale viene utilizzato un controllo dell'A/monensina brefeldin (solo B) . Il campione completamente stimolato viene quindi utilizzato per calcolare le cellule % TNF- T. (D) La strategia di gating utilizzata per definire le celle CD107a- CD4e CD8- T. Un controllo FMO viene utilizzato su campioni completamente stimolati (PMA/ionomycin/brefeldin A/monensin) per determinare la fluorescenza di fondo. Per determinare la degranulazione basale viene utilizzato un controllo dell'a/monensina brefeldin (solo B) . Il campione completamente stimolato viene quindi utilizzato per calcolare la percentuale di cellule CD107a- T. Tutti i dati della citometria di flusso sono stati analizzati su FlowJo versione 10.6.1. I dati di questa cifra sono stati modificati dal lavoro pubblicato in precedenza10. Fare clic qui per visualizzare una versione più grande di questa figura.
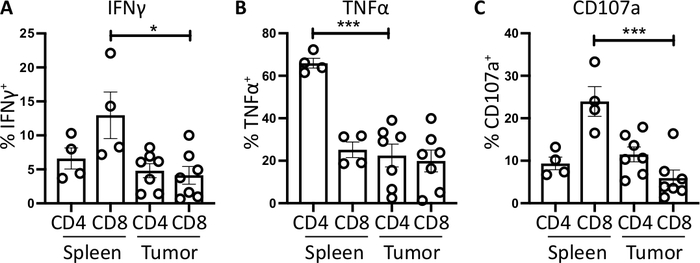
Figura 4: Quantificazione dell'attività delle cellule T derivate dalla milza e dal tumore ex vivo. La proporzione di cd4e CD8- cellule T positive per (A) IFN, (B) TNF ,e (C) CD107a, è stata quantificata nella milza (n. 4) e tumore (n. 7) di topi portatrici ortotopici. Ogni punto dati rappresenta una singola visualizzazione del mouse e delle barre di errore significa : seM. La significatività statistica è stata testata utilizzando un test t non accoppiato in cui , p<0,05 e . Tutti i dati sono stati analizzati utilizzando Prism 8. I dati di questa cifra sono stati modificati dal lavoro pubblicato in precedenza10. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
I modelli in vivo di cancro al pancreas forniscono strumenti inestimabili per comprendere la progressione della malattia e valutare nuovi obiettivi terapeutici3. Il modello ortotopico in particolare è un modello economico e riproducibile che può essere applicato in grandi coorti di topi contemporaneamente4,27. Il modello ortotopico fornisce anche il microambiente cognato e il sistema immunitario intatto per la crescita del tumore, rendendolo più appropriato rispetto ai modelli sottocutanei e PDX. Tuttavia, abbiamo scoperto che alcuni elementi di infiltrazione immunitaria possono differire tra il modello ortotopico e i topi KPC, il modello murino standard oro10. Una ragione per questo potrebbe essere la crescita del tumore accelerata visto nel modello ortotopico. Ulteriori differenze nella densità dei sottoinsiemi di cellule immunitarie sono state descritte tra i modelli ortotopici e sottocutanei3,28. Pertanto, anche se il modello KPC transgenico è più costoso e variabile6, i risultati chiave dovrebbero essere verificati in una piccola coorte di topi KPC, ove possibile.
La preparazione delle cellule tumorali per la chirurgia ortotopica è un passo critico nel protocollo. Le cellule devono essere sempre nella fase di log della crescita e del micoplasma e senza infezioni. Chirurgia ortotopica dovrebbe essere rinviata se ci sono preoccupazioni sulla crescita delle cellule tumorali. L'uso della membrana seminterrato migliora il tasso di incidenza del tumore rispetto alle cellule iniettatricisenza 29 e riduce la perdita di cellule e quindi la diffusione peritoneale27. Tuttavia, una volta sospese nella membrana del seminterrato, le cellule tumorali devono essere iniettate rapidamente (entro 2 ore) per evitare qualsiasi perdita di cellule. È probabile che il numero di cellule tumorali necessarie per generare tumori sia dipendente dalla linea cellulare e deve essere testato un intervallo di numeri di cellule (ad esempio, da 100 a 100.000) che può anche determinare il tempo necessario per raggiungere l'endpoint. È probabile che ci sarà un margine di errore quando si preparano 1.000 cellule per topo per iniezione; pertanto, se sono necessari più giorni di intervento chirurgico, il trattamento dei gruppi dovrebbe essere distribuito equamente tra i giorni per controllare gli effetti del lotto. La maggior parte dei passaggi chirurgici può essere modificata in base alle preferenze; tuttavia, occorre prestare attenzione a non disturbare la membrana del seminterrato quando si sostituisce il pancreas nella cavità addominale o si chiude la parete peritoneale. Perdita di membrana seminterrato può causare la crescita delle cellule tumorali sulla parete peritoneale, che si formano rapidamente e può portare a dover sacrificare l'animale in precedenza.
Idealmente, i tumori pancreatici dovrebbero essere rapidamente digeriti dopo il raccolto e preparati immediatamente per la stimolazione ex vivo. Tuttavia, questo potrebbe non essere possibile se c'è un grande lotto di tumori da raccogliere, in questo caso i tumori dovrebbero essere tenuti sul ghiaccio e digeriti in lotti. Il tipo, la concentrazione e la durata dell'esposizione agli enzimi digestivi hanno tutti dimostrato di influenzare un gran numero di molecole superficiali sulle cellule immunitarie30,31,32. Il tempo di digestione è anche deliberatamente breve per limitare la morte cellulare33. Le cellule digerite possono essere congelate nel mezzo di congelamento per l'immagazzinamento a lungo termine; tuttavia, qualche perdita di cellule si verificherà quando si scongela. Il processo di digestione può essere non ottimale se i pezzi del tumore non sono sufficientemente tagliati a dadini prima dell'incubazione del collagenasi e questo sarà evidente poiché i pezzi di tumore duro rimarranno nel filtro dopo la digestione. La concentrazione di collagenasi può essere abbassata se si lavora con pancreas sani o tumori in fase iniziale; rapporti sull'estrazione di cellule duttali pancreatiche sane utilizzano concentrazioni significativamente più basse34. Un alto grado di morte delle cellule epiteliali è prevedibile durante la digestione; tuttavia, le cellule immunitarie dovrebbero tollerare bene il processo. Esistono metodi alternativi per isolare le cellule epiteliali vitali per la crescita organoide35 o per preservare l'architettura dei tessuti36.
Le modifiche al protocollo di stimolazione possono essere apportate facilmente, a seconda della lettura desiderata e delle cellule immunitarie analizzate (ad esempio, macrofagi o cellule B). L'uso di reagenti panstimolazione PMA/ionomycinnon non discrimina per specificità TCR-antigene, rendendolo utile quando l'antigene non è noto. Tuttavia, la produzione di IFN è strettamente associata all'impegno di TCR37 e sia la produzione di IFN e TNF sono fondamentali nelle risposte antitumorali PDAC38. La stimolazione pMA/ionomycina riflette la capacità massima delle cellule T di produrre citochine, che potrebbero o potrebbero non essere prodotte dai cellule T all'interno del microambiente tumorale. La produzione endogena può essere misurata senza la necessità di stimolazione; tuttavia, i livelli possono essere molto più bassi o non rilevabili. Ci sono metodi alternativi per stimolare le cellule T: perline anti-CD3/28 rivestite, che inoltre non richiedono antigene o addirittura altre popolazioni di cellule immunitarie. Il vantaggio di questo metodo è consentire la quantificazione della produzione di citochine da parte di specifici sottoinsiemi di cellule T senza la necessità di metodi di separazione. Altri marcatori di citotossicità (granzyme B e Perforin A), attività (IL-2) o immunosoppressione (IL-10) possono anche essere aggiunti21. Tuttavia, gli anticorpi della citometria di flusso di alta qualità non sono disponibili per rilevare tutte le citochine e i fattori di interesse. Pertanto, se ci sono altre applicazioni come ELISA richiesto la stimolazione può essere eseguita senza l'inclusione di brefeldin A/monensin, permettendo citochina rilascio nel supernatante. Tuttavia, da notare, questo permetterà il rilascio totale di citochine cellulari e non sarà possibile determinare quali popolazioni cellulari hanno contribuito.
La produzione di IFN è una caratteristica dominante di una risposta antitumorale delle cellule T, spesso utilizzata come sostituto del riconoscimento TCR-antigene37,38. Altri metodi in vivo che definiscono più accuratamente le risposte specifiche dell'antigene utilizzano cellule tumorali che esprimono un antigene noto, come Ovalbumin o SV40. L'antigene universale può quindi essere utilizzato ex vivo per testare il riconoscimento delle cellule T o in combinazione con un mouse host limitato t- TCR. In alternativa, laddove l'antigene è sconosciuto, la quantificazione dell'espansione clonale delle cellule T può essere eseguita mediante sequenziamento bulk-TCR o più recentemente sequenziamento TCR a cella singola39,40. Per comprendere appieno lo stato della risposta delle cellule T intratumorali, è necessario misurare anche i marcatori indicativi di recettori di esaurimento o inibitori, tra cui: CTLA-4, PD-1, LAG-3, TIM3, 2B4. Così come i marcatori di cellule T eseche (CD44hi, CD62lo) e attività proliferativa, Ki67o diluizione CSFE41,42,43,44. Nel complesso, il modello ortotopico fornisce una piattaforma utile per testare rapidamente strategie terapeutiche, in particolare che possono modulare la risposta antitumorale delle cellule T, che può poi essere convalidata su una coorte più piccola di topi transgenici, KPC.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo l'Animal Technician Service e il Dr. Alzbeta Talarovicova (Barts Cancer Institute, Queen Mary University of London, Londra, Regno Unito) per la loro assistenza durante l'intervento ortotopico. Vorremmo anche ringraziare la Dott.ssa Jennifer Morton (Beatson Institute for Cancer Research, Glasgow, Regno Unito) per la sua guida nella tecnica chirurgica, Dr. Cristina Ghirelli (Barts Cancer Institute, Queen Mary University of London, Londra, Regno Unito) per i suoi consigli sulla digestione del tumore e la dott.ssa Fabienne McClanahan (Barts Cancer Institute, Queen Mary University of London, Londra, Regno Unito) per il suo consiglio sulla stimolazione cellulare in vivo. Vorremmo anche ringraziare il Medical Research Council (MRC), Il Pancreatic Cancer Research Fund (PCFR) e l'Ovarian Cancer Action che hanno finanziato questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| 6/0 gauge coated vicryl absorbable sutures | Ethicon | W9500T | |
| 70 μm pore-size cell strainer | Fisher Scientific | 11597522 | |
| 9 mm Clay Adams clips | VetTech Solutions | IN015A | |
| anti-CD107a PE (clone 1D4B) | Biolegend | 121612 | 1:100 to culture media |
| anti-CD16/CD32 | BD Biosciences | 553142 | Use at final dilution 1:200 |
| anti-CD3 PerCP eFluor710 (clone 17A2) | Biolegend | 46-0032 | Use at final dilution 1:50 |
| anti-CD4 FITC (clone GK1.5) | eBioscience | 11-0041 | Use at final dilution 1:100 |
| anti-CD45 Brilliant Violet 605 (clone 30-F11) | Biolegend | 103140 | Use at final dilution 1:200 |
| anti-CD8 Brilliant Violet 421 (clone 53-6.7) | Biolegend | 100738 | Use at final dilution 1:100 |
| anti-IFN-gamma PE/Cy7 (clone XMG1.2) | Biolegend | 505826 | Use at final dilution 1:50 |
| anti-TNF-alpha Alexa Fluor 647 (clone MP6-X) | Biolegend | 506314 | Use at final dilution 1:50 |
| BD Matrigel Basement Membrane Matrix High Concentration | BD Biosciences | 354248 | Aliquot on ice and store in -20 °C |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| Cell Stimulation Cocktail (500x) (phorbol 12-myristate 13-acetate (PMA) and ionomycin) | eBioscience | 00-4970-03 | 1x Final concentration PMA 0.081 μM, ionomycin 1.34 μM |
| Clay Adams Autoclip Applier | VetTech Solutions | IN015B | |
| Clay Adams Autoclip remover | VetTech Solutions | IN015B | |
| Collagenase Type V from Clostridium histolyticum | Sigma-Aldrich | C9263 | 2 mg/mL in media |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D2650-100mL | |
| DMEM High glucose (4.5 g/L) with L-Glutamine | PAA | E15-810 | |
| DNase (Deoxyribonuclease I from bovine pancreas Type II-S) stock 10 mg/mL in 0.15 M NaCl | Sigma-Aldrich | D4513 | Final concentration in digestion media 0.025 mg/mL |
| Fixable Viability Dye 506 (FVD506) | eBioscience | 65-0866 | Use at 1:200 in PBS |
| Foetal calf-serum (FCS) | GE Healthcare | A15-104 | 10% in RPMI |
| Hamilton syringe 700 series, 25 μL volume, 22s gauge needle bevel tip | Fisher Scientific | 10100332 | |
| Intracellular Fixation buffer and Intracellular Permeabilisation Buffer | eBioscience | 88-8824-00 | Dilute permeabilisation buffer to 1x in H2O |
| Penicillin/streptomycin | PAA | 15140122 | 100 units/mL Penicillin, 100 μg/mL Streptomycin |
| Protein transport inhibitor cocktail (500x) (brefeldin A and monesin) | eBioscience | 00-4980-03 | 1x Final concentration Brefeldin A 10.6 μM, monensin 2 μM |
| RPMI-1640 (containing 0.3 g/L Glutamine) | Sigma-Aldrich | R8758 | |
| Surgical Scalpel Blade No.10 | Swann-Morton | 0501 | |
| Trypsin-EDTA Solution 10x | Sigma-Aldrich | 594-18C | Trypsin (0.1%) EDTA (0.4%) final concentration |
| U-bottomed 96 microwell plate | VWR | 734-2080 | |
| Universal Cotton Tipped Applicators - 6 inch x 100 | Medisave | UN982 | |
| V-bottomed 96 microwell plate | VWR | 735-0184 |
Riferimenti
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Conroy, T., et al. Current standards and new innovative approaches for treatment of pancreatic cancer. European Journal of Cancer. 57, 10-22 (2016).
- Lee, J. W., Komar, C. A., Bengsch, F., Graham, K., Beatty, G. L. Genetically engineered mouse models of pancreatic cancer: The KPC model (LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre), its variants, and their application in immuno-oncology drug discovery. Current Protocols in Pharmacology. 2016, (2016).
- Tseng, W. W., et al. Development of an Orthotopic Model of Invasive Pancreatic Cancer in an Immunocompetent Murine Host. Clinical Cancer Research. 16 (14), 3684-3695 (2010).
- Majumder, K., et al. A Novel Immunocompetent Mouse Model of Pancreatic Cancer with Robust Stroma: a Valuable Tool for Preclinical Evaluation of New Therapies. Journal of Gastrointestinal Surgery. 20 (1), 53-65 (2016).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Herreros-Villanueva, M., Hijona, E., Cosme, A., Bujanda, L. Mouse models of pancreatic cancer. World Journal of Gastroenterology. 18 (12), 1286-1294 (2012).
- Witkiewicz, A. K., et al. Integrated Patient-Derived Models Delineate Individualized Therapeutic Vulnerabilities of Pancreatic Cancer. Cell Reports. , (2016).
- Nicolle, R., et al. Pancreatic Adenocarcinoma Therapeutic Targets Revealed by Tumor-Stroma Cross-Talk Analyses in Patient-Derived Xenografts. Cell Reports. , (2017).
- Spear, S., et al. Discrepancies in the Tumor Microenvironment of Spontaneous and Orthotopic Murine Models of Pancreatic Cancer Uncover a New Immunostimulatory Phenotype for B Cells. Frontiers in Immunology. 10, 542(2019).
- Zhu, Y., et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models. Cancer Research. , (2014).
- Lee, J. J., Huang, J., England, C. G., McNally, L. R., Frieboes, H. B. Predictive Modeling of In vivo Response to Gemcitabine in Pancreatic Cancer. PLoS Computational Biology. , (2013).
- Clark, C. E., et al. Dynamics of the Immune Reaction to Pancreatic Cancer from Inception to Invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Fukunaga, A., et al. CD8+ tumor-infiltrating lymphocytes together with CD4+ tumor-infiltrating lymphocytes and dendritic cells improve the prognosis of patients with pancreatic adenocarcinoma. Pancreas. 28 (1), 26-31 (2004).
- Tewari, N., et al. The presence of tumor-associated lymphocytes confers a good prognosis in pancreatic ductal adenocarcinoma: an immunohistochemical study of tissue microarrays. BMC Cancer. 13 (1), 436(2013).
- Royal, R. E., et al. Phase 2 Trial of Single Agent Ipilimumab (Anti-CTLA-4) for Locally Advanced or Metastatic Pancreatic Adenocarcinoma. Journal of Immunotherapy. 33 (8), 828-833 (2010).
- Brahmer, J. R., et al. Safety and Activity of Anti–PD-L1 Antibody in Patients with Advanced Cancer. New England Journal of Medicine. 366 (26), 2455-2465 (2012).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Beatty, G. L., et al. CD40 Agonists Alter Tumor Stroma and Show Efficacy Against Pancreatic Carcinoma in Mice and Humans. Science. 331 (6024), 1612-1616 (2011).
- Lutz, E. R., et al. Immunotherapy converts nonimmunogenic pancreatic tumors into immunogenic foci of immune regulation. Cancer Immunology Research. 2 (7), 616-631 (2014).
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews. Immunology. 2 (6), 401-409 (2002).
- Mojic, M., Takeda, K., Hayakawa, Y. The dark side of IFN-γ: Its role in promoting cancer immunoevasion. International Journal of Molecular Sciences. , (2018).
- Castro, F., Cardoso, A. P., Gonçalves, R. M., Serre, K., Oliveira, M. J. Interferon-gamma at the crossroads of tumor immune surveillance or evasion. Frontiers in Immunology. , (2018).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nature Immunology. , (2011).
- Betts, M. R., et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. Journal of Immunological Methods. 281 (1-2), 65-78 (2003).
- Schuerwegh, A. J., De Clerck, L. S., Bridts, C. H., Stevens, W. J. Comparison of intracellular cytokine production with extracellular cytokine levels using two flow cytometric techniques. Cytometry. 55 (1), 52-58 (2003).
- Partecke, L. I., et al. A syngeneic orthotopic murine model of pancreatic adenocarcinoma in the C57/BL6 mouse using the panc02 and 6606PDA cell lines. European Surgical Research. , (2011).
- An, X., et al. Immunophenotyping of Orthotopic Homograft (Syngeneic) of Murine Primary KPC Pancreatic Ductal Adenocarcinoma by Flow Cytometry. Journal of Visualized Experiments. (140), (2018).
- Jiang, Y. J., et al. Establishment of an orthotopic pancreatic cancer mouse model: Cells suspended and injected in Matrigel. World Journal of Gastroenterology. , (2014).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. , (2017).
- Liu, Q., et al. Effects of enzymatic digestion, cell culture and preservation conditions on surface CD62L expression of primary murine CD3+CD4+T cells. Biomedical Research (India). 29 (10), 2153-2159 (2018).
- Seaman, S. A., Tannan, S. C., Cao, Y., Peirce, S. M., Lin, K. Y. Differential effects of processing time and duration of collagenase digestion on human and murine fat grafts. Plastic and Reconstructive Surgery. , (2015).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. EMBO Journal. , (2013).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. , (2015).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Scientific Reports. , (2019).
- Moran, A. E., Polesso, F., Weinberg, A. D. Immunotherapy Expands and Maintains the Function of High-Affinity Tumor-Infiltrating CD8 T Cells In Situ. The Journal of Immunology. , (2016).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. , (2015).
- Singh, M., et al. High-throughput targeted long-read single cell sequencing reveals the clonal and transcriptional landscape of lymphocytes. Nature Communications. 10 (1), 3120(2019).
- Jiang, N., Schonnesen, A. A., Ma, K. Y. Opinion Ushering in Integrated T Cell Repertoire Profiling in Cancer. Trends in Cancer. 5, 85-94 (2019).
- Schietinger, A., et al. Tumor-Specific T Cell Dysfunction Is a Dynamic Antigen-Driven Differentiation Program Initiated Early during Tumorigenesis. Immunity. 45 (2), 389-401 (2016).
- Raghav, S. K., et al. Exhaustion of tumor-specific CD8+ T cells in metastases from melanoma patients. Journal of Clinical Investigation. , (2011).
- Gros, A., et al. PD-1 identifies the patient-specific in filtrating human tumors. The Journal of Clinical Investigation. , (2014).
- Miller, B. C., et al. Subsets of exhausted CD8 + T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. , (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon