Method Article
Поколение ортотопических опухолей поджелудочной железы и Ex vivo Характеристика опухоли-проникновения T клеточной цитотоксичности
В этой статье
Резюме
Этот протокол описывает хирургическое поколение ортотопических опухолей поджелудочной железы и быстрое переваривание свежеизолированных опухолей поджелудочной железы. После пищеварения, жизнеспособные популяции иммунных клеток могут быть использованы для дальнейшего анализа вниз по течению, в том числе ex vivo стимуляции Т-клеток для внутриклеточного обнаружения цитокинов с помощью цитометрии потока.
Аннотация
In vivo модели рака поджелудочной железы предоставляют бесценные инструменты для изучения динамики заболеваний, иммунной инфильтрации и новых терапевтических стратегий. Ортотопическая моуринная модель может быть выполнена на больших когортах иммунокомпетентных мышей одновременно, является относительно недорогой и сохраняет коньяк ткани микроокружения. Количественная оценка инфильтрации Т-клеток и цитотоксическая активность в ортотопических опухолях является полезным показателем противоопухолевого ответа.
Этот протокол описывает методологию хирургического поколения ортотопических опухолей поджелудочной железы путем инъекций низкого числа сингенных опухолевых клеток, перевезненных в мембране подвала 5 Л непосредственно в поджелудочную железу. Мыши подшипник ортотопических опухолей занять около 30 дней, чтобы достичь конечной точки, в этот момент опухоли могут быть собраны и обработаны для характеристики опухоли инфильтрации Т-клеток деятельности. Быстрое ферментативное пищеварение с помощью коллагеназы и DNase позволяет извлекать одноклеточную суспензию из опухолей. Сохраняется жизнеспособность и маркеры поверхности клеток иммунных клеток, извлеченных из опухоли; Поэтому, это подходит для нескольких приложений вниз по течению, в том числе поток-помощь клеток сортировки иммунных клеток для культуры или экстракции РНК, циклометрический анализ потока иммунных клеток населения. Здесь мы описываем ex vivo стимуляцию популяций Т-клеток для внутриклеточной количественной оценки цитокинов (IFN и TNF) и дегранизационной активности (CD107a) как меру общей цитотоксичности. Цельноопухолевые дайджесты стимулировались ацетатом phorbol myristate и иомамицином на 5 ч, в присутствии анти-CD107a антитела для того, чтобы upregulate производства цитокинов и дегранизывания. Добавление брефельдина А и монэнсина для финальных 4 ч было выполнено для блокирования внеклеточного транспорта и максимального обнаружения цитокинов. Вне- и внутриклеточного окрашивания клеток затем было выполнено для анализа цитометрии потока, где пропорция IFN,TNFи CD107a- CD4 и CD8- Т-клеток была количественно.
Этот метод обеспечивает стартовую основу для проведения всестороннего анализа микросреды опухоли.
Введение
Этот метод детали, от начала до конца, хирургическая процедура для генерации ортотопических опухолей поджелудочной железы с использованием минимального количества клеточного материала и последующей быстрой диссоциации установленных опухолей для всеобъемлющего анализа цитометрии потока иммунных клеток населения, в том числе ex vivo анализ функции Т-клеток.
Аденокарцинома поджелудочной железы (PDAC) является агрессивной карциномой, при этом только 8% пациентов выживают 5 лет1. Поскольку менее 20% пациентов имеют право на хирургическую резекцию2, свежие образцы пациентов не легко доступны для исследований и, таким образом, модели in vivo предоставляют необходимые инструменты для исследования этого заболевания. Есть несколько моделей murine PDAC: ортотопические, подкожные, трансгенные, внутривенные и пациент-производные ксенотрансплантат (PDX), широко описаны здесь3. Описанная здесь ортотопическая модель позволяет впрыснуть сингенные клетки PDAC в поджелудочную железу иммунокомпетентных мышей. Это может быть выполнено в больших когортах диких или мутантных мышей, и, таким образом, обеспечивает экономически эффективную и последовательную модель для сравнения терапевтических агентов. Важно отметить, что ортотопическая модель обеспечивает cognate микроокружения для роста опухолевых клеток и метастазирует в наших руках и других4 к клинически значимым местам (например, печени), что делает его более клинически актуальным, чем подкожные или химически индуцированных моделей. Ортотопические опухоли отображают ключевые особенности PDAC, такие как сильная десмопластическая реакция с обилием фибробластов и внеклеточным ивкообразимым матричным осаждением5. Трансгенные модели PDAC являются золотым стандартом модели мурина и наиболее часто используется модель KPC, которая выражает мутант КрасG12D / и Trp53R172H / " под поджелудочной железы конкретных Pdx-1-Cre промоутер6. Дополнительные модели KPC и других in vivo PDAC рассматриваются здесь7. Мыши КЗК спонтанно развивают опухоли поджелудочной железы с прогрессированием заболевания, которое точно повторяет особенности человека PDAC6. Однако, как и для всех трансгенных моделей, программа разведения является дорогостоящим, прогрессирование опухоли является переменной и, следовательно, часто требует больших когорт мышей. Модели PDX используют опухолевые клетки или кусочки, полученные от пациента, которые затем выращиваются либо ортотопически, либо чаще подкожно у мышей с ослабленным иммунитетом. Модели Xenograft предоставляют полезные инструменты для скрининга терапевтических соединений и учитывают неоднородность пациента. Тем не менее, они не обеспечивают полной иммунной микросреды, тем самым ограничивая их применения8,9.
После установления, ортотопические опухоли обычно занимают около 1 месяца или более, чтобы расти (в зависимости от клеточной линии используется) и образуют большие опухоли, которые могут быть легко изображения с помощью ультразвука или МРТ для отслеживания прогрессирования и определить эффективность лечения4,5,10. Однако, как только в экспоненциальном росте, последняя фаза роста опухоли может быть быстрой, поэтому большинство схем лечения начинаются относительно рано (например, 14 дней)11,12. Иммунная система играет важную роль в развитии опухоли, в том числе в PDAC, которая характеризуется иммуносупрессивной опухоль проникает с относительной нехваткой Т-клеток и частым присутствием миелоидных клеток13. Высокое присутствие Т-клеток в PDAC дает лучший прогноз14,15. Однако, как одиночные агенты, ингибиторы иммунной контрольной точки, которые снимают иммуносупрессию Т-клеток, такие как анти-CTLA-416 и анти-PD-L117, не показали клинической пользы у пациентов PDAC, скорее всего, потому что общая реактивность Т-клеток очень низка. Тем не менее, агенты, которые премьер Т-клеток ответов, таких как анти-CD40, может преодолеть анти-PD-L11/CTLA-4 сопротивление18,19 и вакцинация с ГМ-CSF-секретирования аллогенной вакцины PDAC (GVAX) может увеличить иммуногенность опухолей PDAC20, что свидетельствует о том, что повышение Реакции Т-клеток формирует важный терапевтический путь.
Критически важным для противоопухолевого Ответа Т-клеток является распознавание антигенов, полученных из опухоли, через Т-клеточный рецептор (ТКР) и последующее производство цитотоксических цитокинов и гранул. В то время как распознавание Т-клеток может быть определено путем секвенирования TCR, этот подход является дорогостоящим и трудоемким. Тем не менее, количественная оценка инфильтрации опухолей Т-клеток подмножества обеспечивает хорошее указание на противоопухолевую реакцию. Дальнейшее изучение активности Т-клеток ex vivo с точки зрения дегранизации, производства цитокинов и других цитотоксических факторов обеспечивает более глубокий функциональный анализ. Эти анализы могут быть выполнены на свежих образцов опухоли и многие параметры функции Т-клеток могут быть измерены быстро поток цитометрии.
CD8 и CD4- Т-клетки производят цитокины, такие как IFN и TNF, чтобы потенцировать иммунный ответ21. ИФНЗ индуцирует MHCI upregulation на клетках-мишенях, индуцирует дифференциацию и вербовку иммунных клеток и способствует смерти клеток. Производство ИФНЗ по CD8и Т-клеткам хорошо характеризуется как часть противоопухолевого ответа и коррелирует с регрессией опухоли22,23. ТНФЗ является еще одним провоспалительным цитокином, производимым какCD8, так и CD4и Т-клетками. Это усиливает TCR-зависимой активации и пролиферации Т-клеток, помогая противоопухолевой реакции. После участия TCR, цитотоксические CD8и Т-клетки могут пройти дегранизацию, где предварительно сформированные секреторные лиизосомы, содержащие цитотоксические молекулы, высвобождаются в иммунологический синапс, чтобы вызвать деградацию целевых клеток21. Эти молекулы включают Перфорин, белок, который связывается с мембраной клетки-мибры, образуя поры, которые затем нарушают целостность мембраны и позволяют диффузии21 или эндоцитоз24 других цитотоксических молекул, таких как Granzyme B, непосредственно в цитоплазму клетки-мишени. Granzyme B является протеаза, которая принимает деградации нескольких белков в клетке-мишени, что приводит к гибели клеток21. Освобождение таких молекул требует экзоцитоза эндосом на поверхность клетки, где эндосомный маркер CD107a (также известный как LAMP-1) временно включен в клеточной мембране25.
Измерение секреции цитокинов Т-клетками требует их изоляции либо путем сортировки клеток, либо анализов разделения на основе биса, которые не могут быть легко выполнены на большом количестве образцов одновременно. Однако измерение внутриклеточных цитокинов не требует каких-либо предизоляционных шагов и может быть легко выполнено на нескольких образцах одновременно, что позволяет более высокой пропускной связи. Поскольку цитокины быстро выделяются Т-клетками, внутриклеточные уровни могут быть необнаружимы, и, таким образом, Т-клетка требует стимуляции для увеличения производства базального цитокина. Для оценки производства цитокинов, управляемых антигеном, антиген, признанный TCR, должен быть представлен Т-клетке загрунтованным APC in vitro. В тех случаях, когда специфика антигена неизвестна, необходим широкий подход к стимуляции. Стимуляция TCR может быть имитирована с помощью анти-CD3/28 бусин, которые обеспечивают как активацию TCR и костимуляцию, которая вызывает производство цитокинов и пролиферации. Однако более экономичной альтернативой является использование ПМА и иомицина, которые вместе широко активируют сигнальные пути, которые приводят к синтезу и высвобождению внутриклеточных цитокинов. В частности, PMA активирует протеиновый киназа C (PKC) и иономицин повышает внутриклеточные ионы Ca2, что приводит к увеличению сигнализации клеток. Для сохранения внутриклеточного содержания цитокинов эта стимуляция может эффективно сочетаться с белково-транспортными ингибиторами брефельдина А и монэнсина, которые блокируют белки в голги и тем самым предотвращают внеклеточное высвобождение. Использование PMA/ionomycin является устоявшимся методом стимулирования Т-клеток и существует сильная корреляция между внеклеточными и внутриклеточными цитокинов26. Стимулирование Т-клеток с PmA и иомамицинтакже также увеличивает оборот лизосомы к клеточной мембране и, таким образом, CD107a становится переходно интегрированной на поверхности клетки перед переработкой в клетку. Включая анти-CD107a антитела во время стимуляции, можно использовать его в качестве маркера дегрануляции деятельности25.
Этот метод быстро переваривает опухоли, чтобы обеспечить одноклеточную суспензию. На данный момент отдельные популяции могут быть непосредственно окрашены для цитометрии потока или очищены методами вниз по течению: сортировкой клеток при помощи потока или разделением магнитно-биса. Приготовление одноклеточной суспензии для анализа цитометрии потока позволяет высокопрокладочный анализ нескольких популяций иммунных клеток и их фенотипических маркеров, обеспечивая точную количественную оценку числа иммунных клеток и фенотипа.
Наконец, описанный здесь протокол пищеварения предотвращает потерю маркеров клеточной поверхности и поддерживает жизнеспособность иммунных клеток, позволяя иммунным клеткам пройти дальнейшие шаги по очистке клеток и культуру по мере необходимости. Однако, этот метод не был протестирован для получения эпителиальных клеток из этого пищеварения.
протокол
Ортотопические опухоли поджелудочной железы были созданы, как ранее описано10 в соответствии с Министерством внутренних дел Сша животных и научных процедур Закона 1986 года и Европейской директивы 2010/63/EU. Все мыши были проверены периоперационно на наличие признаков боли или страданий, в том числе, но не ограничиваясь потерей веса (15% в 72 ч или 20% в любой данный период), пилоэрецион, сужение глаз, поднятая походка, сгорбленный внешний вид, а также признаки раневой инфекции, включая кровотечение, покраснение и язву. Рост опухоли контролировался пальпированием, и были также проверены дополнительные клинические признаки, такие как затрудненное дыхание, желтуха и холодные конечности, с тем чтобы определить, были ли достигнуты признаки конечной точки. Все процедуры должны проводиться в стерильных условиях. Все реагенты, используемые до проточного цитометрии окрашивания должны быть подготовлены в стерильных условиях.
1. Подготовка опухолевых клеток для инъекций
- Возьмите аликвот подвальной мембраны от -20 градусов по Цельсию и поместите на лед при 4 градусах Цельсия на ночь.
ПРИМЕЧАНИЕ: Концентрация мембраны подвала может поменять от партии к партии; поэтому, партия специфических партий мембраны подвала должна быть испытана in vivo для того чтобы обеспечить reproducibility. Новая партия мембраны подвала оттаяла на льду на ноче 4 qC после этого aliquoted в user-defined aliquots, на льду, и после этого более далее хранится в -20 C до тех пор пока необходимо. Это сводит к минимуму трубоукладочные и замораживания оттаивания при использовании мембраны подвала.- Поместите стерильные PBS на 4 градуса Цельсия на ночь, чтобы охладить.
- Поместите стерильные 200 л и 1000 пипетки на -20 градусов на ночь, чтобы охладить.
- Используйте опухолевые клетки, которые без микоплазмы, выращенные по крайней мере на 2- 10 проходов после оттаивания и в бревенчатой фазе роста до сбора урожая. Этот протокол использует женский мурин C57BL/6 КПК полученных клеточной линии: TB32048 представлен в качестве щедрого подарка в лаборатории Дэвида Тувесона.
- Когда опухолевые клетки необходимы для сбора урожая, удалить среду из колбы и мыть клетки дважды в PBS (предварительно нагревается до 37 градусов по Цельсию).
- Добавьте 2x трипсин (предварительно разогретый до 37 градусов по Цельсию) в колбу в течение 10 мин при 37 градусах по Цельсию (к колбе T175, добавьте 5 мл).
- После 10 минут, добавить равный объем полной среде (10% FBS, 1x пенициллин, 1x стрептомицин в DMEM) в колбу и диссоциировать клетки, мягко нажав колбу и resuspending хорошо в среде.
- Перенесите клетки в трубку и центрифугу в течение 5 мин при температуре 300 х и комнатной температуре (RT).
- Удалите супернатант и resuspend клетки в полной среде для подсчета клеток.
- Центрифуги клетки снова в течение 5 мин на 300 х г и RT, и удалить супернатант.
- Resuspend клетки в предварительно охлажденной PBS для достижения концентрации 1x106 клеток / мл.
ПРИМЕЧАНИЕ: Эта концентрация запасов подготовлена для достижения конечной концентрации инъекций 1000 клеток в 5 л. Мы обнаружили, инъекции меньшего числа клеток в низком объеме инъекций сведены к минимуму утечки клеток и, следовательно, увеличение воспроизводимости однако, рост опухоли может быть клеточной линии зависит поэтому пользователи должны оптимизировать каждую линию клеток.
- Наряду с этим, поместите предварительно алицитируемый подвальный мембранный аликот, на льду, в капот.
- Соотношение конечного раствора подвальной мембраны, PBS и опухолевых клеток в PBS, подготовленных для инъекций, составляет 5:3:2. Поэтому к 500 злитро-аликотом подвальной мембраны добавить 300 л предварительно охлажденных PBS с помощью предварительно охлажденных 1000 л пипетки отзыв.
- Добавьте PBS непосредственно в подвальную мембрану aliquot, чтобы свести к минимуму трубач.
- Держите p1000 набор до 300 Л и resuspend PBS и подвал мембраны, убедившись, что держать трубку на льду, чтобы сохранить мембрану подвала в жидком состоянии.
- Когда закончили выталкивание всех подвале мембраны из p1000 отзыв, оставьте кончик в трубке, чтобы любой подвал мембраны / PBS спуститься пипетка отзыв.
- После 5-10 мин, извлечь больше подвальной мембраны из p1000 отзыв обратно в трубку и оставить трубку, чтобы сидеть на льду.
- Возьмите 200 л из перевеченных опухолевых клеток в PBS и добавить непосредственно в подвалм мембраны с помощью предварительно охлажденной 200 л пипетки отзыв.
- Возьмите свежий предварительно охлажденный наконечник пипетки p1000, установите пипетку на 300 qL и resuspend 30-40 раз. Большой кончик пипетки, установленный на низком уровне громкости, предпочтительнее, так как мембрана подвала может перемещаться вверх по кончику и касаться фильтра наконечника пипетки во время повторного подвески.
- Опухолевые клетки готовы к инъекциям. Держите опухолевые клетки / подвальной мембраны на льду во время операции.
2. Ортотопическая инъекция опухолевых клеток
- Акклиматизировать мышей в животном объекте в течение 7 дней.
- Около 2 ч до операции, брить левую сторону живота и спины, а затем управлять предоперационного обезболиваще подкожно под потертости шеи (Бупренорфин на 50-100 мкг/кг).
- Подготовка хирургического поля, с тепловой коврик, чтобы положить мышь и шторы для окружающего оборудования и над мышью. Стерилизовать все хирургические инструменты; подготовить достаточное количество инструментов для каждой мыши.
- Поместите мышь в 5% изофларан с O2 камеры до бессознательного.
- Перенесите мышь, лежащую на спине, на тепловой коврик и поддерживайте анестезию с помощью маски, обычно при более низком 2-3% изолюрани.
- Подтвердить глубокую анестезию; как определено потерей педали-вывода рефлекс, когда задняя лапа ущипнул и контролировать скорость дыхания остается постоянным.
- Обложка тела в драпировке, только с бритой части подвергаются. Убедитесь, что мышь надежно находится в маске анестезии.
- Используя стерильный бутон хлопка, добавьте раствор йода круговыми движениями по бритой области: начиная с центра и кружась к краю. Повторите процесс снова со свежим ватным тампоном и йодом.
- Используйте скальпель, чтобы сделать 1 см разрез непосредственно над поджелудочной железы / селезенки (верхний левый квадрант). Стерильные ножницы также могут быть использованы для разреза, если предпочтительнее.
- Потяните кожу друг от друга с помощью щипков. С новыми щипцы, найти перитонеальной стенки и использовать ножницы, чтобы сделать еще 1 см разрез через стенки.
- Извлеките поджелудочной железы, которая может прийти с селезенкой, из тела, используя вторую пару щипцы.
- Аккуратно инвертировать флакон опухолевых клеток / подвал мембраны несколько раз, чтобы смешать.
- Подготовьте стеклянный шприц с 5 л, содержащий 1000 опухолевых клеток в мембране подвала, и поместите на тепловой коврик на несколько секунд, чтобы он согревался.
ПРИМЕЧАНИЕ: Краткое потепление шприца позволит мембране подвала, чтобы начать затвердевание, с тем чтобы сделать его легче вводить без утечки. Однако, это необходимо держать кратко, если выйдено слишком длиной мембрана подвала затвердеет вполне и не будет впрыснут. Использование стеклянного шприца позволяет точно вводить низкий объем. - Держите поджелудочной железы на хвосте, чтобы расширить его и вставить иглу непосредственно в центр поджелудочной железы, параллельно поджелудочной железы себя с усилием, чтобы избежать видимых кровеносных сосудов.
ПРИМЕЧАНИЕ: Центр поджелудочной железы имеет большую площадь, и это легче всего вводить. Тем не менее, голова или хвост поджелудочной железы также могут быть специально введены, если предпочтительнее. - Медленно впрысните 5 кл/с мембраны подвала в поджелудочную железу и держите иглу устойчивой в поджелудочной железе, по крайней мере 30 с после инъекции, чтобы позволить мембране подвала затвердеть и предотвратить утечку. Мембрана подвала должна быть видна, как небольшой прозрачный пузырь будет образоваться; однако, он может быть не виден.
ПРИМЕЧАНИЕ: Большие объемы опухолевых клеток / подвальной мембраны могут быть введены; однако точный объем должен быть проверен, чтобы убедиться, что утечка не происходит. - Удалить иглу из поджелудочной железы и ждать, чтобы подтвердить не кровотечение произошло. Аккуратно вставьте поджелудочную железу обратно в брюшную полость, заботясь, чтобы не коснуться мембранного пузыря подвала.
- Потяните перитонеальной стенки вместе и выполнить один шов, или два прерванных швов, если это необходимо.
- Потяните две стороны разреза кожи вместе и выполнять несколько прерванных швов по мере необходимости или вставить два хирургических клипов.
- Администрирование другой подкожной инъекции бупренорфина в потертости.
- Перенесите мышь в нагретую клетку 37 градусов по Цельсию в течение по крайней мере 30 минут после операции для поддержания температуры тела перед передачей обратно в свежую клетку.
- Подготовка пюре диеты доступны в клетке, чтобы обеспечить регидратацию и вес тела.
- Повторное управление послеоперационной обезболивание, как рекомендуется, и внимательно следите за признаками открытия ран, боли или инфекции и потери веса. При использовании хирургических клипов, они могут быть удалены 7-10 дней спустя с помощью клипа удаления.
- Примерно через 14 дней рубцовая ткань заживет достаточно, чтобы начать пальпирование живота. Мониторинг размера опухоли тесно через пальпации, пока мыши не достигнут конечную точку.
- В конечном пункте мышь отбирается через вывих шейки матки с последующим обезглавливанием. Кожа и полость полости открываются с помощью ножниц и опухоли поджелудочной железы, вырезанных с помощью щипц для удержания опухоли, и ножницы для удаления окружающих тканей.
3. Переваривание опухолей поджелудочной железы
- Поместите расчлененные опухоли поджелудочной железы, метастатических опухолей сайта, или здоровой ткани поджелудочной железы в ледяной PBS, и хранить на льду.
- Используйте щипцдляние для передачи опухоли на чашку Петри.
- Добавьте 5,0 мл среды пищеварения (2 мг/мл Коллагеназы, 0,025 мг/мл DNase RPMI) в трубку 50 мл; хранить на льду, чтобы предотвратить ферментную активность, начиная с.
ПРИМЕЧАНИЕ: Этот протокол использует Коллагеназы типа V, который имеет активность 1 единиц / мг FALGPA и йgt; 125 единиц переваривания коллагена (CDU) / мг твердого тела. Коллагенеза и DNase aliquots могут храниться при -20 градусов и размораживаться на льду перед использованием. Когда оба полностью растворяются в стерильных RPMI, они могут быть переданы через фильтр 0,2 мкм для удаления загрязняющих веществ. Коллагенеза должна быть полностью растворена перед фильтрацией, чтобы избежать потери материала. - Возьмите небольшой aliquot этого решения, чтобы покрыть опухоль на чашку Петри.
- Используйте стерильный скальпель и щипки, чтобы разрезать опухоль на мелкие кусочки, примерно менее 3 мм в длину.
- Очистите части опухоли в трубку и аккуратно инвертировать трубку, пока все части погружены в пищеварение средств массовой информации. Храните на льду, если другие образцы опухоли должны быть подготовлены в партии.
- Перенесите на встряхивающее устройство в течение 20 мин при 37 градусах Цельсия. Убедитесь, что все части опухоли погружены в воду и не прилипают к краю трубки. Если встряхивание не представляется возможным, то вихрь образца каждые 5 минут, чтобы помочь пищеварению.
4. Подготовка одноклеточной суспензии от переваренной опухоли
- Сразу же после шага пищеварения, поместите трубку на лед, чтобы замедлить активность ферментов.
- Добавьте ЭДТА для достижения конечной концентрации 20 мМ и кратко вихревой образец для смешивания. Это еще больше замедлит активность ферментов.
- Откройте трубку и промойте любой опухоли переварить от крышки трубки со свежим ир- среды RPMI.
- Подготовьте ситечко мощностью 70 мкм (размер ситектора может быть изменен по желанию) на открытой трубке 50 мл на льду.
- Предварительно влажный фильтр со средним.
- Resuspend переваренных клеток и мыть стороны трубки с помощью 25 мл стриптиз, или больше. Более широкое отверстие стриптиза важно, чтобы толстый дайджест пройти легко.
- Перенесите весь дайджест, используя стриптиз 25 мл, на ситечко.
- Размять опухоль поверх фильтра с помощью шприца 1 мл. Mash только непосредственно вверх и вниз, чтобы свести к минимуму напряжение сдвига к клеткам.
- Непрерывно мыть клетки через ситечко с RPMI. Убедитесь в том, чтобы мыть с достаточной силой, чтобы протолкнуть клетки.
- Если есть еще материал для пюре, но RPMI останавливается промывки до конца, ситечко будет насыщен. Поэтому перенесите образец в новый фильтр и продолжайте.
ПРИМЕЧАНИЕ: В конце концов только внеклеточные компоненты матрицы останутся в фильтре, все одиночные клетки должны были пройти.
- Центрифуге трубки в течение 5 мин при 300 х г и 4 кв. C.
- Тщательно resuspend клеточной гранулы в полном RPMI и пройти непосредственно через другой фильтр, чтобы удалить любые внеклеточные матрицы или большие ячейки сгустки, которые не могут быть адекватно resuspended.
- На данный момент, если стимуляция не требуется, немедленно пятно изолированных клеток для анализа цитометрии потока, пропустив к шагу 6.1. Кроме того, повторно приостановить их в замораживании среды (10% DMSO в FBS) и хранить при -80 градусов по Цельсию с последующим длительным хранением в жидком азоте.
ПРИМЕЧАНИЕ: Замораживание шаг может позволить очистки иммунных клеток на более поздний срок; однако, количественная оценка подмножеств иммунных клеток может потребовать оптимизации, чтобы подтвердить, что число клеток и фенотип не зависит от процесса замораживания/оттепели. Стимуляция ex vivo T-клеток лучше всего выполняется на свежих образцах опухолей. В этот момент образец может быть дополнительно очищен путем удаления пчеловодство на основе мертвых клеток или иммунной клетки обогащения анализы, если это необходимо.
5. Подготовка клеток для стимуляции ex vivo
- Подсчитайте клетки, чтобы достичь концентрации 2 х 106/ 100 Л л в полной среде (RPMI 10% FBS, 1X пенициллин и 1X стрептомицин).
ПРИМЕЧАНИЕ: Большое количество общих клеток покрытием гарантирует, что будет адекватной Т-клеток в этой выборке для анализа. Тем не менее, число может быть уменьшено вверх или вниз в зависимости от наличия образца и редкого характера Подмножества Т-клеток интереса.- Плита 100 л клеток в U-дном 96-колодец пластины.
- Добавьте 100 qL полной среды, содержащей 2x препарат PMA/ иономицин (для достижения конечной концентрации 0,081 мкм и 1,34 мкм, соответственно, в соответствии с рекомендацией производителя).
ПРИМЕЧАНИЕ: Если измерения дегранизации / exocytosis, а также включить здесь флуоресцентно конъюгированных анти-мышь CD107a в средствах массовой информации. Контрольный образец, который не содержит CD107a, также должен быть выполнен. - Поместите в инкубатор 37 градусов с 5% CO2 на 1 ч.
- Добавьте 20 кл.л. 10-x препарата брефельдина А и моненсина (для достижения конечной концентрации 1,06 мкм и 2,0 мкм соответственно (в соответствии с рекомендацией производителя) в полных носителях.
ПРИМЕЧАНИЕ: Брефельдин А и моненсин являются ингибиторами переноса белка и таким образом блокируют внеклеточный высвобождение цитокинов и т.д., что позволяет их обнаружение с помощью цитометрии потока. Если измерять высвобождение цитокинов в супернатант ELISA или аналогичные методы – тогда этот шаг можно пропустить. - Поместите тарелку в инкубатор 37 градусов с 5% CO2 для дальнейшего 4 ч.
6. Внеклеточное и внутриклеточное окрашивание для цитометрии потока
- Снимите пластину и resuspend каждый колодец, чтобы передать весь материал на V-bottomed пластины, размещенные на льду.
ПРИМЕЧАНИЕ: Эпителиальные клетки, макрофаги и другие клетки адептов не могут быть полностью извлечены путем повторного приостановки. Однако, поскольку анализ ниже по течению только на Т-клетках, это не проблема.- 6.1.1 Центрифуга пластины в течение 5 мин при 300 х г и 4 кв (использовать эти условия для последующих шагов, если не указано).
- Удалите супернатант, щелкнув тарелку вверх дном одним резким движением.
- Повторно езду в 50 л из поправляемого красителя жизнеспособности, подготовленного в ледяном PBS. При повторной приостановке установите пипетку на меньший объем, чтобы избежать создания пузырьков.
- Инкубировать в течение 20 мин при 4 градусах по Цельсию, в темноте.
- Шаг мытья: Добавьте 100 кЛ буфера FACS, центрифугу и удалите супернатант.
- Отрептируйте каждую скважину с 50 юрлиц анти-CD16/CD32 (2,5 мкг/мл) в буфере FACS (0,5 % BSA, 2,0 мМ EDTA в PBS), чтобы заблокировать неспецифическую связывание антител обнаружения рецепторов FC.
- Инкубировать в течение 15 мин при 4 градусах по Цельсию, в темноте.
- Добавьте непосредственно к каждому колодцу 2x мастермикс фторхрома-конъюгированного анти-мышского CD45, CD3, CD4 и CD8 (дальнейшие внеклеточные маркеры могут быть добавлены по желанию) в буфере FACS.
- Инкубировать в течение 30 минут при 4 градусах по Цельсию, в темноте.
- Шаг мытья: Добавьте 100 кЛ буфера FACS, центрифугу и удалите супернатант.
- Добавьте 100 кЛ 1x внутриклеточного (IC) буфера фиксации и инкубировать в течение 30 минут на RT, в темноте.
- Подготовьте центрифугу на RT.
- Добавьте 100 кЛ буфера FACS, центрифугу в течение 5 мин при 300 х г и RT и удалите супернатант. Повторите с 1x буфером пермяки и центрифугой в течение 5 мин при 300 х г; затем удалите супернатант.
- Добавьте 50 л 1x мастермикса флюорохром-конъюгированного антимыкового IFN, TNF и других внутриклеточных маркеров, подготовленных в буфере 1x пермяков.
- Инкубировать 1 ч на RT, в темноте.
- Добавьте 100 юаней буфера пермяков для мытья. Затем центрифуга в течение 5 мин при 300 х г и RT и удалить супернатант.
- Добавьте 100 кЛ буфера FACS для мытья, центрифугу в течение 5 мин при 300 х г и RT и удалите супернатант.
- После этого окончательного центрифугирования, resuspend клетки в объеме, совместимом для потока цитометра. Он может варьироваться в зависимости от размера труб FACS.
- Перенесите этот объем в соответствующие трубки FACS для приобретения.
- Накрыть светом и хранить в холодильнике и приобретать образцы в течение 24 ч.
Результаты
После введения 1000 тб32048 клеток в поджелудочную железу, ортотопические опухоли занять около 30 дней, чтобы развиваться(Рисунок 1A,B). Подвал мембраны утечки во время операции может привести к большим опухолям сформировать непосредственно на стенке перитонеальной, которые заметно видны через кожу(Рисунок 1C). Мы удалим этих мышей из исследования. Однако при хороших хирургических навыках частота утечки сведена к минимуму. Ортотопические опухоли, собранные в конечных точках, могут вырасти до значительного размера у мышей дикого типа C57BL/6(рисунок 1D). Урожай ортотопические опухоли требуют пищеварения в коллагенеза / DNase в течение 20 мин для достижения одноклеточной суспензии (Рисунок 2). На данный момент, опухолевые клетки могут быть покрыты в U-дном пластины на 2 х 106 клеток / хорошо. Количество покрынных клеток может быть изменено в зависимости от распространенности Т-клеток в образце; число клеток может быть снижено, если Т-клетки находятся в высокой плотности. Контроль селезенки или лимфатических узлов образцы также могут быть покрыты в этой точке для стимуляции. Каждый колодец стимулируется с PMA и иомамицином в течение 5 ч и после 1 ч инкубации, брефельдин А и мененсин добавляются для того, чтобы блокировать внеклеточное высвобождение цитокинов(рисунок 2). После инкубации образцы окрашиваются на внеклеточные эпитопы и внутриклеточные цитокины для анализа цитометрией потока(рисунок 2).
Образцы селезенки и опухолей у мышей, несущих ортопедические опухоли, были проанализированы с помощью цитометрии потока. Стратегия gating, используемая в анализе цитометрии потока для опухолей селезенки и ортопедических, исключает мусор с помощью FSC-A, SSC-A, дублетов FSC-A/FSC-H и SSC-A/SSC-W, затем мертвых или апоптотических клеток как положительных для фиксации viability dye(рисунок 3A). Иммунные клетки затем закрыты,как CD45 , и Т-клетки далее закрыты, как CD3, из которыхCD4 иCD8 подмножества определяются(Рисунок 3A). Флуоресценция минус один (FMO) выполняется для определения фоновой флуоресценции для gating и brefeldin A / monensin только контроль осуществляется для определения базального производства цитокинов(Рисунок 3B-D).
Для ИФНЗ инкубация брефельдином A/ monensin не привела к увеличению множества по сравнению с контролем ФМО как в образцах селезенки, так и в опухолевых пробах. Тем не менее, добавление PMA и иомамицина увеличило% внутриклеточного IFN, обнаруживаемых как в селенциальной, так и в опухолевыхCD4 и CD8и Т-клеток.
SplenicCD4 иCD8 - Т-клетки, используемые в качестве положительного контроля, имеют относительно более высокую процизить ИФНС, чем инфильтрация опухолей Т-клеток, со средним и 1,60 - 1,5% и 12,97 и 3,4% по сравнению с 4,81 и 1,0% и 4,13 - 1,3%, что указывает на иммунодепрессион в пределах(фигура 3 и 4). Используя ту же стратегию для ТНФЗ, мы визуализировать, что высокий процент селезенки CD4и Т-клеток являются положительными для внутриклеточного TNF (65,93 и 2,3%), по сравнению с опухолью-инфильтрации CD4и Т-клеток (22,45 5,4%). Селенка и инфильтрация cd8и Т-клеток производят аналогичные уровни ТНФЗ (25,15 и 3,7% и 19,91 и 5,1%, соответственно)(Рисунок 3C, Рисунок 4B).
Наконец, CD107a является эндосомным маркером, который выражается преходяще на поверхности клетки во время экзокцитоза цитотоксических гранул и цитокинов, как таковой, он используется в качестве суррогатного маркера цитотоксичности. Преимущество окрашивания cd107a во время стимуляции заключается в том, что все преходяще клеточной поверхности выраженные CD107a будут захвачены флуоресцентно-антитела. Базальные уровни CD107a показаны в brefeldin A/monensin только обработанные клетки. Для селезенки CD8и Т-клеток, стимуляция с PMA / иономицин увеличивает уровень CD107a обнаружен, с самым сильным upregulation в CD8клетки, которые были 23,95 и 3,5% CD107a, по сравнению с 5,8 и 1,9 % в опухоли проникающих CD8- клетки, что свидетельствует о селеблизмCD8 - имели большую скорость дегранижа. С другой стороны, селезенка и инфильтрация опухоли CD4- выражены сопоставимые уровни CD107a 9,37 и 1,5% и 11,50 и 1,8%(Рисунок 3D и 4C).
В целом эти результаты подчеркивают, что ортотопические опухоли могут быть получены от инъекции очень низкого числа (1000) опухолевых клеток в поджелудочную железу. Эти опухоли могут быть быстро усваивается для изоляции Т-клеток для стимуляции ex vivo. Обнаружение внутриклеточных цитокинов возможно и подчеркивает базальный уровень иммуносупрессии инфильтрации Т-клеток, по сравнению с Т-клетками во вторичных лимфоидных органах.
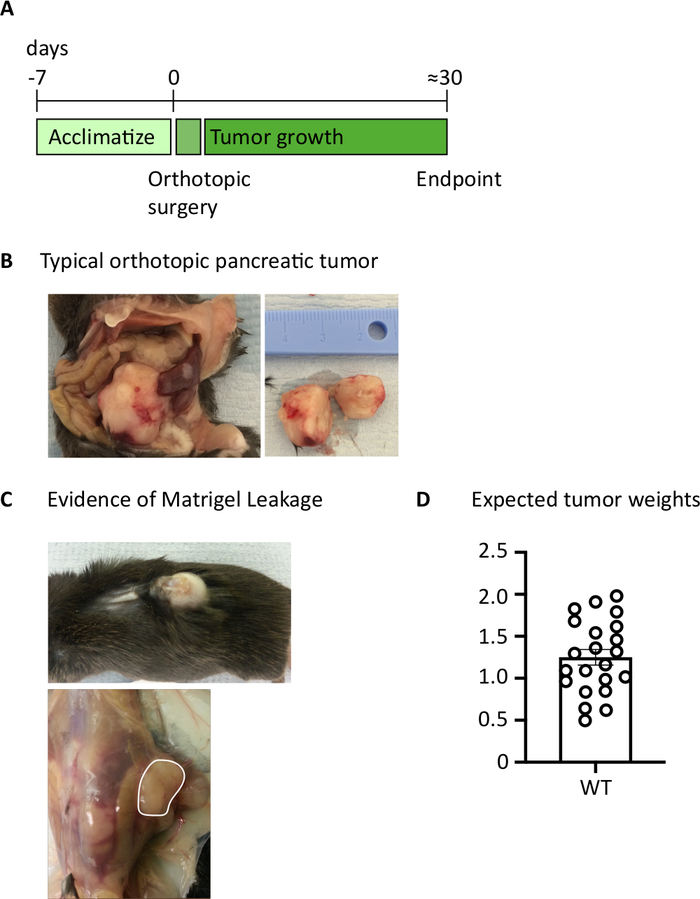
Рисунок 1: Поколение ортотопических опухолей поджелудочной железы. (A) Расписание экспериментов in vivo. (B) Макроскопическое появление ортотопических опухолей в брюшной полости (слева) и после иссечения (справа), где показанная опухоль была разрезана пополам. (C) Доказательства утечки мембраны подвала во время операции может привести к развитию опухолей, которые видны через кожу (верхняя фотография) и формы на перитонеальной стенке (нижняя фотография). (D) Ортотопические веса опухоли поджелудочной железы собраны из мышей, которые достигли конечной точки (n'22). Каждая точка данных представляет собой индивидуальную мышь, бар график показывает среднее И SEM. Данные в этом рисунке были изменены из ранее опубликованной работы10. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
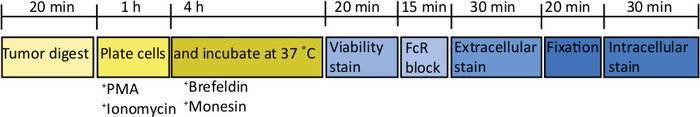
Рисунок 2: Схема обработки ортотопических опухолей для стимуляции экс-виво Т-клеток. После сбора урожая опухоли поджелудочной железы быстро усваиваются в коллагенезе (2 мг/мл) и DNase (0,025 мг/мл) в течение 20 мин при 37 градусах Цельсия. После этого, клетки resuspended на2 x 10 6/mL в вполне средствах RPMI и покрыны в U-bottomed плите. Стимулирующий коктейль PMA и иомамицина добавляется на 5 ч, после чего антимышечные антитела CD107a также могут быть добавлены в культуру. После 1 ч инкубации добавляются внутриклеточные транспортные блокаторы, брефельдин А и моненсин. После стимуляции ex vivo клетки переносятся в v-bottomed пластину для окрашивания с поправляемым красителем жизнеспособности (в PBS) в течение 20 мин 4 кв. C. Клетки промывают сярют в буфере FACS и инкубируются в анти-CD16/32 (блок FcR) в течение 15 минут (в буфере FACS), а затем инкубируются внеклеточными флуоресцентно-конъюгированными антителами в течение еще 30 минут (в буфере FACS). Клетки снова промывают сярют в буфере FACS и повторно входят в внутриклеточный буфер фиксации в течение 20 минут. После этого клетки промывают один раз в буфере FACS и один раз в 1x буфер пермяки. Клетки перепранжируются на 1 ч при RT во внутриклеточной флуоресцентно-конъюгированной антителах на 1 ч (в 1x буфере пермяков). Клетки промывают один раз в буфере пермяков 1x и один раз в буфере FACS перед resuspending в буфере FACS для приобретения на цитометр потока в пределах 24 h. Пожалуйста щелкните здесь для того чтобы осмотреть более большую версию этой диаграммы.
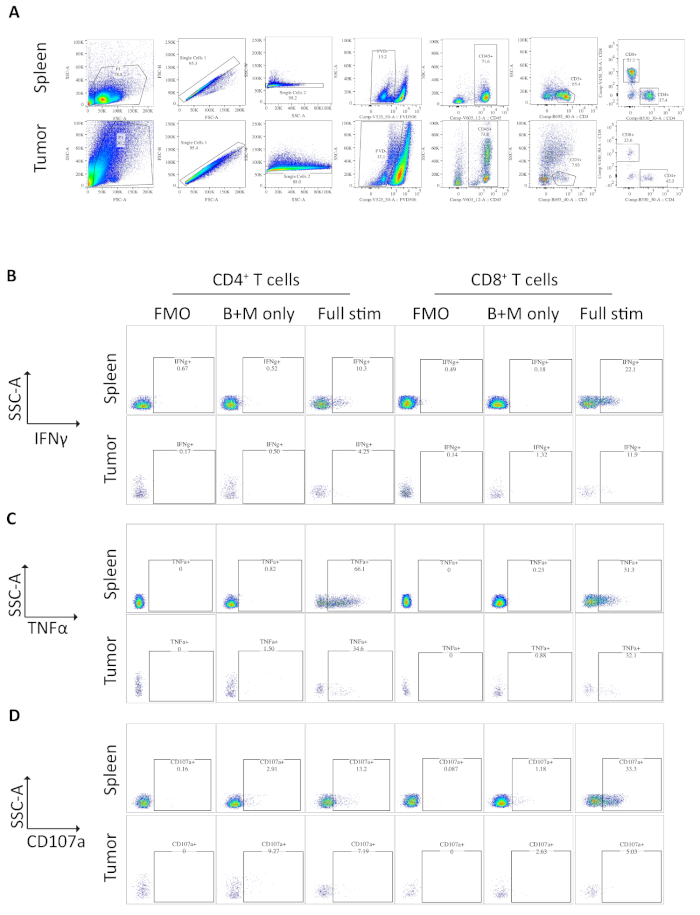
Рисунок 3: Анализ цитометрии потока ex vivo стимулировал селезенку и опухолевые Т-клетки. (A) Поток цитометрии gating стратегия, используемая для селезенки (положительный контроль) и ортотопических опухолей образцов. Клетки подвергаются дискриминации от мусора с помощью FSC-A/SSC-A и отдельные ячейки далее изолированы с помощью FSC-A/FSC-H и SSC-A/SSC-W. Мертвые или апоптотические клетки исключаются с помощью фиксируемого красителя жизнеспособности -FVD506 и иммунные клетки закрыты наCD45. После этого определяются подмножества CD3и CD4 иCD8. Данные были получены на BD Fortessa. (B) Стратегия gating, используемая для количественной оценки IFNи CD4 и CD8и Т-клеток. Для определения фоновой флуоресценции (FMO) для определения фоновой флуоресценции (PMA/ionomycin/brefeldin A/monensin) используется флуоресцентный режим минус один (FMO). Для определения производства базальных цитокинов используется только контроль brefeldin A/monensin (только БЗМ). Полностью стимулируемый образец затем используется для расчета % IFNи Т-клеток. (C) Стратегия gating, используемая для количественной оценки TNF,CD4 и CD8и Т-клеток. Для определения фоновой флуоресценции (PMA/ionomycin/brefeldin A/monensin) для определения фоновой флуоресценции используется контроль FMO. Для определения производства базальных цитокинов используется только контроль brefeldin A/monensin (только БЗМ). Полностью стимулируемый образец затем используется для расчета % TNFи Т-клеток. (D) Стратегия gating, используемая для определения CD107aи CD4 и CD8и Т-клеток. Для определения фоновой флуоресценции (PMA/ionomycin/brefeldin A/monensin) для определения фоновой флуоресценции используется контроль FMO. Для определения базальной деграниляции используется только контроль brefeldin A/monensin (только БЗМ). Полностью стимулируемый образец затем используется для расчета % CD107aи Т-клеток. Все данные цитометрии потока были проанализированы на версии FlowJo 10.6.1. Данные в этом рисунке были изменены из ранее опубликованной работы10. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
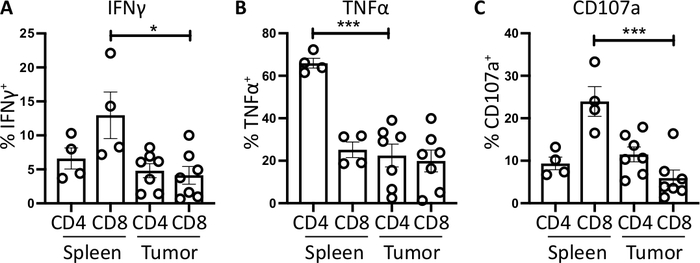
Рисунок 4: Количественная оценка активности клеток, полученных от ex vivo, и опухоли. ДоляCD4 и CD8- Т-клеток, положительных для (A) IFN- (B) TNFи (C) CD107aбыла количественно оценена в селезенке (n-4) и опухоли (n'7) ортотопно-опухолевых мышей. Каждая точка данных представляет собой индивидуальную мышь и отображение баров ошибок, среднее значение SEM. Статистическая значимость была протестирована с помощью непарного t-теста, в котором было проверено значение p'lt;0,05 и no p'lt;0.001. Все данные были проанализированы с помощью Prism 8. Данные в этом рисунке были изменены из ранее опубликованной работы10. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
В vivo модели рака поджелудочной железы обеспечивают бесценные инструменты для понимания прогрессирования заболевания и оценки новых терапевтических целей3. Ортотопическая модель, вчастности,является экономически эффективной и воспроизводимой моделью, которая может быть применена в больших когортах мышей одновременно4,27. Ортотопическая модель также обеспечивает cognate микроокружения и нетронутой иммунной системы для роста опухоли, что делает его более подходящим, чем подкожные и PDX-модели. Тем не менее, мы обнаружили, что некоторые элементы иммунной инфильтрации могут отличаться между ортотопической модели и КЗК мышей, золотостандартный мурин модель10. Одной из причин этого может быть ускоренный рост опухоли видели в ортотопической модели. Дальнейшие различия в плотности подмножеств иммунных клеток были описаны между ортотопическими и подкожными моделями3,28. Поэтому, хотя трансгенная модель КЗК является более дорогостоящей и переменной6,ключевые выводы должны быть проверены в небольшой когорте мышей КЗК, где это возможно.
Подготовка опухолевых клеток к ортотопической хирургии является критическим шагом в протоколе. Клетки всегда должны быть в бревенчатой фазе роста и микоплазмы и инфекции. Ортотопическая хирургия должна быть отложена, если есть какие-либо опасения по поводу роста опухолевых клеток. Использование подвальной мембраны улучшает частоту заболеваемости опухоли по сравнению с инъекционными клетками без него29 и уменьшает утечку клеток и, таким образом, перитонеальный спред27. Однако, после подвешенной в подвале мембраны, опухолевые клетки должны быть быстро введены (в течение 2 часов), чтобы избежать потери клеток. Количество опухолевых клеток, необходимых для генерации опухолей, вероятно, будет клеточной линии зависит, и ряд клеточных чисел должны быть проверены (например, от 100 до 100000), которые также могут определить время для достижения конечной точки. Вполне вероятно, что будет погрешность при подготовке 1000 клеток на мышь для инъекции; поэтому, если требуется несколько дней операции, лечение групп должно быть равномерно распределено в течение нескольких дней для контроля за пакетными эффектами. Большинство хирургических шагов могут быть изменены в зависимости от предпочтений; однако необходимо позаботиться о том, чтобы не нарушать мембрану подвала при замене поджелудочной железы в брюшной полости или закрытии брюшной стенки. Утечка мембраны подвала может вызвать рост опухолевых клеток на перитонеальной стенке, которые образуются быстро и могут привести к необходимости жертвовать животным раньше.
В идеале, опухоли поджелудочной железы должны быть быстро усваивается после сбора урожая и подготовлены для стимуляции ex vivo немедленно. Однако, это не может быть возможным, если есть большая партия опухолей для сбора урожая, в этом случае опухоли должны храниться на льду и переваривается партиями. Тип, концентрация и длина воздействия пищеварительных ферментов все было показано, влияют на большое количество молекул поверхности на иммунных клетках30,31,32. Время пищеварения также намеренно короткий, чтобы ограничить гибель клеток33. Переваренные клетки могут быть заморожены в замораживании среды для длительного хранения; однако, некоторые потери клеток произойдет при оттаивании. Процесс пищеварения может быть менее оптимальным, если опухоли части не достаточно кубиками до инкубации коллагеназы, и это будет очевидно, как твердые части опухоли останется в фильтре после пищеварения. Концентрация коллагеназы может быть снижена при работе со здоровыми опухолями поджелудочной железы или на ранних стадиях; отчеты о извлечении здоровых клеток протоков поджелудочной железы использовать значительно более низкие концентрации34. Высокая степень эпителиальной смерти клеток следует ожидать во время пищеварения; однако, иммунные клетки должны терпеть процесс наилучшим образом. Существуют альтернативные методы для изоляции жизнеспособных эпителиальных клеток для роста органоидов35 или для сохранения архитектуры тканей36.
Изменения в протокол стимуляции могут быть сделаны легко, в зависимости от желаемого чтения и иммунной клетки проанализированы (например, макрофаги или В-клетки). Использование пан-стимуляции реагентов PMA/ionomycin не дискриминирует для TCR-антигена специфичность, что делает его полезным, когда антиген не известно. Тем не менее, производство IFN з тесно связано с TCR взаимодействия37 и как IFN и TNF' производства имеют решающее значение в PDAC противоопухолевых ответов38. PmA/ionomycin стимуляция отражает максимальную способность Т-клеток производить цитокины, которые могут или не могут быть произведены Т-клеток в микроокружении опухоли. Эндогенное производство может быть измерено без необходимости стимуляции; однако уровни могут быть гораздо ниже или необнаруживаемы. Существуют альтернативные методы стимулирования Т-клеток: бусы с покрытием против CD3/28, которые также не требуют антигена или даже других популяций иммунных клеток. Преимущество этого метода позволяет количественно количественно йокуикина производства конкретных подмножеств Т-клеток без необходимости для методов разделения. Другие маркеры цитотоксичности (гранзим B и Перфорин А), активность (IL-2) или иммуносупрессия (IL-10) также могут быть добавлены21. Однако высококачественные цитометрические антитела потока не доступны для обнаружения всех цитокинов и факторов интереса. Поэтому, если Есть другие приложения, такие как ELISA требуется стимуляция может быть выполнена без включения brefeldin A / monensin, что позволяет высвобождение цитокинов в супернатант. Однако, следует отметить, что это позволит полное высвобождение клеточного цитокинов и не будет возможно определить, какие популяции клеток способствовали.
Производство ИФНЗ является доминирующей особенностью противоопухолевой реакции Т-клеток, часто используемой в качестве замены для распознавания TCR-антигена37,38. Другие методы in vivo, которые более точно определяют антиген-специфические реакции, используют опухолевые клетки, выражающие известный антиген, такие как Ovalbumin или SV40. Универсальный антиген может быть использован ex vivo для проверки распознавания Т-клеток или в сочетании с мышью с ограниченным tCR.йохом. Кроме того, где антиген неизвестен, количественная оценка расширения клонального Т-клеток может быть выполнена путем секвенирования объемных ТКР, или в последнее время одноклеточного TCR секвенирования39,40. Чтобы полностью понять состояние внутриопухолевой Реакции Т-клеток, маркеры, свидетельствуют об истощении или ингибирующих рецепторах, также должны быть измерены в том числе: CTLA-4, PD-1, LAG-3, TIM3, 2B4. А также маркеры эффектора Т-клеток (CD44привет, CD62lo) и пролиферативной активности, Ki67или CSFE разбавления41,42,43,44. В целом, ортотопическая модель обеспечивает полезную платформу для быстрого тестирования терапевтических стратегий, в частности, которые могут модулировать противоопухолевую реакцию Т-клеток, которая затем может быть проверена на меньшей когорте трансгенных, КПК, мышей.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Службу зоотехников и д-ра Алзбету Таларовикова (Институт рака Бартса, Лондонский университет королевы Марии, Лондон, Великобритания) за помощь во время ортотопической операции. Мы также хотели бы поблагодарить д-ра Дженнифер Мортон (Beatson Institute for Cancer Research, Глазго, Великобритания) за ее руководство в хирургической технике, доктора Кристину Гирелли (Институт рака Бартса, Лондонский университет королевы Марии, Лондон, Великобритания) за ее советы по пищеварению опухолей и д-р Фабьен МакКланахан (Институт рака Бартса, Университет Королевы Марии, Лондон, Великобритания) Мы также хотели бы поблагодарить Медицинский научно-исследовательский совет (MRC), Фонд исследований рака поджелудочной железы (PCFR) и борьбе с раком яичников, которые финансировали это исследование.
Материалы
| Name | Company | Catalog Number | Comments |
| 6/0 gauge coated vicryl absorbable sutures | Ethicon | W9500T | |
| 70 μm pore-size cell strainer | Fisher Scientific | 11597522 | |
| 9 mm Clay Adams clips | VetTech Solutions | IN015A | |
| anti-CD107a PE (clone 1D4B) | Biolegend | 121612 | 1:100 to culture media |
| anti-CD16/CD32 | BD Biosciences | 553142 | Use at final dilution 1:200 |
| anti-CD3 PerCP eFluor710 (clone 17A2) | Biolegend | 46-0032 | Use at final dilution 1:50 |
| anti-CD4 FITC (clone GK1.5) | eBioscience | 11-0041 | Use at final dilution 1:100 |
| anti-CD45 Brilliant Violet 605 (clone 30-F11) | Biolegend | 103140 | Use at final dilution 1:200 |
| anti-CD8 Brilliant Violet 421 (clone 53-6.7) | Biolegend | 100738 | Use at final dilution 1:100 |
| anti-IFN-gamma PE/Cy7 (clone XMG1.2) | Biolegend | 505826 | Use at final dilution 1:50 |
| anti-TNF-alpha Alexa Fluor 647 (clone MP6-X) | Biolegend | 506314 | Use at final dilution 1:50 |
| BD Matrigel Basement Membrane Matrix High Concentration | BD Biosciences | 354248 | Aliquot on ice and store in -20 °C |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| Cell Stimulation Cocktail (500x) (phorbol 12-myristate 13-acetate (PMA) and ionomycin) | eBioscience | 00-4970-03 | 1x Final concentration PMA 0.081 μM, ionomycin 1.34 μM |
| Clay Adams Autoclip Applier | VetTech Solutions | IN015B | |
| Clay Adams Autoclip remover | VetTech Solutions | IN015B | |
| Collagenase Type V from Clostridium histolyticum | Sigma-Aldrich | C9263 | 2 mg/mL in media |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D2650-100mL | |
| DMEM High glucose (4.5 g/L) with L-Glutamine | PAA | E15-810 | |
| DNase (Deoxyribonuclease I from bovine pancreas Type II-S) stock 10 mg/mL in 0.15 M NaCl | Sigma-Aldrich | D4513 | Final concentration in digestion media 0.025 mg/mL |
| Fixable Viability Dye 506 (FVD506) | eBioscience | 65-0866 | Use at 1:200 in PBS |
| Foetal calf-serum (FCS) | GE Healthcare | A15-104 | 10% in RPMI |
| Hamilton syringe 700 series, 25 μL volume, 22s gauge needle bevel tip | Fisher Scientific | 10100332 | |
| Intracellular Fixation buffer and Intracellular Permeabilisation Buffer | eBioscience | 88-8824-00 | Dilute permeabilisation buffer to 1x in H2O |
| Penicillin/streptomycin | PAA | 15140122 | 100 units/mL Penicillin, 100 μg/mL Streptomycin |
| Protein transport inhibitor cocktail (500x) (brefeldin A and monesin) | eBioscience | 00-4980-03 | 1x Final concentration Brefeldin A 10.6 μM, monensin 2 μM |
| RPMI-1640 (containing 0.3 g/L Glutamine) | Sigma-Aldrich | R8758 | |
| Surgical Scalpel Blade No.10 | Swann-Morton | 0501 | |
| Trypsin-EDTA Solution 10x | Sigma-Aldrich | 594-18C | Trypsin (0.1%) EDTA (0.4%) final concentration |
| U-bottomed 96 microwell plate | VWR | 734-2080 | |
| Universal Cotton Tipped Applicators - 6 inch x 100 | Medisave | UN982 | |
| V-bottomed 96 microwell plate | VWR | 735-0184 |
Ссылки
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Conroy, T., et al. Current standards and new innovative approaches for treatment of pancreatic cancer. European Journal of Cancer. 57, 10-22 (2016).
- Lee, J. W., Komar, C. A., Bengsch, F., Graham, K., Beatty, G. L. Genetically engineered mouse models of pancreatic cancer: The KPC model (LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre), its variants, and their application in immuno-oncology drug discovery. Current Protocols in Pharmacology. 2016, (2016).
- Tseng, W. W., et al. Development of an Orthotopic Model of Invasive Pancreatic Cancer in an Immunocompetent Murine Host. Clinical Cancer Research. 16 (14), 3684-3695 (2010).
- Majumder, K., et al. A Novel Immunocompetent Mouse Model of Pancreatic Cancer with Robust Stroma: a Valuable Tool for Preclinical Evaluation of New Therapies. Journal of Gastrointestinal Surgery. 20 (1), 53-65 (2016).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Herreros-Villanueva, M., Hijona, E., Cosme, A., Bujanda, L. Mouse models of pancreatic cancer. World Journal of Gastroenterology. 18 (12), 1286-1294 (2012).
- Witkiewicz, A. K., et al. Integrated Patient-Derived Models Delineate Individualized Therapeutic Vulnerabilities of Pancreatic Cancer. Cell Reports. , (2016).
- Nicolle, R., et al. Pancreatic Adenocarcinoma Therapeutic Targets Revealed by Tumor-Stroma Cross-Talk Analyses in Patient-Derived Xenografts. Cell Reports. , (2017).
- Spear, S., et al. Discrepancies in the Tumor Microenvironment of Spontaneous and Orthotopic Murine Models of Pancreatic Cancer Uncover a New Immunostimulatory Phenotype for B Cells. Frontiers in Immunology. 10, 542(2019).
- Zhu, Y., et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models. Cancer Research. , (2014).
- Lee, J. J., Huang, J., England, C. G., McNally, L. R., Frieboes, H. B. Predictive Modeling of In vivo Response to Gemcitabine in Pancreatic Cancer. PLoS Computational Biology. , (2013).
- Clark, C. E., et al. Dynamics of the Immune Reaction to Pancreatic Cancer from Inception to Invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Fukunaga, A., et al. CD8+ tumor-infiltrating lymphocytes together with CD4+ tumor-infiltrating lymphocytes and dendritic cells improve the prognosis of patients with pancreatic adenocarcinoma. Pancreas. 28 (1), 26-31 (2004).
- Tewari, N., et al. The presence of tumor-associated lymphocytes confers a good prognosis in pancreatic ductal adenocarcinoma: an immunohistochemical study of tissue microarrays. BMC Cancer. 13 (1), 436(2013).
- Royal, R. E., et al. Phase 2 Trial of Single Agent Ipilimumab (Anti-CTLA-4) for Locally Advanced or Metastatic Pancreatic Adenocarcinoma. Journal of Immunotherapy. 33 (8), 828-833 (2010).
- Brahmer, J. R., et al. Safety and Activity of Anti–PD-L1 Antibody in Patients with Advanced Cancer. New England Journal of Medicine. 366 (26), 2455-2465 (2012).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Beatty, G. L., et al. CD40 Agonists Alter Tumor Stroma and Show Efficacy Against Pancreatic Carcinoma in Mice and Humans. Science. 331 (6024), 1612-1616 (2011).
- Lutz, E. R., et al. Immunotherapy converts nonimmunogenic pancreatic tumors into immunogenic foci of immune regulation. Cancer Immunology Research. 2 (7), 616-631 (2014).
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews. Immunology. 2 (6), 401-409 (2002).
- Mojic, M., Takeda, K., Hayakawa, Y. The dark side of IFN-γ: Its role in promoting cancer immunoevasion. International Journal of Molecular Sciences. , (2018).
- Castro, F., Cardoso, A. P., Gonçalves, R. M., Serre, K., Oliveira, M. J. Interferon-gamma at the crossroads of tumor immune surveillance or evasion. Frontiers in Immunology. , (2018).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nature Immunology. , (2011).
- Betts, M. R., et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. Journal of Immunological Methods. 281 (1-2), 65-78 (2003).
- Schuerwegh, A. J., De Clerck, L. S., Bridts, C. H., Stevens, W. J. Comparison of intracellular cytokine production with extracellular cytokine levels using two flow cytometric techniques. Cytometry. 55 (1), 52-58 (2003).
- Partecke, L. I., et al. A syngeneic orthotopic murine model of pancreatic adenocarcinoma in the C57/BL6 mouse using the panc02 and 6606PDA cell lines. European Surgical Research. , (2011).
- An, X., et al. Immunophenotyping of Orthotopic Homograft (Syngeneic) of Murine Primary KPC Pancreatic Ductal Adenocarcinoma by Flow Cytometry. Journal of Visualized Experiments. (140), (2018).
- Jiang, Y. J., et al. Establishment of an orthotopic pancreatic cancer mouse model: Cells suspended and injected in Matrigel. World Journal of Gastroenterology. , (2014).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. , (2017).
- Liu, Q., et al. Effects of enzymatic digestion, cell culture and preservation conditions on surface CD62L expression of primary murine CD3+CD4+T cells. Biomedical Research (India). 29 (10), 2153-2159 (2018).
- Seaman, S. A., Tannan, S. C., Cao, Y., Peirce, S. M., Lin, K. Y. Differential effects of processing time and duration of collagenase digestion on human and murine fat grafts. Plastic and Reconstructive Surgery. , (2015).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. EMBO Journal. , (2013).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. , (2015).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Scientific Reports. , (2019).
- Moran, A. E., Polesso, F., Weinberg, A. D. Immunotherapy Expands and Maintains the Function of High-Affinity Tumor-Infiltrating CD8 T Cells In Situ. The Journal of Immunology. , (2016).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. , (2015).
- Singh, M., et al. High-throughput targeted long-read single cell sequencing reveals the clonal and transcriptional landscape of lymphocytes. Nature Communications. 10 (1), 3120(2019).
- Jiang, N., Schonnesen, A. A., Ma, K. Y. Opinion Ushering in Integrated T Cell Repertoire Profiling in Cancer. Trends in Cancer. 5, 85-94 (2019).
- Schietinger, A., et al. Tumor-Specific T Cell Dysfunction Is a Dynamic Antigen-Driven Differentiation Program Initiated Early during Tumorigenesis. Immunity. 45 (2), 389-401 (2016).
- Raghav, S. K., et al. Exhaustion of tumor-specific CD8+ T cells in metastases from melanoma patients. Journal of Clinical Investigation. , (2011).
- Gros, A., et al. PD-1 identifies the patient-specific in filtrating human tumors. The Journal of Clinical Investigation. , (2014).
- Miller, B. C., et al. Subsets of exhausted CD8 + T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. , (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены