Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie du flux sanguin avec Ultrafast Doppler
Dans cet article
Résumé
Ce protocole montre comment appliquer l’imagerie doppler ultrason ultra-pur pour quantifier les flux sanguins. Après une longue acquisition de 1 s, l’expérimentateur a accès à un film de plein champ de vision avec des valeurs de vitesse axiaale pour chaque pixel chaque ≈0,3 ms (selon l’heure d’échographie du vol).
Résumé
L’effet pulsed-Doppler est la principale technique utilisée dans l’échographie clinique pour évaluer le flux sanguin. Appliqué avec des ultrasons ciblés conventionnels doppler modes, il a plusieurs limites. Tout d’abord, une opération de filtrage du signal finement réglée est nécessaire pour distinguer les flux sanguins des tissus mobiles environnants. Deuxièmement, l’opérateur doit choisir entre la localisation des flux sanguins ou leur quantification. Au cours des deux dernières décennies, l’imagerie par ultrasons a subi un changement de paradigme avec l’émergence de l’échographie ultrafast à l’aide d’ondes nonfocused. En plus d’une cent fois plus de framerate (jusqu’à 10000 Hz), cette nouvelle technique rompt également le compromis de quantification/localisation conventionnelle, offrant une cartographie complète du flux sanguin du champ de vision et un accès simultané à des mesures de vitesses fines au niveau d’un seul pixel (jusqu’à 50 μm). Cette continuité des données dans les dimensions spatiales et temporelles améliore fortement le processus de filtrage tissulaire/sanguin, ce qui entraîne une sensibilité accrue aux petites vitesses du flux sanguin (jusqu’à 1 mm/s). Dans ce document de méthode, nous visons à introduire le concept de Doppler ultrafast ainsi que ses paramètres principaux. Tout d’abord, nous résumons les principes physiques de l’imagerie par ondes non recentrée. Ensuite, nous présentons les étapes principales du traitement du signal Doppler. En particulier, nous expliquons la mise en œuvre pratique des algorithmes critiques de séparation des tissus et du flux sanguin et sur l’extraction des vitesses à partir de ces données filtrées. Cette description théorique est complétée par des expériences in vitro. Un fantôme de tissu intégrant un canal avec le fluide sang-imitant coulant est imité avec un système programmable d’ultrason de recherche. Une image de flux sanguin est obtenue et les caractéristiques de flux sont affichées pour plusieurs pixels dans le canal. Enfin, un examen des applications in vivo est proposé, montrant des exemples dans plusieurs organes tels que les carotides, les reins, la thyroïde, le cerveau et le cœur.
Introduction
L’imagerie par ultrasons est l’une des techniques d’imagerie les plus couramment utilisées dans la pratique clinique et les activités de recherche. La combinaison de l’émission d’ondes ultrasoniques dans les tissus biologiques suivie de l’enregistrement des échos rétrocâpés permet la reconstruction d’images anatomiques, le soi-disant « B-Mode ». Cette méthode est parfaitement adaptée à l’imagerie des tissus mous, tels que les tissus biologiques, qui permettent généralement la pénétration d’ultrasons sur plusieurs centimètres, avec une vitesse de propagation de ≈1540 m/s. Selon la fréquence centrale de la sonde à ultrasons, des images avec une résolution de 30 μm à 1 mm sont obtenues. En outre, il est bien connu que le mouvement d’une source acoustique, affecte les caractéristiques physiques des ondes associées. En particulier, le lien entre les changements de fréquence d’une vague par rapport à la vitesse de sa source est décrit comme l’effet Doppler1, dont la manifestation la plus simple est le pas changeant de la sirène d’une ambulance en mouvement. L’imagerie par ultrasons a longtemps utilisé cet effet physique pour observer les globules rougesen mouvement 2, et il propose une variété de modes d’imagerie communément appelés « imagerie Doppler ». Ces modes permettent d’évaluer les flux sanguins dans des applications et des organes très différents, tels que le cerveau, le cœur, les reins ou les artères périphériques.
Fait remarquable, la plupart des systèmes d’échographie actuellement disponibles reposent sur la même technologie, appelée ultrasons conventionnels. Les principes sous-jacents sont les suivants : un faisceau acoustique insonifie le champ de vision et est balayé le long de l’ouverture du transducteur à ultrasons. Pour chaque position du faisceau, les échos sont enregistrés et convertis en une ligne de l’image finale. En déplaçant progressivement le faisceau le long du transducteur, tout le champ de vision peut être photographié ligne par ligne (figure 1, panneau gauche). Cette stratégie a été bien adaptée aux contraintes électriques et à la puissance de calcul qui prévalaient jusqu’au début du XXIe siècle. Néanmoins, il a plusieurs inconvénients. Parmi ceux-ci, le framerate final est limité à quelques centaines d’images par seconde par le processus de numérisation du faisceau. En termes de flux sanguin, ce framerate relativement faible affecte les vitesses maximales de débit qui peuvent être détectées, ce qui est dicté par les critères d’échantillonnage de Shannon-Nyquist3. De plus, doppler conventionnel doit faire face à un compromis complexe. Afin d’évaluer la vitesse du flux sanguin dans une région d’intérêt particulière (ROI), plusieurs échos provenant de ce retour sur investissement doivent être enregistrés successivement. Cela implique que le faisceau ultrasons est temporairement maintenu dans une position fixe. Plus l’ensemble d’écho est long, meilleure sera l’estimation de la vitesse pour ce retour sur investissement. Toutefois, pour produire une image complète du champ de vision, le faisceau doit scanner le support. Par conséquent, on peut sentir le conflit entre ces deux contraintes: tenir le faisceau pour évaluer précisément la vitesse le long d’une ligne, ou déplacer le faisceau pour produire une image. Les différents modes doppler conventionnels (c.-à-d. Color Doppler ou Pulse Wave Doppler) reflètent directement ce compromis. En règle générale, le Color Doppler produit une carte d’écoulement de faible fidélité utilisée pour localiserles navires 4,et le Pulse Wave Doppler est ensuite utilisé pour quantifier avec précision le débit d’un navireprécédemment identifié 5.
Ces deux limitations (faible taux d’encadrement et compromis localisation/quantification) sont surmontées par des techniques émergentes à très haut taux d’encadrement. Parmi ceux-ci, l’approche d’ouverturesynthétique 6 ou la technique de transmission multilline peuvent êtrecitées 7. Dans cette étude, nous nous concentrons sur la méthode d’échographie ultrafast. Introduite il y adeux décennies 8,9,10, cette méthode repose également sur l’émission/réception des ultrasons, mais avec un modèle radicalement différent. En effet, au lieu d’utiliser un faisceau focalisé à balayage, l’imagerie ultrafast utilise des ondes plane ou des ondes divergentes, qui sont capables d’insonner le champ de vision avec une seule émission. Suite à cette seule émission, l’électronique associée est également en mesure de recevoir et de traiter le grand nombre d’échos provenant de l’ensemble du champ de vision. À la fin, une image peut être reconstruite à partir d’un seul modèle d’émission/réception11 (figure 1, panneau droit). Ces émissions non recentrées peuvent avoir un faible rapport signal/bruit (SNR) en raison de la propagation de l’énergie acoustique. Ceci peut être abordé en émettant plusieurs ondes plane intitulées (ou ondes divergentes avec différentes sources) et en ajoutant les images résultantes. Cette méthode est appelée « composition cohérente »12. Deux conséquences majeures surgissent. Tout d’abord, le framerate ne dépend que de l’heure d’échographie du vol et peut atteindre des valeurs typiques de 1 à 10 kHz. Deuxièmement, cela assure la continuité des données dans les dimensions spatiales et temporelles, également appelée cohérence spatiotemporale. Le compromis localisation/quantification conventionnelle est ainsi rompu. Cette combinaison d’un framerate élevé et d’une cohérence spatiotemporale a un impact énorme sur la capacité de détecter les flux sanguins par ultrasons. Par rapport à l’échographie conventionnelle, l’échographie ultrafast fournit une caractérisation complète du flux sanguin3. Pratiquement, l’utilisateur a accès au cours du temps de vélocité dans chaque pixel de l’image, pendant toute la durée de l’acquisition (généralement ≈1 s), avec une échelle de temps donnée par le framerate (généralement, un framerate de 5 kHz pour une résolution temporelle de 200 μs). Ce framerate élevé rend la méthode appropriée pour un large éventail d’application telle que le flux rapide dans les organes mobiles comme les chambresde coeur 13 ou le myocarde avec la micro-perfusion coronaire14. En outre, il a été démontré que sa cohérence spatiotemporal améliore fortement sa capacité à séparer le flux sanguin lent des tissus mobiles de fond, augmentant ainsi la sensibilité au flux micro-vasculaire15. Cette capacité donne accès à la micro vascularisation du cerveau chez les animaux16 et les humains17.
Par conséquent, l’échographie ultrafast est bien adapté à la circulation sanguine de l’image dans une variété de situations. Il est limité aux tissus biologiques mous et sera fortement affecté par la présence d’interfaces dures telles que les os, ou la cavité gazeuse comme le poumon. L’accord des paramètres physiques de la séquence ultrasoniques permet d’étudier à la fois les débits lents (jusqu’à 1 mm/s11,16)et rapides (jusqu’à plusieurs m/s). Il existe un compromis entre la résolution spatiale et la profondeur de pénétration. En règle générale, une résolution de 50 μm peut être obtenue au prix d’une pénétration d’environ 5 mm. Inversement, la pénétration peut être étendue à 15-20 cm au prix d’une résolution de 1 mm. Il est à noter que la plupart des scanners ultrafast tels que celui utilisé dans cet article ne fournissent que des images 2D.
Ici, nous proposons un protocole simple pour introduire le concept d’imagerie Ultrafast Doppler, à l’aide d’un scanner à ultrasons de recherche programmable et doppler fantôme imitant un vaisseau (artère ou veine) intégré dans les tissus biologiques.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Doppler configuration de préparation fantôme (Figure 2A)
- Connectez la pompe périssaltique, le réservoir de liquide imitant le sang, l’amortisseur d’impulsions et le fantôme d’écoulement Doppler avec les tubes en plastique.
- Choisissez le canal d’un diamètre de 4 mm.
- Programmer la pompe pour éjecter 720 mL/min de liquide pendant 0,3 s, puis éjecter 50 mL/min pendant 0,7 s pour imiter respectivement les phases cardiaques systole et diastole
- Faites fonctionner la pompe et secouez doucement les tuyaux pour expulser les bulles d’air potentielles.
REMARQUE : L’opérateur peut choisir un diamètre de canal différent et un taux de pompe différent, mais devra s’assurer que la séquence d’ultrasons est assez rapide pour acquérir les vitesses de débit les plus rapides. Eq. 3 présenté plus tard peut aider à concevoir la séquence.
2. Configuration ultrafast de scanner d’ultrason (figure 2A)
- Connectez le scanner de recherche ultrafast-enabled à l’ordinateur hôte avec le lien express PCI.
- Changez l’adaptateur transducteur sur le scanner à ultrasons pour correspondre au connecteur de la sonde, puis connectez la sonde.
- Exécutez Matlab et activez la licence de scanner à ultrasons.
REMARQUE : Cette section et ce qui suit supposent implicitement l’utilisation d’un système Verasonics Vantage.
3. Programmation de séquence d’ultrason
- À l’aide des scripts d’exemples, concevoir une séquence « B- Mode » focalisée conventionnelle (c.-à-d. l’échographie) qui sera utilisée pour le positionnement de la sonde.
- Réglez la profondeur d’imagerie à 50 mm.
- Réglez la profondeur focale à 35 mm.
- À l’aide des scripts d’exemples, concevoir une séquence d’ultrasons ultra-rapide.
- Réglez la profondeur d’imagerie à 50 mm.
- Programme 3 ondes plane inclinées à [-3,0,3] degré.
- Réglez la fréquence de répétition des impulsions (PRF) à 12 kHz.
- Utilisez 4 demi-cycles pour la forme d’onde ultrasoniques, avec une fréquence centrale en fonction de la sonde utilisée. Une fréquence centrale de 5,2 MHz est supposée ici.
- Réglez la durée totale à 1 s.
4. Positionnement de sonde et acquisition de données
- Appliquez un gel à ultrasons sur la lentille de la sonde.
- Placez la sonde sur le fantôme et lancez la séquence d’ultrasons en mode B.
- Localisez le canal d’intérêt. Le fluide semble plus foncé que le tissu environnant. Placez la sonde dans une vue longitudinale.
- Maintenez manuellement la sonde dans la position d’intérêt.
- Terminez la séquence B-Mode et lancez le script d’acquisition de séquence ultrafast.
5. Reconstruction d’image( Figure 2B)
- Une fois la séquence terminée, enregistrez les données brutes (aussi appelées données radiofréquences, « RF »).
- Lancez le script de reconstruction d’image à l’aide du logiciel par défaut du système d’échographie. À la fin du processus, la matrice de données IQ doit être créée.
REMARQUE : Les échos ultrasons sont enregistrés sur chaque élément de la sonde et pour chaque émission/réception, puis stockés dans la matrice de données RF. La reconstruction de l’image a appliqué la loi de retard appropriée à chaque canal et donne lieu à la matrice dite « QI » (Phase/Quadrature). La matrice complexe de QI a trois dimensions : deux pour l’espace (profondeur et largeur d’image) et une pour le temps
6. Filtrage de l’encombrement( Figure 2C)
REMARQUE : Pour les étapes 6 à 7, voir le script Matlab fourni dans le matériel supplémentaire.
- Remodeler la matrice de QI 3D (espace x espace x temps) en matrice Casorati 2D (espace x temps), nommée IQr.
- Calculer la décomposition de valeur singulière15 d’IQr (Eq. 1).
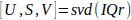 Eq. 1
Eq. 1 - Calculer la matrice de similitude spatiale C à l’aide des vecteurs singuliers spatiaux U tels que décrits par Baranger et coll.18 (II, D), et identifier les limites du sous-espace sanguin N.
- Utilisez cette coupure N pour filtrer les données de QI décrites dans Demene et coll.15 (II,C).
7. Visualisation des flux et mesures de la vitesse( Figure 2C)
- Calculer la puissance Doppler carte en intégrant l’enveloppe des données filtrées IQt le long de la dimension temporelle (Eq. 2). Les coordonnées 3D z, x et t sont respectivement la profondeur, la largeur et la dimension temporelle, nt et est le nombre d’images acquises.
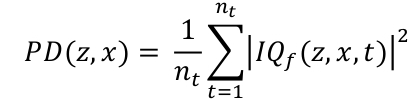 Eq. 2
Eq. 2 - Affichez la carte à l’échelle logarithm. Pour définir la plage dynamique, calculez la moyenne dans une région à l’extérieur du canal et utilisez cette valeur en dB comme limite inférieure de la plage dynamique. Une plage dynamique typique est [-30, 0] dB.
- Définissez une région circulaire d’intérêt (ROI) sur l’image, contenant de 1 à 30 pixels.
- Moyenne du signal IQf sur les pixels de ce roi, pour obtenir un vecteur de points de
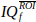 temps nt.
temps nt. - Calculez et affichez le spectrogramme Doppler
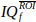 de , en utilisant la magnitude carrée de la transformation fourier de courte durée (STFT).
de , en utilisant la magnitude carrée de la transformation fourier de courte durée (STFT).- Réglez la fenêtre STFT sur une fenêtre Hann de 60 échantillons.
- Réglez le chevauchement STFT à 90% de la longueur de la fenêtre.
- Superposer la fréquence centrale à chaque point de temps du spectrogramme.
- Convertir les valeurs de fréquence f en vitesses axiales sanguines vz à l’aide de la formule Doppler (Eq. 3). c0 est la vitesse du son dans le milieu et fTW la fréquence centrale de la forme d’onde ultrasonée transmise (ici 5,2 MHz).
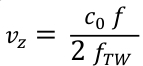 Eq. 3
Eq. 3
Access restricted. Please log in or start a trial to view this content.
Résultats
La qualité de l’acquisition et du post-traitement est d’abord évaluée par inspection visuelle. La forme du canal doit être clairement visible dans l’image doppler de puissance, et la zone tissulaire doit apparaître sombre. Si le signal Doppler de puissance n’est pas limité au canal, cela peut signifier que soit l’étape du filtre d’encombrement a mal tourné (seuil SVD est trop faible), ou la sonde a connu un fort mouvement au cours de l’acquisition.
Après inspection visue...
Access restricted. Please log in or start a trial to view this content.
Discussion
Plusieurs variations sont possibles autour du cadre principal de ce protocole.
Problèmes matériels
Si l’utilisateur fournit son ordinateur hôte personnalisé, la carte mère et le boîtier de l’ordinateur doivent avoir une fente express PCI disponible. Le Processeur doit également avoir suffisamment de voies PCIe pour gérer tous les appareils.
Sélection de sondes
La sonde à ultrasons (également appelée transducteu...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflit d’intérêts
Remerciements
Nous tenons à remercier Shreya Shah pour sa relecture et ses conseils.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Blood-mimicking fluid | CIRS Inc, Norfolk, Virginia, USA | 069DTF | |
| Doppler flow phantom | CIRS Inc, Norfolk, Virginia, USA | ATS523A | |
| Matlab | MathWorks, Natick, Massachusetts, United States | ||
| Peristaltic pump / Doppler flow pump | CIRS Inc, Norfolk, Virginia, USA | 769 | Include tubings and pulse dampener |
| Transducer adpter | Verasonics, Kirkland, Washington, USA | UTA 408-GE | |
| Ultrafast ultrasound research scanner | Verasonics, Kirkland, Washington, USA | Vantage 256 | |
| Ultrasound probe/transducer | GE Healthcare | GE 9L-D |
Références
- Doppler, C. Ueber das farbige Licht der Doppelsterne und einiger anderer Gestirne des Himmels. , (2020).
- Bonnefous, O., Pesqué, P. Time domain formulation of pulse-Doppler ultrasound and blood velocity estimation by cross correlation. Ultrasonic Imaging. 8 (2), 73-85 (2004).
- Bercoff, J., et al. Ultrafast compound doppler imaging: Providing full blood flow characterization. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 58 (1), 134-147 (2011).
- Evans, D. H., Jensen, J. A., Nielsen, M. B. Ultrasonic colour Doppler imaging. Interface Focus. 1 (4), 490-502 (2011).
- Nuffer, Z., Rupasov, A., Bekal, N., Murtha, J., Bhatt, S. Spectral Doppler ultrasound of peripheral arteries: a pictorial review. Clinical Imaging. 46, 91-97 (2017).
- Jensen, J. A., Nikolov, S. I., Gammelmark, K. L., Pedersen, M. H. Synthetic aperture ultrasound imaging. Ultrasonics. 44, SUPPL (2006).
- Tong, L., Ramalli, A., Jasaityte, R., Tortoli, P., D'Hooge, J. Multi-transmit beam forming for fast cardiac imaging-experimental validation and in vivo application. IEEE Transactions on Medical Imaging. 33 (6), 1205-1219 (2014).
- Tanter, M., Bercoff, J., Sandrin, L., Fink, M. Ultrafast compound imaging for 2-D motion vector estimation: application to transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 49 (10), 1363-1374 (2002).
- Udesen, J., et al. High frame-rate blood vector velocity imaging using plane waves: Simulations and preliminary experiments. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 55 (8), 1729-1743 (2008).
- Hansen, K. L., Udesen, J., Gran, F., Jensen, J. A., Bachmann Nielsen, M. In-vivo examples of flow patterns with the fast vector velocity ultrasound method. Ultraschall in der Medizin. 30 (5), Stuttgart, Germany. 471-477 (2009).
- Tanter, M., Fink, M. Ultrafast imaging in biomedical ultrasound. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (1), 102-119 (2014).
- Montaldo, G., Tanter, M., Bercoff, J., Benech, N., Fink, M. Coherent plane-wave compounding for very high frame rate ultrasonography and transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 56 (3), 489-506 (2009).
- Papadacci, C., Pernot, M., Couade, M., Fink, M., Tanter, M. High-contrast ultrafast imaging of the heart. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (2), 288-301 (2014).
- Maresca, D., et al. Noninvasive Imaging of the Coronary Vasculature Using Ultrafast Ultrasound. JACC: Cardiovascular Imaging. 11 (6), 798-808 (2018).
- Demené, C., et al. Spatiotemporal Clutter Filtering of Ultrafast Ultrasound Data Highly Increases Doppler and fUltrasound Sensitivity. IEEE Transactions on Medical Imaging. 34 (11), 2271-2285 (2015).
- Demené, C., et al. 4D microvascular imaging based on ultrafast Doppler tomography. NeuroImage. 127, 472-483 (2016).
- Demené, C., et al. Ultrafast Doppler reveals the mapping of cerebral vascular resistivity in neonates. Journal of Cerebral Blood Flow and Metabolism. 34 (6), 1009-1017 (2014).
- Baranger, J., Arnal, B., Perren, F., Baud, O., Tanter, M., Demene, C. Adaptive Spatiotemporal SVD Clutter Filtering for Ultrafast Doppler Imaging Using Similarity of Spatial Singular Vectors. IEEE Transactions on Medical Imaging. 37 (7), 1574-1586 (2018).
- Demené, C., et al. Ultrafast Doppler Reveals the Mapping of Cerebral Vascular Resistivity in Neonates. Journal of Cerebral Blood Flow & Metabolism. 34 (6), 1009-1017 (2014).
- Goudot, G., et al. Wall Shear Stress Measurement by Ultrafast Vector Flow Imaging for Carotid Stenosis. Ultraschall in der Medizin - European Journal of Ultrasound. , (2019).
- Demené, C., Mairesse, J., Baranger, J., Tanter, M., Baud, O. Ultrafast Doppler for neonatal brain imaging. NeuroImage. 185, 851-856 (2019).
- Villemain, O., et al. Ultrafast Ultrasound Imaging in Pediatric and Adult Cardiology. JACC: Cardiovascular Imaging. , (2019).
- Provost, J., Papadacci, C., Demene, C., Gennisson, J. L., Tanter, M., Pernot, M. 3-D ultrafast doppler imaging applied to the noninvasive mapping of blood vessels in Vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 62 (8), 1467-1472 (2015).
- Osmanski, B. F., Montaldo, G., Fink, M., Tanter, M. In vivo out-of-plane Doppler imaging based on ultrafast plane wave imaging. IEEE International Ultrasonics Symposium, IUS. 62 (4), 76-79 (2013).
- Kim, M. W., Zhu, Y., Hedhli, J., Dobrucki, L. W., Insana, M. F. Multi-dimensional Clutter Filter Optimization for Ultrasonic Perfusion Imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 65 (11), 2020-2029 (2018).
- Chau, G., Li, Y. L., Jakovljevic, M., Dahl, J., Rodr, P. Wall Clutter Removal in Doppler Ultrasound using Principal Component Pursuit. , (2018).
- Tierney, J., Baker, J., Brown, D., Wilkes, D., Byram, B. Independent Component-Based Spatiotemporal Clutter Filtering for Slow Flow Ultrasound. IEEE Transactions on Medical Imaging. , 1-1 (2019).
- Zhang, N., Rivaz, H. Clutter Suppression in Ultrasound: Performance Evaluation and Review of Low-Rank and Sparse Matrix Decomposition Methods. BioMedical Engineering Online. 19, 37(2020).
- Guidi, G., Licciardello, C., Falteri, S. Intrinsic spectral broadening (ISB) in ultrasound Doppler as a combination of transit time and local geometrical broadening. Ultrasound in Medicine and Biology. 26 (5), 853-862 (2000).
- Cloutier, G., Shung, K. K., Durand, L. G. Experimental Evaluation of Intrinsic and Nonstationary Ultrasonic Doppler Spectral Broadening in Steady and Pulsatile Flow Loop Models. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 40 (6), 786-795 (1993).
- Winkler, A. J., Wu, J. Correction of intrinsic spectral broadening errors in doppler peak velocity measurements made with phased sector and linear array transducers. Ultrasound in Medicine and Biology. 21 (8), 1029-1035 (1995).
- Osmanski, B. F., Bercoff, J., Montaldo, G., Loupas, T., Fink, M., Tanter, M. Cancellation of Doppler intrinsic spectral broadening using ultrafast Doppler imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (8), 1396-1408 (2014).
- Sauvage, J., et al. A large aperture row column addressed probe for in vivo 4D ultrafast doppler ultrasound imaging. Physics in Medicine and Biology. 63 (21), (2018).
- Correia, M., Provost, J., Tanter, M., Pernot, M. 4D ultrafast ultrasound flow imaging: in vivo quantification of arterial volumetric flow rate in a single heartbeat. Physics in Medicine and Biology. 61 (23), 48-61 (2016).
- Center for Devices and Radiological Health. FDA Information for Manufacturers Seeking Marketing Clearance of Diagnostic Ultrasound Systems and Transducers. Center for Devices and Radiological Health. , FDA-2017-D-5372 (2008).
- I, IEC. IEC 62127-1 - Measurement and characterization of medical ultrasonic fields up to 40 MHz. IEC. , 61010-61011 (2013).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon