È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging del flusso sanguigno con Doppler ultraveloce
In questo articolo
Riepilogo
Questo protocollo mostra come applicare l'imaging Doppler ad ultrasuoni ultraveloce per quantificare i flussi sanguigni. Dopo un'acquisizione lunga 1 s, lo sperimentatore ha accesso a un filmato dell'intero campo visivo con valori di velocità assiale per ogni pixel ogni ≈0,3 ms (a seconda del tempo di volo ad ultrasuoni).
Abstract
L'effetto pulsato-Doppler è la tecnica principale utilizzata nell'ecografia clinica per valutare il flusso sanguigno. Applicato con le modalità Doppler ad ultrasuoni focalizzate convenzionali, ha diversi limiti. In primo luogo, è necessaria un'operazione di filtraggio del segnale finemente ottimizzata per distinguere i flussi sanguigni dai tessuti in movimento circostanti. In secondo luogo, l'operatore deve scegliere tra localizzare i flussi sanguigni o quantificarli. Negli ultimi due decenni, l'imaging ad ultrasuoni ha subito un cambiamento di paradigma con l'emergere di ultrasuoni ultraveloce utilizzando onde sfocate. Oltre a un aumento di cento volte della frequenza dei fotogrammi (fino a 10000 Hz), questa nuova tecnica rompe anche il compromesso convenzionale di quantificazione /localizzazione, offrendo una mappatura completa del flusso sanguigno del campo visivo e un accesso simultaneo alle misurazioni delle velocità fini a livello di un singolo pixel (fino a 50 μm). Questa continuità dei dati sia nelle dimensioni spaziali che temporali migliora fortemente il processo di filtraggio tessuto/sangue, il che si traduce in un aumento della sensibilità alle piccole velocità del flusso sanguigno (fino a 1 mm/s). In questo documento di metodo, miriamo a introdurre il concetto di Doppler ultraveloce e i suoi parametri principali. In primo luogo, riassumiamo i principi fisici dell'imaging delle onde non focalizzato. Quindi, presentiamo i passaggi principali di elaborazione del segnale Doppler. In particolare, spieghiamo l'implementazione pratica degli algoritmi critici di separazione tessuto/flusso sanguigno e sull'estrazione delle velocità da questi dati filtrati. Questa descrizione teorica è integrata da esperienze in vitro. Un fantasma tissutale che incorpora un canale con fluido che imita il sangue scorre è immaginato con un sistema di ultrasuoni programmabile di ricerca. Si ottiene un'immagine del flusso sanguigno e le caratteristiche del flusso vengono visualizzate per diversi pixel nel canale. Infine, viene proposta una revisione delle applicazioni in vivo, mostrando esempi in diversi organi come carotidi, reni, tiroide, cervello e cuore.
Introduzione
L'imaging ad ultrasuoni è una delle tecniche di imaging più comunemente utilizzate nella pratica clinica e nelle attività di ricerca. La combinazione di emissione di onde ultrasoniche nei tessuti biologici seguita dalla registrazione degli echi retroscatterati consente la ricostruzione delle immagini anatomiche, la cosiddetta "B-Mode". Questo metodo è perfettamente adattato per l'imaging dei tessuti molli, come i tessuti biologici, che in genere consentono la penetrazione di ultrasuoni su diversi centimetri, con una velocità di propagazione di ≈1540 m /s. A seconda della frequenza centrale della sonda ad ultrasuoni, si ottengono immagini con una risoluzione da 30 μm a 1 mm. Inoltre, è ben noto che il moto di una sorgente acustica, influenza le caratteristiche fisiche delle onde associate. In particolare, il legame tra gli spostamenti di frequenza di un'onda rispetto alla velocità della sua sorgente è descritto come l'effetto Doppler1, la cui manifestazione più semplice è il passo della sirena che cambia di un'ambulanza in movimento. L'imaging ad ultrasuoni ha utilizzato a lungo questo effetto fisico per osservare i globulirossi in movimento 2e propone una varietà di modalità di imaging comunemente etichettate come "Imaging Doppler". Queste modalità consentono la valutazione dei flussi sanguigni in applicazioni e organi molto diversi, come cervello, cuore, reni o arterie periferiche.
Sorprendentemente, la maggior parte dei sistemi ad ultrasuoni attualmente disponibili si basa sulla stessa tecnologia, definita ultrasuoni convenzionali. I principi alla base sono i seguenti: un fascio acustico insonizza il campo visivo e viene spazzato lungo l'apertura del trasduttore ad ultrasuoni. Per ogni posizione del fascio, gli echi vengono registrati e convertiti in una linea dell'immagine finale. Spostando progressivamente il fascio lungo il trasduttore, l'intero campo visivo può essere immaginato riga per riga (Figura 1, pannello sinistro). Questa strategia era ben adattata ai vincoli elettrici e alla potenza di calcolo prevalente fino all'inizio del 21 ° secolo. Tuttavia, ha diversi inconvenienti. Tra questi, la frequenza fotogrammi finale è limitata a poche centinaia di immagini al secondo dal processo di scansione del fascio. In termini di flusso sanguigno, questa frequenza fotogrammi relativamente bassa influisce sulle velocità massime del flusso che possono essere rilevate, che è dettata dai criteri di campionamento di Shannon-Nyquist3. Inoltre, doppler convenzionale deve affrontare un compromesso complesso. Per valutare la velocità del flusso sanguigno in una particolare regione di interesse (ROI), è necessario registrare successivamente diversi echi provenienti da tale ROI. Ciò implica che il fascio ad ultrasuoni viene temporaneamente mantenuto in posizione fissa. Più lungo è l'insieme dell'eco, migliore sarà la stima della velocità per quel ROI. Tuttavia, per produrre un'immagine completa del campo visivo, il fascio deve scansionare il mezzo. Pertanto, si può percepire il conflitto tra questi due vincoli: tenere il fascio per valutare con precisione la velocità lungo una linea, o spostare il fascio per produrre un'immagine. Le diverse modalità Doppler convenzionali (ad esempio, Color Doppler o Pulse Wave Doppler) riflettono direttamente questo compromesso. In genere, Color Doppler produce una mappa di flusso a bassa fedeltà utilizzata per localizzare ivasi 4e Pulse Wave Doppler viene quindi utilizzato per quantificare con precisione il flusso in una nave5 precedentemente identificata.
Queste due limitazioni (basso framerate e compromesso di localizzazione/quantificazione) sono superate con tecniche emergenti ad altissima frequenza. Tra questi, l'approccio diapertura sintetica 6 o la tecnica di trasmissione multilinea possono esserecitati 7. In questo studio, ci concentriamo sul cosiddetto metodo ad ultrasuoni Ultrafast. Introdotto due decenni fa8,9,10, questo metodo si basa anche sull'emissione / ricezione degli ultrasuoni, ma con un modello radicalmente diverso. Infatti, invece di utilizzare un fascio focalizzato a scansione, l'imaging ultraveloce utilizza onde piane o onde divergenti, che sono in grado di insonificare il campo visivo con una singola emissione. A seguito di questa singola emissione, l'elettronica associata è anche in grado di ricevere ed elaborare l'enorme numero di echi provenienti da tutto il campo visivo. Alla fine, un'immagine può essere ricostruita da un singolo modello di emissione/ricezione11 (Figura 1,pannello destro). Queste emissioni non focalizzate possono avere un basso rapporto segnale/rumore (SNR) a causa della diffusione dell'energia acustica. Questo può essere affrontato emettendo diverse onde piane intitolate (o onde divergenti con fonti diverse) e aggiungendo le immagini risultanti. Questo metodo è denominato "compounding coerente"12. Ne derivano due conseguenze principali. In primo luogo, la frequenza dei fotogrammi dipende solo dal tempo di volo degli ultrasuoni e può raggiungere valori tipici da 1 a 10 kHz. In secondo luogo, ciò garantisce la continuità dei dati sia in dimensione spaziale che temporale, definita anche coerenza spaziotemporale. Il compromesso convenzionale di localizzazione/quantificazione viene quindi interrotto. Questa combinazione di un'elevata frequenza di fotogrammi e coerenza spaziotemporale ha un enorme impatto sulla capacità di rilevare i flussi sanguigni con ultrasuoni. Rispetto agli ultrasuoni convenzionali, gli ultrasuoni ultraveloce forniscono una caratterizzazione completa del flussosanguigno 3. In pratica, l'utente ha accesso al corso del tempo di velocità in ogni pixel dell'immagine, per l'intera durata dell'acquisizione (tipicamente ≈1 s), con una scala cronologica data dalla frequenza dei fotogrammi (tipicamente, una frequenza fotogrammi di 5 kHz per una risoluzione temporale di 200 μs). Questo alto framerate rende il metodo adatto per una vasta gamma di applicazioni come il flusso rapido in organi in movimentocome camere cardiache 13 o miocardio con la micro-perfusione coronarica14. Inoltre, è stato dimostrato che la sua coerenza spaziotemporale migliora fortemente la sua capacità di separare il flusso sanguigno lento dai tessuti in movimento di fondo, aumentando così la sensibilità al flussomicro-vascolare 15. Questa capacità dà accesso alla microvascolarizzazione del cervello sia negli animali16 che nell'uomo17.
Pertanto, gli ultrasuoni ultraveloci sono adatti per il flusso sanguigno dell'immagine in una varietà di situazioni. È limitato ai tessuti biologici molli e sarà fortemente influenzato dalla presenza di interfacce dure come ossa o cavità gassoso come il polmone. La messa a punto dei parametri fisici della sequenza ecografica consente lo studio sia di flussi lenti (fino a 1 mm/s11,16) che veloci (fino a diversi m/s). Esiste un compromesso tra la risoluzione spaziale e la profondità di penetrazione. Tipicamente, una risoluzione di 50 μm può essere raggiunta al costo di una penetrazione di circa 5 mm. Al contrario, la penetrazione può essere estesa a 15-20 cm al costo di una risoluzione di 1 mm. Vale la pena notare che la maggior parte degli scanner ultraveloci come quello utilizzato in questo articolo forniscono solo immagini 2D.
Qui, proponiamo un semplice protocollo per introdurre il concetto di imaging Doppler ultraveloce, utilizzando uno scanner ad ultrasuoni di ricerca programmabile e un fantasma Doppler che imita un vaso (arteria o vena) incorporato nel tessuto biologico.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Configurazione della preparazione fantasma doppler (Figura 2A)
- Collegare la pompa peristaltica, il serbatoio del fluido imitante del sangue, lo smorzatore di impulsi e il fantasma del flusso Doppler con i tubi di plastica.
- Scegli il canale con un diametro di 4 mm.
- Programmare la pompa per espellere 720 mL/min di liquido per 0,3 s e quindi espellere 50 mL/min per 0,7 s per imitare rispettivamente le fasi cardiache sistole e diastole
- Far funzionare la pompa e scuotere delicatamente i tubi per espellere potenziali bolle d'aria.
NOTA: L'operatore può scegliere un diametro del canale diverso e una velocità di pompaggio diversa, ma dovrà assicurarsi che la sequenza ad ultrasuoni sia abbastanza veloce da acquisire le velocità di flusso più veloci. Eq. 3 presentato in seguito può aiutare a progettare la sequenza.
2. Configurazione dello scanner ad ultrasuoni ultraveloce(Figura 2A)
- Collegare lo scanner di ricerca ultraveloce al computer host con il collegamento PCI express.
- Cambiare l'adattatore del trasduttore sullo scanner ad ultrasuoni in modo che corrisponda al connettore della sonda, quindi collegare la sonda.
- Eseguire Matlab e attivare la licenza dello scanner ad ultrasuoni.
NOTA: Questa sezione e quanto segue assumono implicitamente l'uso di un sistema Verasonics Vantage.
3. Programmazione di sequenze ad ultrasuoni
- Utilizzando gli script degli esempi, progettare una sequenza convenzionale focalizzata "B-Mode" (cioè ecografia) che verrà utilizzata per il posizionamento della sonda.
- Impostare la profondità di imaging su 50 mm.
- Impostare la profondità focale su 35 mm.
- Utilizzando gli script degli esempi, progetta una sequenza di ultrasuoni ultraveloce.
- Impostare la profondità di imaging su 50 mm.
- Programma 3 onde piane inclinate a [-3,0,3] grado.
- Impostare la frequenza di ripetizione dell'impulso (PRF) su 12 kHz.
- Utilizzare 4 semicicli per la forma d'onda ad ultrasuoni, con una frequenza centrale a seconda della sonda utilizzata. Qui si assume una frequenza centrale di 5,2 MHz.
- Impostare la durata totale su 1 s.
4. Posizionamento sonda e acquisizione dati
- Applicare il gel ad ultrasuoni sull'obiettivo della sonda.
- Posizionare la sonda sul fantasma e avviare la sequenza di ultrasuoni B-Mode.
- Individua il canale di interesse. Il fluido appare più scuro del tessuto circostante. Posizionare la sonda in vista longitudinale.
- Mantenere manualmente la sonda nella posizione di interesse.
- Termina la sequenza B-Mode e avvia lo script di acquisizione della sequenza ultraveloce.
5. Ricostruzione dell'immagine( Figura 2B)
- Una volta terminata la sequenza, salvare i dati grezzi (chiamati anche dati a radiofrequenza, "RF").
- Avviare lo script di ricostruzione delle immagini utilizzando il software predefinito del sistema ad ultrasuoni. Al termine del processo, è necessario creare la matrice di dati QI.
NOTA: Gli echi ecografico vengono registrati su ogni elemento della sonda e per ogni emissione/ricezione, quindi memorizzati nella matrice di dati RF. La ricostruzione dell'immagine ha applicato la legge di ritardo appropriata a ciascun canale e si traduce nella cosiddetta matrice "QI" (In-Phase/Quadrature). La complessa matrice QI ha tre dimensioni: due per lo spazio (profondità e larghezza dell'immagine) e una per il tempo
6. Filtraggio degli ingombro(figura 2C)
NOTA: Per i passaggi da 6 a 7, vedere lo script Matlab fornito nel materiale supplementare.
- Rimodellare la matrice IQ 3D (spazio x spazio x tempo) in una matrice Casorati 2D (spazio x ora), denominata IQr.
- Calcolare la decomposizione del valore singolare15 di IQr (Eq. 1).
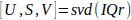 Eq. 1
Eq. 1 - Calcola la matrice di somiglianza spaziale C usando i vettori spaziali singolari U come descritto da Baranger etal.
- Utilizzare questo cutoff N per filtrare i dati del QI come descritto in Demene etal.
7. Visualizzazione del flusso e misurazioni della velocità (Figura 2C)
- Potenza di calcolo Doppler mappa PD integrando l'inviluppo dei dati filtrati QIt lungo la dimensione temporale (Eq. 2). Le coordinate 3D z, x e t sono rispettivamente la profondità, la larghezza e la dimensione temporale, nt e è il numero di fotogrammi acquisiti.
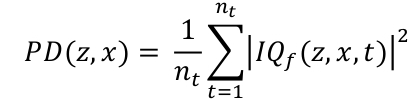 Eq. 2
Eq. 2 - Visualizzare la mappa PD in scala logaritmica. Per impostare l'intervallo dinamico, calcolare la PD media in una regione al di fuori del canale e utilizzare questo valore in dB come limite inferiore dell'intervallo dinamico. Un intervallo dinamico tipico è [-30, 0] dB.
- Definire un'area circolare di interesse (ROI) sull'immagine, contenente da 1 a 30 pixel.
- Media del segnale FQI sui pixel di quel ROI, per ottenere un vettore
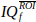 di nt punti di tempo.
di nt punti di tempo. - Calcola e visualizza lo spettrogramma Doppler di
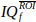 , utilizzando la grandezza quadrata della trasformata di Fourier a tempo breve (STFT).
, utilizzando la grandezza quadrata della trasformata di Fourier a tempo breve (STFT).- Impostare la finestra STFT su una finestra Hann da 60 campioni.
- Impostate la sovrapposizione STFT sul 90% della lunghezza della finestra.
- Sovrapporre la frequenza centrale in ogni punto del tempo dello spettrogramma.
- Convertire i valori di frequenza f in velocità assiali del sangue vz usando la formula doppler (Eq. 3). c0 è la velocità del suono nel mezzo e fTW la frequenza centrale della forma d'onda ad ultrasuoni trasmessa (qui 5,2 MHz).
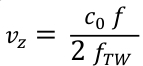 Eq. 3
Eq. 3
Access restricted. Please log in or start a trial to view this content.
Risultati
La qualità dell'acquisizione e della post-elaborazione viene prima valutata mediante ispezione visiva. La forma del canale deve essere chiaramente visibile nell'immagine doppler di potenza e l'area del tessuto deve apparire scura. Se il segnale Doppler di potenza non è limitato al canale, può significare che il passo del filtro del disordine è andato storto (la soglia SVD è troppo bassa), o la sonda ha sperimentato un forte movimento durante l'acquisizione.
Dopo l'ispezione visiva, lo stu...
Access restricted. Please log in or start a trial to view this content.
Discussione
Sono possibili diverse varianti intorno al frame principale di questo protocollo.
Problemi hardware
Se l'utente fornisce il proprio computer host personalizzato, la scheda madre e la custodia del computer devono avere uno slot espresso PCI disponibile. La CPU deve anche avere abbastanza corsie PCIe per gestire tutti i dispositivi.
Selezione sonda
La sonda ad ultrasuoni (chiamata anche trasduttore) viene scelta in base alla ris...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi
Riconoscimenti
Vorremmo ringraziare Shreya Shah per la sua correzione di bozze e i suoi consigli.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Blood-mimicking fluid | CIRS Inc, Norfolk, Virginia, USA | 069DTF | |
| Doppler flow phantom | CIRS Inc, Norfolk, Virginia, USA | ATS523A | |
| Matlab | MathWorks, Natick, Massachusetts, United States | ||
| Peristaltic pump / Doppler flow pump | CIRS Inc, Norfolk, Virginia, USA | 769 | Include tubings and pulse dampener |
| Transducer adpter | Verasonics, Kirkland, Washington, USA | UTA 408-GE | |
| Ultrafast ultrasound research scanner | Verasonics, Kirkland, Washington, USA | Vantage 256 | |
| Ultrasound probe/transducer | GE Healthcare | GE 9L-D |
Riferimenti
- Doppler, C. Ueber das farbige Licht der Doppelsterne und einiger anderer Gestirne des Himmels. , (2020).
- Bonnefous, O., Pesqué, P. Time domain formulation of pulse-Doppler ultrasound and blood velocity estimation by cross correlation. Ultrasonic Imaging. 8 (2), 73-85 (2004).
- Bercoff, J., et al. Ultrafast compound doppler imaging: Providing full blood flow characterization. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 58 (1), 134-147 (2011).
- Evans, D. H., Jensen, J. A., Nielsen, M. B. Ultrasonic colour Doppler imaging. Interface Focus. 1 (4), 490-502 (2011).
- Nuffer, Z., Rupasov, A., Bekal, N., Murtha, J., Bhatt, S. Spectral Doppler ultrasound of peripheral arteries: a pictorial review. Clinical Imaging. 46, 91-97 (2017).
- Jensen, J. A., Nikolov, S. I., Gammelmark, K. L., Pedersen, M. H. Synthetic aperture ultrasound imaging. Ultrasonics. 44, SUPPL (2006).
- Tong, L., Ramalli, A., Jasaityte, R., Tortoli, P., D'Hooge, J. Multi-transmit beam forming for fast cardiac imaging-experimental validation and in vivo application. IEEE Transactions on Medical Imaging. 33 (6), 1205-1219 (2014).
- Tanter, M., Bercoff, J., Sandrin, L., Fink, M. Ultrafast compound imaging for 2-D motion vector estimation: application to transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 49 (10), 1363-1374 (2002).
- Udesen, J., et al. High frame-rate blood vector velocity imaging using plane waves: Simulations and preliminary experiments. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 55 (8), 1729-1743 (2008).
- Hansen, K. L., Udesen, J., Gran, F., Jensen, J. A., Bachmann Nielsen, M. In-vivo examples of flow patterns with the fast vector velocity ultrasound method. Ultraschall in der Medizin. 30 (5), Stuttgart, Germany. 471-477 (2009).
- Tanter, M., Fink, M. Ultrafast imaging in biomedical ultrasound. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (1), 102-119 (2014).
- Montaldo, G., Tanter, M., Bercoff, J., Benech, N., Fink, M. Coherent plane-wave compounding for very high frame rate ultrasonography and transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 56 (3), 489-506 (2009).
- Papadacci, C., Pernot, M., Couade, M., Fink, M., Tanter, M. High-contrast ultrafast imaging of the heart. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (2), 288-301 (2014).
- Maresca, D., et al. Noninvasive Imaging of the Coronary Vasculature Using Ultrafast Ultrasound. JACC: Cardiovascular Imaging. 11 (6), 798-808 (2018).
- Demené, C., et al. Spatiotemporal Clutter Filtering of Ultrafast Ultrasound Data Highly Increases Doppler and fUltrasound Sensitivity. IEEE Transactions on Medical Imaging. 34 (11), 2271-2285 (2015).
- Demené, C., et al. 4D microvascular imaging based on ultrafast Doppler tomography. NeuroImage. 127, 472-483 (2016).
- Demené, C., et al. Ultrafast Doppler reveals the mapping of cerebral vascular resistivity in neonates. Journal of Cerebral Blood Flow and Metabolism. 34 (6), 1009-1017 (2014).
- Baranger, J., Arnal, B., Perren, F., Baud, O., Tanter, M., Demene, C. Adaptive Spatiotemporal SVD Clutter Filtering for Ultrafast Doppler Imaging Using Similarity of Spatial Singular Vectors. IEEE Transactions on Medical Imaging. 37 (7), 1574-1586 (2018).
- Demené, C., et al. Ultrafast Doppler Reveals the Mapping of Cerebral Vascular Resistivity in Neonates. Journal of Cerebral Blood Flow & Metabolism. 34 (6), 1009-1017 (2014).
- Goudot, G., et al. Wall Shear Stress Measurement by Ultrafast Vector Flow Imaging for Carotid Stenosis. Ultraschall in der Medizin - European Journal of Ultrasound. , (2019).
- Demené, C., Mairesse, J., Baranger, J., Tanter, M., Baud, O. Ultrafast Doppler for neonatal brain imaging. NeuroImage. 185, 851-856 (2019).
- Villemain, O., et al. Ultrafast Ultrasound Imaging in Pediatric and Adult Cardiology. JACC: Cardiovascular Imaging. , (2019).
- Provost, J., Papadacci, C., Demene, C., Gennisson, J. L., Tanter, M., Pernot, M. 3-D ultrafast doppler imaging applied to the noninvasive mapping of blood vessels in Vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 62 (8), 1467-1472 (2015).
- Osmanski, B. F., Montaldo, G., Fink, M., Tanter, M. In vivo out-of-plane Doppler imaging based on ultrafast plane wave imaging. IEEE International Ultrasonics Symposium, IUS. 62 (4), 76-79 (2013).
- Kim, M. W., Zhu, Y., Hedhli, J., Dobrucki, L. W., Insana, M. F. Multi-dimensional Clutter Filter Optimization for Ultrasonic Perfusion Imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 65 (11), 2020-2029 (2018).
- Chau, G., Li, Y. L., Jakovljevic, M., Dahl, J., Rodr, P. Wall Clutter Removal in Doppler Ultrasound using Principal Component Pursuit. , (2018).
- Tierney, J., Baker, J., Brown, D., Wilkes, D., Byram, B. Independent Component-Based Spatiotemporal Clutter Filtering for Slow Flow Ultrasound. IEEE Transactions on Medical Imaging. , 1-1 (2019).
- Zhang, N., Rivaz, H. Clutter Suppression in Ultrasound: Performance Evaluation and Review of Low-Rank and Sparse Matrix Decomposition Methods. BioMedical Engineering Online. 19, 37(2020).
- Guidi, G., Licciardello, C., Falteri, S. Intrinsic spectral broadening (ISB) in ultrasound Doppler as a combination of transit time and local geometrical broadening. Ultrasound in Medicine and Biology. 26 (5), 853-862 (2000).
- Cloutier, G., Shung, K. K., Durand, L. G. Experimental Evaluation of Intrinsic and Nonstationary Ultrasonic Doppler Spectral Broadening in Steady and Pulsatile Flow Loop Models. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 40 (6), 786-795 (1993).
- Winkler, A. J., Wu, J. Correction of intrinsic spectral broadening errors in doppler peak velocity measurements made with phased sector and linear array transducers. Ultrasound in Medicine and Biology. 21 (8), 1029-1035 (1995).
- Osmanski, B. F., Bercoff, J., Montaldo, G., Loupas, T., Fink, M., Tanter, M. Cancellation of Doppler intrinsic spectral broadening using ultrafast Doppler imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (8), 1396-1408 (2014).
- Sauvage, J., et al. A large aperture row column addressed probe for in vivo 4D ultrafast doppler ultrasound imaging. Physics in Medicine and Biology. 63 (21), (2018).
- Correia, M., Provost, J., Tanter, M., Pernot, M. 4D ultrafast ultrasound flow imaging: in vivo quantification of arterial volumetric flow rate in a single heartbeat. Physics in Medicine and Biology. 61 (23), 48-61 (2016).
- Center for Devices and Radiological Health. FDA Information for Manufacturers Seeking Marketing Clearance of Diagnostic Ultrasound Systems and Transducers. Center for Devices and Radiological Health. , FDA-2017-D-5372 (2008).
- I, IEC. IEC 62127-1 - Measurement and characterization of medical ultrasonic fields up to 40 MHz. IEC. , 61010-61011 (2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon