Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изображение кровотока с ультрабыстрым доплером
В этой статье
Резюме
Этот протокол показывает, как применять сверхбыструю ультразвуковую доплеровский изображений для количественной оценки потоков крови. После 1 с долгого приобретения, экспериментатор имеет доступ к фильму полного поля зрения с осями значения скорости для каждого пикселя каждые ≈0,3 мс (в зависимости от времени ультразвука полета).
Аннотация
Импульсно-доплеровский эффект является основным методом, используемым в клинической эхографии для оценки кровотока. Применяется с обычными сфокусированными ультразвуковыми доплерными режимами, он имеет несколько ограничений. Во-первых, для того, чтобы отличить потоки крови от окружающих движущихся тканей, необходима тонко настроенная операция фильтрации сигнала. Во-вторых, оператор должен выбирать между локализацией кровотока или количественной оценкой их. За последние два десятилетия ультразвуковая визуализация претерпела смену парадигмы с появлением сверхбыстрого ультразвука с использованием нецеленаправленных волн. В дополнение к стократное увеличение частоты кадров (до 10000 Гц), этот новый метод также нарушает обычные количественной / локализации компромисс, предлагая полное отображение кровотока поля зрения и одновременный доступ к тонкой скорости измерений на одном пиксельном уровне (до 50 мкм). Эта непрерывность данных как в пространственных, так и в височных измерениях сильно улучшает процесс фильтрации тканей/крови, что приводит к повышению чувствительности к небольшим скоростям кровотока (до 1 мм/с). В этом методе мы стремимся внедрить концепцию сверхбыстрого Доплера, а также его основные параметры. Во-первых, мы обобщаем физические принципы нецеленаправленной волновой визуализации. Затем мы представляем основные этапы обработки сигнала Doppler. В частности, мы объясняем практическую реализацию критических алгоритмов разделения тканей/кровотока и извлечение скоростей из этих отфильтрованных данных. Это теоретическое описание дополняется опытом in vitro. Ткань фантома встраивания канала с течет кровь имитирующей жидкость изображена с исследовательской программируемой ультразвуковой системы. Получено изображение кровотока и отображаются характеристики потока для нескольких пикселей в канале. Наконец, предлагается провести обзор применения in vivo, показав примеры в нескольких органах, таких как сонная артерия, почки, щитовидная железа, мозг и сердце.
Введение
Ультразвуковая визуализация является одним из наиболее часто используемых методов визуализации в клинической практике и исследовательской деятельности. Сочетание ультразвукового волнового излучения в биологических тканях с последующим записью забрасываемых эхо позволяет восстановительные анатомические изображения, так называемые "B-Mode". Этот метод прекрасно приспособлен для визуализации мягких тканей, таких как биологические ткани, которые обычно позволяют проникновение ультразвука на несколько сантиметров, со скоростью распространения ≈ 1540 м/с. В зависимости от центральной частоты ультразвукового зонда, получены изображения с разрешением от 30 мкм до 1 мм. Кроме того, хорошо известно, что движение акустического источника влияет на физические характеристики связанных волн. В частности, связь между частотными сдвигами волны относительно скорости ее источника описывается как эффектДоплера 1, самым простым проявлением которого является изменение высоты сирены движущийся скорой помощи. Ультразвуковая визуализация уже давно используется этот физический эффект для наблюдения движущихсякрасных кровяных телец 2, и он предлагает различные режимы визуализации обычно называют "Доплер изображения". Эти режимы позволяют оценить потоки крови в очень различных приложениях и органах, таких как мозг, сердце, почки или периферические артерии.
Примечательно, что большинство имеющихся в настоящее время ультразвуковых систем полагаются на ту же технологию, именуемую обычным ультразвуком. Основные принципы следующие: акустический луч инсонифицирует поле зрения и прометается вдоль ультразвуковой превидующей диафрагмы. Для каждого положения луча эхо записывается и преобразуется в линию конечного изображения. Постепенно перемещая луч вдоль предуцера, все поле зрения может быть изображено по линии за линию(рисунок 1, леваяпанель). Эта стратегия была хорошо адаптирована к электрическим ограничениям и вычислительной мощности, преобладающей до начала 21-го века. Тем не менее, он имеет несколько недостатков. Среди них окончательная частота кадров ограничена несколькими сотнями изображений в секунду в процессе сканирования луча. С точки зрения кровотока, это относительно низкая частота кадров влияет на максимальные скорости потока, которые могут быть обнаружены, что продиктовано критериями отбора проб Шеннон-Nyquist3. Кроме того, обычные Doppler должны иметь дело со сложным компромиссом. Для оценки скорости кровотока в определенном регионе, представляющих интерес (ROI), необходимо последовательно фиксировали несколько отголосков, поступающих от этой рентабельности инвестиций. Это означает, что ультразвуковой луч временно поддерживается в фиксированном положении. Чем длиннее эхо ансамбля, тем лучше оценка скорости будет для этой рентабельности инвестиций. Однако для получения полного изображения поля зрения луч должен сканировать среду. Таким образом, можно почувствовать конфликт между этими двумя ограничениями: проведение пучка точно оценить скорость вдоль одной линии, или перемещение пучка для получения изображения. Различные обычные режимы Доплера (т.е. Color Doppler или Pulse Wave Doppler) непосредственно отражают этот компромисс. Как правило, Color Doppler производит карту потока низкой точности, используемую длялокализации судов 4, и импульсная волна Doppler затем используется для точной количественной оценки потока в ранее идентифицированных судна5.
Эти два ограничения (низкая частота кадров и компромисс локализации/количественной оценки) преодолеваются с помощью очень высококауратных новых методов. Среди них, синтетическая диафрагмаподход 6 или многолинейный метод передачи можно привести7. В этом исследовании мы сосредоточимся на так называемом ультрабыстром ультразвуковом методе. Введенный два десятилетияназад 8,9,10, этот метод также опирается на выбросы / прием ультразвуков, но с радикально иной схеме. Действительно, вместо того, чтобы использовать сканирующий сфокусированный луч, ультрабыстрая визуализация использует плоскостную волну или расходяющиеся волны, которые способны инсонифицировать поле зрения с помощью одного излучения. После этого одного излучения, связанная электроника также может получать и обрабатывать огромное количество эхо, происходящих из всего поля зрения. В конце изображение можно реконструировать из одного шаблона выброса/приема11 (рисунок 1, праваяпанель). Эти нецеленаправленные выбросы могут иметь низкий коэффициент сигнала к шуму (SNR) из-за распространения акустической энергии. С этим можно справиться, испуская несколько озаглавленных плоскостных волн (или расходя волны с различными источниками) и добавляя полученные изображения. Этот метод называется "когерентное соединение"12. Возникают два основных последствия. Во-первых, частота кадров зависит только от времени полета ультразвука и может достигать типичных значений от 1 до 10 кГц. Во-вторых, это обеспечивает непрерывность данных как в пространственных, так и в временных измерениях, также именуемых spatiotemporal согласованности. Таким образом, обычный компромисс локализации/количественной оценки нарушается. Такое сочетание высокой частоты кадров и spatiotemporal согласованности оказывает огромное влияние на способность обнаруживать потоки крови с помощью ультразвука. По сравнению с обычным ультразвуком, ультрабыстрое УЗИ обеспечивает полную характеристикукровотока 3. Практически, пользователь имеет доступ к курсу времени скорости в каждом пикселе изображения, в течение всего срока приобретения (обычно ≈1 с), с временной шкалой, данной частотой кадров (как правило, частота кадров 5 кГц для временного разрешения 200 кс). Эта высокая частота кадров делает метод пригодным для широкого спектра применения, таких как быстрый поток в движущихсяорганах, таких как сердечные камеры 13 или миокард с коронарной микро-перфузией14. Кроме того, было показано, что его spatiotemporal согласованность сильно улучшает его способность отделять медленный кровоток от фоновых движущихся тканей, тем самым повышая чувствительность к микро-сосудистогопотока 15. Эта емкость дает доступ к микро сосудам мозга у животных16 и людей17.
Таким образом, ультрабыстрое УЗИ хорошо подходит для изображения кровотока в различных ситуациях. Он ограничен мягкими биологическими тканями и будет сильно зависеть от наличия жестких интерфейсов, таких как кости, или газовой полости, таких как легкие. Настройка физических параметров ультразвуковой последовательности позволяет изучать как медленные (до 1 мм/с11, 16),такибыстрые потоки (до нескольких м/с). Существует компромисс между пространственным разрешением и глубиной проникновения. Как правило, разрешение 50 мкм может быть достигнуто за счет проникновения около 5 мм. И наоборот, проникновение может быть расширено до 15-20 см при цене разрешения 1 мм. Стоит отметить, что большинство сверхбыстрых сканеров, таких как тот, который используется в этой статье, предоставляют только 2D-изображения.
Здесь мы предлагаем простой протокол, чтобы ввести концепцию Ultrafast Doppler изображений, используя программируемые исследования ультразвукового сканера и доплеровский фантом имитирует сосуд (артерия или вена), встроенные в биологическую ткань.
протокол
1. Доплер фантом подготовки установки (Рисунок 2A)
- Соедините перистатический насос, кровь, имитирующую резервуар жидкости, амортчик пульса и фантом потока Доплера с пластиковыми трубками.
- Выберите канал диаметром 4 мм.
- Запрограммировать насос для выброса 720 мл/мин жидкости в течение 0,3 с, а затем извлечь 50 мл/мин в течение 0,7 с соответственно имитировать сизол и диастол сердечных фаз
- Запустите насос и осторожно встряхните трубы, чтобы изгнать потенциальные пузырьки воздуха.
ПРИМЕЧАНИЕ: Оператор может выбрать другой диаметр канала и различную скорость насоса, но должен будет убедиться, что ультразвуковая последовательность достаточно быстра, чтобы получить самые быстрые скорости потока. Eq. 3, представленный позже, может помочь в разработке последовательности.
2. Ультрабыстрая установка ультразвукового сканера(рисунок 2A)
- Подключите сверхбыстрый исследовательский сканер к компьютеру-хозяину с помощью экспресс-ссылки PCI.
- Измените адаптер предуктора на ультразвуковом сканере, чтобы соответствовать разъему зонда, а затем подключите зонд.
- Запустите Matlab и активируйте лицензию ультразвукового сканера.
ПРИМЕЧАНИЕ: Этот раздел и следующие неявно предположить использование системы Verasonics Vantage.
3. Ультразвуковое программирование последовательности
- Используя сценарии примеров, создайте обычную сфокусированную последовательность "B-Mode" (т.е. эхография), которая будет использоваться для позиционирования зонда.
- Установите глубину изображения до 50 мм.
- Установите фокусную глубину до 35 мм.
- Используя сценарии примеров, создайте сверхбыструю ультразвуковую последовательность.
- Установите глубину изображения до 50 мм.
- Программа 3 наклонена плоскостно-волн на уровне 3,0,3 градуса.
- Установите частоту повторения импульса (PRF) до 12 кГц.
- Используйте 4 полу-цикла для ультразвуковой формы волны, с центральной частотой в зависимости от используемого зонда. Здесь предполагается центральная частота 5,2 МГц.
- Установите общую продолжительность до 1 с.
4. Позиционирование зондов и сбор данных
- Нанесите ультразвуковой гель на объектив зонда.
- Поместите зонд на фантом и запустите ультразвуковую последовательность B-Mode.
- Найдите канал, представляющий интерес. В жидкости появляется темнее, чем окружающие ткани. Поместите зонд в продольный вид.
- Вручную поддерживать зонд в интересном положении.
- Завершите последовательность B-Mode и запустите сценарий приобретения сверхбыстрой последовательности.
5. Реконструкция изображения(рисунок 2B)
- Как только последовательность закончена, сохраните необработанные данные (также называемые радиочастотными данными, "РФ").
- Запустите сценарий реконструкции изображения с помощью программного обеспечения ультразвуковой системы по умолчанию. В конце процесса должна быть создана матрица данных ИК.
ПРИМЕЧАНИЕ: Ультразвуковое эхо регистрируется на каждом элементе зонда и для каждого излучения/приема, а затем хранится в матрице данных РФ. Реконструкция изображения применила соответствующий закон о задержке к каждому каналу и приводит к так называемой матрице «I» (In-Phase/quadrature). Комплексная матрица интеллекта имеет три измерения: два для пространства (глубина изображения и ширина) и один для времени
6. Захламление фильтрации( Рисунок 2C)
ПРИМЕЧАНИЕ: Для шагов 6-7, см. сценарий Matlab, представленный в дополнительном материале.
- Измените форму матрицы 3D (пространство x пространства x time) в матрицу 2D (пространство x time) Casorati, названную I'r.
- Вычислите разложениеособого значения 15 I'r (Eq. 1).
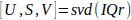 Eq. 1
Eq. 1 - Вычисляйте пространственную матрицу сходства C с помощью пространственных сингулярных векторов U, описанных Baranger et al.18 (II, D), и определите границы подпространства крови N.
- Используйте это отрезать N для фильтрации данных интеллекта, описанных в Demene et al.15 (II,C).
7. Визуализация потока и измерения скорости(рисунок 2C)
- Вычисляйте мощность карты Doppler PD, интегрируя оболочку отфильтрованных данных I't вдоль временного измерения (Eq. 2). 3D координаты z, x и t соответственно являются глубиной, шириной и временным измерением, nt и числом приобретенных кадров.
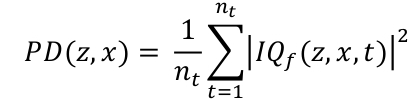 Eq. 2
Eq. 2 - Отображение карты PD в масштабе logarithm. Чтобы установить динамический диапазон, вычисте средний PD в регионе за пределами канала и используйте это значение в дБ в качестве нижней границы динамического диапазона. Типичный динамический диапазон составляет 30, 0 дБ.
- Определите круговую область интереса (ROI) на изображении, содержащую от 1 до 30 пикселей.
- Средний сигналI'f над пикселями этой рентабельности инвестиций, чтобы получить вектор
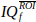 n t точек времени.
n t точек времени. - Вычислить и отобразить доплеровскую спектрограмму
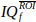 , используя квадратную величину короткого времени Fourier Transform (STFT).
, используя квадратную величину короткого времени Fourier Transform (STFT).- Установите окно STFT в 60-образное окно Hann.
- Установите перекрытие STFT до 90% длины окна.
- Наложение центральной частоты в каждой точке времени спектрограммы.
- Преобразование частотных значений f в аксиальные скорости крови vz с использованием формулы Доплера (Eq. 3). c0 - это скорость звука в среде и fTW центральная частота передаваемой ультразвуковой формы волны (здесь 5,2 МГц).
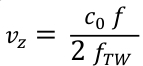 Eq. 3
Eq. 3
Результаты
Качество приобретения и послеобработки в первую очередь оценивается визуальным осмотром. Форма канала должна быть хорошо видна на изображении доплера, а область ткани должна казаться темной. Если сигнал доплера питания не ограничивается каналом, это может означать, что либо шаг фильт?...
Обсуждение
Вокруг основного кадра этого протокола возможно несколько вариаций.
Проблемы с оборудованием
Если пользователь поставляет свой пользовательский хост-компьютер, материнская плата и корпус компьютера должны иметь доступный экспресс-слот PCI. Процессор должен ?...
Раскрытие информации
Нет конфликта интересов
Благодарности
Мы хотели бы поблагодарить Шрейю Шах за ее корректор и советы.
Материалы
| Name | Company | Catalog Number | Comments |
| Blood-mimicking fluid | CIRS Inc, Norfolk, Virginia, USA | 069DTF | |
| Doppler flow phantom | CIRS Inc, Norfolk, Virginia, USA | ATS523A | |
| Matlab | MathWorks, Natick, Massachusetts, United States | ||
| Peristaltic pump / Doppler flow pump | CIRS Inc, Norfolk, Virginia, USA | 769 | Include tubings and pulse dampener |
| Transducer adpter | Verasonics, Kirkland, Washington, USA | UTA 408-GE | |
| Ultrafast ultrasound research scanner | Verasonics, Kirkland, Washington, USA | Vantage 256 | |
| Ultrasound probe/transducer | GE Healthcare | GE 9L-D |
Ссылки
- Doppler, C. . Ueber das farbige Licht der Doppelsterne und einiger anderer Gestirne des Himmels. , (2020).
- Bonnefous, O., Pesqué, P. Time domain formulation of pulse-Doppler ultrasound and blood velocity estimation by cross correlation. Ultrasonic Imaging. 8 (2), 73-85 (2004).
- Bercoff, J., et al. Ultrafast compound doppler imaging: Providing full blood flow characterization. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 58 (1), 134-147 (2011).
- Evans, D. H., Jensen, J. A., Nielsen, M. B. Ultrasonic colour Doppler imaging. Interface Focus. 1 (4), 490-502 (2011).
- Nuffer, Z., Rupasov, A., Bekal, N., Murtha, J., Bhatt, S. Spectral Doppler ultrasound of peripheral arteries: a pictorial review. Clinical Imaging. 46, 91-97 (2017).
- Jensen, J. A., Nikolov, S. I., Gammelmark, K. L., Pedersen, M. H. Synthetic aperture ultrasound imaging. Ultrasonics. 44, (2006).
- Tong, L., Ramalli, A., Jasaityte, R., Tortoli, P., D'Hooge, J. Multi-transmit beam forming for fast cardiac imaging-experimental validation and in vivo application. IEEE Transactions on Medical Imaging. 33 (6), 1205-1219 (2014).
- Tanter, M., Bercoff, J., Sandrin, L., Fink, M. Ultrafast compound imaging for 2-D motion vector estimation: application to transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 49 (10), 1363-1374 (2002).
- Udesen, J., et al. High frame-rate blood vector velocity imaging using plane waves: Simulations and preliminary experiments. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 55 (8), 1729-1743 (2008).
- Hansen, K. L., Udesen, J., Gran, F., Jensen, J. A., Bachmann Nielsen, M. In-vivo examples of flow patterns with the fast vector velocity ultrasound method. Ultraschall in der Medizin. 30 (5), 471-477 (2009).
- Tanter, M., Fink, M. Ultrafast imaging in biomedical ultrasound. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (1), 102-119 (2014).
- Montaldo, G., Tanter, M., Bercoff, J., Benech, N., Fink, M. Coherent plane-wave compounding for very high frame rate ultrasonography and transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 56 (3), 489-506 (2009).
- Papadacci, C., Pernot, M., Couade, M., Fink, M., Tanter, M. High-contrast ultrafast imaging of the heart. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (2), 288-301 (2014).
- Maresca, D., et al. Noninvasive Imaging of the Coronary Vasculature Using Ultrafast Ultrasound. JACC: Cardiovascular Imaging. 11 (6), 798-808 (2018).
- Demené, C., et al. Spatiotemporal Clutter Filtering of Ultrafast Ultrasound Data Highly Increases Doppler and fUltrasound Sensitivity. IEEE Transactions on Medical Imaging. 34 (11), 2271-2285 (2015).
- Demené, C., et al. 4D microvascular imaging based on ultrafast Doppler tomography. NeuroImage. 127, 472-483 (2016).
- Demené, C., et al. Ultrafast Doppler reveals the mapping of cerebral vascular resistivity in neonates. Journal of Cerebral Blood Flow and Metabolism. 34 (6), 1009-1017 (2014).
- Baranger, J., Arnal, B., Perren, F., Baud, O., Tanter, M., Demene, C. Adaptive Spatiotemporal SVD Clutter Filtering for Ultrafast Doppler Imaging Using Similarity of Spatial Singular Vectors. IEEE Transactions on Medical Imaging. 37 (7), 1574-1586 (2018).
- Demené, C., et al. Ultrafast Doppler Reveals the Mapping of Cerebral Vascular Resistivity in Neonates. Journal of Cerebral Blood Flow & Metabolism. 34 (6), 1009-1017 (2014).
- Goudot, G., et al. Wall Shear Stress Measurement by Ultrafast Vector Flow Imaging for Carotid Stenosis. Ultraschall in der Medizin - European Journal of Ultrasound. , (2019).
- Demené, C., Mairesse, J., Baranger, J., Tanter, M., Baud, O. Ultrafast Doppler for neonatal brain imaging. NeuroImage. 185, 851-856 (2019).
- Villemain, O., et al. Ultrafast Ultrasound Imaging in Pediatric and Adult Cardiology. JACC: Cardiovascular Imaging. , (2019).
- Provost, J., Papadacci, C., Demene, C., Gennisson, J. L., Tanter, M., Pernot, M. 3-D ultrafast doppler imaging applied to the noninvasive mapping of blood vessels in Vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 62 (8), 1467-1472 (2015).
- Osmanski, B. F., Montaldo, G., Fink, M., Tanter, M. In vivo out-of-plane Doppler imaging based on ultrafast plane wave imaging. IEEE International Ultrasonics Symposium, IUS. 62 (4), 76-79 (2013).
- Kim, M. W., Zhu, Y., Hedhli, J., Dobrucki, L. W., Insana, M. F. Multi-dimensional Clutter Filter Optimization for Ultrasonic Perfusion Imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 65 (11), 2020-2029 (2018).
- Chau, G., Li, Y. L., Jakovljevic, M., Dahl, J., Rodr, P. . Wall Clutter Removal in Doppler Ultrasound using Principal Component Pursuit. , (2018).
- Tierney, J., Baker, J., Brown, D., Wilkes, D., Byram, B. Independent Component-Based Spatiotemporal Clutter Filtering for Slow Flow Ultrasound. IEEE Transactions on Medical Imaging. , 1-1 (2019).
- Zhang, N., Rivaz, H. Clutter Suppression in Ultrasound: Performance Evaluation and Review of Low-Rank and Sparse Matrix Decomposition Methods. BioMedical Engineering Online. 19, 37 (2020).
- Guidi, G., Licciardello, C., Falteri, S. Intrinsic spectral broadening (ISB) in ultrasound Doppler as a combination of transit time and local geometrical broadening. Ultrasound in Medicine and Biology. 26 (5), 853-862 (2000).
- Cloutier, G., Shung, K. K., Durand, L. G. Experimental Evaluation of Intrinsic and Nonstationary Ultrasonic Doppler Spectral Broadening in Steady and Pulsatile Flow Loop Models. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 40 (6), 786-795 (1993).
- Winkler, A. J., Wu, J. Correction of intrinsic spectral broadening errors in doppler peak velocity measurements made with phased sector and linear array transducers. Ultrasound in Medicine and Biology. 21 (8), 1029-1035 (1995).
- Osmanski, B. F., Bercoff, J., Montaldo, G., Loupas, T., Fink, M., Tanter, M. Cancellation of Doppler intrinsic spectral broadening using ultrafast Doppler imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (8), 1396-1408 (2014).
- Sauvage, J., et al. A large aperture row column addressed probe for in vivo 4D ultrafast doppler ultrasound imaging. Physics in Medicine and Biology. 63 (21), (2018).
- Correia, M., Provost, J., Tanter, M., Pernot, M. 4D ultrafast ultrasound flow imaging: in vivo quantification of arterial volumetric flow rate in a single heartbeat. Physics in Medicine and Biology. 61 (23), 48-61 (2016).
- Center for Devices and Radiological Health. FDA Information for Manufacturers Seeking Marketing Clearance of Diagnostic Ultrasound Systems and Transducers. Center for Devices and Radiological Health. , (2008).
- I, IEC 62127-1 - Measurement and characterization of medical ultrasonic fields up to 40 MHz. IEC. , 61010-61011 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены