このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
超高速ドップラーによる血流イメージング
要約
このプロトコルは、血液の流れを定量化するために超高速超音波ドップラーイメージングを適用する方法を示しています。1秒の長い取得の後、実験者は各ピクセルの軸速度値を持つ全視野のムービーにアクセスできます ≈0.3 ms(飛行の超音波時間に応じて)。
要約
パルスドップラー効果は、血流を評価するために臨床エクログラフィーで使用される主な技術です。従来の焦点を当てた超音波ドップラーモードで適用され、それはいくつかの制限を有する。まず、血液の流れと周囲の動く組織を区別するために、細かく調整された信号フィルタリング操作が必要です。第二に、オペレータは血液の流れを局所化するか、それらを定量化するかを選択する必要があります。過去20年間で、超音波画像は、焦点を合っていない波を使用して超高速超音波の出現とパラダイムシフトを受けています。この新しい技術は、フレームレートの100倍の増加(最大10000Hz)に加えて、従来の定量化/局在化トレードオフを破り、視野の完全な血流マッピングと、単一ピクセルレベル(50μmまで)での細かい速度測定への同時アクセスを提供します。空間的および時間的な次元の両方のこのデータの連続性は、組織/血液のフィルタリングプロセスを強力に改善し、小さな血流速度(1 mm/sまで)に対する感受性を高める結果となる。本論文では、超高速ドップラーの概念と主なパラメータを紹介することを目指しています。まず、非焦点波イメージングの物理的原理を要約する。次に、ドップラー信号処理の主なステップを提示します。特に、重要な組織/血流分離アルゴリズムの実用的な実装と、これらのフィルタリングされたデータからの速度の抽出について説明する。この理論的な記述は、インビトロの経験によって補完されます。流れる血液模倣液を含む運河を埋め込む組織ファントムは、研究プログラム可能な超音波システムで画像化される。血流画像が得られ、運河の数画素に流動特性が表示されます。最後に、生体内応用の検討が提案され、頸動脈、腎臓、甲状腺、脳および心臓などのいくつかの器官における例を示す。
概要
超音波画像診断は、臨床現場および研究活動において最も一般的に使用される画像化技術の1つである。生物組織における超音波放出の組み合わせと後方散乱エコーの記録により、解剖学的画像、いわゆる「Bモード」の再構築が可能となる。この方法は、通常、≈1540 m/sの伝播速度で、通常、数センチメートルにわたって超音波の浸透を可能にする生体組織などの軟部組織イメージングに完全に適合しています。超音波プローブの中心周波数に応じて、30μmから1mmまでの解像度の画像が得られます。さらに、音響源の動きが、関連する波の物理的特性に影響を及ぼすことはよく知られている。特に、波の周波数シフトとソースの速度に対する周波数シフト間のリンクは、ドップラー効果1と呼ばれ、その最も単純な症状は、移動する救急車のサイレンのピッチの変化である。超音波画像は長い間、この物理的効果を使用して移動する赤血球2を観察し、一般的に「ドップラーイメージング」とラベル付けされる様々なイメージングモードを提案している。これらのモードは、脳、心臓、腎臓または末梢動脈などの非常に異なる用途および器官における血液の流れの評価を可能にする。
驚くべきことに、現在利用可能な超音波システムのほとんどは、従来の超音波と呼ばれる同じ技術に依存しています。基礎となる原理は次のとおりです:音響ビームは視野を内在化し、超音波トランスデューサ開口部に沿って掃引されます。ビームの各位置について、エコーが記録され、最終的な画像のラインに変換されます。ビームをトランスデューサに沿って徐々に移動させることで、全視野をライン毎に画像化することができます(図1、左パネル)。この戦略は、21世紀初めまで普及していた電気的制約と計算能力にうまく適応していました。それにもかかわらず、それはいくつかの欠点を持っています。これらの中で、最終的なフレームレートは、ビームスキャンプロセスによって毎秒数百枚の画像に制限されています。血流の面では、この比較的低いフレームレートは、シャノン・ナイキスト3のサンプリング基準によって決定される検出可能な最大流速に影響を与える。さらに、従来のドップラーは複雑なトレードオフに対処する必要があります。特定の関心領域(ROI)における血流速度を評価するためには、そのROIから来るいくつかのエコーを連続的に記録する必要があります。これは、超音波ビームが一定の位置に一時的に維持されることを意味します。エコーアンサンブルが長ければ長いほど、そのROIに対する速度推定が良くなります。しかし、視野の完全な画像を生成するには、ビームは媒体をスキャンする必要があります。したがって、1 つの線に沿って速度を正確に評価するためにビームを保持するか、ビームを移動してイメージを生成するかという 2 つの拘束の間の競合を感知できます。異なる従来のドップラーモード(すなわち、カラードップラーまたはパルス波ドップラー)は、このトレードオフを直接反映しています。通常、カラードップラーは、容器4を局所化するために使用される低忠実度のフローマップを生成し、パルス波ドップラーは、以前に同定された容器5内の流れを正確に定量するために使用される。
これら 2 つの制限 (低フレームレートとローカリゼーション/定量のトレードオフ) は、非常に高フレームレートの新しい手法で克服されます。これらの中でも、合成開口アプローチ6またはマルチライン送信技術は7を挙げられる。本研究では、いわゆる超高速超音波法に焦点を当てる。20年前に導入された8、9、10、この方法はまた、超音波の放出/受信に依存していますが、根本的に異なるパターンを持っています。確かに、走査に焦点を当てたビームを使用する代わりに、超高速イメージングは平面波または発散波を使用し、単一の放出で視野を内振することができます。その単一の放出に続いて、関連する電子工学はまた全体の視野から発生する多数のエコーを受け取り、処理することができる。最後に、画像は単一の放出/受信パターン11(図1、右パネル)から再構築することができる。これらの非焦点放出は音響エネルギーの普及による低い信号対雑音比(SNR)を有することができる。これは、いくつかのタイトルの平面波(または異なるソースで波を発散する)を放出し、結果の画像を追加することによって取り組むことができます。この方法は「コヒーレント・コンパウンディング」12と名付けられています。2つの大きな結果が生じます。まず、フレームレートは飛行の超音波時間にのみ依存し、1〜10 kHzの典型的な値に達することができます。第 2 に、空間ディメンションと時間ディメンションの両方でデータの連続性が保証されます。したがって、従来のローカリゼーション/定量化のトレードオフは破られます。高いフレームレートと時空的な一貫性のこの組み合わせは、超音波で血液の流れを検出する能力に大きな影響を与えます。従来の超音波と比較して、超高速超音波は、血流の完全な特性を提供します 3.実際には、ユーザーは、取得の全期間(通常は≈1秒)、フレームレート(通常は、時間分解能200μsの場合は5kHzのフレームレート)で、画像のすべてのピクセルの速度時間コースにアクセスできます。この高いフレームレートは、冠状マイクロ灌流14を有する心臓室13や心筋のような移動器官における速い流れのような幅広い適用に適した方法を作る。さらに、その時空間的な一貫性が、バックグラウンド移動組織から遅い血流を分離する能力を強く向上させ、したがって微小血管流れ15に対する感受性を増加させることが示されている。この容量は、動物16と人間17の両方の脳の微小血管系へのアクセスを提供します。
したがって、超高速超音波は、様々な状況での血流を画像に適しています。それは軟らかい生物学的組織に限定され、骨、または肺のようなガス腔のような硬いインターフェースの存在によって強く影響を受ける。超音波シーケンスの物理的なパラメータのチューニングは、遅い(1 mm / s11、16まで)と高速流れ(数m / sまで)の両方の研究を可能にします。空間解像度と浸透深度の間にはトレードオフがあります。通常、50 μmの分解能は、5 mm程度の浸透を犠牲にして達成できます。逆に、1mmの分解能を犠牲にして、浸透を15〜20cmまで拡張することができます。この記事で使用されているような超高速スキャナの多くは、2D画像のみを提供していることは注目に値します。
ここでは、生体組織に埋め込まれた血管(動脈または静脈)を模した超音波スキャナーとドップラーファントムをプログラム可能な研究を用いて、超高速ドップラーイメージングの概念を導入する簡単なプロトコルを提案する。
プロトコル
1. ドップラーファントム準備のセットアップ (図2A)
- 蠕動ポンプ、血液模擬流体貯蔵所、パルスダンパー、ドップラーフローファントムをプラスチックチューブに接続します。
- 直径4mmの運河を選ぶ。
- ポンプを0.3 sの流体720 mL/minに排出し、0.7 sで50 mL/minを排出して収縮期と拡張期心相をそれぞれ模倣するようにプログラムする
- ポンプを実行し、静かに潜在的な気泡を排出するためにパイプを振ります。
注:オペレータは別の運河の直径および異なったポンプ速度を選びることができるが、超音波の順序が最も速い流れの速度を得るのに十分な速さであることを保障しなければならない。Eq. 3 は後で提示され、シーケンスを設計するのに役立ちます。
2. 超高速超音波スキャナーのセットアップ (図 2A)
- 超高速対応のリサーチ スキャナを、PCI Express リンクを使用してホスト コンピュータに接続します。
- 超音波スキャナーのトランスデューサアダプタをプローブコネクタに合わせて交換し、プローブを接続します。
- Matlabを実行し、超音波スキャナのライセンスをアクティブにします。
注:このセクションと以下は、Verasonics Vantageシステムの使用を暗黙のうちに想定しています。
3. 超音波シーケンスプログラミング
- 例のスクリプトを使用して、プローブの位置決めに使用される従来の焦点を合わせられる「Bモード」(すなわち、echography)シーケンスを設計する。
- 撮像深さを50mmに設定します。
- 焦点深さを35mmに設定します。
- スクリプトの例を使用して、超高速超音波シーケンスを設計します。
- 撮像深さを50mmに設定します。
- プログラム3は[-3,0,3]度で平面波を傾けた。
- パルス繰り返し周波数(PRF)を12 kHzに設定します。
- 使用するプローブに応じて、中心周波数で、超音波波形に4半サイクルを使用してください。中心周波数は 5.2 MHz と想定されます。
- 合計期間を 1 s に設定します。
4. プローブの位置決めとデータ取得
- プローブのレンズに超音波ゲルを塗布します。
- プローブをファントムに置き、Bモード超音波シーケンスを起動します。
- 興味のある運河を見つけます。流体は周囲の組織よりも暗く見えます。プローブを縦方向のビューに配置します。
- プローブを対象の位置に手動で維持します。
- Bモードシーケンスを終了し、超高速シーケンス取得スクリプトを起動します。
5. 画像再構成 (図2B)
- シーケンスが終了したら、生データ(無線周波数データ「RF」とも呼ばれる)を保存します。
- 超音波システムのデフォルトソフトウェアを使用して画像再構築スクリプトを起動します。プロセスの最後に、IQ データマトリックスを作成する必要があります。
注:超音波エコーは、プローブの各要素と各放出/受信に記録され、RFデータマトリックスに保存されます。画像再構成は、各チャンネルに適切な遅延則を適用し、いわゆる「IQ」(位相/直交)行列を生み出した。複雑なIQマトリックスは、スペース(画像の深さと幅)と時間用の3次元を持っています
6. クラッターフィルタリング (図 2C)
注: 手順 6 ~ 7 については、「 補足資料」に記載されている Matlab スクリプトを参照してください。
- 3D (空間 x 空間 x 時間) の IQ 行列を 2D (空間 x 時間) の Casorati 行列に変更します。
- IQrの単数分解15(Eq. 1)を計算する。
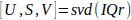 Eq. 1
Eq. 1 - バランゲルら (II,D)で記述された空間的特異ベクトルU(II,D)を用いて空間類似行列Cを計算し、血液部分空間境界Nを特定する。
- このカットオフNを使用して、Demeneら(II,C)に記載されているIQデータをフィルタリングする。
7. 流れの視覚化と速度の測定 (図 2C)
- 時間ディメンションに沿ってフィルターされたデータ IQt のエンベロープを統合することによって、パワードップラーマップPDを計算します(Eq. 2)。3D 座標 z、x、t はそれぞれ深さ、幅、時間寸法 、nt であり、取得したフレーム数です。
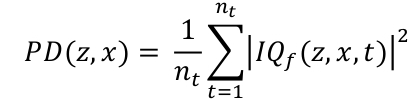 Eq. 2
Eq. 2 - PD マップを対数スケールで表示します。ダイナミック レンジを設定するには、運河の外側の領域で平均 PD を計算し、この値を dB でダイナミック レンジの下限として使用します。一般的なダイナミック レンジは [-30, 0] dB です。
- 1 ~ 30 ピクセルを含む、画像上の対象となる円形領域 (ROI) を定義します。
- そのROIのピクセル上のIQf信号を平均して
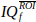 、nt時間ポイントのベクトルを得る。
、nt時間ポイントのベクトルを得る。 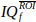 短時間フーリエ変換 (STFT) の平方マグニチュードを使用して、ドップラースペクトログラムを計算して表示します。
短時間フーリエ変換 (STFT) の平方マグニチュードを使用して、ドップラースペクトログラムを計算して表示します。- STFT ウィンドウを 60 サンプルの「Hann」ウィンドウに設定します。
- STFTのオーバーラップをウィンドウ長の90%に設定します。
- スペクトログラムの各時点で中心周波数をオーバーレイします。
- ドップラー式(Eq. 3)を使用して、周波数f値を血液軸速度vzに変換します。c0は、送信された超音波波形の中心周波数(ここでは5.2MHz)の媒体とfTWの音速です。
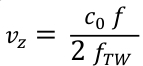 Eq. 3
Eq. 3
結果
取得と後処理の品質は、まず目視検査によって評価されます。運河の形状は、パワードップラー画像ではっきりと見える必要があり、組織領域は暗く見える必要があります。パワードップラー信号が運河に限定されない場合、クラッタフィルターステップが間違っていた(SVDの閾値が低すぎる)か、またはプローブが取得中に強い動きを経験したことを意味することができます。
ディスカッション
このプロトコルのメインフレームの周囲には、いくつかのバリエーションがあります。
ハードウェアに関する懸念事項
ユーザーがカスタム ホスト コンピュータを提供する場合、マザーボードとコンピュータのケースには、使用可能な PCI Express スロットが必要です。CPU には、すべてのデバイスを処理するのに十分な PCIe レーンが必要です。
開示事項
利益相反なし
謝辞
シュレヤ・シャーの校正とアドバイスに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Blood-mimicking fluid | CIRS Inc, Norfolk, Virginia, USA | 069DTF | |
| Doppler flow phantom | CIRS Inc, Norfolk, Virginia, USA | ATS523A | |
| Matlab | MathWorks, Natick, Massachusetts, United States | ||
| Peristaltic pump / Doppler flow pump | CIRS Inc, Norfolk, Virginia, USA | 769 | Include tubings and pulse dampener |
| Transducer adpter | Verasonics, Kirkland, Washington, USA | UTA 408-GE | |
| Ultrafast ultrasound research scanner | Verasonics, Kirkland, Washington, USA | Vantage 256 | |
| Ultrasound probe/transducer | GE Healthcare | GE 9L-D |
参考文献
- Doppler, C. . Ueber das farbige Licht der Doppelsterne und einiger anderer Gestirne des Himmels. , (2020).
- Bonnefous, O., Pesqué, P. Time domain formulation of pulse-Doppler ultrasound and blood velocity estimation by cross correlation. Ultrasonic Imaging. 8 (2), 73-85 (2004).
- Bercoff, J., et al. Ultrafast compound doppler imaging: Providing full blood flow characterization. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 58 (1), 134-147 (2011).
- Evans, D. H., Jensen, J. A., Nielsen, M. B. Ultrasonic colour Doppler imaging. Interface Focus. 1 (4), 490-502 (2011).
- Nuffer, Z., Rupasov, A., Bekal, N., Murtha, J., Bhatt, S. Spectral Doppler ultrasound of peripheral arteries: a pictorial review. Clinical Imaging. 46, 91-97 (2017).
- Jensen, J. A., Nikolov, S. I., Gammelmark, K. L., Pedersen, M. H. Synthetic aperture ultrasound imaging. Ultrasonics. 44, (2006).
- Tong, L., Ramalli, A., Jasaityte, R., Tortoli, P., D'Hooge, J. Multi-transmit beam forming for fast cardiac imaging-experimental validation and in vivo application. IEEE Transactions on Medical Imaging. 33 (6), 1205-1219 (2014).
- Tanter, M., Bercoff, J., Sandrin, L., Fink, M. Ultrafast compound imaging for 2-D motion vector estimation: application to transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 49 (10), 1363-1374 (2002).
- Udesen, J., et al. High frame-rate blood vector velocity imaging using plane waves: Simulations and preliminary experiments. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 55 (8), 1729-1743 (2008).
- Hansen, K. L., Udesen, J., Gran, F., Jensen, J. A., Bachmann Nielsen, M. In-vivo examples of flow patterns with the fast vector velocity ultrasound method. Ultraschall in der Medizin. 30 (5), 471-477 (2009).
- Tanter, M., Fink, M. Ultrafast imaging in biomedical ultrasound. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (1), 102-119 (2014).
- Montaldo, G., Tanter, M., Bercoff, J., Benech, N., Fink, M. Coherent plane-wave compounding for very high frame rate ultrasonography and transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control. 56 (3), 489-506 (2009).
- Papadacci, C., Pernot, M., Couade, M., Fink, M., Tanter, M. High-contrast ultrafast imaging of the heart. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (2), 288-301 (2014).
- Maresca, D., et al. Noninvasive Imaging of the Coronary Vasculature Using Ultrafast Ultrasound. JACC: Cardiovascular Imaging. 11 (6), 798-808 (2018).
- Demené, C., et al. Spatiotemporal Clutter Filtering of Ultrafast Ultrasound Data Highly Increases Doppler and fUltrasound Sensitivity. IEEE Transactions on Medical Imaging. 34 (11), 2271-2285 (2015).
- Demené, C., et al. 4D microvascular imaging based on ultrafast Doppler tomography. NeuroImage. 127, 472-483 (2016).
- Demené, C., et al. Ultrafast Doppler reveals the mapping of cerebral vascular resistivity in neonates. Journal of Cerebral Blood Flow and Metabolism. 34 (6), 1009-1017 (2014).
- Baranger, J., Arnal, B., Perren, F., Baud, O., Tanter, M., Demene, C. Adaptive Spatiotemporal SVD Clutter Filtering for Ultrafast Doppler Imaging Using Similarity of Spatial Singular Vectors. IEEE Transactions on Medical Imaging. 37 (7), 1574-1586 (2018).
- Demené, C., et al. Ultrafast Doppler Reveals the Mapping of Cerebral Vascular Resistivity in Neonates. Journal of Cerebral Blood Flow & Metabolism. 34 (6), 1009-1017 (2014).
- Goudot, G., et al. Wall Shear Stress Measurement by Ultrafast Vector Flow Imaging for Carotid Stenosis. Ultraschall in der Medizin - European Journal of Ultrasound. , (2019).
- Demené, C., Mairesse, J., Baranger, J., Tanter, M., Baud, O. Ultrafast Doppler for neonatal brain imaging. NeuroImage. 185, 851-856 (2019).
- Villemain, O., et al. Ultrafast Ultrasound Imaging in Pediatric and Adult Cardiology. JACC: Cardiovascular Imaging. , (2019).
- Provost, J., Papadacci, C., Demene, C., Gennisson, J. L., Tanter, M., Pernot, M. 3-D ultrafast doppler imaging applied to the noninvasive mapping of blood vessels in Vivo. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 62 (8), 1467-1472 (2015).
- Osmanski, B. F., Montaldo, G., Fink, M., Tanter, M. In vivo out-of-plane Doppler imaging based on ultrafast plane wave imaging. IEEE International Ultrasonics Symposium, IUS. 62 (4), 76-79 (2013).
- Kim, M. W., Zhu, Y., Hedhli, J., Dobrucki, L. W., Insana, M. F. Multi-dimensional Clutter Filter Optimization for Ultrasonic Perfusion Imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 65 (11), 2020-2029 (2018).
- Chau, G., Li, Y. L., Jakovljevic, M., Dahl, J., Rodr, P. . Wall Clutter Removal in Doppler Ultrasound using Principal Component Pursuit. , (2018).
- Tierney, J., Baker, J., Brown, D., Wilkes, D., Byram, B. Independent Component-Based Spatiotemporal Clutter Filtering for Slow Flow Ultrasound. IEEE Transactions on Medical Imaging. , 1-1 (2019).
- Zhang, N., Rivaz, H. Clutter Suppression in Ultrasound: Performance Evaluation and Review of Low-Rank and Sparse Matrix Decomposition Methods. BioMedical Engineering Online. 19, 37 (2020).
- Guidi, G., Licciardello, C., Falteri, S. Intrinsic spectral broadening (ISB) in ultrasound Doppler as a combination of transit time and local geometrical broadening. Ultrasound in Medicine and Biology. 26 (5), 853-862 (2000).
- Cloutier, G., Shung, K. K., Durand, L. G. Experimental Evaluation of Intrinsic and Nonstationary Ultrasonic Doppler Spectral Broadening in Steady and Pulsatile Flow Loop Models. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 40 (6), 786-795 (1993).
- Winkler, A. J., Wu, J. Correction of intrinsic spectral broadening errors in doppler peak velocity measurements made with phased sector and linear array transducers. Ultrasound in Medicine and Biology. 21 (8), 1029-1035 (1995).
- Osmanski, B. F., Bercoff, J., Montaldo, G., Loupas, T., Fink, M., Tanter, M. Cancellation of Doppler intrinsic spectral broadening using ultrafast Doppler imaging. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 61 (8), 1396-1408 (2014).
- Sauvage, J., et al. A large aperture row column addressed probe for in vivo 4D ultrafast doppler ultrasound imaging. Physics in Medicine and Biology. 63 (21), (2018).
- Correia, M., Provost, J., Tanter, M., Pernot, M. 4D ultrafast ultrasound flow imaging: in vivo quantification of arterial volumetric flow rate in a single heartbeat. Physics in Medicine and Biology. 61 (23), 48-61 (2016).
- Center for Devices and Radiological Health. FDA Information for Manufacturers Seeking Marketing Clearance of Diagnostic Ultrasound Systems and Transducers. Center for Devices and Radiological Health. , (2008).
- I, IEC 62127-1 - Measurement and characterization of medical ultrasonic fields up to 40 MHz. IEC. , 61010-61011 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved