Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Piège d’interception de vol automatisé à faible coût pour le sous-échantillonnage temporel d’insectes volants attirés par la lumière artificielle la nuit
Dans cet article
Résumé
Pour étudier les impacts de la lumière artificielle la nuit (ALAN) sur les insectes volants nocturnes, l’échantillonnage doit être limité à la nuit. Le protocole décrit un piège d’interception de vol automatisé à faible coût qui permet aux chercheurs d’échantillonner à des périodes définies par l’utilisateur avec une réplication accrue.
Résumé
Les méthodes d’échantillonnage sont choisies en fonction de l’espèce ciblée ou des exigences spatiales et temporelles de l’étude. Cependant, la plupart des méthodes d’échantillonnage passif des insectes volants ont une mauvaise résolution temporelle car elle prend du temps, est coûteuse et / ou logistiquement difficile à réaliser. L’échantillonnage efficace d’insectes volants attirés par la lumière artificielle la nuit (ALAN) nécessite un échantillonnage à des moments définis par l’utilisateur (nuit uniquement) sur des sites bien répliqués, ce qui entraîne des efforts d’enquête importants et exigeants en temps et en main-d’œuvre ou des technologies automatisées coûteuses. Décrit ici est un piège d’interception automatisé à faible coût qui ne nécessite aucun équipement ou compétence spécialisé pour construire et exploiter, ce qui en fait une option viable pour les études qui nécessitent un sous-échantillonnage temporel sur plusieurs sites. Le piège peut être utilisé pour répondre à un large éventail d’autres questions écologiques qui nécessitent une échelle temporelle et spatiale plus grande que ce qui est possible avec la technologie de piège précédente.
Introduction
Il existe de nombreuses techniques d’échantillonnage des arthropodes 1,2,3, mais les écologistes ont souvent de la difficulté à appliquer ces méthodes de manière appropriée à leurs questions de recherche (voir 4). Lorsqu’ils choisissent une méthode appropriée pour échantillonner les insectes, les écologistes doivent tenir compte de l’espèce ciblée, du temps, des efforts et des coûts impliqués dans les différentes techniques. Par exemple, une limite courante est qu’il peut être difficile sur le plan logistique de sous-échantillonner pendant des périodes de temps spécifiques sur des sites répliqués pour quantifier les variables temporelles qui influencent l’activité des espèces, telles que les changements météorologiques ou l’activité circadienne (mais voir5). La plupart des pièges à insectes à relevé passif sont placés sur de longues périodes (p. ex., sur plusieurs jours, semaines ou même mois), sans résolution temporelle à échelle fine1. Pour les enquêtes ciblant des périodes de temps spécifiques sur plusieurs sites répliqués (comme l’échantillonnage nocturne uniquement sur des sites distincts), une grande équipe peut être tenue de visiter des sites sur plusieurs jours en même temps (par exemple, dans les 30 minutes suivant le lever et le coucher du soleil) pour recueillir des spécimens et réinitialiser les pièges6; sinon, un dispositif de piégeage automatisé est requis 5,7,8.
Il existe un domaine de travail croissant sur les impacts de la lumière artificielle la nuit (ALAN) sur les modèles d’activité des insectes et la dynamique localisée des populations 9,10; et sur les interactions entre l’ALAN et les taux de prédation des insectes 4,11,12,13. Cependant, pour étudier les impacts de l’ALAN sur les taxons d’insectes nocturnes, l’échantillonnage doit être limité à la nuit. Plusieurs pièges à lumière active différents ont été décrits et utilisés pour l’échantillonnage temporel automatisé d’insectes nocturnes14. Quelques exemples incluent de simples dispositifs de séparation de type disque tombant, où la prise tombe dans un tube étroit avec un disque tombant toutes les heures pour séparer la prise15, ou des dispositifs de séparation à table tournante qui font tourner les bouteilles de collecte à des intervalles chronométrés 7,16,17. Ces pièges à lumière automatisés précédents répondent aux défis d’échantillonnage liés aux exigences des enquêtes temporelles, mais ils sont souvent volumineux et lourds et utilisent une technologie obsolète ou peu fiable. Un nouveau dispositif d’échantillonnage passif automatisé a récemment été développé et testé8. Cet appareil utilisait un piège d’interception de vol disponible dans le commerce jumelé à un dispositif de collecte léger conçu sur mesure composé d’une tasse d’échantillonnage de maintien de table tournante qui permet de collecter le contenu du piège à des intervalles définis par l’utilisateur8. Ce nouveau piège automatisé utilise une programmation sophistiquée qui peut être utilisée par un smartphone, mais dont le coût de construction est prohibitif à environ 700 EUROS (1 000 AUD) par piège8.
Les pièges d’interception de vol sont l’un des moyens les plus efficaces d’étudier les insectes volants 1,18,19 et de travailler sur le principe que les insectes volants tombent au sol lorsqu’ils entrent en collision avec une surface verticale. Les pièges d’interception de vol sont disponibles dans une variété de conceptions. Cependant, la plupart sont généralement construits avec une surface transparente ou maillée et un récipient collecteur rempli d’eau et / ou d’un agent de conservation. Le nouveau piège décrit ici utilise un type d’aube croisée / déflecteur ou un piège d’interception multidirectionnel20, étant donné qu’il a été démontré que les déflecteurs croisés augmentent les taux de capturede 14,21 et échantillonnent des insectes de toutes les directions. Le but de ce piège est d’étudier les insectes volants nocturnes qui sont attirés par les lumières artificielles. Cette phototaxie permet aux insectes de tourner autour de la source lumineuse22; par conséquent, un piège multidirectionnel est le plus approprié.
Décrit ici est un piège d’interception automatisé à faible coût qui ne nécessite aucun équipement ou compétence spécialisé pour construire et fonctionner. Le piège utilise un distributeur de nourriture automatisé pour animaux de compagnie disponible dans le commerce et des articles courants disponibles dans les quincailleries. Cette conception coûte moins de 66 EUROS (AUD 105) par piège à construire (tableau 1), ce qui en fait une option viable pour les études nécessitant un sous-échantillonnage temporel sur plusieurs sites simultanément.
Protocole
1. Construction de pièges
REMARQUE : Tous les composants nécessaires à la construction des pièges se trouvent dans la table des matériaux. Chaque piège a été construit comme le montrent les figures 1 et 2 par une personne en 2 h.
- Utilisez une scie sauteuse pour découper les feuilles de toiture en polycarbonate (8 mm x 610 mm x 2400 mm) en sections de 610 mm x 230 mm (Figure 1, points 1 et 2). Coupez ensuite une rainure centrale de 8 mm à mi-hauteur du centre de chaque vitre (610 mm x 230 mm) pour permettre aux deux vitres de glisser ensemble pour former un déflecteur croisé.
- Faites glisser les déflecteurs croisés confortablement dans l’ouverture de l’entonnoir en plastique (Figure 1, point 4) et fixez-les à l’entonnoir avec des supports d’angle en acier inoxydable de 20 mm (Fig 1, point 5b).
- Une fois le support d’angle en place, pré-percez des trous, puis utilisez des vis et des écrous M4 avec des rondelles (Figure 1, point 6b) pour fixer les déflecteurs croisés à l’entonnoir.
- Encore une fois, à l’aide de la scie sauteuse, coupez un morceau de la feuille de polycarbonate (230 mm x 305 mm) à partir des feuilles restantes et fixez-le avec des supports d’angle en acier inoxydable de 20 mm (figure 1, point 5a) à un angle de 90 ° par rapport au sommet des déflecteurs croisés pour former un toit de protection (figure 1, point 3).
- Une fois le support d’angle en place, pré-percez des trous, puis utilisez des vis et des écrous M4 avec des rondelles (Figure 1, point 6a) pour fixer le toit au déflecteur.
- Coupez le bec de l’entonnoir à une longueur d’environ 30 mm avec une scie à métaux pour vous assurer que les plateaux d’échantillonnage de la mangeoire automatisée pour animaux de compagnie tourneront sans obstruction aux intervalles programmés.
- Placez le distributeur automatique d’animaux de compagnie (figure 1, point 8) dans un bassin en plastique de 9 L (38 mm de diamètre) (figure 1, point 7) pour protéger les échantillons des conditions météorologiques.
- Percez un trou de 20 mm dans le haut du bassin de 9 L et placez le bec de l’entonnoir dans le trou pour le positionner directement au-dessus du plateau d’échantillonnage.
- À l’aide d’une perceuse munie d’un foret à tête hexagonale, fixer le bassin en plastique recouvrant le chargeur d’animaux de compagnie à un morceau de 500 mm de paliers de clôture en pin traité (figure 1, point 9) à l’aide de vis hexagonales galvanisées (figure 1, point 14).
- Pour stabiliser l’ensemble du piège à hisser dans les airs à l’aide de cordes, fixez un piquet en bois (17 x 17 x 1200 mm, figure 1, point 10) au morceau de palissage de clôture en pin traité (figure 1, point 9) avec un support d’angle et un fil d’attache (figure 1, points 13, 15 et 16).
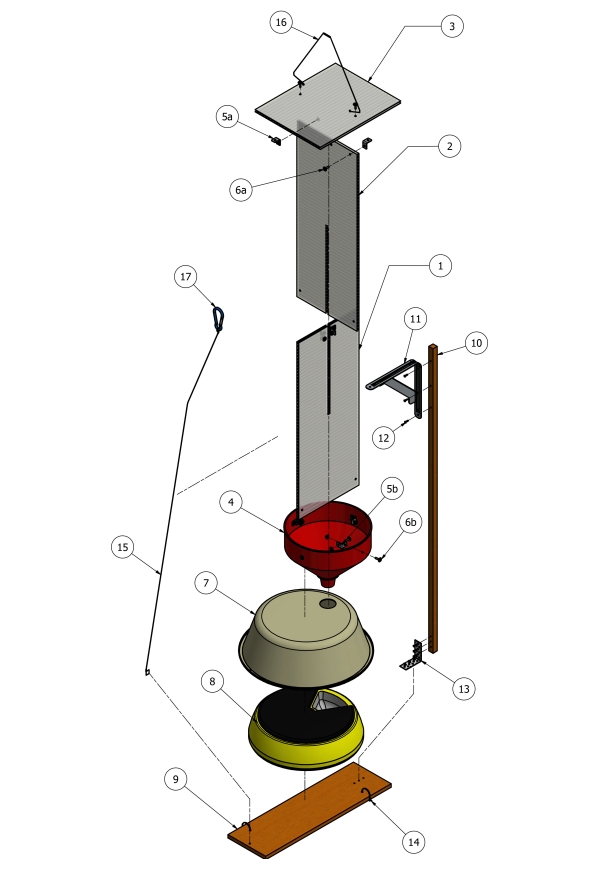
Figure 1 : Diagramme schématique de la construction des pièges. (1 et 2) feuilles de polycarbonate de 610 mm x 230 mm x 8 mm; 3° feuille de polycarbonate de 230 mm x 305 mm x 8 mm; 4° entonnoir en plastique de 24 cm de diamètre; (5a-b) supports d’angle de 20 mm; (6a-b) Vis, rondelles et écrous M4 x 15 mm; 7° bassin en plastique de 9 L de diamètre 38 cm de diamètre; 8° distributeur automatisé d’aliments pour animaux de compagnie; 9° pâlis de pin traité de 150 mm x 12 mm; 10° piquet en bois de 17 mm x 17 mm x 1200 mm; (11) Support d’angle de 125 mm x 150 mm; (12) vis hexagonales de 16 mm x 16 mm; 13° support d’angle; (14) vis hexagonales de 16 mm x 16 mm; (15 et 16) stabilisateur de fil; (17) karabiner, utilisé pour abaisser et soulever en position. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Déploiement d’interruptions
REMARQUE : Les pièges ont été fixés à des arbres situés à 6 m au-dessus du sol (directement sous les feux expérimentaux ou témoins) pour capturer les insectes volants (figure 2). La vidange et la collecte des pièges ont été effectuées par trois personnes en une seule journée. D’autres jours peuvent être échantillonnés si nécessaire en abaissant le piège pour retirer les échantillons prélevés, en réinitialisant les distributeurs d’aliments pour animaux de compagnie et en remettant le piège en place tous les trois jours en fonction du régime d’échantillonnage.

Figure 2 : Piège d’interception de vol automatisé à faible coût pour l’échantillonnage des insectes à des points temporels définis par l’utilisateur. (A) Les déflecteurs croisés en polycarbonate servent de zone d’interception de vol qui permet de collecter les insectes des quatre côtés. Le toit en polycarbonate sert à diriger les insectes vers le bas et à protéger les échantillons prélevés des intempéries. L’entonnoir sous les serveurs de barrière d’interception de vol pour canaliser les insectes qui sont entrés en collision avec les barrières en polycarbonate dans les plateaux collecteurs logés dans le bassin circulaire. (B) Piège suspendu sous la lumière expérimentale et fixé à l’arbre par un piquet en bois et un support d’angle. La boîte en contreplaqué située sous le piège d’interception contient un détecteur de chauves-souris utilisé pour enregistrer passivement les appels d’écholocation produits par les chauves-souris insectivores en liberté. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Une fois à l’endroit de l’échantillonnage, retirez le distributeur automatisé d’aliments pour animaux de compagnie (figure 1, point 8) sous le bassin en plastique.
- Ouvrez le distributeur automatisé d’aliments pour animaux de compagnie (Figure 3A) et placez des plats en aluminium contenant de l’eau savonneuse ou un agent de conservation de votre choix dans chaque plateau alimentaire (Figure 3B, ici 20 mL de propylène glycol ont été utilisés comme agent de conservation).
- Suivez les instructions fournies avec le distributeur automatisé de nourriture pour animaux de compagnie pour régler les temps de rotation du plateau de nourriture. Tout d’abord, réglez l’heure de l’horloge, puis programmez chaque plateau de distribution de nourriture pour animaux de compagnie.
REMARQUE: Le distributeur automatisé de nourriture pour animaux de compagnie fait pivoter les plateaux de nourriture (1-6) à des moments préprogrammés. Les bols de 6 repas peuvent être réglés pour s’ouvrir à toute heure du jour ou de la nuit, les plateaux tournant dans l’ordre séquentiel. Pour cette étude, l’objectif était d’échantillonner séparément les insectes nocturnes et diurnes. Le bac 1 échantillonné à partir de 20 h la première nuit, puis déplacé au bac 2 à 7 h le lendemain matin, suivi du bac 3 à 20 h, du bac 4 à 7 h, du bac 5 à 20 h et du bac 6 à 7 h. Une fonction de retard permettait un délai d’un jour dans l’échantillonnage, car il fallait 2 jours pour mettre en place tous les sites, garantissant ainsi que l’échantillonnage commençait le même jour / heure sur tous les sites.

Figure 3 : Bol automatisé de nourriture pour animaux de compagnie. (A) Bol d’aliments pour animaux de compagnie à 6 repas fonctionnant sur batterie utilisé pour échantillonner les insectes à des intervalles définis par l’utilisateur. Les bols de nourriture ont été programmés selon des horaires alternés pour échantillonner des insectes nocturnes et diurnes. Par exemple, le bac 1 s’ouvrait à 20 h (jour nocturne 1), le bac 2 ouvrait à 7 h (jour diurne 1), le bac 3 ouvrait à 20 h (jour nocturne 2), le bac 4 ouvrait à 7 h (jour diurne 2), le bac 5 ouvrait à 20 h (jour 3 nocturne) et le bac 6 ouvert à 7 h (jour diurne 3). (B) Couvercle retiré du bol automatisé d’aliments pour animaux de compagnie pour montrer les six plateaux de collecte. Les plats en aluminium contenant du propylène glycol comme agent de conservation ont permis d’éliminer facilement les insectes collectés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Replacez le distributeur automatique de nourriture pour animaux de compagnie sous le bassin en plastique et fixez le bassin à la pièce de clôture en bois à l’aide des vis hexagonales galvanisées (Figure 1, point 14).
- Fixez une corde au sommet du piège à l’aide d’un karabiner (figure 1, point 17). À l’aide d’une échelle, hissez le piège en position et fixez-le sous des lumières expérimentales par le karabiner.
- Fixez un deuxième piquet en bois (17 mm x 17 mm x 1200 mm, figure 2B) à l’arbre (ou lampadaire) avec un support d’angle pour stabiliser le piège par vent fort.
- Le piège se trouve au-dessus du pieu; fixez-le à l’aide de deux grandes attaches de câble (Figure 2B).
- Pour prélever des échantillons d’insectes, abaissez les pièges avec une corde. Retirez le distributeur automatisé de nourriture pour animaux de compagnie sous le bassin en plastique.
- Retirez le couvercle du distributeur de nourriture pour animaux de compagnie (Figure 3A) et soulevez les plateaux en aluminium pour verser le contenu dans des flacons d’échantillon pré-étiquetés (Figure 3B).
Résultats
Les pièges ont été testés dans le cadre d’une étude sur des insectes volants attirés par l’éclairage expérimental dans quatre réserves de brousse à Melbourne, en Australie. Les sites se composaient de brousse résiduelle ou revégétalisée entourée de logements résidentiels et espacées en moyenne de 15 km (aire de répartition 3-24 km) et de 45 ha (aire de répartition 30-59 ha). Au total, seize pièges ont été installés, quatre sur chaque site, avec et sans lumières expérimentales (3 lumières et ...
Discussion
Bien que le piège automatisé d’interception de vol décrit par Bolliger et coll. (2020)8 soit bien conçu et très efficace pour l’échantillonnage à des périodes définies par l’utilisateur, il est susceptible d’être prohibitif pour de nombreux chercheurs. Cette étude montre que les enquêtes de piégeage passif à l’aide de pièges automatisés pour le sous-échantillonnage des insectes volants à des périodes définies par l’utilisateur peuvent être effectuées avec un budge...
Déclarations de divulgation
Aucun
Remerciements
La recherche a été financée par le Fonds Net Zero de l’Université La Trobe, parrainé par Sonepar. La recherche a été menée en vertu du permis scientifique no 10009741 du ministère de l’Environnement, des Terres, de l’Eau et de l’Aménagement du territoire. Nous remercions Martin Steinbauer pour ses commentaires sur une première ébauche et deux réviseurs anonymes.
matériels
| Name | Company | Catalog Number | Comments |
| Batteries (C cell) – 10 pack | Duracell | MN1400B10 | https://www.duracell.com.au/product/alkaline-c-batteries/ |
| Battery operated automated 6 meal pet food bowl – each | OEM China | XR-P006-002 | Automated 6-meal pet food bowls range in price dependent on supplier, for example in the UK they can be purchased for £19 GBP ($36 AUD). |
| Galvanised hex-head screws (10-16 x 16 mm) – 100 pack | Bunnings Warehouse | 1-311-9151-CTPME | Bunnings Warehouse is an Australian hardware chain with stores in Australia and New Zealand. Items purchased from Bunnings Warehouse can be found at most hardware stores. https://www.bunnings.com.au/ |
| Galvanised steel angle bracket (125 x 150 mm) – each | Bunnings Warehouse | AZ11 | https://www.bunnings.com.au/ |
| Galvanised tie wire (0.70 mm x 75 m) – per roll | Bunnings Warehouse | 50218 | https://www.bunnings.com.au/ |
| Plastic basin (38 cm, 9 L round) – each | Ezy Storage | FBA31541 | https://www.ezystorage.com/product/laundry/basic-accessories/9l-round-basin/ |
| Plastic funnel (24 cm) – each | Sandleford | Pf24 | https://www.sandleford.com.au/plastic-funnel-24cm |
| Stainless steel angle bracket (20 mm) – 16 pack | Bunnings Warehouse | WEB2020 | https://www.bunnings.com.au/ |
| Stainless steel screws & nuts (M4 x 15 mm) – 18 pack | Bunnings Warehouse | SFA394 | https://www.bunnings.com.au/ |
| Stainless steel washers (3/16” & M5) – 50 pack | Bunnings Warehouse | EBM5005 | https://www.bunnings.com.au/ |
| Sunlite Polycarbonate roofing sheet (8mm x 610 mm x 2.4 m) – each | Suntuf (Palram Industries Ltd) | SL8CL2.4 | https://www.palram.com/au/product/sunlite-polycarbonate-multi-wall/ |
| Treated pine paling (150 x 12 mm) – each | STS Timber Wholesale P/L | n/a | https://www.ststimber.com.au/sts-timber-wholesale-products/fencing |
| Wooden stakes (1200 x 17 x 17 mm) – 10 pack | Lattice Makers | n/a | https://latticemakers.com/product/tomato-stakes-17x17mm-pack-of-10/ |
Références
- Epsky, N. D., Morrill, W. L., Mankin, R. W., Capinera, J. L. Traps for Capturing Insects. Encyclopedia of Entomology. , (2008).
- Catanach, T. A., Silvy, N. J. Invertebrate sampling methods for use in wildlife studies. The Wildlife Techniques Manual. 1, 336-348 (2012).
- Montgomery, G. A., Belitz, M. W., Guralnick, R. P., Tingley, M. W. Standards and best practices for monitoring and benchmarking insects. Frontiers in Ecology and Evolution. 8, 579193 (2021).
- Haddock, J. K., Threlfall, C. G., Law, B., Hochuli, D. F. Light pollution at the urban forest edge negatively impacts insectivorous bats. Biological Conservation. 236, 17-28 (2019).
- Steinbauer, M. J. Using ultra-violet traps to monitor autumn gum moth, Mnesampela private (Lepidoptera: Geometridae), in south-eastern Australia. Australian Forestry. 66 (4), 279-286 (2003).
- Wakefield, A., Broyles, M., Stone, E. L., Harris, S., Jones, G. Quantifying the attractiveness of broad-spectrum street lights to aerial nocturnal insects. Journal of Applied Ecology. 55, 714-722 (2017).
- Williams, C. B. The time of activity of certain nocturnal insects, chiefly Lepidoptera, as indicated by a light-trap. Transactions of the Entomological Society of London. 83 (4), 523-555 (1935).
- Bolliger, J., Collet, M., Hohl, M., Obrist, M. K. Automated flight-interception traps for interval sampling of insects. PLoS ONE. 15 (7), 0229476 (2020).
- Grubisic, M., van Grunsven, R. H. A., Kyba, C. C. M., Manfrin, A., Hölker, F. Insect declines and agroecosystems: does light pollution matter. Annals of Applied Biology. 173, 180-189 (2018).
- Owens, A. C. S., Lewis, S. M. The impact of artificial light at night on nocturnal insects: a review and synthesis. Ecology and Evolution. 8 (22), 11337-11358 (2018).
- Rydell, J. Exploitation of insects around streetlamps by bats in Sweden. Functional Ecology. 6, 744-750 (1992).
- Bolliger, J., Hennet, T., Wermelinger, B., Blum, S., Haller, J., Obrist, M. K. Low impact of two LED colors on nocturnal insect abundance and bat activity in a peri-urban environment. Journal of Insect Conservation. 24, 625-635 (2020).
- Rodríguez, A., Orozco-Valor, P. M., Sarasola, J. H. Artificial light at night as a driver of urban colonization by an avian predator. Landscape Ecology. 36, 17-27 (2021).
- Hienton, T. E. Summary of investigations of electric insect traps. United States Department of Agriculture. , (1974).
- Johnson, C. G. A suction trap for small airborne insects which automatically segregates the catch into successive hourly samples. Annals of Applied Biology. 37 (1), 80-91 (1950).
- Hutchins, R. E. Insect activity at a light trap during various periods of the night. Journal of Economic Entomology. 33 (4), 654-657 (1940).
- Nagel, R. H., Granovsky, A. A. A turn-table light trap for taking insects over regulated periods. Journal of Economic Entomology. 40 (4), 583-586 (1947).
- Hill, C. J., Cemak, M. A new design and some preliminary results for a flight intercept trap to sample forest canopy arthropods. Australian Journal of Entomology. 36, 51-55 (1997).
- Lamarre, G. P. A., Molto, Q., Fine, P. V. A., Baraloto, C. A comparison of two common flight interception traps to survey tropical arthropods. ZooKeys. 216, 43-55 (2012).
- Wilkening, A. J., Foltz, J. L., Atkinson, T. H., Connor, M. D. An omnidirectional flight trap for ascending and descending insects. The Canadian Entomologist. 113, 453-455 (1981).
- Frost, S. W. Insects captured in light traps with and without baffles. The Canadian Entomologist. 90 (9), 566-567 (1958).
- Muirhead-Thompson, R. . Trap responses of flying insects: The influence of trap design on capture efficiency. , 287 (1991).
- Carrel, J. E. A novel aerial-interception trap for arthropod sampling. Florida Entomologist. 85 (4), 656-657 (2002).
- Steinbauer, M. J., Haslem, A., Edwards, E. Using meteorological and lunar information to explain catch variability of Orthoptera and Lepidoptera from 250 W Farrow light traps. Insect Conservation and Diversity. 5, 367-380 (2012).
- Recher, H. F., Majer, J. D., Ganesh, S. Seasonality of canopy invertebrate communities in eucalypt forests of eastern and western Australia. Australian Journal of Ecology. 21, 64-80 (1996).
- van Klink, R., et al. Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science. 368, 417-420 (2020).
- Wagner, D. L. Insect declines in the Anthropocene. Annual Review of Entomology. 65, 457-480 (2020).
- Cardoso, P., et al. Scientists' warning to humanity on insect extinctions. Biological Conservation. 242, 108426 (2020).
- Saunders, M. E., Janes, J. K., O'Hanlon, J. C. Moving on from the insect apocalypse narrative: Engaging with evidence-based insect conservation. BioScience. 70 (1), 80-89 (2020).
- Cardoso, P., Leather, S. R. Predicting a global insect apocalypse. Insect Conservation and Diversity. 12, 263-267 (2019).
- Owens, A. C. S., Cochard, P., Durrant, J., Perkin, E., Seymoure, B. Light pollution is a driver of insect declines. Biological Conservation. 241, 108259 (2020).
- Chapman, J. A., Kinghorn, J. M. Window traps for insects. The Canadian Entomologist. 87 (1), 46-47 (1955).
- Canaday, C. L. Comparison of insect fauna captured in six different trap types in a Douglas-fir forest. The Canadian Entomologist. 119, 1101-1108 (2012).
- Burns, M., Hancock, G., Robinson, J., Cornforth, I., Blake, S. Two novel flight-interception trap designs for low-cost forest insect surveys. British Journal of Entomology and Natural History. 27, 155-162 (2014).
- Basset, Y. A composite interception trap for sampling arthropods in tree canopies. Journal of the Australian Entomological Society. 27, 213-219 (1988).
- Russo, L., Stehouwer, R., Heberling, J. M., Shea, K. The composite insect trap: An innovative combination trap for biologically diverse sampling. PLoS ONE. 6 (6), 21079 (2011).
- Knuff, A. K., Winiger, N., Klein, A. -. M., Segelbacher, G., Staab, M. Optimizing sampling of flying insects using a modified window trap. Methods in Ecology & Evolution. 10 (10), 1820-1825 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon