Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Недорогая автоматизированная ловушка перехвата полетов для временного субобразования летающих насекомых, привлеченных искусственным светом ночью
В этой статье
Резюме
Для изучения воздействия искусственного света в ночное время (ALAN) на ночных летающих насекомых отбор проб должен быть ограничен ночным временем. Протокол описывает недорогую автоматизированную ловушку перехвата полетов, которая позволяет исследователям проводить выборку в определенные пользователем периоды с увеличенной репликацией.
Аннотация
Методы отбора проб выбираются в зависимости от целевого вида или пространственных и временных требований исследования. Однако большинство методов пассивного отбора проб летающих насекомых имеют плохое временное разрешение, поскольку это отнимает много времени, является дорогостоящим и/или логистически сложным для выполнения. Эффективная выборка летающих насекомых, привлеченных искусственным светом в ночное время (ALAN), требует отбора проб в определенные пользователем временные точки (только в ночное время) на хорошо воспроизведенных участках, что приводит к значительным временным и трудоемким усилиям по обследованию или дорогостоящим автоматизированным технологиям. Здесь описана недорогая автоматизированная ловушка перехвата, которая не требует специального оборудования или навыков для строительства и эксплуатации, что делает ее жизнеспособным вариантом для исследований, требующих временной субвыборки на нескольких участках. Ловушка может быть использована для решения широкого круга других экологических вопросов, которые требуют большего временного и пространственного масштаба, чем это возможно с предыдущей технологией ловушки.
Введение
Существует много методов отбора проб членистоногих 1,2,3, но экологи часто испытывают трудности с применением этих методов способами, которые соответствуют их исследовательским вопросам (см. 4). При выборе подходящего метода отбора проб насекомых экологи должны учитывать целевые виды, время, усилия и затраты, связанные с различными методами. Например, общим ограничением является то, что может быть логистически сложно подзаборка в течение определенных периодов времени над реплицированными участками для количественной оценки временных переменных, которые влияют на активность видов, таких как изменения погоды или циркадная активность (см.5). Большинство пассивных обзорных ловушек для насекомых устанавливаются на длительные периоды времени (например, в течение нескольких дней, недель или даже месяцев), не имея мелкомасштабного временного разрешения1. Для обследований, нацеленных на конкретные периоды времени на нескольких реплицируемых участках (например, ночной отбор проб только на отдельных участках), может потребоваться большая группа посетить участки в течение нескольких дней в одних и тех же точках времени (например, в течение 30 минут после восхода и захода солнца) для сбора образцов и сброса ловушек6; в противном случае требуется автоматическое устройство улавливания 5,7,8.
Расширяется область работы по изучению воздействия искусственного освещения в ночное время (ALAN) на модели активности насекомых и локализованную динамику популяции 9,10; и о взаимодействии между АЛАН и темпами хищничества насекомых 4,11,12,13. Однако для изучения воздействия ALAN на ночные таксоны насекомых отбор проб должен быть ограничен ночным временем. Несколько различных активных световых ловушек были описаны и использованы для автоматизированного временного отбора проб ночных насекомых14. Некоторые примеры включают простые падающие дисковые разделительные устройства, где улавливание падает в узкую трубку с диском, падающим каждый час, чтобы отделить улавливание15, или поворотные сепарационные устройства, которые вращают бутылки для сбора с временными интервалами 7,16,17. Эти предыдущие автоматизированные световые ловушки решают проблемы выборки, связанные с требованиями временного обследования, но часто являются большими и громоздкими и используют устаревшие или ненадежные технологии. Недавно было разработано и испытано новое автоматизированное пассивное устройство отбора проб8. В этом устройстве использовалась коммерчески доступная ловушка перехвата полета в сочетании с легким специально разработанным устройством сбора, состоящим из чашки для отбора проб, которая позволяет собирать содержимоеловушки через определенные пользователем интервалы 8. Эта новая автоматизированная ловушка использует сложное программирование, которое может управляться смартфоном, но непомерно дорого в сборке около 700 евро (1000 австралийских долларов) за ловушку8.
Ловушки перехвата полета являются одним из наиболее эффективных способов обследования летающих насекомых 1,18,19 и работают по принципу, что летающие насекомые падают на землю при столкновении с вертикальной поверхностью. Ловушки для перехвата полета бывают разных конструкций. Однако большинство из них обычно изготавливаются с прозрачной или сетчатой поверхностью и собирающим контейнером, заполненным водой и/или консервантом. В новой ловушке, описанной здесь, используется поперечная ловушка типа лопасти/перегородки или разнонаправленная ловушка перехвата20, учитывая, что побочные перегородки, как было показано, увеличивают скорость захвата14,21 и выборку насекомых со всех сторон. Целью этой ловушки является обследование ночных летающих насекомых, которых привлекает искусственное освещение. Этот фототаксис приводит к тому, что насекомые кружат вокруг источника света22; следовательно, наиболее подходящая разнонаправленная ловушка.
Здесь описана недорогая автоматизированная ловушка перехвата, которая не требует специального оборудования или навыков для создания и эксплуатации. Ловушка использует коммерчески доступный автоматизированный диспенсер для кормов для домашних животных и общие предметы, доступные в хозяйственных магазинах. Эта конструкция стоит менее 66 евро (105 австралийских долларов) за каждую ловушку для строительства (таблица 1), что делает их жизнеспособным вариантом для исследований, требующих временной субвыборки на нескольких участках одновременно.
протокол
1. Конструкция ловушки
ПРИМЕЧАНИЕ: Все компоненты, необходимые для сборки ловушек, можно найти в Таблице материалов. Каждая ловушка была построена, как показано на рисунках 1 и 2 , одним человеком в течение 2 часов.
- Используйте лобзик, чтобы разрезать кровельные листы поликарбоната (8 мм x 610 мм x 2400 мм) на секции 610 мм x 230 мм (рисунок 1, пункты 1 и 2). Затем вырежьте 8-миллиметровую центральную канавку на полпути вверх по центру каждого (610 мм x 230 мм) стекла, чтобы позволить двум панелям скользить вместе, образуя перекрестную перегородку.
- Сдвиньте перекрещенные перегородки в пластиковое отверстие воронки (рис. 1, пункт 4) и прикрепите их к воронке угловыми кронштейнами из нержавеющей стали диаметром 20 мм (рис. 1, пункт 5b).
- Поставив угловой кронштейн на место, предварительно просверлите отверстия, а затем используйте винты и гайки M4 с шайбами (рисунок 1, пункт 6b) для крепления поперечных перегородок к воронке.
- Снова используя лобзик, отрежьте кусок поликарбонатного листа (230 мм х 305 мм) из оставшихся листов и закрепите угловыми кронштейнами из нержавеющей стали диаметром 20 мм (рисунок 1, пункт 5а) под углом 90° к верхней части скрещенных перегородок, чтобы сформировать защитную крышу (рисунок 1, пункт 3).
- Установив угловой кронштейн, предварительно просверлите отверстия, а затем используйте винты и гайки M4 с шайбами (рисунок 1, пункт 6a) для крепления крыши к перегородке.
- Обрежьте воронкообразный носик до длины ~ 30 мм с помощью ножовки, чтобы лотки для образцов автоматизированной кормушки для домашних животных вращались беспрепятственно через запрограммированные интервалы.
- Поместите автоматический дозатор для домашних животных (рисунок 1, пункт 8) в пластиковый таз объемом 9 л (диаметр 38 мм) (рисунок 1, пункт 7) для защиты образцов от погодных условий.
- Просверлите отверстие диаметром 20 мм в верхней части бассейна объемом 9 л и поместите воронкообразный носик в отверстие, чтобы расположить его непосредственно над лотком для образцов.
- С помощью дрели с шестигранным наконечником закрепите пластиковый таз, покрывающий кормушку для домашних животных, на 500-миллиметровый кусок обработанного соснового забора (рисунок 1, пункт 9) оцинкованными винтами с шестигранной головкой (рисунок 1, пункт 14).
- Чтобы стабилизировать всю ловушку для подъема в воздух с помощью канатов, прикрепите деревянный кол (17 х 17 х 1200 мм, рисунок 1, пункт 10) к куску обработанного соснового забора (фиг.1, пункт 9) с угловым кронштейном и стяжкой проволоки (фиг.1, пункты 13, 15 и 16).
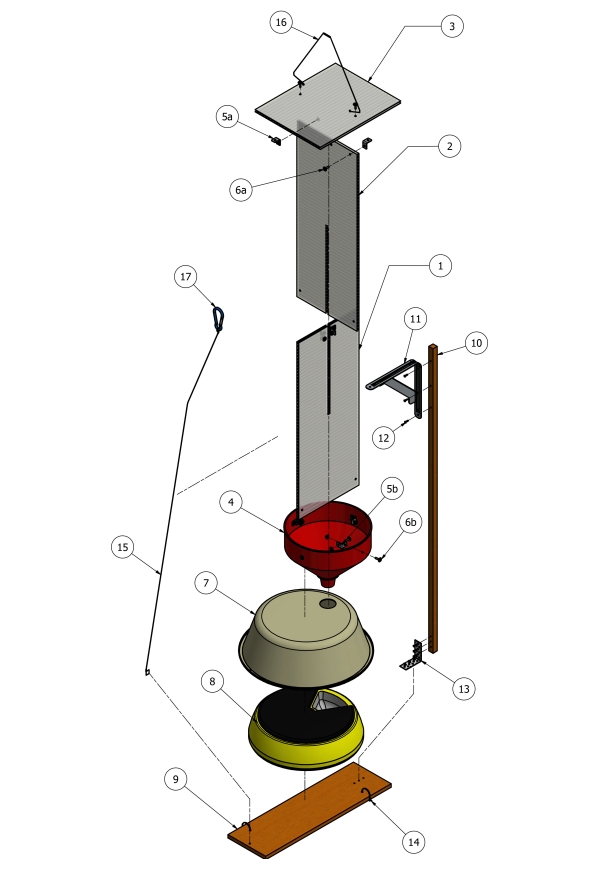
Рисунок 1: Принципиальная схема конструкции ловушки. (1 и 2) листы поликарбоната 610 мм x 230 мм x 8 мм; (3) лист поликарбоната 230 мм x 305 мм x 8 мм; (4) пластиковая воронка диаметром 24 см; (5a-b) угловые кронштейны 20 мм; (6а-б) M4 x 15 мм винты, шайбы и гайки; (7) Пластиковый таз диаметром 38 см 9 л; (8) автоматизированный дозатор кормов для домашних животных; (9) 150 мм x 12 мм обработанный сосновый поддон; (10) деревянный кол 17 мм x 17 мм x 1200 мм; (11) угловой кронштейн 125 мм x 150 мм; (12) винты с шестигранной головкой 16 мм x 16 мм; 13) угловой кронштейн; (14) винты с шестигранной головкой 16 мм x 16 мм; (15 и 16) проволочный стабилизатор; (17) карабин, используемый для опускания и подъема в положение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Развертывание ловушек
ПРИМЕЧАНИЕ: Ловушки были прикреплены к деревьям на высоте 6 м над землей (непосредственно под экспериментальными или контрольными огнями) для захвата летающих насекомых (рисунок 2). Опорожнение и сбор ловушек производились тремя людьми в один день. Дополнительные дни могут быть отобраны, если это необходимо, путем опускания ловушки для удаления собранных образцов, сброса диспенсеров для кормов для домашних животных и размещения ловушки обратно на место каждые три дня в зависимости от режима отбора проб.

Рисунок 2: Недорогая автоматизированная ловушка перехвата полетов для отбора проб насекомых в определенные пользователем временные точки. (А) Поликарбонатные перегородки служат зоной перехвата полета, которая позволяет собирать насекомых со всех четырех сторон. Крыша из поликарбоната служит для направления насекомых вниз и защиты собранных образцов от непогоды. Воронка под полетом перехватывает барьерные серверы для воронки насекомых, которые столкнулись с поликарбонатными барьерами, в сборные лотки, размещенные в круглом бассейне. (B) Ловушка, подвешенная под экспериментальным светом и закрепленная на дереве деревянным колом и угловым кронштейном. Фанерный ящик под ловушкой перехвата содержит детектор летучих мышей, используемый для пассивной записи эхолокационных вызовов, производимых насекомоядными летучими мышами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Оказавшись в месте отбора проб, извлеките автоматический дозатор кормов для домашних животных (рисунок 1, пункт 8) из-под пластикового бассейна.
- Откройте автоматизированный дозатор кормов для домашних животных (рисунок 3A) и поместите в каждый лоток для пищевых продуктов посуду из фольги, содержащую мыльную воду или консервант по выбору (рисунок 3B, здесь в качестве консерванта было использовано 20 мл пропиленгликоля).
- Следуйте инструкциям, прилагаемым к автоматизированному диспенсеру кормов для домашних животных, чтобы установить время вращения лотка для корма. Сначала установите время часов, затем запрограммируйте каждый лоток дозатора кормов для домашних животных.
ПРИМЕЧАНИЕ: Автоматизированный дозатор кормов для домашних животных вращает лотки для кормов (1-6) в заранее запрограммированное время. Миски с 6 приемами пищи могут открываться в любое время дня и ночи, причем лотки вращаются последовательно. Цель этого исследования состояла в том, чтобы отобрать образцы ночных и суточных насекомых отдельно. Лоток 1 был отобран с 8 вечера в первую ночь, а затем перемещен в лоток 2 в 7 утра на следующее утро, затем лоток 3 в 8 вечера, лоток 4 в 7 утра, лоток 5 в 8 вечера и лоток 6 в 7 утра. Функция задержки допускает однодневную задержку отбора проб, поскольку для создания всех участков требуется 2 дня, что обеспечивает начало отбора проб в один и тот же день/время на всех участках.

Рисунок 3: Автоматизированная миска для корма для домашних животных. (A) 6-разовая миска для корма для домашних животных с батарейным питанием, используемая для отбора проб насекомых через определенные пользователем интервалы. Пищевые миски были запрограммированы по чередующимся графикам для отбора проб ночных и суточных насекомых. Например, лоток 1 открылся в 8 вечера (ночной день 1), лоток 2 открылся в 7 утра (суточный день 1), лоток 3 открылся в 8 вечера (ночной день 2), лоток 4 открылся в 7 утра (суточный день 2), лоток 5 открылся в 8 вечера (ночной день 3) и лоток 6 открылся в 7 утра (суточный день 3). (B) Крышка снята с автоматизированной миски для корма для домашних животных, чтобы показать шесть лотков для сбора. Фольгированные блюда, содержащие пропиленгликоль в качестве консерванта, позволяли легко удалять собранных насекомых. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Поместите автоматический дозатор кормов для домашних животных обратно под пластиковый таз и прикрепите его к деревянному забору с помощью оцинкованных винтов с шестигранной головкой (рисунок 1, пункт 14).
- Прикрепите веревку к верхней части ловушки карабином (рисунок 1,.17). С помощью лестницы поднимите ловушку в нужное положение и закрепите ее под экспериментальными огнями с помощью карабинера.
- Прикрепите второй деревянный кол (17 мм x 17 мм x 1200 мм, рисунок 2B) к дереву (или фонарному столбу) с помощью углового кронштейна для стабилизации ловушки при сильном ветре.
- Ловушка сидит на вершине кола; закрепите его двумя большими кабельными стяжками (рисунок 2B).
- Чтобы собрать образцы насекомых, опустите ловушки веревкой. Снимите автоматический дозатор кормов для домашних животных из-под пластикового бассейна.
- Снимите крышку диспенсера для кормов для домашних животных (рисунок 3А) и поднимите алюминиевые лотки, чтобы вылить содержимое в предварительно маркированные флаконы для образцов (рисунок 3B).
Результаты
Ловушки были опробованы в обзоре летающих насекомых, привлеченных к экспериментальному освещению в четырех заповедниках кустарников по всему Мельбурну, Австралия. Участки состояли либо из остатков, либо из заросших растительностью кустарников, окруженных жилыми домами и в среднем на...
Обсуждение
Несмотря на то, что автоматизированная ловушка перехвата полета, описанная Bolliger et al. (2020)8 , хорошо спроектирована и очень эффективна при отборе проб в определенные пользователем периоды времени, они, вероятно, будут непомерно дорогими для многих исследователей. Это исследо?...
Раскрытие информации
Никакой
Благодарности
Исследование финансировалось через фонд La Trobe University Net Zero Fund, спонсируемый Sonepar. Исследование проводилось в соответствии с научным разрешением Департамента окружающей среды, земли, воды и планирования No 10009741. Мы благодарим Мартина Штайнбауэра за комментарии к раннему проекту и двух анонимных рецензентов.
Материалы
| Name | Company | Catalog Number | Comments |
| Batteries (C cell) – 10 pack | Duracell | MN1400B10 | https://www.duracell.com.au/product/alkaline-c-batteries/ |
| Battery operated automated 6 meal pet food bowl – each | OEM China | XR-P006-002 | Automated 6-meal pet food bowls range in price dependent on supplier, for example in the UK they can be purchased for £19 GBP ($36 AUD). |
| Galvanised hex-head screws (10-16 x 16 mm) – 100 pack | Bunnings Warehouse | 1-311-9151-CTPME | Bunnings Warehouse is an Australian hardware chain with stores in Australia and New Zealand. Items purchased from Bunnings Warehouse can be found at most hardware stores. https://www.bunnings.com.au/ |
| Galvanised steel angle bracket (125 x 150 mm) – each | Bunnings Warehouse | AZ11 | https://www.bunnings.com.au/ |
| Galvanised tie wire (0.70 mm x 75 m) – per roll | Bunnings Warehouse | 50218 | https://www.bunnings.com.au/ |
| Plastic basin (38 cm, 9 L round) – each | Ezy Storage | FBA31541 | https://www.ezystorage.com/product/laundry/basic-accessories/9l-round-basin/ |
| Plastic funnel (24 cm) – each | Sandleford | Pf24 | https://www.sandleford.com.au/plastic-funnel-24cm |
| Stainless steel angle bracket (20 mm) – 16 pack | Bunnings Warehouse | WEB2020 | https://www.bunnings.com.au/ |
| Stainless steel screws & nuts (M4 x 15 mm) – 18 pack | Bunnings Warehouse | SFA394 | https://www.bunnings.com.au/ |
| Stainless steel washers (3/16” & M5) – 50 pack | Bunnings Warehouse | EBM5005 | https://www.bunnings.com.au/ |
| Sunlite Polycarbonate roofing sheet (8mm x 610 mm x 2.4 m) – each | Suntuf (Palram Industries Ltd) | SL8CL2.4 | https://www.palram.com/au/product/sunlite-polycarbonate-multi-wall/ |
| Treated pine paling (150 x 12 mm) – each | STS Timber Wholesale P/L | n/a | https://www.ststimber.com.au/sts-timber-wholesale-products/fencing |
| Wooden stakes (1200 x 17 x 17 mm) – 10 pack | Lattice Makers | n/a | https://latticemakers.com/product/tomato-stakes-17x17mm-pack-of-10/ |
Ссылки
- Epsky, N. D., Morrill, W. L., Mankin, R. W., Capinera, J. L. Traps for Capturing Insects. Encyclopedia of Entomology. , (2008).
- Catanach, T. A., Silvy, N. J. Invertebrate sampling methods for use in wildlife studies. The Wildlife Techniques Manual. 1, 336-348 (2012).
- Montgomery, G. A., Belitz, M. W., Guralnick, R. P., Tingley, M. W. Standards and best practices for monitoring and benchmarking insects. Frontiers in Ecology and Evolution. 8, 579193 (2021).
- Haddock, J. K., Threlfall, C. G., Law, B., Hochuli, D. F. Light pollution at the urban forest edge negatively impacts insectivorous bats. Biological Conservation. 236, 17-28 (2019).
- Steinbauer, M. J. Using ultra-violet traps to monitor autumn gum moth, Mnesampela private (Lepidoptera: Geometridae), in south-eastern Australia. Australian Forestry. 66 (4), 279-286 (2003).
- Wakefield, A., Broyles, M., Stone, E. L., Harris, S., Jones, G. Quantifying the attractiveness of broad-spectrum street lights to aerial nocturnal insects. Journal of Applied Ecology. 55, 714-722 (2017).
- Williams, C. B. The time of activity of certain nocturnal insects, chiefly Lepidoptera, as indicated by a light-trap. Transactions of the Entomological Society of London. 83 (4), 523-555 (1935).
- Bolliger, J., Collet, M., Hohl, M., Obrist, M. K. Automated flight-interception traps for interval sampling of insects. PLoS ONE. 15 (7), 0229476 (2020).
- Grubisic, M., van Grunsven, R. H. A., Kyba, C. C. M., Manfrin, A., Hölker, F. Insect declines and agroecosystems: does light pollution matter. Annals of Applied Biology. 173, 180-189 (2018).
- Owens, A. C. S., Lewis, S. M. The impact of artificial light at night on nocturnal insects: a review and synthesis. Ecology and Evolution. 8 (22), 11337-11358 (2018).
- Rydell, J. Exploitation of insects around streetlamps by bats in Sweden. Functional Ecology. 6, 744-750 (1992).
- Bolliger, J., Hennet, T., Wermelinger, B., Blum, S., Haller, J., Obrist, M. K. Low impact of two LED colors on nocturnal insect abundance and bat activity in a peri-urban environment. Journal of Insect Conservation. 24, 625-635 (2020).
- Rodríguez, A., Orozco-Valor, P. M., Sarasola, J. H. Artificial light at night as a driver of urban colonization by an avian predator. Landscape Ecology. 36, 17-27 (2021).
- Hienton, T. E. Summary of investigations of electric insect traps. United States Department of Agriculture. , (1974).
- Johnson, C. G. A suction trap for small airborne insects which automatically segregates the catch into successive hourly samples. Annals of Applied Biology. 37 (1), 80-91 (1950).
- Hutchins, R. E. Insect activity at a light trap during various periods of the night. Journal of Economic Entomology. 33 (4), 654-657 (1940).
- Nagel, R. H., Granovsky, A. A. A turn-table light trap for taking insects over regulated periods. Journal of Economic Entomology. 40 (4), 583-586 (1947).
- Hill, C. J., Cemak, M. A new design and some preliminary results for a flight intercept trap to sample forest canopy arthropods. Australian Journal of Entomology. 36, 51-55 (1997).
- Lamarre, G. P. A., Molto, Q., Fine, P. V. A., Baraloto, C. A comparison of two common flight interception traps to survey tropical arthropods. ZooKeys. 216, 43-55 (2012).
- Wilkening, A. J., Foltz, J. L., Atkinson, T. H., Connor, M. D. An omnidirectional flight trap for ascending and descending insects. The Canadian Entomologist. 113, 453-455 (1981).
- Frost, S. W. Insects captured in light traps with and without baffles. The Canadian Entomologist. 90 (9), 566-567 (1958).
- Muirhead-Thompson, R. . Trap responses of flying insects: The influence of trap design on capture efficiency. , 287 (1991).
- Carrel, J. E. A novel aerial-interception trap for arthropod sampling. Florida Entomologist. 85 (4), 656-657 (2002).
- Steinbauer, M. J., Haslem, A., Edwards, E. Using meteorological and lunar information to explain catch variability of Orthoptera and Lepidoptera from 250 W Farrow light traps. Insect Conservation and Diversity. 5, 367-380 (2012).
- Recher, H. F., Majer, J. D., Ganesh, S. Seasonality of canopy invertebrate communities in eucalypt forests of eastern and western Australia. Australian Journal of Ecology. 21, 64-80 (1996).
- van Klink, R., et al. Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science. 368, 417-420 (2020).
- Wagner, D. L. Insect declines in the Anthropocene. Annual Review of Entomology. 65, 457-480 (2020).
- Cardoso, P., et al. Scientists' warning to humanity on insect extinctions. Biological Conservation. 242, 108426 (2020).
- Saunders, M. E., Janes, J. K., O'Hanlon, J. C. Moving on from the insect apocalypse narrative: Engaging with evidence-based insect conservation. BioScience. 70 (1), 80-89 (2020).
- Cardoso, P., Leather, S. R. Predicting a global insect apocalypse. Insect Conservation and Diversity. 12, 263-267 (2019).
- Owens, A. C. S., Cochard, P., Durrant, J., Perkin, E., Seymoure, B. Light pollution is a driver of insect declines. Biological Conservation. 241, 108259 (2020).
- Chapman, J. A., Kinghorn, J. M. Window traps for insects. The Canadian Entomologist. 87 (1), 46-47 (1955).
- Canaday, C. L. Comparison of insect fauna captured in six different trap types in a Douglas-fir forest. The Canadian Entomologist. 119, 1101-1108 (2012).
- Burns, M., Hancock, G., Robinson, J., Cornforth, I., Blake, S. Two novel flight-interception trap designs for low-cost forest insect surveys. British Journal of Entomology and Natural History. 27, 155-162 (2014).
- Basset, Y. A composite interception trap for sampling arthropods in tree canopies. Journal of the Australian Entomological Society. 27, 213-219 (1988).
- Russo, L., Stehouwer, R., Heberling, J. M., Shea, K. The composite insect trap: An innovative combination trap for biologically diverse sampling. PLoS ONE. 6 (6), 21079 (2011).
- Knuff, A. K., Winiger, N., Klein, A. -. M., Segelbacher, G., Staab, M. Optimizing sampling of flying insects using a modified window trap. Methods in Ecology & Evolution. 10 (10), 1820-1825 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены