É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Armadilha de interceptação de voo automatizada de baixo custo para a sub-amostragem temporal de insetos voadores atraídos pela luz artificial à noite
Neste Artigo
Resumo
Para estudar os impactos da luz artificial à noite (ALAN) em insetos voadores noturnos, a amostragem precisa ser limitada à noite. O protocolo descreve uma armadilha automatizada de interceptação de voo de baixo custo que permite aos pesquisadores amostrar em períodos definidos pelo usuário com maior replicação.
Resumo
Os métodos amostrais são selecionados dependendo das espécies-alvo ou dos requisitos espaciais e temporais do estudo. No entanto, a maioria dos métodos de amostragem passiva de insetos voadores tem uma resolução temporal ruim porque é demorada, cara e/ou logísticamente difícil de realizar. A amostragem efetiva de insetos voadores atraídos pela luz artificial à noite (ALAN) requer amostragem em pontos de tempo definidos pelo usuário (somente noturno) em locais bem replicados, resultando em grande tempo e esforço de pesquisa intensivo em mão-de-obra ou tecnologias automatizadas caras. Descrita aqui é uma armadilha de interceptação automatizada de baixo custo que não requer equipamentos ou habilidades especializadas para construir e operar, tornando-se uma opção viável para estudos que requerem subperpar amostragem temporal em vários locais. A armadilha pode ser usada para abordar uma ampla gama de outras questões ecológicas que requerem uma escala temporal e espacial maior do que é viável com a tecnologia de armadilha anterior.
Introdução
Existem muitas técnicas de amostragem de artrópodes 1,2,3, mas os ecologistas muitas vezes têm dificuldade em aplicar esses métodos de maneiras adequadas às suas questões de pesquisa (ver4). Ao escolher um método adequado para amostragem de insetos, os ecologistas devem considerar as espécies-alvo, o tempo, o esforço e o custo envolvidos em diferentes técnicas. Por exemplo, uma limitação comum é que pode ser logisticamente desafiador sub-amostrar durante períodos de tempo específicos sobre locais replicados para quantificar variáveis temporais que influenciam a atividade das espécies, como mudanças no clima ou atividade circadiana (mas ver5). A maioria das armadilhas passivas de insetos são definidas por longos períodos (por exemplo, ao longo de vários dias, semanas ou até meses), sem resolução temporal em escala fina1. Para pesquisas que visam períodos de tempo específicos em vários locais de replicação (como amostragem noturna apenas em locais distintos), uma grande equipe pode ser obrigada a visitar locais durante vários dias ao mesmo tempo (por exemplo, dentro de 30 minutos do nascer e do pôr do sol) para coletar espécimes e redefinir armadilhas6; caso contrário, um dispositivo de captura automatizado é necessário 5,7,8.
Há um campo de trabalho crescente sobre os impactos da luz artificial à noite (ALAN) nos padrões de atividade de insetos e na dinâmica populacional localizada 9,10; e sobre as interações entre ALAN e taxas de predação de insetos 4,11,12,13. No entanto, para estudar os impactos do ALAN na taxa noturna de insetos, a amostragem precisa ser limitada à noite. Várias armadilhas de luz ativas diferentes foram descritas e usadas para amostragem temporal automatizada de insetos noturnos14. Alguns exemplos incluem simples dispositivos de separação do tipo disco, onde a captura cai em um tubo estreito com um disco caindo a cada hora para separar a captura15, ou dispositivos de separação de mesa de giro que giram garrafas de coleta em intervaloscronometrados 7,16,17. Essas armadilhas de luz automatizadas anteriores abordam os desafios de amostragem envolvidos com os requisitos de pesquisa temporal, mas são muitas vezes grandes e desordendas e usam tecnologia desatualizada ou não confiável. Um novo dispositivo automatizado de amostragem passiva foi recentemente desenvolvido e testado8. Este dispositivo utilizou uma armadilha de interceptação de voo comercialmente disponível emparelhada com um dispositivo de coleta leve projetado sob medida, composto por um copo de amostragem de mesa de turn que permite coletar conteúdo de armadilha em intervalos definidos pelo usuário8. Esta nova armadilha automatizada emprega programação sofisticada que pode ser operada por um smartphone, mas é proibitivamente cara de construir em torno de EURO 700 (AUD 1.000) por armadilha8.
As armadilhas de interceptação de voo são uma das formas mais eficientes de examinar insetos voadores 1,18,19 e trabalhar no princípio de que insetos voadores caem no chão quando colidem com uma superfície vertical. As armadilhas de interceptação de voo vêm em uma variedade de projetos. No entanto, a maioria é tipicamente construída com uma superfície transparente ou de malha e um recipiente de coleta cheio de água e/ou um conservante. A nova armadilha descrita aqui usa um tipo de palheta cruzada/defletor ou interceptação multidirecional20, dado que os defletores cruzados foram mostrados para aumentar as taxas de captura14,21 e provar insetos de todas as direções. O objetivo desta armadilha é examinar insetos voadores noturnos que são atraídos por luzes artificiais. Esta fototaxis resulta em insetos circulando a fonte de luz22; portanto, uma armadilha multidirecional é mais adequada.
Descrita aqui é uma armadilha de interceptação automatizada de baixo custo que não requer nenhum equipamento ou habilidades especializadas para construir e operar. A armadilha usa um distribuidor automatizado de alimentos para animais de estimação disponíveis comercialmente e itens comuns disponíveis em lojas de hardware. Este projeto custa menos do que euro 66 (AUD 105) por armadilha para construir (Tabela 1), tornando-os uma opção viável para estudos que requerem subpar amostragem temporal em vários locais simultaneamente.
Protocolo
1. Construção de armadilhas
NOTA: Todos os componentes necessários para a construção das armadilhas podem ser encontrados na Tabela de Materiais. Cada armadilha foi construída como mostrado na Figura 1 e Figura 2 por uma pessoa dentro de 2 h.
- Use um quebra-cabeça para cortar as folhas de cobertura de policarbonato (8 mm x 610 mm x 2400 mm) em seções de 610 mm x 230 mm (Figura 1, item 1 e 2). Em seguida, corte uma ranhura central de 8 mm no meio do centro de cada painel (610 mm x 230 mm) para permitir que os dois painéis deslizem juntos para formar um defletor cruzado.
- Deslize os defletores cruzados aconchegantemente na abertura do funil plástico (Figura 1, item 4) e fixe-os no funil com suportes angulares de aço inoxidável de 20 mm (Fig 1, item 5b).
- Com o suporte de ângulo no lugar, faça furos pré-furos e, em seguida, use parafusos M4 e porcas com arruelas (Figura 1, item 6b) para fixar os defletores cruzados ao funil.
- Novamente usando o quebra-cabeça, corte um pedaço da chapa de policarbonato (230 mm x 305 mm) das folhas restantes e fixe com suportes angulares de aço inoxidável de 20 mm (Figura 1, item 5a) em um ângulo de 90° até o topo dos defletores cruzados para formar um teto protetor (Figura 1, item 3).
- Com o suporte de ângulo no lugar, faça furos pré-furos e, em seguida, use parafusos M4 e porcas com arruelas (Figura 1, item 6a) para fixar o teto ao defletor.
- Corte o bico do funil em um comprimento de ~30 mm com uma serra de corte para garantir que as bandejas de amostra do alimentador de animais de estimação automatizado gire desobstruídas nos intervalos programados.
- Coloque o distribuidor automatizado de animais de estimação (Figura 1, item 8) dentro de uma bacia plástica de 9 L (38 mm de diâmetro) (Figura 1, item 7) para proteger as amostras das condições climáticas.
- Faça um orifício de 20 mm na parte superior da bacia 9 L e coloque o bico do funil no orifício para posicioná-lo diretamente acima da bandeja de amostra.
- Usando uma broca com uma broca de motorista hexa-cabeça, proteja a bacia plástica que cobre o alimentador de animais de estimação a um pedaço de cerca de pinheiro tratado de 500 mm (Figura 1, item 9) com parafusos de cabeça hexa-hexamada galvanizados (Figura 1, item 14).
- Para estabilizar toda a armadilha para içar no ar através de cordas, conecte uma estaca de madeira (17 x 17 x 1200 mm, Figura 1, item 10) ao pedaço de cerca de pinheiro tratada (Figura 1, item 9) com um suporte angular e fio de gravata (Figura 1, itens 13, 15 e 16).
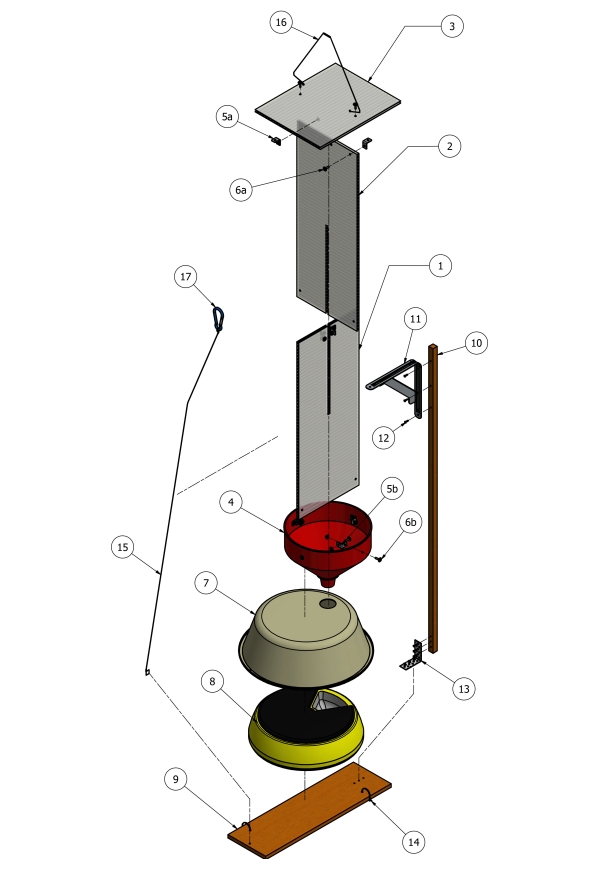
Figura 1: Diagrama esquemático da construção de armadilhas. (1 e 2) folhas de policarbonato de 610 mm x 230 mm x 8 mm; (3) 230 mm x 305 mm x 8 mm de chapa de policarbonato; (4) Funil plástico de 24 cm de diâmetro; (5a-b) suportes angulares de 20 mm; (6a-b) Parafusos M4 x 15 mm, arruelas e porcas; (7) Bacia plástica de 38 cm de diâmetro 9 L; (8) dispensador automatizado de alimentos para animais de estimação; (9) 150 mm x 12 mm de paling de pinheiro tratado; (10) 17 mm x 17 mm x estaca de madeira de 1200 mm; (11) suporte angular de 125 mm x 150 mm; (12) parafusos hexa-cabeça de 16 mm x 16 mm; (13) suporte de ângulo; (14) parafusos hexa-cabeça de 16 mm x 16 mm; (15 e 16) estabilizador de fio; (17) karabinador, usado para baixar e elevar-se em posição. Clique aqui para ver uma versão maior desta figura.
2. Implantação de armadilhas
NOTA: As armadilhas foram anexadas a árvores 6 m acima do solo (diretamente abaixo das luzes experimentais ou de controle) para capturar insetos voadores (Figura 2). Esvaziamento e coleta de armadilhas foram feitos por três pessoas em um único dia. Outros dias podem ser amostrados se necessário, reduzindo a armadilha para remover as amostras coletadas, redefinindo os distribuidores de alimentos para animais de estimação e colocando a armadilha de volta em posição a cada três dias com base no regime amostral.

Figura 2: Armadilha automatizada de interceptação de voo de baixo custo para amostragem de insetos em pontos de tempo definidos pelo usuário. (A) Os defletores cruzados do policarbonato servem como a área de interceptação de voo que permite a coleta de insetos dos quatro lados. O teto de policarbonato serve para direcionar insetos para baixo e proteger as amostras coletadas do clima. O funil sob os servidores de barreira de interceptação de voo para funil insetos que colidiram com as barreiras de policarbonato nas bandejas coletoras alojadas dentro da bacia circular. (B) Armadilha suspensa abaixo da luz experimental e presa à árvore por uma estaca de madeira e suporte de ângulo. A caixa de compensado abaixo da armadilha de interceptação contém um detector de morcegos usado para gravar passivamente chamadas de ecolocalização produzidas por morcegos insetívoros de alcance livre. Clique aqui para ver uma versão maior desta figura.
- Uma vez no local de amostragem, remova o distribuidor automatizado de alimentos para animais de estimação (Figura 1, item 8) abaixo da bacia plástica.
- Abra o distribuidor automatizado de alimentos para animais de estimação (Figura 3A) e coloque pratos de papel alumínio contendo água com sabão ou um conservante de escolha em cada bandeja de alimentos (Figura 3B, aqui 20 mL de propilenoglicol foi usado como conservante).
- Siga as instruções fornecidas com o dispensador automatizado de alimentos para animais de estimação para definir os tempos de rotação da bandeja de alimentos. Primeiro, afina o horário do relógio, depois programe cada bandeja de distribuidor de alimentos para animais de estimação.
NOTA: O distribuidor automatizado de alimentos para animais de estimação gira bandejas de alimentos (1-6) em horários pré-programados. As tigelas de 6 refeições podem ser definidas para abrir a qualquer hora do dia ou da noite, com as bandejas girando em ordem sequencial. Para este estudo, o objetivo foi amostrar insetos noturnos e diurnos separadamente. A bandeja 1 foi amostrada a partir das 20h da primeira noite e depois mudou-se para a bandeja 2 às 7h da manhã seguinte, seguida pela bandeja 3 às 20h, bandeja 4 às 7:00, bandeja 5 às 20h e bandeja 6 às 7 da manhã. Uma função de atraso permitiu um atraso de um dia na amostragem porque levou 2 dias para configurar todos os locais, garantindo assim que a amostragem começasse no mesmo dia/horário em todos os locais.

Figura 3: Tigela automatizada de comida para animais de estimação. (A) Tigela de alimentos para animais de estimação de 6 refeições operadas por bateria usada para provar insetos em intervalos definidos pelo usuário. As tigelas de alimentos foram programadas em horários alternados para amostrar insetos noturnos e diurnos. Por exemplo, a bandeja 1 abriu às 20h (dia 1º), bandeja 2 aberta às 7h (dia 1), bandeja 3 aberta às 20h (dia 2), bandeja 4 aberta às 7h (dia 2), bandeja 5 aberta às 20h (dia 3), e bandeja 6 aberta às 7 horas (dia diurnal 3). (B) Tampa removida da tigela automatizada de alimentos para animais de estimação para mostrar as seis bandejas de coleta. Pratos de papel alumínio contendo propilenoglicol como conservante permitiram a fácil remoção dos insetos coletados. Clique aqui para ver uma versão maior desta figura.
- Coloque o distribuidor automatizado de alimentos para animais de estimação de volta sob a bacia de plástico e proteja a bacia até a peça da cerca de madeira com os parafusos galvanizados da cabeça de hexa-cabeça (Figura 1, item 14).
- Coloque uma corda no topo da armadilha com um karabiner (Figura 1, item 17). Com o uso de uma escada, iça a armadilha em posição e fixe-a sob luzes experimentais pelo karabinador.
- Fixar uma segunda estaca de madeira (17 mm x 17 mm x 1200 mm, Figura 2B) à árvore (ou poste de lâmpada) com um suporte de ângulo para estabilizar a armadilha em ventos fortes.
- A armadilha fica em cima da estaca; fixá-lo com duas grandes amarras de cabo (Figura 2B).
- Para coletar amostras de insetos, abaixe as armadilhas com uma corda. Remova o dispensador automatizado de alimentos para animais de estimação sob a bacia de plástico.
- Retire a tampa do dispensador de alimentos para animais de estimação (Figura 3A) e levante as bandejas de alumínio para despejar o conteúdo em frascos de amostra pré-rotulados (Figura 3B).
Resultados
As armadilhas foram testadas em uma pesquisa de insetos voadores atraídos pela iluminação experimental em quatro reservas de mata em Melbourne, Austrália. Os locais consistiam em matas remanescentes ou revegetadas cercadas por habitações residenciais e com média de 15 km de distância (alcance de 3 a 24 km) e 45 ha de tamanho (faixa de 30-59 ha). Foram instaladas dezesseis armadilhas, quatro em cada local, com e sem luzes experimentais (3 luzes e 1 controle por local), e pesquisadas por 3 dias e 3 noites de 30 de ...
Discussão
Apesar da armadilha automatizada de interceptação de voo descrita por Bolliger et al. (2020)8 estar bem projetada e muito eficaz na amostragem em períodos de tempo definidos pelo usuário, é provável que sejam proibitivas para muitos pesquisadores. Este estudo mostra que inquéritos de captura passiva utilizando armadilhas automatizadas para subpersuperse insetos voadores em períodos definidos pelo usuário podem ser realizados com um orçamento modesto. As armadilhas foram construídas para...
Divulgações
Nenhum
Agradecimentos
A pesquisa foi financiada por meio do La Trobe University Net Zero Fund, patrocinado pela Sonepar. A pesquisa foi realizada sob a licença científica do Departamento de Meio Ambiente, Terra, Água e Planejamento 10009741. Agradecemos a Martin Steinbauer por comentários sobre um rascunho antecipado e dois revisores anônimos.
Materiais
| Name | Company | Catalog Number | Comments |
| Batteries (C cell) – 10 pack | Duracell | MN1400B10 | https://www.duracell.com.au/product/alkaline-c-batteries/ |
| Battery operated automated 6 meal pet food bowl – each | OEM China | XR-P006-002 | Automated 6-meal pet food bowls range in price dependent on supplier, for example in the UK they can be purchased for £19 GBP ($36 AUD). |
| Galvanised hex-head screws (10-16 x 16 mm) – 100 pack | Bunnings Warehouse | 1-311-9151-CTPME | Bunnings Warehouse is an Australian hardware chain with stores in Australia and New Zealand. Items purchased from Bunnings Warehouse can be found at most hardware stores. https://www.bunnings.com.au/ |
| Galvanised steel angle bracket (125 x 150 mm) – each | Bunnings Warehouse | AZ11 | https://www.bunnings.com.au/ |
| Galvanised tie wire (0.70 mm x 75 m) – per roll | Bunnings Warehouse | 50218 | https://www.bunnings.com.au/ |
| Plastic basin (38 cm, 9 L round) – each | Ezy Storage | FBA31541 | https://www.ezystorage.com/product/laundry/basic-accessories/9l-round-basin/ |
| Plastic funnel (24 cm) – each | Sandleford | Pf24 | https://www.sandleford.com.au/plastic-funnel-24cm |
| Stainless steel angle bracket (20 mm) – 16 pack | Bunnings Warehouse | WEB2020 | https://www.bunnings.com.au/ |
| Stainless steel screws & nuts (M4 x 15 mm) – 18 pack | Bunnings Warehouse | SFA394 | https://www.bunnings.com.au/ |
| Stainless steel washers (3/16” & M5) – 50 pack | Bunnings Warehouse | EBM5005 | https://www.bunnings.com.au/ |
| Sunlite Polycarbonate roofing sheet (8mm x 610 mm x 2.4 m) – each | Suntuf (Palram Industries Ltd) | SL8CL2.4 | https://www.palram.com/au/product/sunlite-polycarbonate-multi-wall/ |
| Treated pine paling (150 x 12 mm) – each | STS Timber Wholesale P/L | n/a | https://www.ststimber.com.au/sts-timber-wholesale-products/fencing |
| Wooden stakes (1200 x 17 x 17 mm) – 10 pack | Lattice Makers | n/a | https://latticemakers.com/product/tomato-stakes-17x17mm-pack-of-10/ |
Referências
- Epsky, N. D., Morrill, W. L., Mankin, R. W., Capinera, J. L. Traps for Capturing Insects. Encyclopedia of Entomology. , (2008).
- Catanach, T. A., Silvy, N. J. Invertebrate sampling methods for use in wildlife studies. The Wildlife Techniques Manual. 1, 336-348 (2012).
- Montgomery, G. A., Belitz, M. W., Guralnick, R. P., Tingley, M. W. Standards and best practices for monitoring and benchmarking insects. Frontiers in Ecology and Evolution. 8, 579193 (2021).
- Haddock, J. K., Threlfall, C. G., Law, B., Hochuli, D. F. Light pollution at the urban forest edge negatively impacts insectivorous bats. Biological Conservation. 236, 17-28 (2019).
- Steinbauer, M. J. Using ultra-violet traps to monitor autumn gum moth, Mnesampela private (Lepidoptera: Geometridae), in south-eastern Australia. Australian Forestry. 66 (4), 279-286 (2003).
- Wakefield, A., Broyles, M., Stone, E. L., Harris, S., Jones, G. Quantifying the attractiveness of broad-spectrum street lights to aerial nocturnal insects. Journal of Applied Ecology. 55, 714-722 (2017).
- Williams, C. B. The time of activity of certain nocturnal insects, chiefly Lepidoptera, as indicated by a light-trap. Transactions of the Entomological Society of London. 83 (4), 523-555 (1935).
- Bolliger, J., Collet, M., Hohl, M., Obrist, M. K. Automated flight-interception traps for interval sampling of insects. PLoS ONE. 15 (7), 0229476 (2020).
- Grubisic, M., van Grunsven, R. H. A., Kyba, C. C. M., Manfrin, A., Hölker, F. Insect declines and agroecosystems: does light pollution matter. Annals of Applied Biology. 173, 180-189 (2018).
- Owens, A. C. S., Lewis, S. M. The impact of artificial light at night on nocturnal insects: a review and synthesis. Ecology and Evolution. 8 (22), 11337-11358 (2018).
- Rydell, J. Exploitation of insects around streetlamps by bats in Sweden. Functional Ecology. 6, 744-750 (1992).
- Bolliger, J., Hennet, T., Wermelinger, B., Blum, S., Haller, J., Obrist, M. K. Low impact of two LED colors on nocturnal insect abundance and bat activity in a peri-urban environment. Journal of Insect Conservation. 24, 625-635 (2020).
- Rodríguez, A., Orozco-Valor, P. M., Sarasola, J. H. Artificial light at night as a driver of urban colonization by an avian predator. Landscape Ecology. 36, 17-27 (2021).
- Hienton, T. E. Summary of investigations of electric insect traps. United States Department of Agriculture. , (1974).
- Johnson, C. G. A suction trap for small airborne insects which automatically segregates the catch into successive hourly samples. Annals of Applied Biology. 37 (1), 80-91 (1950).
- Hutchins, R. E. Insect activity at a light trap during various periods of the night. Journal of Economic Entomology. 33 (4), 654-657 (1940).
- Nagel, R. H., Granovsky, A. A. A turn-table light trap for taking insects over regulated periods. Journal of Economic Entomology. 40 (4), 583-586 (1947).
- Hill, C. J., Cemak, M. A new design and some preliminary results for a flight intercept trap to sample forest canopy arthropods. Australian Journal of Entomology. 36, 51-55 (1997).
- Lamarre, G. P. A., Molto, Q., Fine, P. V. A., Baraloto, C. A comparison of two common flight interception traps to survey tropical arthropods. ZooKeys. 216, 43-55 (2012).
- Wilkening, A. J., Foltz, J. L., Atkinson, T. H., Connor, M. D. An omnidirectional flight trap for ascending and descending insects. The Canadian Entomologist. 113, 453-455 (1981).
- Frost, S. W. Insects captured in light traps with and without baffles. The Canadian Entomologist. 90 (9), 566-567 (1958).
- Muirhead-Thompson, R. . Trap responses of flying insects: The influence of trap design on capture efficiency. , 287 (1991).
- Carrel, J. E. A novel aerial-interception trap for arthropod sampling. Florida Entomologist. 85 (4), 656-657 (2002).
- Steinbauer, M. J., Haslem, A., Edwards, E. Using meteorological and lunar information to explain catch variability of Orthoptera and Lepidoptera from 250 W Farrow light traps. Insect Conservation and Diversity. 5, 367-380 (2012).
- Recher, H. F., Majer, J. D., Ganesh, S. Seasonality of canopy invertebrate communities in eucalypt forests of eastern and western Australia. Australian Journal of Ecology. 21, 64-80 (1996).
- van Klink, R., et al. Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science. 368, 417-420 (2020).
- Wagner, D. L. Insect declines in the Anthropocene. Annual Review of Entomology. 65, 457-480 (2020).
- Cardoso, P., et al. Scientists' warning to humanity on insect extinctions. Biological Conservation. 242, 108426 (2020).
- Saunders, M. E., Janes, J. K., O'Hanlon, J. C. Moving on from the insect apocalypse narrative: Engaging with evidence-based insect conservation. BioScience. 70 (1), 80-89 (2020).
- Cardoso, P., Leather, S. R. Predicting a global insect apocalypse. Insect Conservation and Diversity. 12, 263-267 (2019).
- Owens, A. C. S., Cochard, P., Durrant, J., Perkin, E., Seymoure, B. Light pollution is a driver of insect declines. Biological Conservation. 241, 108259 (2020).
- Chapman, J. A., Kinghorn, J. M. Window traps for insects. The Canadian Entomologist. 87 (1), 46-47 (1955).
- Canaday, C. L. Comparison of insect fauna captured in six different trap types in a Douglas-fir forest. The Canadian Entomologist. 119, 1101-1108 (2012).
- Burns, M., Hancock, G., Robinson, J., Cornforth, I., Blake, S. Two novel flight-interception trap designs for low-cost forest insect surveys. British Journal of Entomology and Natural History. 27, 155-162 (2014).
- Basset, Y. A composite interception trap for sampling arthropods in tree canopies. Journal of the Australian Entomological Society. 27, 213-219 (1988).
- Russo, L., Stehouwer, R., Heberling, J. M., Shea, K. The composite insect trap: An innovative combination trap for biologically diverse sampling. PLoS ONE. 6 (6), 21079 (2011).
- Knuff, A. K., Winiger, N., Klein, A. -. M., Segelbacher, G., Staab, M. Optimizing sampling of flying insects using a modified window trap. Methods in Ecology & Evolution. 10 (10), 1820-1825 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados