È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Trappola di intercettazione di volo automatizzata a basso costo per il sottocampionamento temporale di insetti volanti attratti dalla luce artificiale di notte
In questo articolo
Riepilogo
Per studiare gli impatti della luce artificiale di notte (ALAN) sugli insetti volanti notturni, il campionamento deve essere limitato alla notte. Il protocollo descrive una trappola di intercettazione di volo automatizzata a basso costo che consente ai ricercatori di campionare in periodi definiti dall'utente con una maggiore replica.
Abstract
I metodi di campionamento sono selezionati in base alle specie bersaglio o alle esigenze spaziali e temporali dello studio. Tuttavia, la maggior parte dei metodi per il campionamento passivo degli insetti volanti ha una scarsa risoluzione temporale perché richiede tempo, costoso e / o logisticamente difficile da eseguire. Il campionamento efficace degli insetti volanti attratti dalla luce artificiale di notte (ALAN) richiede il campionamento in punti temporali definiti dall'utente (solo notturni) attraverso siti ben replicati, con conseguente sforzo di indagine ad alta intensità di tempo e lavoro o costose tecnologie automatizzate. Qui è descritta una trappola di intercettazione automatizzata a basso costo che non richiede attrezzature o competenze specialistiche per costruire e operare, rendendola un'opzione praticabile per studi che richiedono un sottocampionamento temporale su più siti. La trappola può essere utilizzata per affrontare una vasta gamma di altre questioni ecologiche che richiedono una scala temporale e spaziale maggiore di quanto sia fattibile con la precedente tecnologia trappola.
Introduzione
Esistono molte tecniche di campionamento degli artropodi 1,2,3, ma gli ecologi hanno spesso difficoltà ad applicare questi metodi in modi appropriati alle loro domande di ricerca (vedi 4). Quando si sceglie un metodo appropriato per il campionamento degli insetti, gli ecologi devono considerare le specie mirate, il tempo, lo sforzo e il costo coinvolti nelle diverse tecniche. Ad esempio, una limitazione comune è che può essere logisticamente difficile sottocampionare durante specifici periodi di tempo su siti replicati per quantificare le variabili temporali che influenzano l'attività delle specie, come i cambiamenti climatici o l'attività circadiana (ma vedi5). La maggior parte delle trappole per insetti passive sono impostate per lunghi periodi (ad esempio, su più giorni, settimane o addirittura mesi), prive di risoluzione temporale su scala fine1. Per le indagini mirate a periodi di tempo specifici su più siti di replica (come il campionamento notturno solo in siti distinti), un grande team potrebbe essere tenuto a visitare i siti per più giorni nello stesso momento (ad esempio, entro 30 minuti dall'alba e dal tramonto) per raccogliere campioni e ripristinare le trappole6; in caso contrario, è necessario un dispositivo di trapping automatico 5,7,8.
C'è un crescente campo di lavoro sugli impatti della luce artificiale di notte (ALAN) sui modelli di attività degli insetti e sulle dinamiche localizzate della popolazione 9,10; e sulle interazioni tra ALAN e tassi di predazione degli insetti 4,11,12,13. Tuttavia, per studiare gli impatti di ALAN sui taxa notturni degli insetti, il campionamento deve essere limitato alla notte. Diverse trappole luminose attive sono state descritte e utilizzate per il campionamento temporale automatizzato di insetti notturni14. Alcuni esempi includono semplici dispositivi di separazione a disco in caduta, in cui la cattura cade in un tubo stretto con un disco che cade ogni ora per separare la cattura15, o dispositivi di separazione girevole che ruotano le bottiglie di raccolta a intervalli di tempo 7,16,17. Queste precedenti trappole luminose automatizzate affrontano le sfide di campionamento coinvolte nei requisiti di indagine temporale, ma sono spesso grandi e ingombranti e utilizzano tecnologie obsolete o inaffidabili. Un nuovo dispositivo di campionamento passivo automatizzato è stato recentemente sviluppato e testato8. Questo dispositivo utilizzava una trappola di intercettazione di volo disponibile in commercio abbinata a un dispositivo di raccolta leggero progettato su misura costituito da una tavola girevole che conteneva una tazza di campionamento che consente di raccogliere il contenuto della trappola a intervalli definiti dall'utente8. Questa nuova trappola automatizzata impiega una programmazione sofisticata che può essere azionata da uno smartphone, ma è proibitivamente costosa da costruire a circa EURO 700 (AUD 1.000) per trappola8.
Le trappole di intercettazione del volo sono uno dei modi più efficienti per ispezionare gli insetti volanti 1,18,19 e lavorare sul principio che gli insetti volanti cadono a terra quando si scontrano con una superficie verticale. Le trappole di intercettazione di volo sono disponibili in una varietà di design. Tuttavia, la maggior parte sono in genere costruiti con una superficie trasparente o a rete e un contenitore di raccolta pieno d'acqua e / o un conservante. La nuova trappola qui descritta utilizza un tipo di alette incrociate / deflettore o una trappola di intercettazione multidirezionale20, dato che i deflettori incrociati hanno dimostrato di aumentare i tassi di cattura14,21 e campionare gli insetti da tutte le direzioni. Lo scopo di questa trappola è quello di esaminare gli insetti volanti notturni che sono attratti dalle luci artificiali. Questa fototassi provoca insetti che circondano la sorgente luminosa22; quindi una trappola multidirezionale è la più adatta.
Qui è descritta una trappola di intercettazione automatizzata a basso costo che non richiede attrezzature o competenze specialistiche per costruire e operare. La trappola utilizza un distributore automatico di cibo per animali domestici disponibile in commercio e articoli comuni disponibili nei negozi di ferramenta. Questo progetto costa meno di EURO 66 (AUD 105) per trappola da costruire (Tabella 1), rendendoli un'opzione praticabile per studi che richiedono un sottocampionamento temporale su più siti contemporaneamente.
Protocollo
1. Costruzione della trappola
NOTA: tutti i componenti necessari per costruire le trappole sono disponibili nella Tabella dei materiali. Ogni trappola è stata costruita come mostrato in Figura 1 e Figura 2 da una persona entro 2 ore.
- Utilizzare un seghetto alternativo per tagliare le lastre di copertura in policarbonato (8 mm x 610 mm x 2400 mm) in sezioni di 610 mm x 230 mm (Figura 1, voce 1 e 2). Quindi tagliare una scanalatura centrale di 8 mm a metà del centro di ciascun pannello (610 mm x 230 mm) per consentire ai due pannelli di scorrere insieme per formare un deflettore trasversale.
- Far scorrere i deflettori incrociati comodamente nell'apertura dell'imbuto di plastica (Figura 1, punto 4) e fissarli all'imbuto con staffe angolari in acciaio inossidabile da 20 mm (Fig 1, punto 5b).
- Con la staffa angolare in posizione, pre-praticare fori e quindi utilizzare viti e dadi M4 con rondelle (Figura 1, punto 6b) per fissare i deflettori incrociati all'imbuto.
- Sempre utilizzando il seghetto alternativo, tagliare un pezzo della lamiera di policarbonato (230 mm x 305 mm) dalle lastre rimanenti e fissare con staffe angolari in acciaio inossidabile da 20 mm (Figura 1, punto 5a) con un angolo di 90 ° rispetto alla parte superiore dei deflettori incrociati per formare un tetto protettivo (Figura 1, punto 3).
- Con la staffa angolare in posizione, pre-praticare fori e quindi utilizzare viti e dadi M4 con rondelle (Figura 1, punto 6a) per fissare il tetto al deflettore.
- Tagliare il beccuccio dell'imbuto a una lunghezza di ~ 30 mm con un seghetto per garantire che i vassoi campione dell'alimentatore automatico per animali domestici ruotino senza ostacoli agli intervalli programmati.
- Posizionare il distributore automatico di animali domestici (Figura 1, punto 8) all'interno di un bacino di plastica da 9 L (38 mm di diametro) (Figura 1, punto 7) per proteggere i campioni dalle condizioni atmosferiche.
- Praticare un foro di 20 mm nella parte superiore del bacino da 9 L e posizionare il beccuccio dell'imbuto nel foro per posizionarlo direttamente sopra il vassoio del campione.
- Utilizzando un trapano con una punta driver a testa esagonale, fissare il bacino di plastica che copre l'alimentatore per animali domestici a un pezzo di recinzione di pino trattato da 500 mm (Figura 1, punto 9) con viti a testa esagonale zincate (Figura 1, punto 14).
- Per stabilizzare l'intera trappola per il sollevamento in aria tramite corde, attaccare un palo di legno (17 x 17 x 1200 mm, Figura 1, punto 10) al pezzo di recinzione di pino trattato (Figura 1, punto 9) con una staffa angolare e un filo di cravatta (Figura 1, articoli 13, 15 e 16).
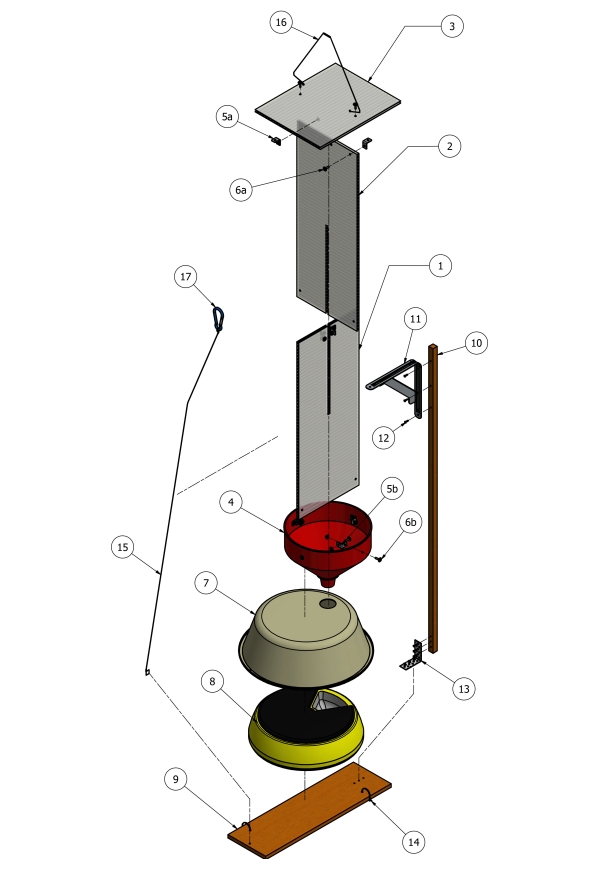
Figura 1: Diagramma schematico della costruzione della trappola. (1 e 2) lastre di policarbonato 610 mm x 230 mm x 8 mm; (3) foglio di policarbonato 230 mm x 305 mm x 8 mm; (4) Imbuto di plastica di diametro 24 cm; (5a-b) staffe angolari da 20 mm; (6a-b) M4 x 15 mm viti, rondelle e dadi; (7) 38 cm diametro 9 L bacino di plastica; (8) distributore automatico di alimenti per animali domestici; (9) 150 mm x 12 mm di pino trattato pallido; (10) palo di legno da 17 mm x 17 mm x 1200 mm; (11) staffa angolare 125 mm x 150 mm; (12) viti a testa esagonale da 16 mm x 16 mm; (13) staffa angolare; (14) viti a testa esagonale da 16 mm x 16 mm; (15 e 16) stabilizzatore a filo; (17) moschettone, utilizzato per abbassare e sollevare in posizione. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Distribuzione di trap
NOTA: Le trappole sono state attaccate ad alberi a 6 m dal suolo (direttamente sotto le luci sperimentali o di controllo) per catturare gli insetti volanti (Figura 2). Lo svuotamento e la raccolta delle trappole sono stati fatti da tre persone in un solo giorno. Ulteriori giorni possono essere campionati se necessario abbassando la trappola per rimuovere i campioni raccolti, ripristinando i distributori di cibo per animali domestici e rimettendo la trappola in posizione ogni tre giorni in base al regime di campionamento.

Figura 2: Trappola di intercettazione di volo automatizzata a basso costo per il campionamento di insetti in punti temporali definiti dall'utente. (A) I deflettori incrociati in policarbonato fungono da area di intercettazione di volo che consente di raccogliere insetti da tutti e quattro i lati. Il tetto in policarbonato serve a dirigere gli insetti verso il basso e proteggere i campioni raccolti dalle intemperie. L'imbuto sotto il volo intercetta i server della barriera per incanalare gli insetti che si sono scontrati con le barriere in policarbonato nei vassoi di raccolta alloggiati all'interno del bacino circolare. (B) Trappola sospesa sotto la luce sperimentale e fissata all'albero da un palo di legno e da una staffa angolare. La scatola di compensato sotto la trappola di intercettazione contiene un rilevatore di pipistrelli utilizzato per registrare passivamente i richiami di ecolocalizzazione prodotti dai pipistrelli insettivori liberi. Fare clic qui per visualizzare una versione più grande di questa figura.
- Una volta nel luogo di campionamento, rimuovere il distributore automatico di cibo per animali domestici (Figura 1, punto 8) da sotto il bacino di plastica.
- Aprire il distributore automatico di cibo per animali domestici (Figura 3A) e posizionare piatti di alluminio contenenti acqua saponata o un conservante di scelta in ogni vassoio di alimenti (Figura 3B, qui 20 ml di glicole propilenico sono stati usati come conservante).
- Seguire le indicazioni fornite con il distributore automatico di alimenti per animali domestici per impostare i tempi di rotazione del vassoio degli alimenti. Innanzitutto, imposta l'ora dell'orologio, quindi programma ogni vassoio del distributore di cibo per animali domestici.
NOTA: il distributore automatico di alimenti per animali domestici ruota i vassoi per alimenti (1-6) in orari pre-programmati. Le ciotole da 6 pasti possono essere impostate per l'apertura in qualsiasi momento del giorno o della notte, con i vassoi che ruotano in ordine sequenziale. Per questo studio, l'obiettivo era quello di campionare separatamente gli insetti notturni e diurni. Il vassoio 1 è stato campionato dalle 20:00 della prima notte e poi spostato nel vassoio 2 alle 7:00 del mattino seguente, seguito dal vassoio 3 alle 20:00, dal vassoio 4 alle 7:00, dal vassoio 5 alle 20:00 e dal vassoio 6 alle 7:00. Una funzione di ritardo ha consentito un ritardo di un giorno nel campionamento perché ci sono voluti 2 giorni per configurare tutti i siti, garantendo così che il campionamento iniziasse nello stesso giorno / ora in tutti i siti.

Figura 3: Ciotola automatica per alimenti per animali domestici. (A) Ciotola per alimenti per animali domestici a 6 pasti a batteria utilizzata per campionare gli insetti a intervalli definiti dall'utente. Le ciotole di cibo sono state programmate su orari alternati per assaggiare insetti notturni e diurni. Ad esempio, il vassoio 1 ha aperto alle 20(giorno 1 notturno), il vassoio 2 ha aperto alle 7 del mattino (giorno 1 diurno), il vassoio 3 ha aperto alle 20 (giorno 2 notturno), il vassoio 4 ha aperto alle 7 del mattino (giorno diurno 2), il vassoio 5 ha aperto alle 20 (giorno 3 notturno) e il vassoio 6 ha aperto alle 7 del mattino (giorno diurno 3). (B) Coperchio rimosso dalla ciotola automatizzata per alimenti per animali domestici per mostrare i sei vassoi di raccolta. I piatti di alluminio contenenti glicole propilenico come conservante hanno permesso la facile rimozione degli insetti raccolti. Fare clic qui per visualizzare una versione più grande di questa figura.
- Riposizionare il distributore automatico di cibo per animali domestici sotto il bacino di plastica e fissare il bacino al pezzo di recinzione in legno con le viti a testa esagonale zincate (Figura 1, punto 14).
- Attaccare una corda alla parte superiore della trappola con un moschettone (Figura 1, punto 17). Con l'uso di una scala, solleva la trappola in posizione e fissala sotto le luci sperimentali dal moschettone.
- Attaccare un secondo paletto di legno (17 mm x 17 mm x 1200 mm, Figura 2B) all'albero (o al lampione) con una staffa angolare per stabilizzare la trappola in caso di forti venti.
- La trappola si trova in cima al palo; fissarlo con due grandi fascette (Figura 2B).
- Per raccogliere campioni di insetti, abbassare le trappole con una corda. Rimuovere il distributore automatico di cibo per animali domestici da sotto il bacino di plastica.
- Rimuovere il coperchio del distributore di alimenti per animali domestici (Figura 3A) e sollevare i vassoi di alluminio per versare il contenuto in flaconcini di campione pre-etichettati (Figura 3B).
Risultati
Le trappole sono state sperimentate in un'indagine sugli insetti volanti attratti dall'illuminazione sperimentale in quattro riserve di boscaglia in tutta Melbourne, in Australia. I siti consistevano in boscaglie residue o rivegetate circondate da abitazioni residenziali e in media a 15 km di distanza (gamma 3-24 km) e 45 ettari di dimensioni (gamma 30-59 ettari). Sono state installate un totale di sedici trappole, quattro in ogni sito, con e senza luci sperimentali (3 luci e 1 controllo per sito), e rilevate per 3 giorn...
Discussione
Nonostante la trappola automatica di intercettazione di volo descritta da Bolliger et al. (2020)8 sia ben progettata e molto efficace nel campionamento in periodi di tempo definiti dall'utente, è probabile che siano proibitivi in termini di costi per molti ricercatori. Questo studio dimostra che le indagini di cattura passiva che utilizzano trappole automatizzate per il sottocampionamento degli insetti volanti in periodi definiti dall'utente possono essere effettuate con un budget modesto. Le tra...
Divulgazioni
Nessuno
Riconoscimenti
La ricerca è stata finanziata attraverso il La Trobe University Net Zero Fund, sponsorizzato da Sonepar. La ricerca è stata condotta sotto il permesso scientifico n. 10009741 del Dipartimento dell'ambiente, del territorio, dell'acqua e della pianificazione. Ringraziamo Martin Steinbauer per i commenti su una prima bozza e due revisori anonimi.
Materiali
| Name | Company | Catalog Number | Comments |
| Batteries (C cell) – 10 pack | Duracell | MN1400B10 | https://www.duracell.com.au/product/alkaline-c-batteries/ |
| Battery operated automated 6 meal pet food bowl – each | OEM China | XR-P006-002 | Automated 6-meal pet food bowls range in price dependent on supplier, for example in the UK they can be purchased for £19 GBP ($36 AUD). |
| Galvanised hex-head screws (10-16 x 16 mm) – 100 pack | Bunnings Warehouse | 1-311-9151-CTPME | Bunnings Warehouse is an Australian hardware chain with stores in Australia and New Zealand. Items purchased from Bunnings Warehouse can be found at most hardware stores. https://www.bunnings.com.au/ |
| Galvanised steel angle bracket (125 x 150 mm) – each | Bunnings Warehouse | AZ11 | https://www.bunnings.com.au/ |
| Galvanised tie wire (0.70 mm x 75 m) – per roll | Bunnings Warehouse | 50218 | https://www.bunnings.com.au/ |
| Plastic basin (38 cm, 9 L round) – each | Ezy Storage | FBA31541 | https://www.ezystorage.com/product/laundry/basic-accessories/9l-round-basin/ |
| Plastic funnel (24 cm) – each | Sandleford | Pf24 | https://www.sandleford.com.au/plastic-funnel-24cm |
| Stainless steel angle bracket (20 mm) – 16 pack | Bunnings Warehouse | WEB2020 | https://www.bunnings.com.au/ |
| Stainless steel screws & nuts (M4 x 15 mm) – 18 pack | Bunnings Warehouse | SFA394 | https://www.bunnings.com.au/ |
| Stainless steel washers (3/16” & M5) – 50 pack | Bunnings Warehouse | EBM5005 | https://www.bunnings.com.au/ |
| Sunlite Polycarbonate roofing sheet (8mm x 610 mm x 2.4 m) – each | Suntuf (Palram Industries Ltd) | SL8CL2.4 | https://www.palram.com/au/product/sunlite-polycarbonate-multi-wall/ |
| Treated pine paling (150 x 12 mm) – each | STS Timber Wholesale P/L | n/a | https://www.ststimber.com.au/sts-timber-wholesale-products/fencing |
| Wooden stakes (1200 x 17 x 17 mm) – 10 pack | Lattice Makers | n/a | https://latticemakers.com/product/tomato-stakes-17x17mm-pack-of-10/ |
Riferimenti
- Epsky, N. D., Morrill, W. L., Mankin, R. W., Capinera, J. L. Traps for Capturing Insects. Encyclopedia of Entomology. , (2008).
- Catanach, T. A., Silvy, N. J. Invertebrate sampling methods for use in wildlife studies. The Wildlife Techniques Manual. 1, 336-348 (2012).
- Montgomery, G. A., Belitz, M. W., Guralnick, R. P., Tingley, M. W. Standards and best practices for monitoring and benchmarking insects. Frontiers in Ecology and Evolution. 8, 579193 (2021).
- Haddock, J. K., Threlfall, C. G., Law, B., Hochuli, D. F. Light pollution at the urban forest edge negatively impacts insectivorous bats. Biological Conservation. 236, 17-28 (2019).
- Steinbauer, M. J. Using ultra-violet traps to monitor autumn gum moth, Mnesampela private (Lepidoptera: Geometridae), in south-eastern Australia. Australian Forestry. 66 (4), 279-286 (2003).
- Wakefield, A., Broyles, M., Stone, E. L., Harris, S., Jones, G. Quantifying the attractiveness of broad-spectrum street lights to aerial nocturnal insects. Journal of Applied Ecology. 55, 714-722 (2017).
- Williams, C. B. The time of activity of certain nocturnal insects, chiefly Lepidoptera, as indicated by a light-trap. Transactions of the Entomological Society of London. 83 (4), 523-555 (1935).
- Bolliger, J., Collet, M., Hohl, M., Obrist, M. K. Automated flight-interception traps for interval sampling of insects. PLoS ONE. 15 (7), 0229476 (2020).
- Grubisic, M., van Grunsven, R. H. A., Kyba, C. C. M., Manfrin, A., Hölker, F. Insect declines and agroecosystems: does light pollution matter. Annals of Applied Biology. 173, 180-189 (2018).
- Owens, A. C. S., Lewis, S. M. The impact of artificial light at night on nocturnal insects: a review and synthesis. Ecology and Evolution. 8 (22), 11337-11358 (2018).
- Rydell, J. Exploitation of insects around streetlamps by bats in Sweden. Functional Ecology. 6, 744-750 (1992).
- Bolliger, J., Hennet, T., Wermelinger, B., Blum, S., Haller, J., Obrist, M. K. Low impact of two LED colors on nocturnal insect abundance and bat activity in a peri-urban environment. Journal of Insect Conservation. 24, 625-635 (2020).
- Rodríguez, A., Orozco-Valor, P. M., Sarasola, J. H. Artificial light at night as a driver of urban colonization by an avian predator. Landscape Ecology. 36, 17-27 (2021).
- Hienton, T. E. Summary of investigations of electric insect traps. United States Department of Agriculture. , (1974).
- Johnson, C. G. A suction trap for small airborne insects which automatically segregates the catch into successive hourly samples. Annals of Applied Biology. 37 (1), 80-91 (1950).
- Hutchins, R. E. Insect activity at a light trap during various periods of the night. Journal of Economic Entomology. 33 (4), 654-657 (1940).
- Nagel, R. H., Granovsky, A. A. A turn-table light trap for taking insects over regulated periods. Journal of Economic Entomology. 40 (4), 583-586 (1947).
- Hill, C. J., Cemak, M. A new design and some preliminary results for a flight intercept trap to sample forest canopy arthropods. Australian Journal of Entomology. 36, 51-55 (1997).
- Lamarre, G. P. A., Molto, Q., Fine, P. V. A., Baraloto, C. A comparison of two common flight interception traps to survey tropical arthropods. ZooKeys. 216, 43-55 (2012).
- Wilkening, A. J., Foltz, J. L., Atkinson, T. H., Connor, M. D. An omnidirectional flight trap for ascending and descending insects. The Canadian Entomologist. 113, 453-455 (1981).
- Frost, S. W. Insects captured in light traps with and without baffles. The Canadian Entomologist. 90 (9), 566-567 (1958).
- Muirhead-Thompson, R. . Trap responses of flying insects: The influence of trap design on capture efficiency. , 287 (1991).
- Carrel, J. E. A novel aerial-interception trap for arthropod sampling. Florida Entomologist. 85 (4), 656-657 (2002).
- Steinbauer, M. J., Haslem, A., Edwards, E. Using meteorological and lunar information to explain catch variability of Orthoptera and Lepidoptera from 250 W Farrow light traps. Insect Conservation and Diversity. 5, 367-380 (2012).
- Recher, H. F., Majer, J. D., Ganesh, S. Seasonality of canopy invertebrate communities in eucalypt forests of eastern and western Australia. Australian Journal of Ecology. 21, 64-80 (1996).
- van Klink, R., et al. Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science. 368, 417-420 (2020).
- Wagner, D. L. Insect declines in the Anthropocene. Annual Review of Entomology. 65, 457-480 (2020).
- Cardoso, P., et al. Scientists' warning to humanity on insect extinctions. Biological Conservation. 242, 108426 (2020).
- Saunders, M. E., Janes, J. K., O'Hanlon, J. C. Moving on from the insect apocalypse narrative: Engaging with evidence-based insect conservation. BioScience. 70 (1), 80-89 (2020).
- Cardoso, P., Leather, S. R. Predicting a global insect apocalypse. Insect Conservation and Diversity. 12, 263-267 (2019).
- Owens, A. C. S., Cochard, P., Durrant, J., Perkin, E., Seymoure, B. Light pollution is a driver of insect declines. Biological Conservation. 241, 108259 (2020).
- Chapman, J. A., Kinghorn, J. M. Window traps for insects. The Canadian Entomologist. 87 (1), 46-47 (1955).
- Canaday, C. L. Comparison of insect fauna captured in six different trap types in a Douglas-fir forest. The Canadian Entomologist. 119, 1101-1108 (2012).
- Burns, M., Hancock, G., Robinson, J., Cornforth, I., Blake, S. Two novel flight-interception trap designs for low-cost forest insect surveys. British Journal of Entomology and Natural History. 27, 155-162 (2014).
- Basset, Y. A composite interception trap for sampling arthropods in tree canopies. Journal of the Australian Entomological Society. 27, 213-219 (1988).
- Russo, L., Stehouwer, R., Heberling, J. M., Shea, K. The composite insect trap: An innovative combination trap for biologically diverse sampling. PLoS ONE. 6 (6), 21079 (2011).
- Knuff, A. K., Winiger, N., Klein, A. -. M., Segelbacher, G., Staab, M. Optimizing sampling of flying insects using a modified window trap. Methods in Ecology & Evolution. 10 (10), 1820-1825 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon