Method Article
Laparoscopie-endoscopie Chirurgie coopérative pour le traitement des tumeurs stromales gastro-intestinales gastriques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La chirurgie coopérative laparoscopie-endoscopie est appropriée pour le traitement des tumeurs stromales gastro-intestinales gastriques de moins de 5 cm. Il peut obtenir les avantages respectifs des chirurgies endoscopiques et laparoscopiques tout en évitant leurs inconvénients.
Résumé
Compte tenu des lacunes des chirurgies endoscopiques ou laparoscopiques seules dans le traitement des tumeurs stromales gastro-intestinales gastriques (G-GIST), cette approche apporte une amélioration innovante dans le traitement des G-GIST de moins de 5 cm. La chirurgie coopérative laparoscopie-endoscopie (LECS) est utilisée pour combiner les chirurgies endoscopiques et laparoscopiques, en réalisant pleinement leurs avantages respectifs et en évitant leurs inconvénients. Les principales étapes sont les suivantes. Tout d’abord, la gastroscopie et la laparoscopie sont combinées pour confirmer l’emplacement et la limite de la tumeur. La résection tumorale est réalisée par laparoscopie, guidée par un gastroscope. L’échantillon est retiré par voie orale et la plaie gastrique fermée par laparoscopie. Ensuite, la gastroscopie et la laparoscopie sont combinées pour déterminer s’il y a un saignement de la plaie, si la suture est satisfaisante et si la cavité gastrique est déformée.
Le LECS présente des avantages naturels dans le traitement des G-GIST de moins de 5 cm. L’estimation précise de l’emplacement et de la limite de la tumeur améliore considérablement le taux de résection complet des tumeurs. Le risque de rupture tumorale est considérablement réduit et le pronostic à long terme des patients est considérablement amélioré. Le processus permet une résection précise de la tumeur, une préservation maximale du tissu gastrique normal et de la fonction des organes, et évite la déformation gastrique postopératoire. La rééducation postopératoire du patient est grandement accélérée et l’alimentation orale peut reprendre le jour de l’opération. L’échantillon est prélevé par la bouche pour éviter la nécessité d’une incision abdominale prolongée. Cela réduit considérablement la douleur postopératoire et les cicatrices du patient. La méthode raccourcit considérablement le séjour postopératoire à l’hôpital (c’est-à-dire que le congé est possible le lendemain de l’opération), ce qui augmente le roulement des lits d’hôpital.
Introduction
Les tumeurs stromales gastro-intestinales (TSGI) sont les lésions sous-épithéliales les plus courantes dans le tractus gastro-intestinal1. Les chirurgies endoscopiques ou laparoscopiques sont des méthodes chirurgicales courantes pour traiter les tumeurs stromales gastro-intestinales gastriques (G-GIST) de moins de 5 cm2,3,4. Cependant, la chirurgie endoscopique seule présente certains inconvénients, tels qu’une localisation et un jugement des limites inexacts de la tumeur, une rupture tumorale, une fermeture de plaie de mauvaise qualité, des saignements. Par conséquent, selon les lignes directrices, la chirurgie endoscopique seule n’est actuellement pas recommandée comme méthode chirurgicale pour le traitement des G-GIST5,6. Il existe également des différends concernant le traitement des G-GIST par la chirurgie endoscopique seule dans le travail clinique pratique. Par rapport à la chirurgie endoscopique, la chirurgie laparoscopique présente les avantages d’un champ de vision plus clair, d’une exposition plus complète et d’une plus grande plage de résection7,8. Cependant, la chirurgie laparoscopique seule a également des difficultés en termes de jugement de l’emplacement de la tumeur (pour les tumeurs endogènes) et un jugement inexact des limites tumorales, entraînant une rupture tumorale, en particulier lorsque la tumeur est située près de la courbure inférieure ou du cardia de la paroi postérieure de l’estomac. De plus, si la limite tumorale n’est pas jugée correctement, la plage de résection sera trop grande, ce qui entraînera une déformation gastrique.
Compte tenu des lacunes des chirurgies endoscopiques et laparoscopiques effectuées séparément, nous avons développé une approche innovante et améliorée dans le traitement des G-TIST de moins de 5 cm. La chirurgie coopérative laparoscopie-endoscopie (LECS) est utilisée pour combiner organiquement les techniques chirurgicales endoscopiques et laparoscopiques, en tirant pleinement parti de leurs avantages respectifs tout en évitant leurs inconvénients respectifs. Les objectifs de cette méthode comprennent la réduction des traumatismes, la préservation de la fonction gastrique, la promotion de la réadaptation postopératoire et l’amélioration de la qualité de vie postopératoire tout en éliminant de manière sûre et précise les G-GIST de moins de 5 cm.
Protocole
Cette étude a été menée avec l’approbation du Comité d’éthique de la recherche (Comité d’examen institutionnel) du premier hôpital affilié, de l’Université Sun Yat-sen (Guangzhou, Chine) (n ° 2022085) et du septième hôpital affilié, l’Université Sun Yat-sen (Shenzhen, Chine) (No. KY-2022-006-01).
1. Préparation préopératoire
- Mettez le patient sur 3 h de jeûne préopératoire pour le liquide et 6 h de jeûne pour les aliments solides.
- Administrer une anesthésie générale par intubation trachéale.
- Administrer des antibiotiques prophylactiques avec des céphalosporines de deuxième génération 30 minutes avant la chirurgie.
2. Exploration gastoscopique
- Après l’administration d’une anesthésie générale, effectuer une gastroscopie sur le patient avec insufflation de CO2 .
- Ensuite, aspirez le liquide gastrique résiduel et confirmez l’emplacement de la tumeur.
- Après l’exploration, aspirez complètement le CO2 et le liquide dans l’estomac et le liquide et le mucus dans l’œsophage et la gorge.
REMARQUE: Dans cet hôpital, les chirurgiens gastro-intestinaux effectuent une gastroscopie.
3. Exploration laparoscopique
- Placez le patient en position couchée avec les jambes ouvertes. Demandez au chirurgien de se tenir à gauche, à l’assistant à droite et au support de caméra entre les jambes du patient.
- Utilisez une méthode à quatre trocarts avec deux trocarts de 10 mm et deux trocarts de 5 mm et appliquez une pression de CO2 de 10 à 12 mmHg.
- Tout d’abord, confirmez l’emplacement et la limite de la tumeur dans l’estomac à l’aide d’une gastroscopie, si nécessaire. Ensuite, effectuez une large exploration intraabdominale pour exclure toute autre lésion.
4. Résection tumorale laparoscopique guidée par gastroscopie
- Disséquez le tissu de l’épiploon autour de la masse. Assurez-vous que le plan de dissection est juste au-dessus du muscle pour éviter les blessures au tronc vagal.
- Réséquez la masse en bloc avec une marge négative visuelle de 5 mm.
- Après la résection, placez l’échantillon dans la cavité gastrique à travers le défaut de la paroi gastrique.
REMARQUE: Avant la résection, il est recommandé de faire une suture séromusculaire résorbable 4-0 à environ 5 mm de la marge tumorale pour faciliter la rétraction pendant la résection.
5. Fermeture laparoscopique du défaut de la paroi gastrique
- Tout d’abord, effectuez une suture de course pleine épaisseur avec une suture résorbable 3-0 V-lock pour fermer le défaut dans la paroi gastrique.
- Ensuite, effectuez une suture de course séromolusculaire avec la même suture 3-0 V-lock pour renforcer la fermeture.
6. Vérification des plaies d’estomac
- Après la fermeture laparoscopique, effectuer un test d’étanchéité en utilisant une combinaison de laparoscopie et de gastroscopie.
- Vérifiez par laparoscopie s’il y a des bulles qui sortent de la plaie après avoir rincé avec de l’eau.
- Vérifiez s’il y a des saignements de plaie, si la suture est satisfaisante et si la cavité gastrique a été déformée par la gastroscopie.
7. Récolte orale d’échantillons
- Retirez l’échantillon par la bouche à l’aide d’un panier endoscopique.
REMARQUE: Si la taille de la tumeur est supérieure à 3 cm, une déflation temporaire du sac du tube d’intubation peut être nécessaire.
8. Gestion des spécimens
- Après la procédure, vérifiez visuellement l’échantillon pour confirmer l’état de la marge.
- Ensuite, immergez l’échantillon dans une solution neutre de formol à 10%.
REMARQUE: Trancher la tumeur tous les 1 cm si la tumeur mesure plus de 2 cm pour assurer une fixation complète.
Résultats
De 2017 à 2020, 10 patients atteints de G-GIST ont reçu des LECS (tableau 1). Chaque diagnostic GIST a été confirmé par un examen pathologique. Aucun n’a été converti en chirurgie ouverte. L’âge moyen était de 49 ans. La taille moyenne de la tumeur était de 2,7 cm. Emplacement de la tumeur: 7 à la paroi antérieure, 2 à la paroi postérieure et 1 à une courbure moindre. La durée moyenne de l’opération était de 112 minutes et la perte de sang peropératoire moyenne était de 8 mL. Tous les patients ont repris leur consommation de liquide buccal 2 h après la chirurgie et le séjour moyen à l’hôpital postopératoire était de 73 h. Tous les cas avaient des marges tumorales négatives et il n’y avait pas de complications périopératoires. Chaque patient a reçu un suivi régulier, y compris une gastroscopie. Il n’y avait pas de déformations gastriques (Figure 1) ou de récidives.
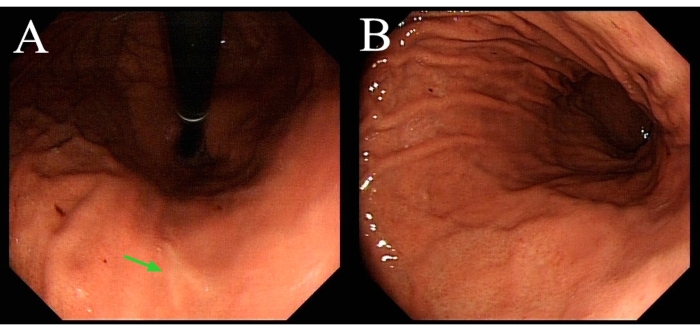
Figure 1 : Gastroscopie du même patient démontrée dans la vidéo trois mois après la chirurgie. (A) La flèche verte indique la plaie cicatrisée. (B) La cavité gastrique ne présente aucune déformation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Cas | Genre | Âge (années) | Taille de la tumeur (cm) | Durée de l’opération (min) | Perte de sang (mL) | Séjour postopératoire à l’hôpital (h) |
| 1 | F | 46 | 2 | 80 | 5 | 46 |
| 2 | F | 33 | 2.5 | 80 | 5 | 67 |
| 3 | F | 71 | 1.5 | 105 | 2 | 42 |
| 4 | F | 47 | 2.5 | 130 | 10 | 70 |
| 5 | M | 35 | 4 | 185 | 20 | 134 |
| 6 | F | 42 | 4 | 190 | 10 | 69 |
| 7 | M | 63 | 4.5 | 135 | 20 | 69 |
| 8 | F | 57 | 2.2 | 88 | 5 | 68 |
| 9 | M | 51 | 1.8 | 65 | 5 | 93 |
| 10 | M | 46 | 2.1 | 63 | 5 | 74 |
| Moyenne | 49 | 2.7 | 112 | 8 | 73 |
Tableau 1 : Paramètres cliniques de 10 cas.
Discussion
Le LECS présente des avantages naturels pour le traitement des G-GIST de moins de 5 cm. Le jugement précis de l’emplacement et de la limite de la tumeur améliore considérablement le taux de résection complète de la tumeur. Le processus réduit considérablement le risque de rupture tumorale et améliore considérablement le pronostic à long terme. La méthode permet une résection précise de la tumeur, une préservation maximale du tissu gastrique normal et de la fonction des organes, et évite la déformation gastrique postopératoire. La rééducation postopératoire du patient est considérablement accélérée et l’alimentation orale peut être reprise le jour de l’opération. L’échantillon est prélevé par la bouche pour éviter le retrait par une incision abdominale prolongée. Cela réduit considérablement la douleur postopératoire et les cicatrices du patient. Le processus raccourcit considérablement le séjour postopératoire à l’hôpital (permettant au patient d’être libéré le premier jour après l’opération) et accélère la rotation des lits d’hôpital9,10,11,12.
Certains éléments techniques sont remarquables. Tout d’abord, l’aspiration complète du liquide résiduel dans l’estomac lors de l’exploration macroscopique est essentielle pour prévenir la pollution peropératoire. Deuxièmement, le maintien continu de la tumeur avec une suture séro-vasculaire pendant la résection laparoscopique est également nécessaire pour prévenir la pollution peropératoire. Troisièmement, lors de la fermeture du défaut de la paroi gastrique, suturez le moins possible du tissu cutané gastrique pour assurer l’effet d’inversion de la suture et éventuellement garantir la qualité de guérison postopératoire de la plaie.
Tous les patients de cette cohorte ont reçu d’excellents résultats oncologiques avec un caractère peu invasif et une réserve de la fonction gastrique, aucune marge tumorale positive ou récidive, une perte de sang peropératoire inférieure à 10 mm et une durée d’opération inférieure à 2 h. Tous les patients ont eu une récupération postopératoire améliorée et en douceur, le séjour moyen à l’hôpital postopératoire étant de trois jours.
Il y a quelques limites à cette méthode. Tout d’abord, par rapport à d’autres formes de LECS sans ouverture de la paroi gastrique, telles que NEWS ou CLEAN-NET, cette méthode présente le risque de dissémination peropératoire du contenu gastrique. Cependant, le risque est très faible avec une aspiration gastoscopique complète avant d’ouvrir l’estomac. De plus, ce faible risque est raisonnable et acceptable par rapport à la durée d’opération considérablement raccourcie. Deuxièmement, bien que le diamètre maximal de la tumeur de cette cohorte ait atteint jusqu’à 4,5 cm, les tumeurs de plus de 4 cm de diamètre sont difficiles pour la récupération orale. Troisièmement, bien que la résection laparoscopique guidée par gastroscopie soit sûre et efficace dans la plupart des cas, une prérésection gastroscopique peut être nécessaire pour certaines tumeurs avec des modèles incarnés.
Nous n’avons pas discuté de l’application des LECS dans le traitement des G-TIST de plus de 5 cm. L’application future du LECS pourrait inclure des comparaisons avec la chirurgie endoscopique ou laparoscopique dans des essais randomisés prospectifs. En conclusion, la chirurgie coopérative laparoscopie-endoscopie est appropriée pour le traitement des tumeurs stromales gastro-intestinales gastriques de moins de 5 cm, obtenant les avantages respectifs des chirurgies endoscopiques et laparoscopiques tout en évitant leurs inconvénients.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (n° 82172637), le Fonds de l’Institut central de recherche à but non lucratif de l’Académie chinoise des sciences médicales (n° 2021-JKCS-004) et le Laboratoire clé provincial de recherche sur le cancer digestif du Guangdong (n° 2021B1212040006).
matériels
| Name | Company | Catalog Number | Comments |
| Eneoscopic facilites | |||
| Camera Control Unit | Olympus, Tokyo, Japan | CV-290 | |
| Disposable Grasping Forceps with Net | Changzhou Jiuhong Medical Instrument, Changzhou, China | JHY-FG-25-230-C1-5 | |
| Electronic Gastroscope | Olympus, Tokyo, Japan | GIF-HQ290 | |
| LCD Monitor | Olympus, Tokyo, Japan | OEV262H | |
| Xenon Light Source | Olympus, Tokyo, Japan | CLV-290 | |
| Laparoscopic facilities | |||
| Camera Control Unit | Olympus, Tokyo, Japan | OTV-S400 | |
| Camera Head | Olympus, Tokyo, Japan | CH-S400-XZ-EB | |
| HARMONIC ACE+7 | Johnson & Johnson, New Brunswick, USA | HARH36 | |
| LCD Monitor | Olympus, Tokyo, Japan | LMD-X550S/LMD-X310S | |
| Ultrasonic Surgical & Electrosurgical Generator | Johnson & Johnson, New Brunswick, USA | GEN11CN | |
| ULTRA Telescope | Olympus, Tokyo, Japan | WA4KL130 | |
| V-Loc Suture | Medtronic, Minneapolis, USA | 3-0. | |
| Xenon Light Source | Olympus, Tokyo, Japan | CLV-S400 |
Références
- Rubin, B. P., Heinrich, M. C., Corless, C. L. Gastrointestinal stromal tumour. Lancet. 369 (9574), 1731-1741 (2007).
- Chen, K., et al. Systematic review and meta-analysis of safety and efficacy of laparoscopic resection for gastrointestinal stromal tumors of the stomach. Surgical Endoscopy. 29 (2), 355-367 (2015).
- Koh, Y. X., et al. A systematic review and meta-analysis comparing laparoscopic versus open gastric resections for gastrointestinal stromal tumors of the stomach. Annals of Surgical Oncology. 20 (11), 3549-3560 (2013).
- Zhou, P. H., et al. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria. Surgical Endoscopy. 25 (9), 2926-2931 (2011).
- Li, J., et al. Chinese consensus guidelines for diagnosis and management of gastrointestinal stromal tumor. Chinese Journal of Cancer Research. 29 (4), 281-293 (2017).
- Mantese, G. Gastrointestinal stromal tumor: epidemiology, diagnosis, and treatment. Current Opinion in Gastroenterology. 35 (6), 555-559 (2019).
- Karakousis, G. C., et al. Laparoscopic versus open gastric resections for primary gastrointestinal stromal tumors (GISTs): a size-matched comparison. Annals of Surgical Oncology. 18 (6), 1599-1605 (2011).
- Melstrom, L. G., Phillips, J. D., Bentrem, D. J., Wayne, J. D. Laparoscopic versus open resection of gastric gastrointestinal stromal tumors. American Journal of Clinical Oncology. 35 (5), 451-454 (2012).
- Shoji, Y., et al. Optimal minimally invasive surgical procedure for gastric submucosal tumors. Gastric Cancer. 21 (3), 508-515 (2018).
- Hiki, N., et al. Laparoscopic endoscopic cooperative surgery. Digestive Endoscopy. 27 (2), 197-204 (2015).
- Ntourakis, D., Mavrogenis, G. Cooperative laparoscopic endoscopic and hybrid laparoscopic surgery for upper gastrointestinal tumors: Current status. World Journal of Gastroenterology. 21 (43), 12482-12497 (2015).
- Aisu, Y., Yasukawa, D., Kimura, Y., Hori, T. Laparoscopic and endoscopic cooperative surgery for gastric tumors: Perspective for actual practice and oncological benefits. World Journal of Gastrointestinal Oncology. 10 (11), 381-397 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon