Method Article
Un dépistage multiplexé à haut débit pour le diabète de type 1, les maladies cœliaques et la COVID-19
Dans cet article
Résumé
Conformément au besoin urgent de dépistage du diabète de type 1, de la maladie cœliaque et de la maladie à coronavirus 2019, nous avons développé un test d’électrochimiluminescence 6-Plex à haut débit pour détecter simultanément les quatre autoanticorps des îlots, les autoanticorps de la transglutaminase tissulaire et les anticorps dirigés contre le domaine de liaison aux récepteurs du coronavirus 2 du syndrome respiratoire aigu sévère.
Résumé
Un essai clinique en cours, Autoimmunity Screening for Kids (ASK), est la première étude de dépistage dans la population générale du diabète de type 1 (DT1) et de la maladie cœliaque aux États-Unis. Avec la pandémie de maladie à coronavirus 2019 (COVID-19), l’épidémiologie de la COVID-19 dans la population générale et les connaissances sur l’association entre l’infection COVID-19 et le développement du DT1 sont nécessaires de toute urgence. La méthode de criblage actuellement standard du test de liaison radio (RBA) a relevé deux grands défis : une faible efficacité avec un seul format de test et une faible spécificité de la maladie avec une grande proportion d’anticorps de faible affinité générés lors du criblage. Avec la plate-forme du test d’électrochimiluminescence multiplex (ECL) que nous avons établie précédemment, un nouveau test ECL 6-Plex a été développé qui combine, dans un seul puits, les quatre autoanticorps des îlots (IAbs) à l’insuline, l’acide glutamique décarboxylase (GAD65), l’antigène 2 de l’insulinome (IA-2) et le transporteur de zinc 8 (ZnT8) pour le DT1, les autoanticorps transglutaminases (TGA) pour la maladie cœliaque et les anticorps du domaine de liaison au récepteur (RBD) du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) pour COVID-19. Le test a été validé à l’aveugle à l’aide de 880 échantillons de l’étude ASK, dont 325 échantillons positifs et 555 échantillons tous négatifs pour les anticorps, et comparé aux RBA standard et à un seul test ECL. Avec les avantages d’une efficacité élevée, d’un faible coût et d’un faible volume sérique, ce test a été accepté comme principal outil de dépistage pour l’étude ASK.
Introduction
De vastes études épidémiologiques menées dans le monde entier démontrent que l’incidence du diabète de type 1 (DT1) a augmenté rapidement de 3 % à 5 % par an, et que la prévalence du DT1 a doublé au cours des 20 dernières années, en particulier chez les jeunes enfants[1,2]. Les autoanticorps des îlots pancréatiques apparaissent généralement des années avant les symptômes cliniques et sont actuellement les biomarqueurs prédictifs et diagnostiques les plus fiables pour le DT13. Le dépistage des autoanticorps DT1 permet d’identifier les personnes à risque de passer au DT1 clinique, d’éduquer le public, de réduire considérablement la complication potentiellement mortelle de l’acidocétose et de bénéficier aux essais cliniques pour les thérapies de prévention. Des efforts mondiaux de prévention du DT1 sont en cours et de multiples essais interventionnels sont en cours chez des sujets ayant un SAII positif pour retarder la progression vers le DT1 clinique, et le Centre Barbara Davis pour le diabète a lancé le premier essai clinique américain de dépistage dans la population générale en 2016 pour le DT1 et la maladie cœliaque, Autoimmunity Screening for the Kids (ASK)4 . La maladie cœliaque (MC) est une maladie inflammatoire intestinale chronique liée à des facteurs immunitaires et génétiques. La prévalence de la MC chez les enfants atteints de DT1 peut atteindre jusqu’à 24,5 %5. Plus de la moitié des personnes atteintes de la maladie coeliaque peuvent ne pas présenter de symptômes typiques à la présentation 6, de sorte que le dépistage sérologiquede la maladie cœliaque est tout à fait nécessaire.
Depuis le début de la pandémie de maladie à coronavirus 2019 (COVID-19), plus de 200 millions de cas ont été signalés dans le monde, et les enfants représentent jusqu’à 16 % des cas confirmés en laboratoire7. De nombreuses études ont démontré l’impact du DT1 existant sur la gravité et la mortalité de l’infection à la COVID-198, tandis que l’impact de l’infection à la COVID-19 sur le développement du DT1 n’est pas clair. L’étude du taux total d’infection par la COVID-19 dans la population générale par la détermination des anticorps du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-COV-2) et l’étude de l’association entre l’infection par la COVID-19 et le déclenchement de l’auto-immunité DT1 ou l’accélération de la progression du DT1 sont urgentes et très importantes, tandis que l’étude ASK en cours est une excellente plate-forme pour cela. En raison du format de test unique et de la génération d’une grande proportion de positivité aux anticorps de faible affinité, le test de liaison radio standard (RBA) a rencontré un goulot d’étranglement de faible efficacité et de faible spécificité de la maladie9. Dans le présent article, nous présentons un nouveau test d’électrochimiluminescence (ECL) 6-Plexed construit sur notre précédente plateforme de test ECL multiplex utilisant une plaque multiple-Plex, combinant six tests d’autoanticorps dans un seul puits, y compris les quatre principaux IAbs à l’insuline (IAA), l’acide glutamique décarboxylase-65 (GADA), l’antigène 2 de l’insulinome (IA-2A) et le transport de zinc 8 (ZnT8A), autoanticorps contre la transglutaminase (TGA) pour la maladie cœliaque, et les anticorps du domaine de liaison aux récepteurs (RBD) du SRAS-CoV-2 (COVID-19A). Il s’agit du premier test multiplex qui a recruté un panel complet de quatre IAbs majeurs et l’a combiné avec TGA et COVID-19A. Il a été validé et officiellement accepté comme principal outil de dépistage remplaçant la RBA standard dans l’étude ASK.
Protocole
Le protocole de recherche a été approuvé par le Colorado Multiple Institutional Review Board.
1. Préparation du tampon
- Préparer le tampon d’étiquetage (2x PBS, pH 7,9) : Ajouter 100 mL de 10x PBS à 400 mL d’eau distillée et ajuster le pH en utilisant NaOH à 7,9.
- Faire 3 mM de biotine et de Ru Sulfo-NHS: Dissoudre 1 mg de biotine dans 588 μL de tampon de marquage et dissoudre 150 nmol de Ru Sulfo-NHS dans 50 μL de tampon d’étiquetage.
- Préparer le tampon antigénique (1% BSA): Dissoudre 5 g d’albumine sérique bovine (BSA) dans 500 mL de 1x PBS.
- Préparer le tampon de revêtement (bloqueur A à 3 %) : Dissoudre 15 g de bloqueur A dans 500 mL de 1x PBS.
- Préparer le premier tampon de lavage (0,05 % Tween 20, PBST) : Mélanger 2,5 mL de Tween 20 dans 5 000 mL de 1x PBS.
- Préparer le deuxième tampon de lavage (0,4 M NaCl) : Mélanger 50 mL de NaCl 5 M dans 575 mL d’eau distillée pour obtenir la solution de NaCl 0,4 M.
REMARQUE: Pour un étiquetage efficace, utilisez toujours des solutions de biotine fraîchement préparées et de Ru Sulfo-NHS et non des solutions stockées fabriquées précédemment.
2. Marquage des protéines antigéniques avec la biotine et le Ru Sulfo-NHS séparément
REMARQUE : Une concentration plus élevée de protéine antigénique ≥0,5 mg/mL est recommandée pour une plus grande efficacité de marquage.
- Préparer six solutions protéiques antigéniques ciblées, y compris la proinsuline, GAD-65, IA-2, ZnT8, TG et le domaine de liaison aux récepteurs (RBD) de la protéine de pointe du SRAS-CoV-2. Calculer les moles de chaque protéine antigénique en fonction de son poids moléculaire et faire des rapports molaires appropriés de biotine ou de Ru Sulfo-NHS. Le rapport de l’antigène à la somme de la biotine ou du Ru Sulfo-NHS sera de 1:5 pour les petits antigènes moléculaires (poids moléculaire ≤10 kd), tels que la protéine proinsuline. Pour les antigènes moléculaires moyens (poids moléculaire 10-50 kd), tels que ZnT8, le rapport s’ajustera à 1:10. Pour les antigènes de poids moléculaire de grande taille (poids moléculaire >50 kd), tels que le TAG, le rapport molaire sera de 1:20.
- Divisez la protéine antigénique en deux parties égales et mélangez-la séparément avec de la biotine et du Ru Sulfo-NHS en utilisant le rapport molaire calculé à l’étape 2.1. Incuber le mélange à température ambiante (RT) pendant 1,5 h, en évitant la lumière.
REMARQUE: Tous les produits chimiques réducteurs tels que le Tris ou la glycine dans le tampon de la protéine antigénique doivent être éliminés par une colonne de spin de dimensionnement amorcée avec un tampon de 2x PBS (pH 7,9). - Amorcez les colonnes de spin avec 2x PBS (la taille de la colonne de spin, 2 mL ou 5 mL, dépend du volume de la protéine de l’antigène de marquage): Ajouter 1 ml de tampon PBS 2x à la colonne de spin, centrifuger à 1 000 x g pendant 2 min, et répéter l’étape 2x plus.
- Laisser le mélange protéine-biotine antigénique ou -Ru Sulfo-NHS passer par la colonne de spin amorcée 1x (centrifuger la colonne à 1 000 x g pendant 2 min) pour la purification et arrêter la réaction de marquage.
- Mesurer le volume final de la protéine antigénique marquée éluée à partir des colonnes de spin, en calculant les concentrations de protéine antigénique marquée à la biotine ou au Ru Sulfo-NHS. Fabriquez de plus petites aliquotes de protéine antigénique marquée (50 μL/tube) et conservez-les à −80 °C pour une utilisation à long terme.
REMARQUE: La couverture de protéines après chaque colonne de spin sera un taux de rétention d’environ 90% à 95%.
3. Définir la meilleure concentration et les meilleurs ratios pour les antigènes marqués à la biotine et au Ru Sulfo-NHS pour le test ECL 6-Plex (test en damier)
NOTE: Le test en damier pour chaque antigène est nécessaire avant l’intégration dans le test multiplexé.
- Appliquez le test en damier pour chaque antigène séparément.
REMARQUE : Étapes 3.2.-3.7. utilisera TGA comme bref exemple. Le processus de dosage en damier TGA consiste à simuler le processus de dosage, mais avec un seul type d’antigène. - Faire la dilution en série du tTG biotinylé et du tTG marqué au Ru Sulfo-NHS. Les concentrations de travail recommandées de la première solution de mélange commencent à partir de 240 ng / mL pour le tTG biotinylé et marqué au Ru Sulfo-NHS. Supposons que les concentrations de tTG biotinylée d’origine et de tTG marquée au Ru Sulfo-NHS sont de 1,0 μg/μL. Faire une dilution 10x de la tTG originale marquée au Ru Sulfo-NHS et une dilution 5x de la tTG biotinylée originale avec 5% de BSA.
- Mélanger 4 μL de protéine tTG biotinylée avec 156 μL de BSA (tampon antigénique) à 5 % et 240 μL de l’agent de liaison conjugué à la streptavidine dans un tube et incuber la solution à TA pendant 30 min. Ensuite, ajoutez 160 μL de solution stop et incuber à TA pendant encore 30 minutes. Prendre 400 μL du mélange et mélanger avec 2 mL de solution d’arrêt. La concentration du tTG biotinylé dans le mélange est de 240 ng/mL.
- Pour effectuer une dilution en série de l’antigène ZnT8 marqué à la biotine, préparer cinq autres nouveaux tubes, prélever 1 mL d’une partie aliquote du mélange à l’étape 3.3. et mélanger avec 1 mL de solution stop dans un nouveau tube, et obtenir le mélange avec une concentration de 120 ng / mL. Répétez cette étape, faites des dilutions en série 1:1 et obtenez la tTG marquée à la biotine à 60 ng / mL, 30 ng / mL, 15 ng / mL et 7,5 ng / mL.
- Ajouter 4 μL de tTG marqué au Ru Sulfo-NHS avec 1,6 mL de solution stop, et obtenir un mélange de tTG marqué au Ru Sulfo-NHS à une concentration de 240 ng / mL. Avec les mêmes étapes de 3.4., faites des dilutions en série 1:1 et obtenez l’antigène ZnT8 marqué au Ru Sulfo-NHS à 60 ng / mL, 30 ng / mL, 15 ng / mL, 7,5 ng / mL et 3,75 ng / mL. La dernière concentration est de 0 ng / mL, avec une solution d’arrêt et aucun antigène marqué au Ru Sulfo-NHS.
- Préparer des échantillons de sérum de contrôle positif et de contrôle négatif (préqualifiés et normalisés par un seul test de tTG ECL) et une plaque de PCR à 96 puits. Aliquote les échantillons de sérum témoin positif et négatif dans la moitié gauche et la moitié droite de la plaque, respectivement, avec 7 μL dans chaque puits. Ajouter 1x PBS à la plaque, avec 33 μL par puits.
- Sur la moitié gauche de la plaque de PCR, ajouter 24 μL de la solution de liaison tTG diluée à la biotine en série à chaque puits, une colonne avec une concentration dans l’ordre du plus élevé au plus bas. De la même manière, ajoutez 16 μL de l’antigène tTG marqué au Ru Sulfo-NHS dilué en série à chaque puits, une rangée avec une concentration, puis mélangez soigneusement. Répétez l’étape sur la moitié droite de la plaque PCR.
- Continuez le reste des étapes de dosage décrites aux étapes 5.3.-9.1. jusqu’à l’obtention des données brutes de comptage.
- Calculer les rapports entre les signaux de contrôle positifs et les signaux de contrôle négatifs correspondants. Déterminer la meilleure concentration pour l’antigène marqué à la biotine et l’antigène marqué au Ru Sulfo-NHS avec des valeurs de rapport plus élevées et un fond plus faible pour l’échantillon témoin négatif. Les concentrations optimales de travail de la biotine et de la protéine antigénique marquée Ru Sulfo-NHS sont indiquées ci-dessous : 16,0 ng/mL et 8,0 ng/mL pour GAD65, 18,8 ng/mL et 9,4 ng/mL pour le SRAS-CoV-2 RBD, 42,0 ng/mL et 42,0 ng/mL pour l’IA-2, 60,0 ng/mL et 60,0 ng/mL pour la tTG, 4,2 ng/mL et 4,2 ng/mL pour le ZnT8, et 31,3 ng/mL et 31,3 ng/mL pour la proinsuline.
4. Créer une solution d’antigène couplée à un agent de liaison
- Diluer les antigènes marqués à la biotine et au Ru Sulfo-NHS avec 5% de BSA aux concentrations de travail optimales conformément à l’étape 3.9.
- Lier des agents de liaison présélectionnés à chaque protéine antigénique biotinylée. Pour un essai sur plaque à 96 puits, ajouter 4 μL de GAD65 biotinylé, de SRAS-CoV-2 RBD, IA-2, tTG, ZnT8 et de protéine d’antigène proinsuline dans un tube séparé contenant 156 μL de BSA à 1 % et mélanger avec 240 μL de liants conjugués à la streptavidine 1, 2, 3, 8, 9 et 10 correspondants (Figure 1). Incuber le mélange pendant 30 min à TA.
- Aliquote 160 μL de solution stop dans chaque tube et incuber le mélange à TA pendant 30 min. Prélever 400 μL de la solution de mélange de chaque tube et les combiner ensemble.
- Ajouter 4 μL de Ru Sulfo-NHS marqué GAD65, SARS-CoV-2 RBD, IA-2, tTG, ZnT8 et antigène de proinsuline au mélange ci-dessus, puis ajouter 1,6 mL de solution stop et 3,2 mL de 1x PBS et mélanger. Maintenant, la solution antigénique est prête à être utilisée dans le test.
5. Incuber les échantillons de sérum avec l’antigène marqué
- Aliquote 7 μL de sérum par puits pour une plaque PCR à 96 puits et couvrir d’un film d’étanchéité. Préchauffer les sérums à 56 °C pendant 30 min sur une machine de PCR. Centrifuger brièvement la plaque à 100 x g pendant 1 min.
- Ajouter 63 μL de solution antigénique (préparée à l’étape 4.4) par puits, et mélanger avec les sérums. Couvrir la plaque PCR avec une feuille d’étanchéité pour éviter la lumière.
- Agiter la plaque sur un agitateur à 450 tr/min à TA pendant 2 h, puis incuber la plaque à 4 °C pendant 18-24 h.
6. Préparez la plaque 6-Plex
- Prenez une plaque 6-Plex du réfrigérateur à 4 °C, permettant à la plaque de venir à RT. Ajouter 150 μL de bloqueur A à 3% dans chaque puits de la plaque 6-Plex.
- Remettez l’assiette au réfrigérateur à 4 °C, couvrez la plaque de papier d’aluminium en évitant la lumière et incuber pendant la nuit.
REMARQUE : Les étapes de dosage du jour 1 comprennent les sections 4.-6.
7. Transférer le sérum/antigène incuber dans la plaque 6-Plex
- Le lendemain, sortez la plaque d’incubation 6-Plex du réfrigérateur et videz tout le tampon de l’assiette. Tapotez l’assiette sur du papier absorbant pour la sécher.
- Lavez la plaque 6-Plex 3x avec 150 μL de tampon de lavage par puits à chaque fois. Sécher l’assiette sur du papier absorbant, et sérum/antigène aliquote incube de chaque puits de la plaque de PCR d’incubation nocturne dans deux puits de la plaque 6-Plex (30 μL par puits pour les doublons).
- Couvrir la plaque avec du papier d’aluminium, puis mettre la plaque sur un agitateur à plaque, et agiter à une vitesse de 450 tr / min à RT pendant 1 h.
8. Lavez la plaque 6-Plex et ajoutez un tampon de lecture
- Versez la solution dans la plaque 6-Plex et lavez la plaque 3x avec 150 μL de tampon de lavage NaCl 0,4 M par puits à chaque fois.
- Une fois le troisième lavage terminé, séchez la plaque contre le papier absorbant et ajoutez 150 μL de tampon de lecture dans chaque puits.
REMARQUE: Les bulles d’air dans le puits affectent la précision de la machine de lecture de plaques et doivent être évitées à tout prix.
9. Lire la plaque et analyser les données
- Comptez la plaque sur un analyseur à électrochimiluminescence. Les résultats de lecture seront présentés avec les valeurs en comptages par seconde (CPS). Calculer l’indice relatif d’anticorps de chaque échantillon à l’aide du CPS brut obtenu à partir de la machine de lecture par rapport au CPS des témoins positifs et négatifs de l’étalon interne de chaque anticorps spécifique (valeur de l’indice = [CPS (échantillon) - CPS (étalon négatif)] / [CPS (étalon positif) - CPS (étalon négatif)]).
- Déterminer les résultats négatifs ou positifs en matière d’anticorps à l’aide des valeurs seuils qui ont été établies entre le 99,5e et le 99,8e percentiles de 555 échantillons témoins négatifs de l’étude ASK (tous les échantillons négatifs d’anticorps sans antécédents ou antécédents familiaux de diabète ou de tout autre type de maladie auto-immune).
REMARQUE : Les étapes de dosage du jour 2 comprennent les sections 7 à 9.
Résultats
Les tableaux 1, 2 et 3 illustrent les résultats représentatifs. Les CPS bruts obtenus à partir de la machine à lire sont illustrés dans le tableau 1. Dans le tableau 2, les CPS bruts ont été classés et triés par les six agents de liaison et les anticorps correspondants. Le tableau 3 montre les valeurs d’indice calculées avec CPS telles que décrites dans le protocole d’essai. Toutes les valeurs de comptage brutes doivent être vérifiées pour éviter les résultats d’index finaux erronés causés par de mauvais doublons. Dans le tableau 1, des exemples de doublons défectueux sont donnés, ce qui a entraîné une erreur pour le calcul de l’indice final dans le tableau 3.
Ce test a été validé à l’aveugle en utilisant 880 échantillons sélectionnés de l’étude ASK avec 325 échantillons positifs IAbs et 555 échantillons négatifs pour tous les abs. Les niveaux d’autoanticorps du test ECL 6-Plex pour les 880 échantillons ont été comparés point par point avec les niveaux des tests ECL uniques correspondants (Figure 2) et avec la RBA étalon unique correspondante (Figure 3). Le seuil, la sensibilité et la spécificité de chaque anticorps sont indiqués dans le tableau 4. La sensibilité et la spécificité de ce test ECL-COVID-19A ont été identifiées comme étant de 100 % et 99,9 %, respectivement10.
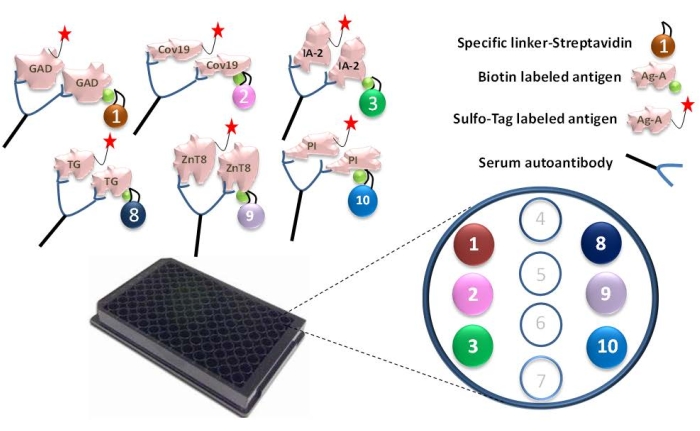
Figure 1 : Illustration du test ECL 6-Plex. Les autoanticorps sériques établissent la connexion de l’antigène marqué au Ru Sulfo-NHS à l’antigène biotinylé, qui est couplé à un agent de liaison spécifique et forme un complexe antigène-anticorps-antigène-liant. Les complexes sont capturés à travers chaque linker spécifique sur les points spécifiques de la plaque 6-Plex. Pour chaque antigène, les numéros de liaison spécifiques ont été attribués : GAD-linker-1, Covid-19-linker-2, IA-2-linker-3, tTG-linker-8, ZnT8-linker-9 et Proinslulin-linker-10. Ce chiffre a été modifié avec la permission de He et al.11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
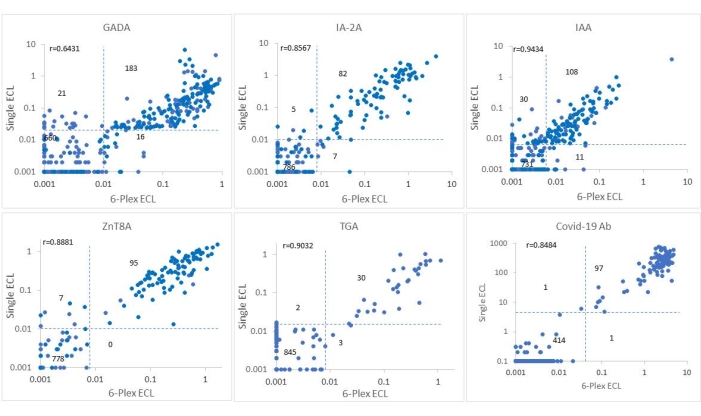
Figure 2 : Comparaison de six niveaux d’anticorps dans 880 échantillons de l’étude ASK entre le test ECL unique et le test ECL 6-Plex. Les panels présentent des comparaisons des niveaux d’anticorps pour GADA, IAA, IA-2A, ZnT8A, TGA et COVID-19A, respectivement (l’indice de COVID-19A a été présenté comme (100 x valeur calculée de l’indice)). Les lignes pointillées représentent les seuils de dosage pour chaque test d’anticorps. Ce chiffre a été modifié avec la permission de He et al.11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
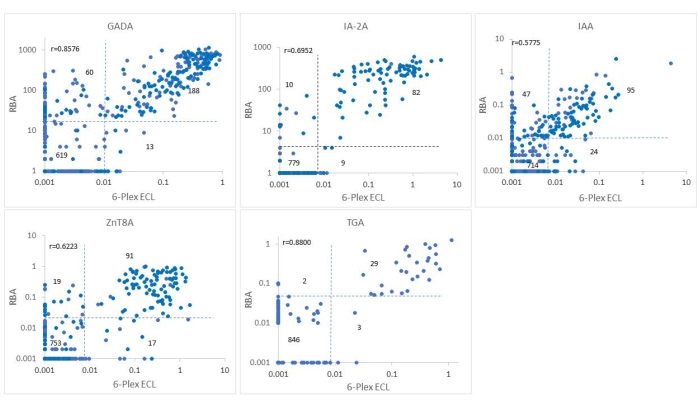
Figure 3 : Comparaison de cinq niveaux d’anticorps dans 880 échantillons de l’étude ASK entre le test RBA et le test ECL 6-Plex. Les panels affichent des comparaisons des niveaux d’anticorps pour GADA, IAA, IA-2A, ZnT8A et TGA, respectivement. Les lignes pointillées représentent les seuils de dosage pour chaque test d’anticorps. Ce chiffre a été modifié avec la permission de He et al.11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Comptes CPS bruts (moitié gauche de la plaque). Nombre de CPS bruts acquis à partir de la moitié gauche d’une plaque d’essai. Chaque échantillon est effectué en double. Chaque nombre de CPS dans la même colonne (A1, A2, A3, etc.) représente les données de lecture des 10 points dans le même puits (les numéros de liaison correspondants sont marqués). Les exemples de doublons défectueux sont surlignés en gris, comme illustré dans les lignes D-linker 3 colonne 5 et colonne 6. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Disposition des données du tableau 1, triées à l’aide de six agents de liaison. Les valeurs CPS du tableau 1 ont été réorganisées, calculant les valeurs moyennes pour les lectures en double de CPS et supprimant les valeurs inutilisées pour les linkers 4-7. Les valeurs des témoins standard internes hautement positifs, faiblement positifs et négatifs de chaque test d’autoanticorps sont indiquées en gras foncé. PC, contrôle positif. NC, contrôle négatif. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Résultats des valeurs de l’indice. Les valeurs indicatrices pour chaque échantillon pour les six anticorps ont été calculées par rapport aux témoins positifs et négatifs correspondants. Une valeur d’index supérieure à la valeur seuil a été définie comme positive, marquée en gras foncé. Les mauvaises valeurs CPS en double dans le tableau 1, ligne D-linker 3-colonnes 5 et 6, ont conduit à une valeur positive de l’indice IA-2A de l’échantillon 11 (surlignée en gris), ce qui était probablement un résultat faussement positif. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Seuil de dosage, sensibilité et spécificité pour GADA, IA-2A, ZnT8A, IAA et TGA parmi 880 échantillons ASK, dont 325 échantillons positifs IAbs et 555 échantillons négatifs pour tous les anticorps. La valeur optimale de l’indice de coupure des tests GADA, IA-2A, ZnT8A, IAA et TGA a été fixée à au moins le 99e centile des 555 échantillons témoins normaux. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
L’intervention pour le DT1 est entrée dans l’ère pré-DT1, avec des programmes nationaux et internationaux de dépistage à grande échelle en cours pour le DT1 et des essais cliniques en plein essor appliqués au stade 1 du DT1 pour abroger ou ralentir la progression vers le DT1clinique 12,13. Les mesures de quatre IAbs utilisant la RBA standard actuelle avec un seul format de test IAb sont laborieuses et inefficaces pour un programme de dépistage de masse. Avec la demande urgente d’un test IAbs multiplexé à haut débit, d’un test ECL multiplexé, d’un test ICA ELISA à 3 écrans et d’une détection d’anticorps par PCR agglutinatoire (ADAP) sont devenus des technologies actuellement compétitives. Dans l’étude Fr1da sur le dépistage du DT1 dans une population de jeunes enfants en Allemagne, 3-Screen ICA ELISA combinant 3 IAbs (GADA, IA-2A et ZnT8A) a été utilisé comme test principal14. Une limitation majeure de l’ELISA ICA à 3 écrans est l’absence d’IAA, qui est principalement la première IAb à apparaître avec une prévalence élevée chez les jeunes enfants atteints de DT1. De plus, le test n’est pas en mesure de distinguer lequel des trois IAbs est positif d’un signal positif, et chaque échantillon positif doit être répété avec trois tests uniques pour confirmation. L’ADAP15 combine GADA, IA-2A et IAA et a illustré une sensibilité et une spécificité élevées des essais dans l’atelier de l’IASP, mais manque de données sur son degré de prédiction dans le dépistage basé sur la population pour les études de DT1, que l’atelier de l’IASP n’est pas en mesure de déterminer. Le test ECL multiplex de la présente étude est construit sur la plate-forme d’un seul test ECL qui a été validé par rapport à la RBA standard actuelle dans plusieurs essais cliniques comme TrailNet 9,16, DAISY17,18,19 et ASK 4,20,21 étudier. Le présent test a été validé par rapport au test RBA et au test ECL unique en utilisant 880 échantillons de sérum provenant de participants à l’étude ASK. Comme le montrent les figures 2 et 3, les taux d’anticorps entre 6-Plex et ECL unique ou entre 6-Plex et RBA étaient généralement congruents les uns avec les autres pour la positivité des anticorps. Les taux de coïncidence des IAbs testés par RBA et 6-Plex étaient de 91,7%-97,8%, et les taux de coïncidence des IAbs testés par ECL unique et 6-Plex étaient de 95,3%-99,2%. La discordance entre le test ECL et la RBA provenait principalement des personnes atteintes d’IAb unique. Les niveaux d’IAbs testés par 6-Plex et ECL simple (r = 0,6431-0,9434, tous p < 0,0001) et 6-Plex et RBA (r = 0,5775-0,8576, tous p < 0,0001) étaient également bien corrélés. Les TGA testés par le test 6-Plex étaient fortement corrélés avec les résultats du test RBA (99,4%) et du test ECL unique (99,4%). De plus, le test COVID-19A testé par 6-Plex a atteint une conformité de 99,8% avec les résultats du test ECL unique.
En conséquence, le test ECL 6-Plex a été officiellement accepté comme méthode de dépistage primaire pour l’étude ASK en cours et a remplacé le RBA22 standard. Ce test a démontré son excellente sensibilité et spécificité avec un débit plus élevé, un coût inférieur et un volume de sérum plus petit par rapport à la RBA standard.
Il a été documenté que, dans l’étude de dépistage du DT1, l’IAb unique détecté par la RBA, qui absorbait une grande proportion des positivités de l’IAb, était de faible affinité, avec un faible risque de maladie, et a entraîné une faible valeur prédictive globale 19,21,23,24,25,26. Une telle prédiction à faible risque a entraîné d’énormes coûts supplémentaires pour les visites de suivi et a entraîné des difficultés pour les études préventives sur le DT1. La plateforme de dosage ECL établie a été démontrée dans de nombreux essais cliniques pour distinguer les IAbs de haute affinité des IAbs de faible affinité générés par RBA et améliorer considérablement les valeurs prédictives pour les quatre IAb, en particulier avec une seule positivité IAb16,17,18,21 . La technologie de dosage ECL multiplex a été construite sur la plate-forme du test ECL unique, avec cet avantage distinct de la détection d’Abs de haute affinité. Dans la présente étude, le test ECL 6-Plex a illustré sa similitude avec les tests ECL uniques correspondants en termes de sensibilité et de spécificité.
Certaines limites et les préoccupations techniques du test ECL multiplex utilisant plusieurs plaques Plex ont déjà été couvertes dans des publications précédentes27,28. Avec six antigènes marqués dans un puits, il peut y avoir des influences entre différents antigènes, et le fond du test pourrait augmenter lors de l’ajout de chaque test d’anticorps pour le multiplexage dans le même puits. Un grand nombre de travaux d’optimisation du test sont nécessaires pour ajuster les conditions du test, en particulier pour ajuster les concentrations finales de chaque protéine d’antigène marquée en fonction du test en damier pour chaque antigène, afin de maintenir la sensibilité et la spécificité de chaque test d’anticorps. Comme mentionné dans des études précédentes27,28, un petit nombre d’échantillons (<1%) entraîne une fausse positivité sur la plaque Plex multiple sans raison sous-jacente claire. Tous les résultats positifs doivent être répétés et confirmés par un seul test de LMTEC comme assurance de routine de la qualité en laboratoire; Habituellement, les faux positifs seront supprimés. Les résultats faussement négatifs causés par « l’effet prozone » observé dans le test ECL7-Plex précédent 27,28 n’ont pas été observés dans la présente étude. Dans le test décrit ici, nous avons supprimé l’étape du traitement acide des échantillons de sérum du protocole précédent; au lieu de cela, nous avons préchauffé les échantillons de sérum à 56 °C pendant 30 minutes (étape 5.1.). Le deuxième jour de lavage de la plaque, nous avons utilisé un tampon de lavage contenant 0,4 M de NaCl (étape 8.1.) au lieu du tampon de lavage ordinaire pour laver la plaque plus rigoureusement. Ces modifications ont rendu le test ECL multiplex plus simple et abaissé le bruit de fond sans perdre la sensibilité du test.
En conclusion, ce test a des performances exceptionnelles pour détecter simultanément quatre IAbs, TGA et COVID-19A. La fonction de multiplexage, ainsi que le débit élevé, le faible coût et le faible volume sérique requis, rendent le dépistage à grande échelle du DT1 et des maladies concomitantes beaucoup plus réalisable dans la population générale. Les patients atteints de DT1 ou de maladies auto-immunes ont un risque beaucoup plus élevé d’autres maladies auto-immunes. Le test ECL multiplex fournit une excellente plate-forme pour dépister simultanément le DT1 et de multiples maladies auto-immunes.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
L’étude a été financée par les subventions 2-SRA-2019-695-S-B, 2-SRA-2020-965-S-B, 1-SRA-2017-564-M_N, la subvention DK32083 des NIH et la subvention P30 DK116073 du Centre de recherche sur le diabète (DRC).
matériels
| Name | Company | Catalog Number | Comments |
| 5 mM NaCl | ThermoFisher | 1070832 | |
| 96-well Plate Shaker | VWR | 12620-926 | |
| 96-well round bottom plate | Fisher | 8408220 | |
| Biotin | ThermoFisher | PI21329 | |
| Blocker A | MSD | R93AA | |
| Bottle-Top 500 ml-Filter Units | Fisher | 0974064A | |
| Bovine Serum Albumin | Sigma | A-7906 | |
| GAD65 protein | Diamyd Medical | 10-65702-01 | |
| IA-2 protein (aa 605-979) | Creative BioMart | 283309 | |
| MESO QuickPlex SQ120 | MSD | R31QQ-3 | Electrochemiluminescence analyzer |
| PBS 10x | ThermoFisher | 70011044 | |
| PBS 1x | ThermoFisher | 10010023 | |
| Proinsulin protein | AmideBio | 20160118B3 | |
| Read buffer B | MSD | Y0800019 | |
| SARS-CoV-2 RBD protein | Creative Biomart | Spike-190V | |
| Stop Solution | MSD | Y0090019 | |
| Sulfo-TAG | MSD | R91AO-1 | |
| tTG protein | Diarect AG | 15201 | |
| Tween 20 | Sigma | P-1379 | |
| U-Plex 6-Assay SECTOR plate | MSD | Z00U0142E | 6-plex plate |
| U-PLEX Linker 1 | MSD | L0010022 | |
| U-PLEX Linker 10 | MSD | L0100020 | |
| U-PLEX Linker 2 | MSD | L0020015 | |
| U-PLEX Linker 3 | MSD | L0030018 | |
| U-PLEX Linker 8 | MSD | L0080018 | |
| U-PLEX Linker 9 | MSD | L0090014 | |
| ZeBa Column | ThermoFisher | 89892 | Spin columns |
| ZnT8 protein | Research Laboratory | n/a |
Références
- Group, T. S. The Environmental Determinants of Diabetes in the Young (TEDDY) Study. Annals of the New York Academy of Sciences. 1150, 1-13 (2008).
- Vehik, K., et al. Increasing incidence of type 1 diabetes in 0- to 17-year-old Colorado youth. Diabetes Care. 30 (3), 503-509 (2007).
- Insel, R. A., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Stahl, M. G., et al. Mass screening for celiac disease: The autoimmunity screening for kids study. The American Journal of Gastroenterology. 116 (1), 180-187 (2021).
- Al-Hussaini, A., Sulaiman, N., Al-Zahrani, M., Alenizi, A., El Haj, I. High prevalence of celiac disease among Saudi children with type 1 diabetes: A prospective cross-sectional study. BMC Gastroenterology. 12, 180 (2012).
- Agardh, D., et al. Clinical features of celiac disease: A prospective birth cohort. Pediatrics. 135 (4), 627-634 (2015).
- COVID-19: Clinical manifestations and diagnosis in children. UpToDate Available from: https://www.uptodate.com/contents/covid-19-clinical-manifestations-and-diagnosis-in-children/print (2021)
- Barron, E., et al. Associations of type 1 and type 2 diabetes with COVID-19-related mortality in England: a whole-population study. The Lancet Diabetes & Endocrinology. 8 (10), 813-822 (2020).
- Miao, D., et al. Electrochemiluminescence assays for insulin and glutamic acid decarboxylase autoantibodies improve prediction of type 1 diabetes risk. Diabetes Technology & Therapeutics. 17 (2), 119-127 (2015).
- Jia, X., et al. Prevalence of SARS-CoV-2 antibodies in children and adults with Type 1 diabetes. Diabetes Technology & Therapeutics. 23 (7), 517-521 (2021).
- He, L., et al. High-throughput multiplex electrochemiluminescence assay applicable to general population screening for type 1 diabetes and celiac disease. Diabetes Technology & Therapeutics. , (2022).
- McQueen, R. B., et al. Cost and cost-effectiveness of large-scale screening for type 1 diabetes in Colorado. Diabetes Care. 43 (7), 1496-1503 (2020).
- Insel, R. A., Dunne, J. L., Ziegler, A. G. General population screening for type 1 diabetes: has its time come. Current Opinion in Endocrinology & Diabetes and Obesity. 22 (4), 270-276 (2015).
- Ziegler, A. G., et al. 3 Screen ELISA for high-throughput detection of beta cell autoantibodies in capillary blood. Diabetes Technology & Therapeutics. 18 (11), 687-693 (2016).
- Cortez, F. J., et al. Sensitive detection of multiple islet autoantibodies in type 1 diabetes using small sample volumes by agglutination-PCR. PLoS One. 15 (11), 0242049 (2020).
- Steck, A. K., et al. ECL-IAA and ECL-GADA can identify high-risk single autoantibody-positive relatives in the TrialNet pathway to prevention study. Diabetes Technology & Therapeutics. 18 (7), 410-414 (2016).
- Yu, L., et al. Proinsulin/Insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Yu, L., et al. Distinguishing persistent insulin autoantibodies with differential risk: Nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Zhao, Z., et al. Higher sensitivity and earlier identification of celiac disease autoimmunity by a nonradioactive assay for transglutaminase autoantibodies. Journal of Immunology Research. 2016, 2904563 (2016).
- Jia, X., et al. High-affinity ZnT8 autoantibodies by electrochemiluminescence assay improve risk prediction for type 1 diabetes. The Journal of Clinical Endocrinology and Metabolism. 106 (12), 3455-3463 (2021).
- He, L., et al. A complete-panel islet autoantibody multiplex ECL assay. Diabetes. 70, 158 (2021).
- Achenbach, P., et al. Mature high-affinity immune responses to (pro)insulin anticipate the autoimmune cascade that leads to type 1 diabetes. Journal of Clinical Investigation. 114 (4), 589-597 (2004).
- Schlosser, M., et al. In insulin-autoantibody-positive children from the general population, antibody affinity identifies those at high and low risk. Diabetologia. 48 (9), 1830-1832 (2005).
- Mayr, A., et al. GAD autoantibody affinity and epitope specificity identify distinct immunization profiles in children at risk for type 1 diabetes. Diabetes. 56 (6), 1527-1533 (2007).
- Siljander, H., et al. Role of insulin autoantibody affinity as a predictive marker for type 1 diabetes in young children with HLA-conferred disease susceptibility. Diabetes/Metabolism Research and Reviews. 25 (7), 615-622 (2009).
- Gu, Y., et al. High-throughput multiplexed autoantibody detection to screen type 1 diabetes and multiple autoimmune diseases simultaneously. Ebiomedicine. 47, 365-372 (2019).
- Jia, X., He, L., Gu, Y., High, H., Yu, L. A high-throughput electrochemiluminescence 7-plex assay simultaneously screening for type 1 diabetes and multiple autoimmune diseases. Journal of Visualized Experiments. (159), e61160 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon