Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyses basées sur la pharmacologie comportementale et de réseau pour la médecine traditionnelle mongole Zadi-5 dans un modèle de dépression chez le rat
Dans cet article
Résumé
Le présent protocole décrit une méthode de validation des tests comportementaux et de prédiction bioinformatique de l’efficacité thérapeutique de Zadi-5, un médicament traditionnel mongol, dans la dépression.
Résumé
Zadi-5 est un médicament traditionnel mongol qui est largement utilisé pour le traitement de la dépression et des symptômes d’irritation. Bien que les effets thérapeutiques de Zadi-5 contre la dépression aient été indiqués dans des études cliniques précédemment rapportées, l’identité et l’impact des composés pharmaceutiques actifs présents dans le médicament n’ont pas été entièrement élucidés. Cette étude a utilisé la pharmacologie en réseau pour prédire la composition du médicament et identifier les composés thérapeutiquement actifs dans les pilules Zadi-5. Ici, nous avons établi un modèle de stress léger chronique imprévu (CUMS) chez le rat et effectué un test en champ ouvert (OFT), une analyse du labyrinthe aquatique de Morris (MWM) et un test de consommation de saccharose (SCT) pour étudier l’efficacité thérapeutique potentielle de Zadi-5 dans la dépression. Cette étude visait à démontrer les effets thérapeutiques de Zadi-5 sur la dépression et à prédire la voie critique de l’action de Zadi-5 contre la maladie. Les scores verticaux et horizontaux (OFT), SCT et les nombres de croisement de zone des groupes fluoxétine (contrôle positif) et Zadi-5 étaient significativement plus élevés (P < 0,05) que ceux des rats du groupe CUMS sans traitement. Selon les résultats de l’analyse pharmacologique du réseau, la voie PI3K-AKT s’est avérée essentielle pour l’effet antidépresseur de Zadi-5.
Introduction
La dépression, également connue sous le nom de trouble dépressif majeur (TDM), est une maladie neuropsychiatrique grave responsable d’un fardeau médical et économique croissant pour la société. En raison de la complexité, de la morbidité et des taux de mortalité associés, une quantité importante de recherches a été menée pour trouver des remèdes à la maladie 1,2. Selon une enquête sur la santé mentale menée par l’Organisation mondiale de la santé, environ 350 millions de personnes souffrent actuellement de dépression et de symptômes associés dans le monde. On prévoit que la dépression dépassera le cancer et les maladies cardiovasculaires en tant que principale cause de morbidité dans le monde d’ici 2030. Ainsi, la prévention et le traitement de la dépression deviendront une priorité mondiale dans un avenir proche3. La pathogenèse du TDM n’a pas encore été élucidée. Pourtant, elle est communément attribuée aux facteurs suivants : prédisposition génétique, dysfonctionnement de l’axe hypothalamus-hypophyso-surrénalien, réduction de la sécrétion de neurotransmetteurs, neuroinflammation induite par la dysrégulation neuro-immunitaire, apoptose cellulaire et réduction de la prolifération cellulaire 4,5.
Parmi ces facteurs, la neuroinflammation induite par le dérèglement neuroimmunitaire et l’altération de la sécrétion de facteurs neurotrophiques ont fait l’objet d’une attention particulière pour leur rôle dans le développement de la dépression et de nombreuses autres maladies psychiatriques6. Au cours de la dernière décennie, les chercheurs ont démontré que l’hippocampe est le site dominant des fonctions nerveuses régénératrices et qu’il est impliqué dans la régulation des émotions et de la cognition. À cet égard, les neurones de l’hippocampe sont reconnus comme de nouvelles cibles thérapeutiques pour les médicaments antidépresseurs en cours de développement 7,8. De plus, l’hippocampe serait également impliqué dans la mémoire à court et à long terme dans l’apprentissage et la consolidation des souvenirs. Plus précisément, la pénurie de neurones pyramidaux dans la région CA1 de l’hippocampe provoque une amnésie rétrograde et antérograde9. Une stratégie thérapeutique antidépressive typique vise à améliorer la prolifération cellulaire et la neurogenèse dans le gyrus denté de l’hippocampe. Les composés dérivés de produits naturels et les petites molécules synthétisées à l’aide de techniques de chimie médicinale sont considérés comme les principales sources d’agents thérapeutiques innovants pour diverses affections neuropsychiatriques.
Les médecines traditionnelles mongoles, qui ont une longue histoire et un système médical théorique bien étayé, descendent des nomades du plateau mongol Ces médicaments présentent des effets multi-cibles et multi-voies en raison des divers composants médicinaux qui agissent de concert pour générer des fonctions synergiques. Zadi-5 est une formulation bien établie parmi ces médicaments et a été enregistrée pour la première fois dans « Expérience clinique du Dr Gao Shi », écrit par un clinicien mongol exceptionnel appelé Dr Gao Shi (1804-1876). C’est une pratique clinique depuis longtemps en Mongolie d’utiliser ces pilules pour traiter les symptômes de détresse, de palpitations, d’irritation et de douleur cardiaque lancinante10,11. De plus, Zadi-5 a des effets prouvés sur le soulagement de la dépression post-AVC chez les patients touchés12. Les recherches expérimentales récentes sur le CUMS ont révélé que la formulation Zadi-5 soulage la dépression en régulant les neurotransmetteurs centraux13 ; En effet, avec Zadi-5, des niveaux accrus de facteur neurotrophique dérivé du cerveau (BDNF) et de récepteur B de la tyrosine kinase (TrkB) ont été détectés et corrélés à une amélioration de l’apprentissage et de la mémoire dans un modèle de dépression chez le rat14. Cependant, le mécanisme d’action exact de Zadi-5 pour un tel soulagement de la dépression n’a pas été élucidé.
Cette étude visait à démontrer les effets thérapeutiques de Zadi-5 contre la dépression chez le rat à l’aide d’un test comportemental et à identifier les composants de Zadi-5 à l’aide de la pharmacologie des systèmes de médecine traditionnelle chinoise (TCMSP) et de la prédiction de cibles suisses pour prédire les mécanismes potentiels sous-jacents à l’efficacité de Zadi-5, un médicament traditionnel mongol, dans le traitement de la dépression.
Access restricted. Please log in or start a trial to view this content.
Protocole
Tous les protocoles expérimentaux ont été approuvés par le Comité d’éthique des soins expérimentaux sur les animaux de l’Université médicale de Mongolie intérieure et ont suivi les directives des National Institutes of Health sur les soins et l’éthique des animaux. Des rats Sprague Dawley mâles (SD) âgés de 8 semaines (200 g ± 20 g) ont été logés dans une pièce à température contrôlée (22 °C ± 2 °C) et à humidité (55 % ± 15 %) selon un cycle lumière/obscurité régulé de 12 h/12 h pendant 1 semaine. Reportez-vous à la figure 1 pour le flux de travail de l’analyse pharmacologique en réseau.
1. Test comportemental chez le rat
- Etablir un modèle de rat CUMS
- Appliquer les stimuli suivants combinés à l’isolement pendant 28 jours à tous les rats, à l’exception des témoins : inversion du cycle lumière/obscurité pendant 24 h, privation de nourriture pendant 24 h, privation d’eau pendant 24 h, secousses de niveau à grande vitesse pendant 15 min (une fois/s), pince de queue pendant 2 min, nage en eau froide (4 °C) pendant 5 min, Stimulation thermique à 45 °C et rembourrage humide pendant 24 h (tableau 1). Élevez les rats dans des cages individuelles.
REMARQUE : Évitez de répéter le même type de stimuli pendant des jours consécutifs. Les procédures ci-dessus pour établir un modèle de rat CUMS ont été approuvées par le comité d’éthique animale et décrites précédemment15.
- Appliquer les stimuli suivants combinés à l’isolement pendant 28 jours à tous les rats, à l’exception des témoins : inversion du cycle lumière/obscurité pendant 24 h, privation de nourriture pendant 24 h, privation d’eau pendant 24 h, secousses de niveau à grande vitesse pendant 15 min (une fois/s), pince de queue pendant 2 min, nage en eau froide (4 °C) pendant 5 min, Stimulation thermique à 45 °C et rembourrage humide pendant 24 h (tableau 1). Élevez les rats dans des cages individuelles.
- Préparation des médicaments
- Pulvérisez la pilule Zadi-5 dans un broyeur et préparez une solution de 1,16 g/mL dans de l’eau distillée. Préparer séparément une solution de fluoxétine de 0,36 mg/mL dans de l’eau distillée.
- Administration de médicaments
- Divisez les rats au hasard en six groupes (n = 10) : témoin (CON), modèle (MOD), groupe Zadi-5 (Zadi-5, 1,6 g de Zadi-5/kg16), groupe fluoxétine (fluoxétine, 3,6 mg de fluoxétine/kg). Une fois par jour pendant 28 jours, administrer 1 mL/g par rat de la solution médicamenteuse appropriée par gavage et traiter les groupes CON et MOD avec un volume égal d’eau distillée.
REMARQUE : Le gavage commence au début de l’établissement du modèle pour tous les groupes.
- Divisez les rats au hasard en six groupes (n = 10) : témoin (CON), modèle (MOD), groupe Zadi-5 (Zadi-5, 1,6 g de Zadi-5/kg16), groupe fluoxétine (fluoxétine, 3,6 mg de fluoxétine/kg). Une fois par jour pendant 28 jours, administrer 1 mL/g par rat de la solution médicamenteuse appropriée par gavage et traiter les groupes CON et MOD avec un volume égal d’eau distillée.
- Test en champ libre (OFT)
- Divisez une boîte noire (50 cm x 50 cm x 30 cm) en neuf régions carrées de surface égale. Équipez la box d’un système d’analyse de suivi vidéo. Un jour après le dernier gavage, placez le rat dans la case centrale, et notez ses activités horizontales et verticales pendant 3 min.
- Marquez le nombre de cases croisées avec toutes les pattes comme une activité horizontale, et notez la position debout et le toilettage comme une activité verticale. Après chaque test, nettoyez la boîte avec de l’alcool à 75 % afin d’éliminer l’odeur du rat pour les tests ultérieurs17.
- Test de consommation de saccharose (SCT)
- Pesez les bouteilles respectives avant et après la consommation et calculez les taux de préférence de saccharose sur 60 minutes le jour 0, le jour 7, le jour 14, le jour 21 et le jour 28 à l’aide de l’équation (1) :
Consommation de saccharose =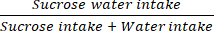 × 100% (1)
× 100% (1)
- Pesez les bouteilles respectives avant et après la consommation et calculez les taux de préférence de saccharose sur 60 minutes le jour 0, le jour 7, le jour 14, le jour 21 et le jour 28 à l’aide de l’équation (1) :
- Labyrinthe aquatique Morris (MWM)
- Divisez la piscine en quatre quadrants. Classez les quadrants de un à quatre et placez la plate-forme cachée dans le troisième quadrant, à 1 cm sous la surface de l’eau.
- Placez le sujet rat dans le labyrinthe dans différents quadrants pour rechercher la plate-forme pendant 120 s et enregistrez le temps de latence à l’aide du système d’analyse de la piste vidéo MWM.
- Placez le sujet rat dans une position fixe dans la piscine. Si le sujet ne trouve pas la plate-forme cachée en 120 s, enregistrez la latence à 120 s.
- Ensuite, délogez la plate-forme, placez le rat dans l’eau et notez le nombre de passages de zone pendant 120 s.
- Ajoutez du lait à la piscine pour un certain niveau d’opacité. Maintenir la température de l’eau entre 23 °C ± 1 °C pendant l’expérience.
2. Prédiction pharmacologique du réseau
- Criblez les composants actifs de Zadi-5.
- Parcourez la pharmacologie des systèmes de médecine traditionnelle chinoise (TCMSP, https://old.tcmsp-e.com/tcmsp.php) et entrez « Graines de semence de Myristicae », « Racines d’Aucklandiae Radix » et « Piperis Longi Fructus » dans la section « nom de l’herbe » pour obtenir les noms des produits chimiques. Définir l’indice pharmacocinétique de biodisponibilité orale (OB) sur >30 % et l’indice de pharmacogence (DL) sur >0,18 (Fichier supplémentaire 1).
- Recherche « Rou Dou Kou » (Myristica fragrans Houtt), « Tu Mu Xiang » (Inula helenium L.), « Mu Xiang » (Aucklandia lappa Decne.), « Guang Zao » (Choerospondias axillaris Roxb. Burtt Hill) et « Bi Ba » (Piper longum L.) dans la Pharmacopée de médecine chinoise (http://www.zhongyaocai360.com/zhongguoyaodian/) pour identifier les noms chimiques de chaque composant.
- Recherchez les noms chimiques identifiés dans PubChem (https://pubchem.ncbi.nlm.nih.gov/) pour trouver l’isomère SMILES ou InChIkey
- Identifier les protéines cibles des composants actifs de Zadi-5.
- Identifiez les protéines cibles des composants actifs à l’aide de SEA (http://sea.bkslab.org/), BATMAN (http://bionet.ncpsb.org.cn/batman-tcm/) et Swiss Target Prediction (http://www.swisstargetprediction.ch/) avec l’isomère SMILES ou InChIkey, et trouvez les protéines qui se chevauchent.
- Utilisez la base de données de protéines UniProt (http://www.uniprot.org/uploadlists/) pour convertir les cibles identifiées en noms de gènes unifiés.
- Rechercher les protéines cibles de la dépression.
- Recherchez et identifiez les cibles protéiques potentielles de la dépression en utilisant les mots-clés « dépression » et « trouble dépressif » dans Genecards (https://www.genecards.org/), Disgenet (https://www.disgenet.org/) et Drugbank (https://www.drugbank.com/).
- Trouvez les gènes cibles.
- Parcourez le diagramme de Venn (http://bioinformatics.psb.ugent.be/webtools/Venn/), téléchargez les cibles des composants actifs de Zadi-5 dans la liste-1, téléchargez les cibles de dépression dans la liste-2 et soumettez. Procurez-vous le diagramme de Venn et filtrez les cibles candidates qui se chevauchent.
- Construisez le réseau.
- Construisez une feuille de calcul appelée « Type et réseau » (Fichier supplémentaire 2). « Type » est la signature du réseau, et « Réseau » illustre la relation entre les signes.
- Exportez le « Type et le Réseau » vers Cytoscape v3.9.0 pour construire le réseau « Zadi-5 herbes-ingrédients-maladies cibles ».
- Analyser le réseau d’interaction protéine-protéine (IPP) des candidats cibles.
- Définissez les cibles communes dans la base de données STRING (https://cn.string- db.org/) pour analyser leurs interactions. Définissez le type de protéine comme « homo sapiens ». Définissez la valeur du seuil d’interaction sur 0,9 et sélectionnez uniquement les types vérifiés expérimentalement. N’affichez pas les noeuds de l’île solitaire.
- Effectuer des analyses d’enrichissement des voies liées à la cible dans le cadre de l’Encyclopédie des gènes et des génomes (KEGG) et de l’ontologie génique (GO).
- Collez 86 cibles antidépressives potentielles de Zadi-5 dans la fourchette d’analyse de départ de DAVID (https:// david.ncifcrf.gov/) pour étudier les voies de signalisation associées en effectuant la fonction d’ontologie génique (GO) - y compris le processus biologique, la composante cellulaire et la fonction moléculaire - et les analyses d’enrichissement de la voie de l’Encyclopédie des gènes et des génomes de Kyoto (KEGG).
REMARQUE : KEGG est visualisé dans le graphique à bulles à l’aide d’un IMageGP en ligne (http://www.ehbio.com /ImageGP/index.php/Home/Index/). La taille de la bulle représente le nombre de cibles enrichies dans la voie indiquée, et la couleur de la bulle représente la valeur P de l’enrichissement.
- Collez 86 cibles antidépressives potentielles de Zadi-5 dans la fourchette d’analyse de départ de DAVID (https:// david.ncifcrf.gov/) pour étudier les voies de signalisation associées en effectuant la fonction d’ontologie génique (GO) - y compris le processus biologique, la composante cellulaire et la fonction moléculaire - et les analyses d’enrichissement de la voie de l’Encyclopédie des gènes et des génomes de Kyoto (KEGG).
- Construire le réseau pour illustrer les composés actifs de Zadi-5 qui interagissent avec la voie de signalisation PI3K-AKT.
- Téléchargez le document sur la voie KEGG, sélectionnez les gènes de la voie PI3K-AKT à partir de l’analyse d’enrichissement et collez-les sur la feuille de calcul pour construire un document « Type et réseau ».
- Exportez le document « Type et réseau » vers le Cytoscape pour générer le « réseau de composés-cibles-voies visualisés PI3K-AKT » (Fichier supplémentaire 3).
REMARQUE : « Type » est la signature du réseau, et « Réseau » illustre la relation entre les panneaux.
3. Analyse statistique
- Utilisez une analyse de variance à un facteur (ANOVA), suivie du test post-hoc de Duncan, pour déterminer les différences significatives dans les paramètres biochimiques et d’expression génique. Calculez la moyenne ±écart-type (ET) et visualisez les données. Considérez P < 0,05 comme statistiquement significatif.
Access restricted. Please log in or start a trial to view this content.
Résultats
Test comportemental chez l’animal
Résultats des tests comportementaux dans le modèle de dépression de rat induite par le CUMS
Aucune différence significative entre les groupes testés n’a été trouvée pour le score OFT, la consommation de saccharose et l’analyse MWM avant la stimulation CUMS. Après l’établissement du modèle CUMS, les scores verticaux et horizontaux du groupe MOD étaient inférieurs à ceux du groupe CON (P < 0,05). Par rapport au groupe MOD, les s...
Access restricted. Please log in or start a trial to view this content.
Discussion
La dépression est une maladie mentale caractérisée par une humeur maussade, une anhédonie et un manque d’énergie. Ce trouble s’accompagne de distraction, de dysfonctionnement cognitif, de retrait social, d’insomnie, de dysfonctionnement sexuel et de maladies gastro-intestinales18,19. Dans l’étude de la dépression, l’établissement d’un modèle animal est crucial pour comprendre les mécanismes pathologiques et les effets des nouveaux médicamen...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous sommes reconnaissants pour l’instrumentation et le laboratoire fournis par la faculté de médecine mongole de l’Université médicale de Mongolie intérieure, en Chine. Cette étude a été financée par la Fondation nationale des sciences naturelles de Chine (81760762) et le projet de plan scientifique et technologique de la Commission de la santé de Mongolie intérieure, Chine (202201300).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Cytoscape software | version 3.7.0 | ||
| Fluoxetine | Lilly Suzhou Pharmaceutical Co., Ltd | J20160029 | |
| Morris water maze video trail analysing system | Tai Meng Tech Co., Ltd | WMT-200 | |
| Sprague Dawley rats | Beijing Biotechnology Co., Ltd, China | SCXK (JING) 2016-0002 | |
| video tracking system | Tai Meng Tech Co., Ltd | ZH-ZFT | |
| Zadi-5 pill | Pharmaceutical Preparation Center of International Mongolian Hospital, Inner Mongolia, China | M1301006 |
Références
- Jiang, N., et al. The antidepressant-like effects of Shen Yuan in a chronic unpredictable mild stress rat model. Frontiers in Psychiatry. 12, 622204(2021).
- Yang, L. F., et al. The effects of psychological stress on depression. Current Neuropharmacology. 13 (4), 494-504 (2015).
- Liu, Q. Q., et al. Changes in the global burden of depression from 1990 to 2017: Findings from the Global Burden of Disease study. Journal of Psychiatric Research. 126, 134-140 (2020).
- Pinto, B., Conde, T., Domingues, I., Domingues, M. R. Adaptation of lipid profiling in depression disease and treatment: A critical review. International Journal of Molecular Sciences. 23 (4), 2032(2022).
- Rahman, S., et al. Increased serum resistin but not G-CSF levels are associated in the pathophysiology of major depressive disorder: Findings from a case-control study. PLoS One. 17 (2), 0264404(2022).
- Liu, C., et al. Danzhi Xiaoyao powder promotes neuronal regeneration by downregulating Notch signaling pathway in the treatment of generalized anxiety disorder. Frontiers in Pharmacology. 12, 772576(2021).
- Tanti, A., Belzung, C. Hippocampal neurogenesis: a biomarker for depression or antidepressant effects? Methodological considerations and perspectives for future research. Cell and Tissue Research. 354 (1), 203-219 (2013).
- Zhu, C., et al. Silencing of RGS2 enhances hippocampal neuron regeneration and rescues depression-like behavioral impairments through activation of cAMP pathway. Brain Research. 1746, 147018(2020).
- Toda, T., Parylak, S. L., Linker, S. B., Gage, F. H. The role of adult hippocampal neurogenesis in brain health and disease. Molecular Psychiatry. 24 (1), 67-87 (2019).
- Bold, S. History and Development of Traditional Mongolian Medicine, third edition. , Sodpress Kompanid Khevlv. Ulaanbaatar, Mongolia. (2013).
- Medical, E. committee of Mongolian Encyclopedia. Mongolian Studies' Encyclopedia: Mongolian Medicine, third edition. , Hohhot, Mongolia. (2012).
- Fan, L., Wang, W. Clinical observation of Mongolian medicine Zadi-5 combined with Western medicine to treat depression after stroke. China Practice Medicine. 14 (2), 115-116 (2019).
- Hu, R. L. B. G., et al. Experimental research on nutmeg wuwei pills against of depression model rats behavior and hippocampus monoamine neurotransmitters. Chinese Journal of ETMF. 21 (11), 146-149 (2015).
- Hu, R. L. B. G., et al. Effects of Rou kou Wuwei Pill on the learning and memory abilities and the expression of BDNF and TrkB in hippocampus of depression rats. CJTCMP. 32 (8), 3797-3800 (2017).
- Yang,, et al. Morinda officinalis oligosaccharides mitigate depression-like behaviors in hypertension rats by regulating Mfn2-mediated mitophagy. J Neuroinflammation. 20 (1), 31(2023).
- Hu, R. L. B. G., et al. Effect of Zadi Wuwei pills on behaviors and learning memory in the depression model rats. World Journal of ITWM. 10 (10), 1367-1370 (2015).
- Ghasemi, M., Raza, M., Dehpour, A. R. NMDA receptor antagonists augment antidepressant-like effects of lithium in the mouse forced swimming test. Journal of Psychopharmacology. 24 (4), 585-594 (2010).
- Zhang, Y., et al. tea attenuates chronic unpredictable mild stress-induced depressive-like behavior in rats via the gut-brain axis. Nutrients. 14 (1), 99(2021).
- Kandola, A., Ashdown-Franks, G., Hendrikse, J., Sabiston, C. M., Stubbs, B. Physical activity and depression: Towards understanding the antidepressant mechanisms of physical activity. Neuroscience and Biobehavioral Reviews. 107, 525-539 (2019).
- Sun, J., et al. Clostridium butyricum attenuates chronic unpredictable mild stress-induced depressive-like behavior in mice via the gut-brain axis. Journal of Agricultural and Food Chemistry. 66 (31), 8415-8421 (2018).
- Willner, P. Chronic mild stress (CMS) revisited: Consistency and behavioural-neurobiological concordance in the effects of CMS. Neuropsychobiology. 52 (2), 90-110 (2005).
- Albrakati, A., et al. Neuroprotective efficiency of prodigiosins conjugated with selenium nanoparticles in rats exposed to chronic unpredictable mild stress is mediated through antioxidative, anti-inflammatory, anti-apoptotic, and neuromodulatory activities. International Journal of Nanomedicine. 16, 8447-8464 (2021).
- Chan, K., et al. Good practice in reviewing and publishing studies on herbal medicine, with special emphasis on traditional Chinese medicine and Chinese materia medica. Journal of Ethnopharmacology. 140 (3), 469-475 (2012).
- Su, H., et al. Exploration of the mechanism of Lianhua Qingwen in treating influenza virus pneumonia and new coronavirus pneumonia with the concept of "different diseases with the same treatment" based on network pharmacology. Evidence Based Complementary Alternative Medicine. 2022, 5536266(2022).
- Zhou, P., et al. Network pharmacology and molecular docking analysis on pharmacological mechanisms of Astragalus membranaceus in the treatment of gastric ulcer. Evidence Based Complementary Alternative Medicine. 2022, 9007396(2022).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568(2023).
- Aoyagi, T., Matsui, T. Phosphoinositide-3 kinase signaling in cardiac hypertrophy and heart failure. Current Pharmaceutical Design. 17 (18), 1818-1824 (2011).
- Zhu, H., et al. The neuroprotection of liraglutide against ischaemia-induced apoptosis through the activation of the PI3K/AKT and MAPK pathways. Scientific Reports. 6, 26859(2016).
- Radak, Z., Zhao, Z., Koltai, E., Ohno, H., Atalayet, M. Oxygen consumption and usage during physical exercise: The balance between oxidative stress and ROS-dependent adaptive signaling. Antioxidants & Redox Signaling. 18 (10), 1208-1246 (2013).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. Journal of Ethnopharmacology. 2022, 115278(2022).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon