Method Article
Assemblage et fonctionnement d’une platine de refroidissement pour immobiliser C. elegans sur leurs plaques de culture
Dans cet article
Résumé
Cet article décrit les protocoles de construction et d’exploitation d’une étape de refroidissement pour immobiliser C. elegans sur leurs plaques de culture d’origine en masse.
Résumé
Les approches de microscopie in vivo à haute résolution peuvent révéler des informations subtiles et des détails fins à l’intérieur de l’animal modèle Caenorhabditis elegans (C. elegans), mais nécessitent une forte immobilisation de l’animal pour éviter le flou de mouvement dans les images. Malheureusement, la plupart des techniques d’immobilisation actuelles nécessitent un effort manuel considérable, ce qui rend l’imagerie haute résolution à faible débit. L’immobilisation de C. elegans est grandement simplifiée en utilisant une approche de refroidissement qui peut facilement immobiliser des populations entières directement sur leurs plaques de culture. L’étape de refroidissement peut établir et maintenir une large plage de températures avec une répartition uniforme sur la plaque de culture. Dans cet article, l’ensemble du processus de construction de l’étape de refroidissement est documenté. L’objectif est qu’un chercheur typique puisse construire un étage de refroidissement opérationnel dans son laboratoire en suivant ce protocole sans difficulté. L’utilisation de l’étape de refroidissement suivant trois protocoles est montrée, et chaque protocole présente des avantages pour différentes expériences. On y trouve également un exemple de profil de refroidissement de la scène à l’approche de sa température finale et quelques conseils utiles sur l’utilisation de l’immobilisation de refroidissement.
Introduction
La microscopie optique à haute résolution fournit un outil indispensable pour étudier les structures biologiques in vivo au niveau subcellulaire. De nombreuses études biologiques nécessitent une imagerie à résolution submicronique pour résoudre des détails anatomiques subtils, notamment la morphologie des neurones1,2, la structure membranaire3,4 et la localisation des protéines 5,6. Une image haute résolution nécessite un temps d’exposition de plusieurs millisecondes à secondes, selon la modalité d’imagerie et la sonde 7,8. Pour obtenir des résultats optimaux, il est essentiel de planifier et de mener soigneusement des expériences basées sur la microscopie. Une méthode efficace de préparation des animaux qui facilite l’imagerie à haute résolution est cruciale pour cet effort.
Le nématode C. elegans est un organisme modèle largement utilisé pour l’étude de nombreux processus biologiques9. Ce petit animal est généralement cultivé sur des plaques de gélose à milieu de croissance des nématodes (NGM), et ils se reproduisent rapidement par autofécondation, ce qui les rend bien adaptés aux études à grande échelle. Leur transparence et un large éventail de techniques d’étiquetage permettent la visualisation directe de leur anatomie interne10,11. Les structures fines de C. elegans sont idéales pour étudier les processus biologiques au niveau subcellulaire, tels que la régénération des neurones 12, la dégénérescence des neurones13 et la division cellulaire14. De telles études nécessitent une imagerie à une résolution submicronique et une immobilisation animale suffisamment forte pour empêcher le flou de l’image. Une forte immobilisation est particulièrement cruciale pour les techniques impliquant plusieurs images dans l’espace ou le temps, telles que les piles d’images 3D (c’est-à-dire les piles z) et l’imagerie accélérée. Tout mouvement d’animal entre les expositions peut obscurcir le résultat. Pour C. elegans, une forte immobilisation implique généralement la manipulation manuelle d’animaux individuels et leur montage sur des lames avec un anesthésique15,16. Ces procédures à forte intensité de temps et de main-d’œuvre rendent les expériences à grande échelle très difficiles. Une stratégie d’immobilisation où les animaux sont directement et réversiblement immobilisés sur leurs plaques de culture d’origine pourrait permettre une imagerie haute résolution à haut débit.
L’immobilisation au refroidissement de C. elegans a été démontrée dans quelques études, mais n’est pas largement utilisée. Il est généralement associé à un dispositif microfluidique pour immobiliser davantage les animaux17,18,19. Cependant, les dispositifs microfluidiques sont complexes, nécessitent une formation opérationnelle importante et ne peuvent pas être facilement intégrés aux flux de travail typiques de culture solide des expériences de C. elegans. Ainsi, la microfluidique n’est pas largement utilisée pour l’immobilisation de C. elegans. Présentée ici, conjointement avec la récente publication20 du laboratoire Chung, est l’introduction d’une nouvelle approche d’immobilisation du refroidissement utilisant un étage de refroidissement thermoélectrique (Figure 1) pour remédier à ces lacunes. Avec l’étape de refroidissement, une plaque typique de culture de polystyrène de 60 mm peut être refroidie à n’importe quelle température cible (ensemble T) comprise entre -8 ° C et la température ambiante. Cette approche de l’étape de refroidissement peut facilement et de manière réversible immobiliser toute une population animale avec un minimum d’effort de l’utilisateur, éliminant 98% du temps de traitement des animaux20.
Ci-dessous, les procédures pour construire une étape de refroidissement à partir de zéro sont décrites. À l’exception de l’usinage des pièces et de l’impression 3D, l’ensemble de la procédure devrait prendre 4 heures sans nécessiter d’outils spéciaux ou d’expertise. Ensuite, trois stratégies de refroidissement différentes avec des vitesses de refroidissement variables et les efforts de l’utilisateur pour immobiliser C. elegans sur un microscope vertical typique sont décrites plus en détail. La stratégie préférée peut dépendre de l’application utilisateur. Les protocoles de ces trois stratégies d’immobilisation du refroidissement sont décrits en détail.
Protocole
1. Fabrication et préparation de chaque composant de l’étape de refroidissement
NOTA : L’étage de refroidissement comprend plusieurs composants (voir le tableau des matériaux). La plupart des composants sont prêts à l’emploi. La fenêtre en saphir nécessite une commande personnalisée, tandis que la plaque de cuivre, le support de maintien et la plaque d’isolation peuvent être fabriqués sur place avec un broyeur à commande numérique par ordinateur ou une imprimante 3D. Après la fabrication initiale, le processus d’assemblage ultérieur prend environ 2-3 h.
- Utiliser un broyeur à commande numérique par ordinateur pour usiner la plaque de cuivre à partir d’une tôle de cuivre pur de 170 mm x 120 mm x 3 mm à 99,9 % (figure 2A). Le dessin 2D pour cette fabrication est fourni dans le fichier supplémentaire 1. Utilisez du papier de verre à grain fin pour éliminer les arêtes vives et les résidus sales.
- Pour fabriquer le support de maintien et la plaque d’isolement, utilisez une imprimante 3D et un filament d’acide polylactique (PLA) de 1,75 mm de diamètre (Figure 2B,C). Pour une meilleure qualité, l’imprimante 3D doit fournir une hauteur de couche supérieure à 0,2 mm.3D les modèles sont fournis dans le fichier supplémentaire 2 et le fichier supplémentaire 3.
2. Construction de l’ensemble de refroidissement par eau
- Préparez le tube en silicone durci au platine, le réservoir de pompe, le bloc de refroidissement en cuivre et le radiateur (Figure 3A) pour la construction de l’ensemble de refroidissement par eau. Préparez une lame de rasoir, des ciseaux et une clé hexagonale prêts à l’emploi. Soyez conscient des risques électriques dus à l’utilisation d’eau tout au long de l’assemblage.
- Coupez le tube en silicone en trois sections avec des longueurs suggérées de 40 cm, 50 cm et 80 cm. Ajustez la longueur si nécessaire.
- Branchez les sections de tube en silicone de l’étape 2.2 dans les orifices du radiateur, du réservoir de pompe et du bloc de refroidissement en cuivre, comme illustré à la Figure 3B. Assurez-vous que toutes les connexions sont étanches. L’ensemble de refroidissement par eau est maintenant construit.
- Préparez l’ensemble de refroidissement par eau, une alimentation de 12 V, trois fils de démarrage rouges et trois noirs, une planche à pain et 500 ml d’eau purifiée.
- Assurez-vous que l’établi est exempt de liquide pour la sécurité électrique.
- Connectez les réservoirs de la pompe et les fils du radiateur à l’alimentation 12 V via la breadboard (Figure 3C). La planche à pain est utilisée pour plus de commodité.
REMARQUE: Pour une connexion plus permanente et plus sûre, les chercheurs peuvent remplacer la planche à pain par des fils de soudure. - Ouvrez le bouchon du réservoir de la pompe à l’aide d’un tournevis à tête plate. Utilisez un entonnoir pour ajouter de l’eau jusqu’à ce que le réservoir de la pompe soit rempli à environ 80 % (Figure 3D). Ne pas boucher le réservoir de la pompe après ce remplissage.
- Mettez sous tension l’ensemble de refroidissement par eau en branchant l’alimentation 12 V ou en l’allumant (si un interrupteur est présent). Après la mise sous tension, l’eau coulera à l’intérieur de l’ensemble et les ventilateurs du radiateur devraient souffler.
- En raison du débit d’eau du réservoir de la pompe, le niveau de liquide dans le réservoir baissera. Ajouter plus d’eau dans le réservoir de la pompe jusqu’à ce qu’il se stabilise à presque 2/3 plein (Figure 3E).
- Secouez le radiateur pour éliminer les bulles d’air, puis bouchez le réservoir de refroidissement.
- Coupez l’alimentation avant de passer à l’étape suivante.
3. Test des surfaces froides et chaudes de Peltier
REMARQUE: Le Peltier, un composant clé de l’étage de refroidissement, est une pompe à chaleur active à semi-conducteurs qui transfère la chaleur d’un côté à l’autre21. Une surface du Peltier devient chaude et l’autre surface devient froide lorsqu’elle fournit de l’énergie électrique. Par défaut, les fabricants Peltier marquent la surface froide avant de la vendre, mais il est toujours utile de la tester manuellement avant de l’assembler.
- Préparez le bloc d’alimentation réglable et le Peltier, comme illustré à la Figure 4A.
- Assurez-vous que l’alimentation électrique réglable est éteinte pour éviter d’éventuels risques électriques.
- Connectez le fil rouge du Peltier à la sortie positive et le fil noir à la sortie négative de l’alimentation accordable avec des pinces crocodiles fournies avec le bloc d’alimentation (Figure 4B).
- Allumez l’alimentation réglable et réglez-la sur environ 2 V en modulant à la fois les boutons de tension et de courant sur la rangée supérieure de l’alimentation. Utilisez immédiatement un doigt nu pour sentir les deux surfaces du Peltier. Une surface devient froide en quelques secondes.
- Après avoir identifié quelle surface est froide, coupez immédiatement l’alimentation et débranchez le Peltier.
- Utilisez un marqueur pour indiquer la surface froide pour un assemblage futur.
4. Construction de l’ensemble pour refroidir le Peltier à l’aide d’un ensemble de refroidissement par eau
- Comme le montre la figure 4A, préparez l’ensemble de refroidissement par eau éteint, le Peltier (marqué à la surface froide) et la pâte thermique (pour une meilleure conduction thermique).
- Nettoyez toutes les surfaces du bloc de refroidissement en cuivre avec de l’éthanol à 70 % (ou une autre solution plus propre) dans l’ensemble de refroidissement par eau.
- Appliquez environ 0,4 g de pâte thermique sur une surface du bloc de refroidissement par eau en cuivre et assurez-vous que cette orientation de surface empêchera les tubes de se croiser ou de se plier lorsqu’ils sont orientés vers le bas. Utilisez un gant pour protéger la peau et essayez de répartir la pâte thermique de façon fine et uniforme (figure 4C).
- De même, nettoyez la surface chaude du Peltier, puis appliquez la pâte thermique sur la surface (Figure 4D).
- Connectez la surface chaude Peltier à la surface du bloc de refroidissement en cuivre avec de la pâte thermique. Appliquez une pression pour vous assurer qu’il est sécurisé. Suivez l’orientation des fils sur le Peltier et les tubes du bloc de refroidissement en cuivre, comme illustré à la figure 4E. Nettoyez l’excès de pâte thermique.
- Gardez le bloc d’alimentation 12 V et le bloc d’alimentation réglable hors tension. Connectez le Peltier à l’alimentation accordable, comme indiqué dans la section 3.
- Vérifiez à nouveau les connexions de l’ensemble électrique et du refroidissement par eau, puis mettez sous tension l’alimentation 12 V et le bloc d’alimentation réglable de manière séquentielle.
- Réglez progressivement l’alimentation réglable à 12 V. Avec le Peltier suggéré, le courant devrait être d’environ 7,3 A.
- Attendez 2 min; la température de la surface froide de Peltier doit devenir plus froide que -35 °C. Mesurez cette température à l’aide d’un thermomètre infrarouge (figure 4F). Ne touchez pas la surface froide pour éviter de blesser les mains.
- Vérifiez tous les raccords et composants si la température ne peut pas descendre en dessous de -30 °C. Les bulles d’air à l’intérieur de l’ensemble de refroidissement par eau sont une raison possible des performances de refroidissement sous-optimales.
- Pour assurer la sécurité dans les étapes ultérieures, éteignez l’alimentation réglable, attendez 1 min, puis éteignez l’alimentation 12 V.
5. Construction d’une plaque de cuivre et d’une fenêtre en saphir
- Préparez la plaque de cuivre, la fenêtre en saphir de 80 mm de diamètre, la pâte thermique, un ruban de 4 pouces de large et une lame tranchante pour la coupe (figure 5A).
- Nettoyez soigneusement la plaque de cuivre et la fenêtre en saphir avec de l’éthanol à 70% et utilisez du papier de verre à grain fin pour lisser les surfaces rugueuses.
- Appliquez la pâte thermique sur trois surfaces intérieures, comme illustré à la figure 5B. Assurez-vous que la pâte thermique couvre les trois surfaces, mais qu’elle n’est pas trop épaisse, environ 0,5 mm.
- Posez la plaque de cuivre sur la paillasse protégée avec du papier d’imprimante. Le papier facilite le nettoyage ultérieur.
- Insérez la fenêtre en saphir dans le trou de la plaque de cuivre (Figure 5C). Assurez-vous que le saphir ne tourne pas pendant l’insertion pour empêcher la pâte thermique de se déplacer vers d’autres zones. Enlevez l’excès de pâte thermique.
- Collez le ruban de 4 pouces de large à la surface supérieure de l’ensemble plaque de cuivre-saphir (la surface qui a la zone de dépression carrée, comme illustré à la figure 5D). Évitez les bulles d’air entre le ruban et les surfaces de cuivre pendant le collage en guidant lentement l’adhérence d’un côté à l’autre.
- Découpez les zones pointillées bleues spécifiées du ruban à l’aide d’une lame tranchante, en suivant la figure 5E. La découpe expose les deux trous de filetage, la dépression carrée et la surface de 70 mm de diamètre de la fenêtre en saphir.
- Collez la surface inférieure de la plaque de cuivre-fenêtre saphir, puis répétez la procédure de coupe (zone saphir uniquement) sur cette surface, comme illustré à la figure 5F.
REMARQUE: Maintenant, la fenêtre de saphir est fixée à la plaque de cuivre et les surfaces en cuivre sont protégées de la rouille.
6. Assemblage final de l’étape de refroidissement
- Assurez-vous que tous les sous-ensembles et composants essentiels sont prêts.
- Appliquer environ 0,4 g de pâte thermique sur la dépression carrée de la plaque de cuivre (figure 6A).
- Appliquez environ 0,4 g de pâte thermique sur la surface froide du Peltier. Notez que le Peltier est déjà fixé au bloc de refroidissement en cuivre (Figure 6B).
- Connectez la surface froide Peltier à la dépression de la plaque de cuivre avec une pression vers le bas. Nettoyez tout excès de pâte thermique (figure 6C).
- Montez le support imprimé en 3D sur le dessus du bloc de refroidissement en cuivre, puis utilisez une clé hexagonale pour serrer deux vis de 8 à 32 pouces de long afin de fixer le support à la plaque de cuivre (Figure 6D). Utilisez un serrage à faible couple afin que le support imprimé ne se casse pas ou ne se déforme pas pour assurer une conduction thermique correcte du Peltier au cuivre.
- Placez la plaque de cuivre dans la base d’isolation imprimée en 3D pour l’isolation thermique de la paillasse ou de la base du microscope pendant le fonctionnement (Figure 6D).
- L’étage de refroidissement est assemblé et prêt à l’emploi (figure 6E).
- Pour la microscopie, placer l’étape de refroidissement terminée sur une plate-forme de microscope verticale (figure 7A).
- L’assemblage de l’étage de refroidissement est terminé. De plus amples détails sont disponibles dans la publication complémentaire du Laboratoire Chung, qui caractérise pleinement les stratégies détaillées et les mouvements des animaux20.
REMARQUE: Dans les sections suivantes, les protocoles de refroidissement lent, rapide et brusque sont abordés. Les hermaphrodites N2 à L4 ou au début de l’âge adulte ont été utilisés pour produire les données suivantes. La stratégie de refroidissement lent est utile pour immobiliser des animaux cultivés en N2 à 20 °C à 6 °C; Les animaux N2 cultivés à 15 °C sont plus fortement immobilisés à 1 °C20. Une brève comparaison entre ces trois protocoles de refroidissement est présentée dans le tableau 1.
7. Protocole d’immobilisation à refroidissement lent
- Déplacez la plaque de culture avec un couvercle sur un réfrigérateur à 4 °C.
- Après avoir déplacé la plaque de culture vers le réfrigérateur, allumez l’alimentation 12 V de l’étage de refroidissement et réglez la tension d’alimentation réglable sur 5,5 V.
- Une fois que la plaque de culture à couvercle est restée dans le réfrigérateur à 4 °C pendant 1 h, transférer immédiatement la plaque à l’étape de refroidissement et retirer le couvercle (figure 7A). Ces plaques de culture sont généralement autour de 6 ° C. L’étage prérefroidi est stable et suffisamment froid pour maintenir la surface de la gélose à 6 °C.
- Si la température de surface de la gélose change, telle que mesurée ou en notant le mouvement de l’animal, ajuster légèrement la tension jusqu’à ce qu’elle se stabilise à 6 °C.
- Les animaux sont correctement immobilisés au moment du transfert.
8. Protocole d’immobilisation à refroidissement rapide
REMARQUE: La stratégie de refroidissement rapide est la méthode d’immobilisation la plus élémentaire (voir le film 1); cependant, les plaques de gélose occupent la scène pendant un temps prolongé tout en atteignantl’ensemble T. De plus, lorsqu’une forte immobilisation est nécessaire et quel’ensemble T est de 6 °C, le temps d’inactivité est prolongé à environ 1 h20.
- Allumez l’alimentation 12 V de l’étage de refroidissement et réglez la tension d’alimentation réglable sur environ 12 V. Attendez 10 minutes.
- Apportez une plaque de culture de son incubateur directement à l’étape de refroidissement et retirez le couvercle.
- Une fois que la température de surface de la gélose diminue à (Tset + ΔT) °C, réglez l’alimentation accordable sur Vréglé et attendez que la gélose atteigne Tset. L’ensemble V est la tension appropriée pour stabiliser la gélose àl’ensemble T. Le ΔT est une variable qui empêche le surrefroidissement. Voir le tableau 2 pour la combinaison de l’ensemble T, de l’ensemble ΔT et de l’ensemble V.
REMARQUE : Les données présentées dans le tableau 2 concernent spécifiquement le laboratoire Chung et, par conséquent, il convient de noter que les paramètres expérimentaux peuvent varier en fonction des conditions environnementales et d’utilisation uniques de chaque expérience. - Les animaux sont immobilisés lorsque la gélose atteintl’ensemble T. L’immobilisation s’améliore avec le temps jusqu’à ~50 min après le début du refroidissement.
9. Protocole d’immobilisation par refroidissement brutal
REMARQUE: La stratégie de refroidissement brusque consomme le plus de temps de l’utilisateur, mais immobilise les animaux le plus rapidement de leur température de culture.
- Allumez l’alimentation 12 V de l’étage de refroidissement et réglez la tension du bloc d’alimentation réglable à environ 12 V. Conserver pendant 10 min.
- Apportez une plaque de gélose inoccupée à l’étape de refroidissement. Utilisez l’étape 8.3 du protocole d’immobilisation à refroidissement rapide pour stabiliser la température de surface de la gélose àl’ensemble T.
- Déplacez les animaux de leur plaque de culture d’origine à la plaque refroidie située sur l’étage de refroidissement.
- En fonction de la petite taille de l’animal, on s’attend à ce que les animaux refroidissent à Tréglé en quelques secondes et soient immobilisés. L’immobilisation s’améliore avec le temps jusqu’à ~50 min après le début du refroidissement.
10. Renaissance des animaux après l’immobilisation du refroidissement
- Replacez la plaque de culture refroidie dans l’incubateur d’origine ou à température ambiante.
- Attendez 20 minutes à 1 h jusqu’à ce que tous les vers de l’assiette reprennent leur comportement normal de ramper et d’alimentation.
Résultats
Mesure de la température de refroidissement
Pour les expériences initiales d’immobilisation par refroidissement, il est important de suivre la température de surface de la gélose pour s’assurer que les animaux peuvent être correctement immobilisés. Les expériences futures qui sont reproduites à partir de la première peuvent utiliser les mêmes paramètres, généralement sans suivi fréquent de la température. Pour la mesure de la température, la pointe du thermocouple du thermomètre est stérilisée à l’aide d’une solution d’éthanol à 70%, en attendant que l’éthanol s’évapore complètement avant de l’utiliser. Ensuite, la pointe du thermocouple est insérée de 1 mm dans la gélose NGM pour assurer une lecture précise de la température. L’embout du thermomètre est maintenu à l’aide d’un support de pince ou d’autres supports (figure 7B).
Mesure de température avec une caméra infrarouge
L’étage de refroidissement est conçu pour assurer une répartition de la température dans la zone centrale de 40 mm de diamètre de la plaque. Une caméra infrarouge orientée vers l’avant (FLIR) est utilisée pour imager la distribution de la température sur la surface de la gélose . La différence de température maximale est d’environ 1 °C lorsquel’ensemble T est de 1, 3 ou 6 °C (Figure 8A).
Évaluation de la vitesse de refroidissement avec la stratégie de refroidissement rapide
La stratégie de refroidissement rapide est utilisée pour caractériser la vitesse de refroidissement d’un étage à 12 V. Une plaque de 20 °C est placée sur l’étage de refroidissement et un thermocouple est utilisé pour suivre la température de surface. L’étage refroidit les plaques de 20 °C à 6 °C en 6 min, à 1 °C en 10 min, et finit par se stabiliser en dessous de -7 °C en 40 min environ (Figure 8B).
Utilisation de l’étage de refroidissement sur une plate-forme de microscope vertical
Un microscope droit comprend généralement un objectif pour l’imagerie, une étape pour la tenue de l’échantillon et l’éclairage. Cet étage de refroidissement est conçu pour être utilisé sur un étage de microscope vertical typique avec une insertion et un retrait faciles (Figure 8C). Lorsque l’immobilisation du refroidissement est nécessaire pour l’imagerie ou le dépistage, l’étage de refroidissement est simplement placé sur l’étage du microscope pour terminer l’installation et vice versa.
L’immobilisation des vers sur la plaque de refroidissement est montrée dans le film 1.
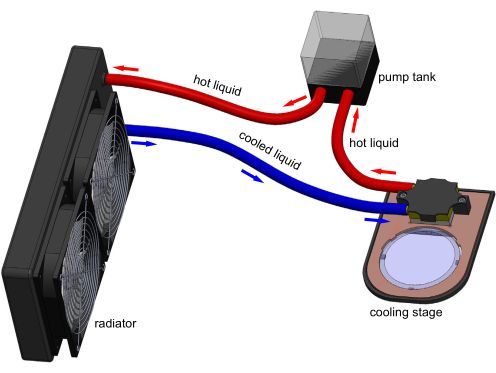
Figure 1 : Modèle 3D de l’appareil de l’étage de refroidissement. Les connexions électroniques ne sont pas affichées pour plus de clarté. Un réservoir pompe l’eau à travers le bloc de refroidissement pour éliminer la chaleur transférée par le Peltier intégré dans l’étage. Une plaque de culture de polystyrène typique de 60 mm peut être posée sur la fenêtre en saphir transparente et être refroidie par scène. Modèle généré dans Solidworks. Veuillez cliquer ici pour voir une version agrandie de cette figure.
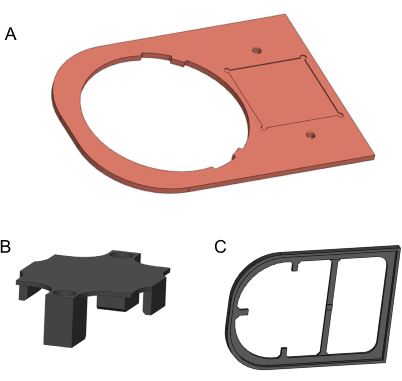
Figure 2 : Modèles 3D des composants à fabriquer. (A) Plaque de cuivre. (B) Support de maintien imprimé en 3D. (C) Plaque d’isolation imprimée en 3D. Modèles générés dans Solidworks. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3: Ensemble de refroidissement par eau . (A) Composants individuels. Tubes coupés à des longueurs spécifiées. (B) Composants de refroidissement par eau connectés. (C) Fils reliant le réservoir de la pompe et le radiateur à l’alimentation électrique de 12 V. En général, les fils rouges se connectent à l’extrémité positive et les fils noirs à l’extrémité négative. (D) Eau purifiée versée dans la pompe. (E) Le réservoir rempli à plus des deux tiers pour une efficacité optimale de la pompe. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Connexion du Peltier et de l’ensemble de refroidissement par eau. (A) Composants pour faire fonctionner le Peltier. (B) Utilisation de l’alimentation réglable pour déterminer les côtés chauds et froids du Peltier. Pour des raisons de sécurité, pas plus de 2 V sont utilisés. (C) Application uniforme de pâte thermique sur la surface du bloc de cuivre. (D) Application uniforme de pâte thermique sur la surface chaude de Peltier. (E) Côté chaud du Peltier pressé sur le bloc de cuivre avec de la pâte thermique. (F) Thermomètre infrarouge utilisé pour mesurer la température de surface froide de Peltier. Idéalement, la température froide peut atteindre près de -35 ° C. Veuillez cliquer ici pour voir une version agrandie de cette figure.
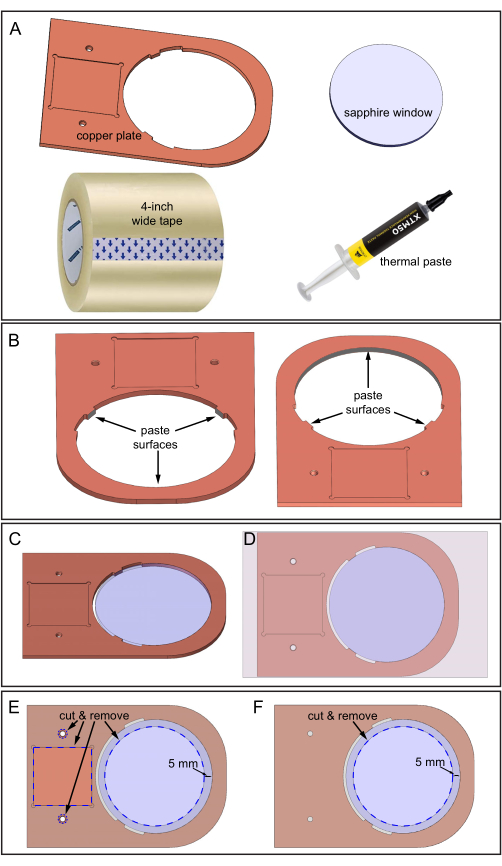
Figure 5 : Assemblage de la plaque de cuivre et de la fenêtre en saphir. (A) Composants requis. (B) Pâte thermique appliquée sur trois surfaces intérieures de la plaque de cuivre où la fenêtre en saphir entrera en contact. Deux vues vers le bas de la plaque de cuivre montrant l’emplacement des trois surfaces. (C) Fenêtre en saphir dans le trou de plaque de cuivre. D) Ruban adhésif appliqué sur la surface supérieure de l’ensemble. (E) Face supérieure : Les lignes pointillées bleues indiquent les endroits où couper et enlever le ruban : dépression carrée, deux trous et une zone de saphir de 70 mm de diamètre. (F) Face inférieure : Le ruban est coupé et enlevé comme indiqué. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Assemblage final de l’étage de refroidissement. (A) Pâte thermique appliquée sur la dépression de la plaque de cuivre. (B) Pâte thermique appliquée sur le côté froid du Peltier. (C) Surface froide du Peltier reliée à la dépression. (D) Bloc de refroidissement en cuivre fixé à la plaque de cuivre à l’aide de vis. Étape de refroidissement dans la base d’isolement. E) Phase de refroidissement terminée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
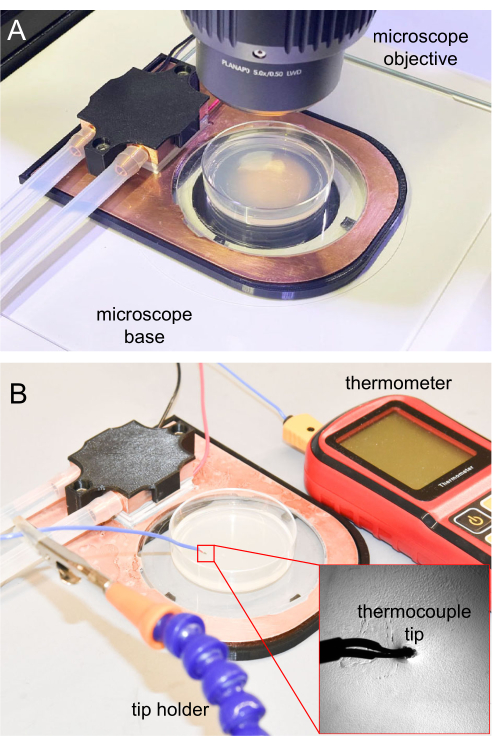
Figure 7 : Etape de refroidissement au microscope et mesure du thermocouple. (A) Etape de refroidissement placée sur la base du microscope pour l’imagerie. La fenêtre saphir est transparente, permettant la transillumination. (B) Thermocouple thermomètre utilisé pour mesurer la température de surface de la gélose NGM. La pointe est insérée à environ 1 mm dans la gélose NGM. Veuillez cliquer ici pour voir une version agrandie de cette figure.
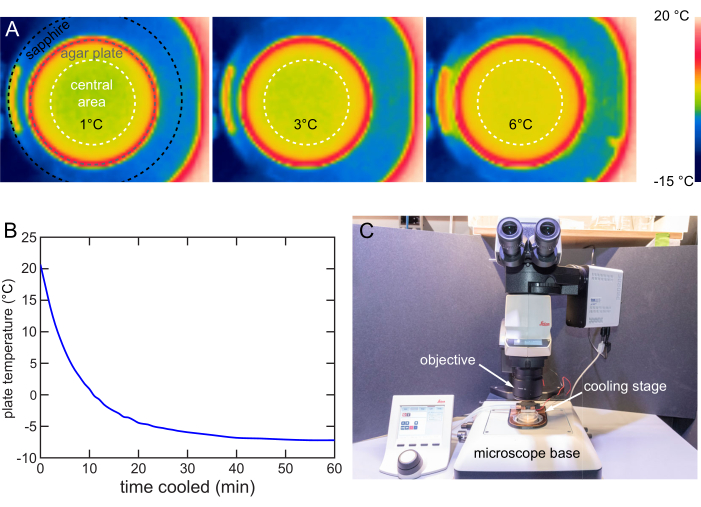
Figure 8 : Caractérisation et utilisation de l’étape de refroidissement. (A) Images thermiques montrant la surface de la gélose refroidie à 1, 3 et 6 °C. Répartition uniforme de la température dans la zone centrale de 40 mm (cercle pointillé blanc). (B) Température de la surface de gélose NGM dans le temps sur l’étage de refroidissement à 12 V. La surface de gélose NGM peut être refroidie à une température inférieure à -7 °C. Température mesurée par la méthode de la figure 7B. (C) Étage de refroidissement utilisé sur un microscope droit typique. L’étage de refroidissement peut être facilement installé ou retiré. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| refroidissement lent | Refroidissement rapide | refroidissement brusque | |
| Profession de scène | minimum | long | Douleur moyenne |
| temps jusqu’à l’immobilisation des animaux | long | Douleur moyenne | court |
| Force d’immobilisation | fort | Douleur moyenne | Douleur moyenne |
| Effort de l’utilisateur | minimum | un peu plus que le minimum | maximum |
Tableau 1 : Comparaison des stratégies de refroidissement.
| Ensemble T (°C) | ΔT (°C) | Ensemble V (V) |
| 1 | 2 | 8 |
| 2 | 3 | 7.4 |
| 3 | 4.5 | 7 |
| 4 | 5.5 | 6.5 |
| 5 | 6 | 5.9 |
| 6 | 6 | 5.5 |
Tableau 2 : Paramètres permettant d’atteindre la température souhaitée dans la stratégie de refroidissement rapide.
Fichier supplémentaire 1 : Plaque de cuivre en métrique. Dessin A2D pour l’usinage de la plaque de cuivre. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2 : Crochet d’attente. Dessin 3D d’un support de maintien qui peut être ouvert ou modifié par Solidworks et exporté vers un logiciel d’impression 3D. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 3 : Plaque d’isolement. Dessin 3D d’une plaque d’isolation pouvant être ouvert ou modifié par Solidworks et exporté vers un logiciel d’impression 3D. Veuillez cliquer ici pour télécharger ce fichier.
Film 1: Vidéo de refroidissement. Vers d’immobilisation sur la plaque de gélose NGM à 2 °C. La plaque a été refroidie de la température ambiante à 2 °C et est restée à 2 °C pendant plusieurs minutes. Ensuite, l’étage de refroidissement a été désactivé et les plaques ont commencé à se réchauffer naturellement à température ambiante. La vidéo est accélérée de 10x pour adapter une vidéo de 1 h en 6 min. Veuillez cliquer ici pour télécharger ce film.
Tableau supplémentaire 1 : Estimation du prix Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La fabrication, l’assemblage et l’utilisation de l’étape de refroidissement sont présentés dans ce manuscrit. La plupart des composants sont des articles prêts à l’emploi qui peuvent être achetés en ligne. Certains composants, comme la plaque de cuivre et la fenêtre en saphir, nécessitent une commande personnalisée et peuvent prendre jusqu’à 1 mois pour être fabriqués. D’autres composants qui peuvent être imprimés en 3D sont facilement fabriqués dans la plupart des établissements de recherche (tableau supplémentaire 1). Le processus d’assemblage ne nécessite que quelques outils et peut être effectué rapidement par un non-expert en quelques heures. Ainsi, la plupart des laboratoires biologiques devraient être en mesure de mettre facilement en œuvre ce dispositif.
L’étape de refroidissement et l’approche d’immobilisation du refroidissement possèdent plusieurs améliorations significatives par rapport aux méthodes d’immobilisation existantes, soigneusement détaillées dans la publication originale20. En bref, l’étape de refroidissement permet une forte immobilisation de grandes populations de C. elegans de tous âges, y compris les embryons et les dauers, sur leurs plaques de culture typiques dans le cadre de flux de travail de microscopie standard. Il élimine le besoin de configurations matérielles complexes, comme la microfluidique, tout en fournissant un effet d’immobilisation plus fort. De plus, il minimise l’exposition chimique toxique possible des animaux et des chercheurs puisqu’aucun produit chimique n’est utilisé, tout en fournissant un effet d’immobilisation similaire. Ces capacités techniques permettent une large application de ce dispositif et une approche à de nombreuses expériences nécessitant une microscopie in vivo à haute résolution sur un grand nombre d’animaux.
Il y a quelques étapes critiques lors de la construction de l’appareil, y compris toute l’application de pâte thermique et le ruban large pour fixer la fenêtre saphir à la plaque de tonnelier. La pâte thermique assure une forte conductivité thermique en remplaçant les espaces par un matériau à faible résistance thermique. Pour obtenir les performances de refroidissement souhaitées, la pâte doit être correctement introduite entre toutes les surfaces aboutissantes / en contact, y compris la surface froide Peltier à la plaque de cuivre, la surface chaude Peltier au bloc de refroidissement en cuivre et la plaque de cuivre à la fenêtre saphir. Le large ruban appliqué sur la scène isole la plaque de cuivre pour empêcher le chauffage de l’air et de la condensation, ce qui entraîne de la rouille. Il renforce également la connexion entre la fenêtre en saphir et la plaque de cuivre. Ainsi, l’application de la pâte thermique et du ruban large nécessitent des soins supplémentaires.
Dans une expérience réelle d’immobilisation de refroidissement, les paramètres fournis dans ce manuscrit, tels que les tensions et les temps, dépendent des propriétés spécifiques des plaques de culture et de l’étage, telles que la quantité de gélose dans les plaques, l’efficacité de la scène, la température ambiante et l’humidité. Dans les modifications futures, un contrôleur de rétroaction pourrait être installé, comme une dérivée proportionnelle-intégrale (PID), pour ajuster activement l’entrée de tension à l’étage de refroidissement afin d’atteindre la température souhaitée et de la stabiliser.
Il existe plusieurs limites à cette immobilisation de l’étage de refroidissement, soigneusement détaillées dans la publication originale20. En bref, les animaux élevés à différentes températures sont immobilisés à des degrés différents, ce qui peut nécessiter un réglage plus fin. En outre, cet étage de refroidissement actuel n’est pas conçu pour un microscope inversé. De plus, l’imagerie ou le criblage sur une plaque de culture directement peut introduire une contamination dans la plaque.
Nous concevons de nouvelles versions de l’étage de refroidissement adaptées à différentes plates-formes d’imagerie, y compris les microscopes verticaux composés et les microscopes inversés. Ces nouvelles conceptions permettront l’immobilisation directe du refroidissement des animaux sur des plaques de culture lors de l’imagerie sur ces plateformes. L’imagerie sur ces étages de refroidissement utilisera des objectifs d’immersion dans l’air à longue distance, similaires à la configuration verticale. De nos jours, les objectifs d’immersion dans l’air peuvent avoir une ouverture numérique allant jusqu’à 0,9, ce qui fournit une résolution d’environ 300 nm pour l’imagerie des protéines de fluorescence verte. Ainsi, la combinaison d’un nouvel étage de refroidissement avec un microscope pourrait permettre une imagerie de fluorescence à résolution submicronique de routine.
Nous fournissons également quelques conseils utiles pour l’utilisation de la phase de refroidissement selon notre expérience. Par exemple, les individus devraient vérifier s’il y a des bulles d’air à l’intérieur de l’ensemble de refroidissement par eau. Les bulles d’air dégradent le refroidissement à la surface chaude de Peltier et dégradent ainsi l’efficacité du refroidissement de l’étage de refroidissement. Si des bulles d’air sont présentes, l’alimentation 12 V doit être allumée pour faire couler l’eau et tous les composants du débit d’eau doivent être secoués. Les bulles d’air peuvent être évacuées des zones piégées et évacuées par le réservoir de la pompe. Les chercheurs doivent s’assurer que le tuyau d’écoulement de l’eau n’est pas plié ou croisé lors de l’assemblage de l’ensemble de refroidissement par eau. La flexion ou le franchissement des tubes peut empêcher l’écoulement adéquat de l’eau et réduire l’efficacité du refroidissement. Les raccords de tube doivent être bien ajustés et serrés. Si nécessaire, un tube souple de diamètre différent peut être utilisé à la place pour assurer l’étanchéité. La pâte ne doit pas être appliquée, même si la connexion n’est pas assez serrée, car la pâte peut introduire des sabots lors d’une utilisation future. L’humidité ambiante affecte les performances de refroidissement et introduit de la condensation et de la glace sur la platine de refroidissement. Avant de placer une plaque de culture sur la scène de refroidissement, il est recommandé d’utiliser un mouchoir en papier pour éliminer la condensation ou d’utiliser un dissipateur thermique pour éliminer rapidement la glace qui s’est formée sur la fenêtre en saphir. Le réservoir de la pompe et les ventilateurs du radiateur peuvent provoquer de petites vibrations dans le microscope s’ils travaillent sur la même table. Les vibrations du microscope brouillent l’image acquise et doivent donc être évitées. Un coussin peut être utilisé pour isoler mécaniquement le réservoir et le radiateur, ou ils peuvent être placés sur une table séparée à proximité. L’étage de refroidissement peut devenir un étage de chauffage en inversant la connexion électrique au Peltier.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts financiers concurrents ou autres conflits d’intérêts.
Remerciements
Nous remercions Noah Joseph (Northeastern Bioengineering Department) pour l’usinage des plaques de cuivre.
matériels
| Name | Company | Catalog Number | Comments |
| 12-V power supply | ANYTITI | ledpower00 | output DC 12V +/-0.5V, 5A power 60W |
| 8-32 screw | arbitrary | for bracket fixation | |
| bracket | N/A | N/A | 3D printed using 1.75mm PLA filament. See supplementary for 3D model. |
| breadboard | DEYUE | 7545924028 | 400 pin solderless board kit for DIY electric connection |
| copper cooling block | Kalolary | Kalolary-Heatsink001 | 40*40mm internal fin thickness 0.5mm |
| copper plate | arbitrary | N/A | Machined from a 170x120x3 mm 99.9% pure copper sheet. See supplementary for 2D drawing for manufacturing. |
| digital thermocouple thermometer | Proster | 4333090752 | dual channel thermometer with two K-type thermocouple probes measuring range -50-300°C accuracy ±1.5% resolution 0.1°C /°F < 1000° |
| isolation base | N/A | N/A | 3D printed using 1.75mm PLA filament. See supplementary for 3D model. |
| jumper wires | arbitrary | for electronic connection | |
| multistage peltier | DigiKey | TEC1-12706 | thermoelectric cooling device size 40*40*7.05 mm Umax 16.1 V Imax 8.5 A ΔTmax @ Th 85°C @ 27°C Qmax @ Th 51.6W @ 27°C resistance 1.65 Ω |
| Nalgene 50 Platinum-Cured Silicone Tubing | ThermoScientific | 14-176-332E | ultrasoft tube durometer hardness Shore A, 50 inner diameter 1/4 in outer diameter 9.5 mm |
| packaging tape | arbitrary | 4 inch wide to cover the copper plate | |
| pump tank | Yosoo | SC-300T | input power DC 12V flow rate 300L/h max |
| radiator | DIYhzWater | 10463 | 12 pipe aluminum heat exchanger cooling water drain row with two 120mm fans |
| sapphire window | Altos Photonics, Inc. | N/A | Contact Altos for custom order size Ø 80mm, 3mm thick surface quality 60-40s/d uncoated |
| thermal paste | Corsair | XTM50 | reduce thermal impedance between surfaces thermal conductivity 5.0W/mK |
| tunable power supply | Kungber | DY-SPS3010B | voltage range 0 – 30V current range 0 – 10A linear Power Supply with 4-Digits coarse and fine adjustments with alligator leads |
Références
- Wearne, S. L., et al. New techniques for imaging, digitization and analysis of three-dimensional neural morphology on multiple scales. Neuroscience. 136 (3), 661-680 (2005).
- Zhou, Z., Sorensen, S., Zeng, H., Hawrylycz, M., Peng, H. Adaptive image enhancement for tracing 3D morphologies of neurons and brain vasculatures. Neuroinformatics. 13 (2), 153-166 (2015).
- Parthasarathy, R., Groves, J. T. Optical techniques for imaging membrane topography. Cell Biochemistry and Biophysics. 41 (3), 391-414 (2004).
- Chan, C. Y., Faragalla, Y., Wu, L. -G. Illuminating membrane structural dynamics of fusion and endocytosis with advanced light imaging techniques. Biochemical Society Transactions. 50 (4), 1157-1167 (2022).
- Chen, Y., Periasamy, A. Characterization of two-photon excitation fluorescence lifetime imaging microscopy for protein localization. Microscopy Research and Technique. 63 (1), 72-80 (2004).
- Chen, Y., Mills, J. D., Periasamy, A. Protein localization in living cells and tissues using FRET and FLIM. Differentiation. 71 (9-10), 528-541 (2003).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy-tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. Journal of Microscopy. 245 (3), 311-318 (2012).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Hobert, O., Loria, P. Uses of GFP in Caenorhabditis elegans. Green Fluorescent Protein: Properties, Applications, and Protocols. 47, 203-226 (2005).
- Emmons, S. W., Yemini, E., Zimmer, M. Methods for analyzing neuronal structure and activity in Caenorhabditis elegans. Genetics. 218 (4), (2021).
- Chung, S. H., et al. Novel DLK-independent neuronal regeneration in Caenorhabditis elegans shares links with activity-dependent ectopic outgrowth. Proceedings of the National Academy of Sciences. 113 (20), E2852-E2860 (2016).
- Caldwell, K. A., Willicott, C. W., Caldwell, G. A. Modeling neurodegeneration in Caenorhabditis elegans. Disease Models & Mechanisms. 13 (10), (2020).
- Pintard, L., Bowerman, B. Mitotic cell division in Caenorhabditis elegans. Genetics. 211 (1), 35-73 (2019).
- Bargmann, C. I., Avery, L. Laser killing of cells in Caenorhabditis elegans. Methods in Cell Biology. 48, 225-250 (1995).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Chung, K. H., Crane, M. M., Lu, H. Automated on-chip rapid microscopy, phenotyping and sorting of C. elegans. Nature Methods. 5 (7), 637-643 (2008).
- Rohde, C. B., Yanik, M. F. Subcellular in vivo time-lapse imaging and optical manipulation of Caenorhabditis elegans in standard multiwell plates. Nature Communications. 2, 271(2011).
- Guo, S. X., et al. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5 (6), 531-533 (2008).
- Wang, Y. L., Grooms, N. W. F., Jaklitsch, E. L., Schulting, L. G., Chung, S. H. High-throughput submicron-resolution microscopy of Caenorhabditis elegans populations under strong immobilization by cooling cultivation plates. iScience. 26 (2), 105999(2023).
- Zhao, D., Tan, G. A review of thermoelectric cooling: Materials, modeling and applications. Applied Thermal Engineering. 66 (1-2), 15-24 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon