Loi des gaz parfaits
Vue d'ensemble
Source : Laboratoire de Dr. Andreas Züttel - Swiss Federal Laboratories for Materials Science and Technology
La Loi des gaz parfaits décrit le comportement des gaz plus communs dans des conditions proches de l’air ambiant et la tendance de toute matière chimique dans la limite de la diluer. Il existe une relation fondamentale entre trois variables système macroscopique mesurable (pression, température et le volume) et le nombre de molécules de gaz dans le système et est donc un lien essentiel entre l’univers macroscopiques et microscopique.
L’histoire de la Loi des gaz parfaits remonte jusqu’au milieu du 17ème siècle lorsque la relation entre la pression et le volume d’air s’est avérée pour être inversement proportionnelle, une expression confirmée par Robert Boyle et que nous appelons maintenant Loi de Boyle (équation 1).
P  V-1 (équation 1)
V-1 (équation 1)
Œuvre non publiée par Jacques Charles dans les années 1780, qui a été étendu à de nombreux gaz et vapeurs de Joseph Louis Gay-Lussac et signalés en 1802, établi la relation proportionnelle entre la température absolue et le volume d’un gaz. Cette relation est appelée Loi de Charles (équation 2).
V  T (équation 2)
T (équation 2)
Guillaume Amontons est généralement crédité sur la première découverte de la relation entre la température et la pression d’air dans un volume déterminé au début du 18ème siècle. Cette loi a été étendue aussi aux nombreux autres gaz par Joseph Louis Gay-Lussac au début du 19ème siècle et est donc que soit dénommée loi de Amontons ou loi de Gay-Lussac, a déclaré comme le montre l’équation 3.
P  T (équation 3)
T (équation 3)
Ensemble, ces trois relations peuvent être combinées pour donner la relation dans l’équation 4.
V  T (équation 4)
T (équation 4)
Enfin, en 1811, il a été proposé par Amedeo Avogadro que tout deux gaz, qui s’est tenue dans le même volume et à la même température et pression, contiennent le même nombre de molécules. Cela a conduit à la conclusion que tous les gaz peuvent être décrite par une constante commune, la constante des gaz parfaits R, qui est indépendant de la nature du gaz. Ceci est connu comme la Loi des gaz parfaits (équation 5). 1, 2
PV  T (équation 5)
T (équation 5)
Procédure
1. mesure du Volume de l’échantillon
- Nettoyer l’échantillon soigneusement et sécher.
- Remplir un cylindre gradué haute résolution avec assez d’eau pour couvrir l’échantillon distillée. Noter le volume initial
- Déposer l’échantillon dans l’eau et noter le changement de volume. C’est le volume de l’échantillon, V.
- Retirer l’échantillon et séchez-le. Remarque : vous pouvez également mesuré la longueur du côté de l’échantillon et calculer son volume à l’aide de la géométrie.
Résultats
La Loi des gaz parfaits est une description valide des propriétés des gaz réels de nombreux gaz communs aux conditions près ambiant (encart de laFigure 1 ) et est donc utile dans le cadre de nombreuses applications. Les limites de la Loi des gaz parfaits dans la description de systèmes dans des conditions de pression haute ou basse température peuvent s’expliquer par l’importance croissante des interactions moléculaires et/ou la taille finie des molécules de gaz qui contribuent aux propriét?...
Applications et Résumé
La Loi des gaz parfaits est telle une équation fondamentale des sciences chimiques qu’il a une multitude d’utilisations tant dans les activités quotidiennes de laboratoire, ainsi que dans les calculs et modélisation de systèmes très complexes, au moins en première approximation. Son application est limitée uniquement par les approximations inhérentes à la Loi elle-même ; à l’air ambiant près de pressions et des températures, où la Loi des gaz parfaits est bien valable pour nombreux gaz communs, il es...
References
- Zumdahl, S.S., Chemical Principles. Houghton Mifflin, New York, NY. (2002).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Rouquerol, F., Rouquerol, J., Sing, K.S.W., Llewellyn, P., Maurin, G. Adsorption by Powders and Porous Solids: Principles, Methodology and Applications.Academic Press, San Diego, CA. (2014).
Passer à...
Vidéos de cette collection:

Now Playing
Loi des gaz parfaits
General Chemistry
78.7K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
657.7K Vues

Solutions et Concentrations
General Chemistry
274.8K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
556.6K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.7K Vues

Déterminer la formule empirique
General Chemistry
183.7K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.5K Vues

Utiliser un pH-mètre
General Chemistry
346.6K Vues

Introduction au titrage
General Chemistry
425.2K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.6K Vues

Principe de Le Châtelier
General Chemistry
265.7K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.8K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
196.2K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.5K Vues

Complexes de coordination
General Chemistry
91.7K Vues
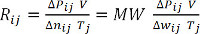 (Équation 9)
(Équation 9)