Introduction au titrage
Vue d'ensemble
Source : Laboratoire de Dr Yee Tan Nee — Agency for Science, Technology and Research
Titrage est une technique courante utilisée pour déterminer quantitativement la concentration inconnue d’un analyte identifié. 1-4 , il est aussi appelé l’analyse volumétrique, la mesure des volumes est essentielle au titrage. Il existe de nombreux types de titrages basés sur les types de réactions qu’ils exploitent. Les types les plus courants sont les titrages acide-base et titrages d’oxydo-réduction. 5-11
Dans un processus de titrage typique, une solution titrée de titrant dans une burette est progressivement appliquée pour réagir avec un analyte avec une concentration inconnue dans un erlenmeyer. Titrages acide-base, un indicateur de pH est généralement ajouté dans la solution d’analyte pour indiquer le point de terminaison de titration. 12 au lieu d’ajouter des indicateurs de pH, pH peut être également surveillée à l’aide d’un pH-mètre pendant le processus de titrage et le point de terminaison est déterminée graphiquement sur une courbe de titrage pH. Le volume de solution titrante enregistré au point de terminaison peut être utilisé pour calculer la concentration de l’analyte basé sur la stoechiométrie de la réaction.
Pour le titrage acide-base présenté dans cette vidéo, la solution titrante est une solution d’hydroxyde de sodium normalisée et l’analyte est vinaigre domestique. Le vinaigre est un liquide acide qui est fréquemment utilisé comme condiment culinaire ou arômes. Vinaigre se compose principalement de l’eau et l’acide acétique (CH3COOH). La teneur en acide acétique du vinaigre commercial peut varier considérablement, et le but de cette expérience est de déterminer la teneur en acide acétique du vinaigre commercial par titrage.
Principles
La détermination de l’acide acétique dans le vinaigre est basée sur le principe d’une méthode de titrage acide-base. La réaction entre le NaOH et CH3COOH est illustrée dans l’équation 1:
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2(aq) (1)
La solution standardisée de NaOH on ajoute progressivement le vinaigre avec la concentration de l’acide acétique inconnu jusqu'à atteindre le point de fin. Au cours du titrage acide-base, le pH peut être tracé en fonction du volume de la solution titrante ajoutée. Le point d’inflexion sur la courbe, le point au cours de laquelle il y a une quantité stoechiométrique d’égale d’acide et basique dans une solution, est appelé le point d’équivalence. La plupart des acides et des bases sont incolores, sans aucune réaction visible au point d’équivalence. Pour observer lorsque le point d’équivalence est atteinte, un indicateur de pH est ajouté. Le point de terminaison n’est pas le point d’équivalence, mais un point auquel l’indicateur de pH change de couleur. Il est important de choisir un indicateur de pH approprié de sorte que le point final est au plus près du point d’équivalence de titrage possible.
À la fin de cette réaction, le conjugué base NaCH3CO2 est légèrement basique. Indicateur de phénolphtaléine a un travail pH de 8,3 à 10,0, qui est incolore en solution acide et magenta au-dessus de pH 8,2. Phénol-phtaléine est donc un indicateur préféré car il passera de l’incolore au rose à cette condition. Lors de l’exécution de l’expérience, il est préférable de garder la concentration de l’indicateur de pH faible parce que les indicateurs de pH eux-mêmes sont acides généralement faibles qui réagissent avec la base.
Le volume de solution de NaOH normalisé ajouté au point final peut alors servir à calculer la concentration molaire de l’acide acétique basé sur la stœchiométrie de l’équation ci-dessus. Dans cette expérience, la solution titrante NaOH est une forte alcaline et l’acide acétique de l’analyte est un acide faible.
Avant d’effectuer l’expérience, il est important de considérer la nature hygroscopique de NaOH. Cette propriété requiert sa solution à normaliser avec un étalon primaire stable comme le phtalate d’hydrogène de potassium (KHC8H4O4). La concentration molaire exacte de la solution de NaOH peut ensuite être déterminée avec précision après normalisation. La réaction entre l’acide primaire standard et NaOH est illustrée dans l’équation 2:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
Un protocole de titration de pas à pas détaillé est présenté dans la section suivante.
Procédure
1. normalisation de NaOH avec Hydrogenphthalate de Potassium (KHC8H4O4)
- Pour commencer, la solution titrante, hydroxyde de sodium doit être standardisé. Préparer un solution de NaOH de stock en dissolvant environ 4 g de NaOH culot dans 100 mL d’eau désionisée. Notez que NaOH est un produit chimique dangereux qui est corrosif pour la peau et irritant pour les yeux, être prudent et porter l’équipement approprié de protection individuelle (EPI) pour éviter le contact cutané ou oculaire.
- Faire un 01:10 dilution de la solution d’hydroxyde de sodium en ajoutant 25 mL de la solution d’hydroxyde de sodium stock à une bouteille de 500 mL. Hydroxyde de sodium absorbe le dioxyde de carbone. Il est important d’éviter cela en faisant en sorte d’utiliser l’eau bouillie, déminéralisée, un flacon séché au four et de plafonner la bouteille rapidement. Faire la solution à 250 mL avec de l’eau désionisée et secouez pour mélanger.
- 4 – 5 g de la principale norme acide, KHC8H4O4 à 110 ° C pendant 4 heures dans une étuve à sec et ensuite refroidir le solide dans un dessiccateur pendant 1 h.
- Dissoudre environ 4 g de sèche KHC8H4O4 dans 250 mL d’eau désionisée. Enregistrer la masse avec précision. Calculer la concentration molaire de la solution KHC8H4O4 .
- Pipetter 25 mL de KHC8H4O4 dans un erlenmeyer propre et sec. Ajouter 2 gouttes de phénolphtaléine et agiter doucement pour bien mélanger. Notez que la phénol-phtaléine est toxique et irritant, faire preuve de prudence afin d’éviter le contact cutané ou oculaire.
- Nettoyer une burette de 50 mL et un entonnoir soigneusement à l’eau et de détergent. Rincer la burette avec de l’eau et rincer 3 fois avec de l’eau désionisée. Rincer la burette avec la solution de NaOH diluée 3 x, en vous assurant que le NaOH mouille la totalité de la surface intérieure et drainer les déchets par le biais de la pointe. Monter la burette lavée sur un ringstand avec une pince et faire en sorte qu’il se dresse verticalement.
- Remplir la burette propre avec la solution de NaOH diluée. Il est à noter que le montant de la NaOH dilué doit ne pas être exactement à la marque zéro mais qu’il devrait être dans l’échelle et suffisante pour au moins un titrage. Bulles d’air peuvent affecter la précision du volume de lecture. Vérifiez soigneusement la burette de bulles d’air et tapoter la burette pour les libérer et d’ouvrir le robinet pour laisser quelques mL de solution titrante s’écouler à travers et dans le même temps, libérant toute l’air emprisonné. Lire le volume en regardant le bas du ménisque après 10 s. Record ce volume initial. Faire attention aux chiffres significatifs de la lecture. Enregistrez la valeur à deux décimales dans mL.
- Placer l’erlenmeyer contenant du phtalate d’hydrogène de potassium (KHC8H4O4) sous la burette et régler la hauteur de la burette correctement. Titrer la solution KHC8H4O4 en ajoutant lentement la solution de NaOH par incréments de 1 à 2 mL à l’aide d’une part à contrôler le débit d’eau en réglant le robinet d’arrêt et l’autre en agitant le flacon.
- Près du point de terminaison, commencez à ajouter la solution titrante goutte à goutte. Le point de terminaison est atteint quand la solution devient une couleur rose pâle, persistante. Noter le volume final du NaOH dilué dans la burette.
- Répétez le titrage au moins deux fois plus d’obtenir des données cohérentes. Calculer la concentration molaire de la solution de NaOH.
2. titrage du vinaigre avec la Solution d’hydroxyde de Sodium normalisée
- La solution d’hydroxyde de sodium est maintenant normalisée et peut être utilisée comme une solution titrante pour analyser le vinaigre. Pour réduire l’odeur âcre de vinaigre, diluer 10 mL de la solution à tester dans un 01:10 ration pour un volume total de 100 mL.
- Pipetter 25 mL de l’analyte, dans un erlenmeyer propre et sec (remarqué que VA). Ajouter 2 gouttes de phénolphtaléine.
- Remplir la burette avec la solution de NaOH normalisée de la première partie de la procédure. Noter le volume initial de solution titrante (V1).
- Ajouter progressivement la solution standardisée de NaOH pour le vinaigre. Quand le volume de solution titrante s’approche de la valeur attendue, ajuster le robinet pour ajouter la solution titrante goutte à goutte. Continuer à agiter le ballon d’une main et gardez l’autre main prêt à fermer le robinet d’arrêt. Une fois la solution d’analyte change de couleur rose clair, agiter pendant quelques secondes voir si la couleur s’estompera. Si la couleur persiste, le titrage atteint le point de fin. Enregistrer le dernier volume de titrant (V1'). Si la couleur de la solution s’estompe, ajouter une goutte de plus de solution titrante. Laver l’extrémité inférieure de la burette à l’aide de la pissette. Prélever le mélange lavé et regardez la couleur changent de la solution d’analyte. Continuer le titrage jusqu'à ce que le point de terminaison. Enregistrer la quantité de solution titrante nécessaire (Vt1 = V1' V1).
- Répétez le titrage au moins deux fois jusqu'à trois valeurs concordantes qui se trouvent dans 0,1 mL de l’autre est obtenu (Vt2 ett3de la V).
- Calculer la valeur moyenne du volume de solution titrante en utilisant les trois valeurs obtenues dans trois différents titrages : Vt = (Vt1 +t2 de la V + Vt3) / 3. La concentration molaire de l’acide acétique dans le vinaigre peut être ainsi calculée à l’aide de l’équation 3.
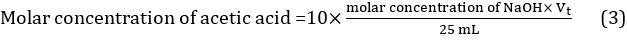
Résultats
| Unité | Essai 1 | Essai 2 | Essai 3 | |||
| Volume d’acide de vinaigre dilué (VA) | mL | 25,00 | ||||
| Concentration molaire de NaOH (ch.NaOH) | mol/L | 0.09928 | ||||
| Lecture de la burette initiale de NaOH | mL | 0,10 | 0. 05 | 1.20 | ||
| Lecture de la burette final de NaOH | mL | 18,75 | 18.60 | 19,80 | ||
| Volume de NaOH distribué | mL | 18.65 | 18.55 | 18.60 | ||
| Volume moyen de NaOH dispensé (V,t) | mL | 18.60 | ||||
Le tableau 1. Résultats de titrage.
Exemples de calcul :
Masse du KC8H5O4 = 4,0754 g
La masse molaire du KC8H5O4 = 204.22 g/mol
Nombre de moles du KC8H5O4 à 25,00 mL de solution standard =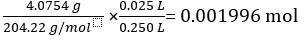
Conformément à l’équation 2,
Concentration de la solution de NaOH =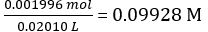
Moles de NaOH distribué = concentration du NaOH × volume moyen de NaOH distribué = 0.09928 mol/L × 18,60 mL = 1.847 × 10-3 mol
Conformément à l’équation 1,
Nombre de moles de CH3COOH dans 25,00 mL de vinaigre dilué = 1,847 × 10-3 mol
Concentration de vinaigre dilué =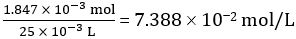
Donc concentration de vinaigre pur = 10 × 7,388 102 mol/L = 0.7388 mol/L
Les étapes ci-dessus sont présentés pour illustrer la procédure de calcul ; Nous pouvons simplement appliquer l’équation 3 pour obtenir la concentration de vinaigre pur en une seule étape.
C’est pourquoi 1,000 L de vinaigre pur contient 0.7388 mol de CH3COOH.
Volume de CH3COOH =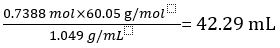
% De volume de vinaigre = 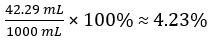
Applications et Résumé
Titrage est une méthode chimique importante qui est souvent appliquée dans les recherches actuelles de chimie. Par exemple, acide base titrage est appliquée pour déterminer la valeur amine ou hydroxyle d’un échantillon. La valeur de l’amine est définie comme le nombre de milligrammes de KOH équivalente au contenu amine dans un gramme d’échantillon. Pour déterminer l’indice d’hydroxyle, l’analyte est tout d’abord acétylé en utilisant l’anhydride acétique puis titré avec KOH. La masse en mg de KOH correspond ensuite à des groupes hydroxyles dans un gramme d’échantillon. 13 un autre exemple est le test de Winkler, un type spécifique de titrage redox utilisé pour déterminer la concentration d’oxygène dissous dans l’eau pour les études de qualité de l’eau. L’oxygène dissous est réduite à l’aide de sulfate de manganèse (II), qui réagit alors avec l’iodure de potassium pour produire l’iode. Étant donné que l’iode libéré est directement proportionnelle à la teneur en oxygène, la concentration d’oxygène est déterminée par titration iode avec thiosulfate à l’aide d’un indicateur à l’amidon. 14
En plus d’applications en recherche fondamentale en chimie, titrage a également été largement adopté à usage industriel et tous les jours. Dans l’industrie du biodiesel, huile végétale usagée (WVO) doit tout d’abord être neutralisé pour éliminer les acides gras libres qui réagirait normalement pour faire du savon non désiré. Une partie de WVO est titrée avec une base pour déterminer l’acidité de l’échantillon, alors que le reste du lot peut être neutralisé correctement. 15 méthode de Benoît XVI, un test pour la quantification du niveau de glucose d’urine, est un autre exemple montrant l’importance de titration en soins de santé. Dans ce titrage, ions cuivriques sont réduites à des ions cuivreux par le glucose, qui réagissent ensuite avec le thiocyanate de potassium pour former un précipité blanc, indiquant le point de terminaison. 16
References
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Introduction au titrage
General Chemistry
425.4K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
658.3K Vues

Solutions et Concentrations
General Chemistry
275.1K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
556.8K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.8K Vues

Déterminer la formule empirique
General Chemistry
183.7K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.6K Vues

Utiliser un pH-mètre
General Chemistry
346.7K Vues

Loi des gaz parfaits
General Chemistry
79.0K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.7K Vues

Principe de Le Châtelier
General Chemistry
265.8K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.8K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
196.3K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.7K Vues

Complexes de coordination
General Chemistry
91.7K Vues