A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיחקרו את ההשפעות של מטריקס נוקשות על פונקציה נייד באמצעות Acrylamide מבוססי הידרוג
In This Article
Summary
ההשפעה של קשיחות מתחת לקרקע על התפקוד התאי יכול להיות המודל במבחנה באמצעות הידרוג polyacrylamide של התאמות שונות.
Abstract
רקמות קשיחות הוא הקובע חשוב של תפקוד הסלולרי, ושינויים רקמות נוקשות קשורות כלל בסרטן פיברוזיס, ומחלות לב וכלי דם 1-11. גישות מסורתיות תא ביולוגי ללימוד פונקציה הסלולר לערב תאים culturing על תשתית נוקשה (צלחות פלסטיק או זכוכית coverslips) אשר אינו יכול להסביר את ההשפעה של ECM אלסטי או וריאציות קשיחות ECM בין רקמות. מודל in vivo ציות התנאים רקמה במבחנה, אנו ואחרים להשתמש ECM מצופה הידרוג. במעבדה שלנו, הידרוג מבוססים על polyacrylamide אשר יכול לחקות את טווח התאמות רקמה ביולוגית לראות 12. "תגובתי" תלושי לכסות מופקים על ידי הדגירה עם NaOH ואחריו תוספת של 3-APTMS. Glutaraldehyde משמש צולבות הקישור 3-APTMS ואת ג'ל polyacrylamide. הפתרון של acrylamide (AC), bis-acrylamide (BIS-AC) ו persulfate אמוניום משמש פילמור של הידרוג. N-hydroxysuccinimide (NHS) הוא שולב פתרון ה-AC חלבון ECM crosslink כדי הידרוג. לאחר פילמור של הידרוג, משטח ג'ל מצופה חלבון ECM של בחירה כגון, קולגן פיברונקטין, vitronectin וכו '
קשיחות של הידרוג ניתן לקבוע על ידי rheology או במיקרוסקופ כוח אטומי (AFM) ובניכוי ידי שינוי אחוז AC ו / או bis-AC בפתרון 12. באופן זה, נוקשות תשתית ניתן להתאים קשיות של רקמות ביולוגיות אשר ניתן לכמת באמצעות rheology או AFM. תאים אז יכול להיות seeded על אלה הידרוג ותרבותיים בהתבסס על תנאי הניסוי הנדרש. הדמיה של התאים והתאוששות שלהם לניתוח מולקולרית היא פשוטה. במאמר זה, אנו מגדירים לקרקע רך כמו אלה שיש moduli אלסטי (E) <3000 פסקל לקרקע נוקשה / רקמות אלה עם E> 20,000 פסקל.
Protocol
הכנה
- Coverslips צריך להיות autoclaved.
- מים מזוקקים או deionized ועיקור יש להשתמש כדי להכין פתרונות עבור coverslips כביסה.
- AC (40% w / v) bis-AC (1% w / v) פתרונות עיקור על ידי סינון 0.2 מיקרומטר. הכן persulfate אמוניום 10% (APS; מים 100μg/ml) זמן קצר לפני השימוש לסנן סטרילית. החלף את הפתרון APS חודשי.
- ריאגנטים כימיים כגון 3-APTMS, כלורופורם, glutaradehyde, NHS, ו SurfaSil שלא ניתן autoclaved נשמרים בקבוק מוקצה ורק לצורך הכנת הידרוג.
- לקבלת התוצאות הטובות ביותר, הידרוג צריך להיות מנוצל בתוך כמה ימים לאחר הדגרה למשך הלילה עם החלבון ECM המתאים.
- הכן פתרון SurfaSil 10% כלורופורם (10 מ"ל בדרך כלל מספיק עבור 20 coverslips למעלה) בתוך שפופרת 50 מ"ל פלקון פוליפרופילן לפני שוטף של הידרוג'ל. (המעבדה שלנו בדרך כלל siliconizes coverslips העליון במהלך הצעד 0.5% הדגירה glutaraldehyde). מוסיפים את coverslips אל הצינור פלקון ורוק דקות לפחות 10. למזוג את הפתרון SurfaSil ואוויר יבש coverslips על Kimwipes בממשלה בטיחות ביולוגית שבו הידרוג יהיה מוכן.
- הכן את הפתרון חום מומת BSA כדלקמן: 20 מ"ג / מ"ל פתרון של BSA שומן חומצה חופשית PBS היא מודגרות בתוך אמבט המים 68 מעלות צלזיוס למשך 30 דקות. אז הפתרון הוא סינון סטרילי מאוחסנים 4 ° C.
נוהל
- מניחים שכבה של Parafilm על החצי התחתון של צלחת פטרי 150 מ"מ.
- הנח עד 9 25 מ"מ coverslips על גבי Parafilm ו לכסות אותם עם 1 מ"ל 0.1 M NaOH. דגירה של 3 דקות ואז לשאוב עם קו ריק.
- עבודה במנדף כימי, במקום 0.5 מ"ל 3-APTMS על כל coverslip. דגירה של 3 דקות ואז לשאוב APTMS. אם אתה ממתין זמן רב מדי, קצף יהוו.
- שוטפים את coverslips פעם עם מים 20 מ"ל deionized בצלחת אחת. הסר את coverslips מצלחת באמצעות מלקחיים מעוקל ולהעביר אותם, עם טיפול בצד שלהם פונה כלפי מעלה, אל צלחת 150 מ"מ חדשה. שטפו את coverslips עם מים deionized שלוש פעמים, על כיסא הנדנדה, כל 10 דקות לשטוף. אם לא תצליח להסיר את כל APTMS, הוא יגיב עם glutaraldehyde בשלב הבא ולהשאיר משקע עכור לבן (איור 1).
- ההפשרה glutaraldehyde (~ 10 דקות לפני השימוש).
- בעזרת מלקחיים מעוקל, העברת coverslips לצלחת נקייה שכבתית עם Parafilm ואת לשאוב כל נוזל הנותרים. השתמש בקו ואקום או Kimwipe למחוק את המים הנותרים לפי הצורך.
- כיסוי כל coverslip לחלוטין עם 0.5 מ"ל של glutaraldehyde 0.5% במים deionized סטרילית דגירה למשך 30 דקות במנדף כימי. לשאוב glutaraldehyde. לשטוף לשטוף את coverslips כמו בשלב 4. יבש coverslips לחלוטין. [אתה יכול לעצור כאן ולהשאיר את coverslips למשך מספר שבועות באזור יבש].
- כאשר אתה מוכן להכין את הידרוג, להשתמש במלקחיים מעוקל להעביר את coverslips, למעלה בצד תגובתי, לגיליון של Parafilm כי כבר מודבק על פני השטח של הקבינט בטיחות ביולוגית. ודא כי coverslips הן שטוחות על פני השטח Parafilm.
- הכן פתרון רווי NHS ב טולואן. (להמיס כמות קטנה של NHS ב טולואן מספיק לצורך הניסוי בפרט. המשך להוסיף קצת NHS טיפין עד NHS כבר לא נמס. הפתרון רווי הוא בדרך כלל מעונן וורוד.)
- בשלב הבא, להכין את, acrylamide bis-acrylamide, מים APS להגיע אחוז acrylamide הרצוי. מוסיפים את ריאגנטים צינורות microcentrifuge הרשום להלן כדי בהיקף כולל של 0.8ml.
- ואז, אחד aliquot בכל פעם, מוסיפים את שירותי הבריאות ואת TEMED את פתרון ה-AC 0.8 מ"ל, מערבולת בקצרה מיד לשפוך 3-5 ג'לים באמצעות 140 μl לכל coverslip במנדף בטיחות ביולוגי. במידת האפשר, את כל הצעדים מנקודה זו צריכה להתבצע בתוך ארון בטיחות ביולוגית. [הערה: coverslips בגדלים שונים יכול להיות מנוצל על בסיס צורך. אם 18 מ"מ coverslips משמשים, השתמש ~ 33 μl פתרון לכל coverslip AC ו coverslip 18 מ"מ siliconized העליון.]
Bis-AC (%) 0.3 (נוקשה) 0.15 0.06 0.03 (רך) μl μl μl μl מים 402 522 594 618 AC 150 150 150 150 Bis-AC 240 120 48 24 APS 8 8 8 8 TEMED 1 1 1 1 NHS 228 228 228 228 - במהירות למקום coverslip siliconized 25 מ"מ על גבי ג'ל אחד לפני שהוא מתחיל לפלמר. הוספת coverslip העליון צריך לאפשר AC כדי מכסות לחלוטין את coverslip התחתונה. דגירה זה "כריך" בטמפרטורת החדר עד AC polymerizes. (בדוק את הפתרון שיורית AC בצינור microcentrifuge כדי לקבוע מתי אירעה פילמור. בדרך כלל מספר דקות ג'ל נוקשה קצת יותר עבור אלה רך יספיק.).
- בזהירות להרים את הכריך (כפפות סטריליות על!) והחלק את coverslip העליון עד הסככות ג'ל polymerized. לאחר מכן תוכל לחלץ אותו הג'ל. אם אתה ממתין זמן רב מדי לפני הסרת coverslip העליון, ג'ל יהיה לקרוע את coverslip מוסר.
- בטל coverslip העליון. מניחים את תחתית ג'ל coverslips (להלן שנקרא הידרוג'ל) לתוך 6-גם צלחות עם 2 מ"ל PBS / היטב. PBS ניתן להוסיף לפני או אחרי coverslip ג'ל אל היטב כל אחד. שטפו את הידרוג עם PBS שלוש פעמים, על כיסא נדנדה, 5 דקות לכל לשטוף.
- חזור על שלבים 11-14 עד המספר הנדרש של הידרוג הוכנו.
- כיסוי כל הידרוג'ל עם 2 מ"ל של פתרון פיברונקטין (3 מיקרוגרם / מ"ל PBS) או חלבון ECM אחרים (ראו קליין, et al. 13 לקבלת פרטים.). החלבון ECM הופך מחויב קוולנטית אל הידרוג במהלך הדגירה לילה בשעה 4 ° C.
- לשאוב את הפתרון ECM ו-NHS לחסום unreacted עם BSA 1mg/ml חומצת שומן חום מומת חופשי בסרום ללא מדיה דקות לפחות 30 ב 37 ° C בתוך תרבית תאים חממה. שוטפים את הידרוג פעם עם PBS סטרילי או תרבות בינוני התא.
- פלייט תאים המדיום המתאים תרבות המכילה FBS. מספר התאים שנזרעו על הידרוג צריך להיקבע על ידי המשתמש מבוסס על מידת התפשטות תאים confluency הנדרש לניסויים. כ -10 5 תאים בדרך כלל מספיק לניתוח המערבי סופג qPCR.
- לאחר תקופת הדגירה, חלבון התא או mRNA ניתן לחלץ. Coverslips מוסרים בזהירות מבארות בעזרת מלקחיים מעוקל והניח (תא בצד למטה) על גבי 100 טיפות של μl חיץ תמוגה אשר היו מפוזרות (2-3 ס"מ) לאורך גיליון Parafilm על הספסל המעבדה. (אנו משתמשים תקן חיץ SDS מדגם TRIzol, בהתאמה, כדי להכין את דגימות סופג המערבי לבודד רנ"א עבור qPCR). דגירה התאים עם למאגר תמוגה למשך דקה אחת בדיוק. הסר את coverslips ולהעביר את החיץ תמוגה לצינור microcentrifuge. לחילופין להפקת RNA בלבד, המשתמש יכול להעביר את כל הידרוג לצלחת 6-היטב חדשה ולהוסיף 1ml של TRIzol / היטב. דגירה במשך 3 דקות ולהסיר TRIzol פתרון לאחסון בתוך שפופרת microcentrifuge.
פרטים נוספים על נהלים כגון immunofluorescence, מכתים BrdU, transfection, וכו 'עבור תאים שנזרעו על הידרוג מתואר קליין et al. 2007 13.
נציג תוצאות
שטיפה יסודית של coverslips הבאה תוספת של APTMS היא צעד חשוב בהפקת "תגובתי" coverslips. אם אחד לא מצליח להסיר את APTMS לחלוטין, יגיב עם glutaraldehyde בשלב הבא וליצור משקע עכור לבן כפי שניתן לראות באיור 1 א. 1B איור מראה coverslip נשטף כראוי יבשים. אם המשקע מפתחת, ההליך כולו יש להפעיל מחדש מההתחלה כמו coverslip כבר אינו שמיש.
בעקבות היווצרות הידרוג ציפוי עם חלבונים ECM לילה, תאים יכולים להיות seeded למחרת. כמו איור 2 מראה, יש הבדל ניכר בין תא מתפשטת על הידרוג נוקשה לעומת הרכות. כפי שניתן לראות על ידי צביעה phalloidin ב fibroblasts העכבר עובריים (MEFs), התפשטות תאים במידה רבה יותר על נוקשות לעומת הידרוג רך. ואכן, רוב התאים הצמדת הידרוג רכה יישאר קומפקטי לצרף בצורה פחות יעילה.
אמנם רק מורפולוגיה MEF מוצג באיור 2, ההבדל בתא הפצת עקבי לאורך מספר שורות תאים אחרות שנבדקו 11-12,14.
סודות להצלחה
- לאחר הליך זה התחיל, חשוב מאוד לשמור על coverslips עם הצד "תגובתי" מעלה לזכור באיזה צד היה מצופה.
- יש ללבוש כפפות בכל עת במהלך ההליך כדי לספק סביבת עבודה כי הוא סטרילי ככל האפשר.
- רוב הצעדים הראשונים מבוצעים בין במנדף כימי קטר ועל הספסל מעבדה. כל הצעדים הבאים כדי להסיר glutaraldehyde עודף coverslips צריכה להתבצע תחת ארון בטיחות ביולוגית.
- בשל הבדלים בתא spreaדינג (איור 2), אנו ממליצים זריעת פעמיים את מספר התאים על הידרוג רך לעומת הידרוג נוקשה.
- תהליך פילמור AC הוא מהיר מאוד. עבור משתמשים בפעם הראשונה, אפשר להקטין את כמות APS או TEMED בפתרון להאריך את תהליך פילמור. אל תנסו להכין יותר coverslips כמה בבת אחת.
- במחזור התא שבו מחקרים הסינכרון G0 נדרש, אנחנו בדרך כלל בסרום-להרעיב תאים בצלחות פלסטיק תרבות, trypsinize את התאים ולזרוע אותם על הידרוג של התאמות שונות בנוכחות mitogens (FBS ו / או גורמי גדילה). הליך זה מבטיח כי אוכלוסיית המוצא של G0-מסונכרן תאים זהים כל הדגימות. עם זאת, מחקרים רבים התמרה האות, תקופת נדרש גירוי mitogen לא יכול להיות מספיק זמן כדי לאפשר התקשרות והפצת של תאים. במקרה זה, אנו בסרום-להרעיב את התאים הידרוג ולאחר מכן ישירות לגרות אותם עם mitogen.

איור 1 א. שטף כיאות coverslip. בעקבות תוספת של APTMS, coverslip נשטף במשך 1-2 דקות לפני תוספת של הפתרון glutaraldehyde. המשקע טפסים coverslip שלא נחפף על פי הצעדים המפורטים בנוהל.

איור 1B. נשטף כראוי coverslip. בנוסף הבאים APTMS, coverslip נשטף במשך שלוש פעמים 10 דקות כל אחד, לפני התוספת של הפתרון glutaraldehyde. המשקע לא טפסים coverslip.
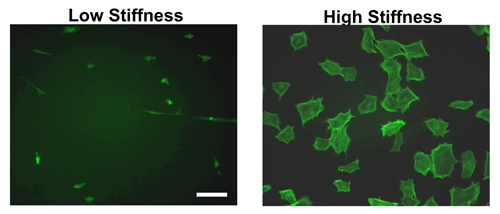
איור 2. מורפולוגיה של תאים על הידרוג של קשיחות שונות. נוסדה MEFs היו זורעים על פיברונקטין מצופה הידרוג של קשיחות גבוה או נמוך עבור 9 שעות. לאחר תקופת הדגירה, התאים היו קבועים, permeabilized ומוכתמים FITC-phalloidin אשר נקשר אקטין-F. MEFs על ג'לים קשיחות גבוהה התערוכה סיבי מתח מפוזרים היטב בהשוואה לאלו seeded על הידרוג קשיחות נמוכה. בר סולם = 50μm.
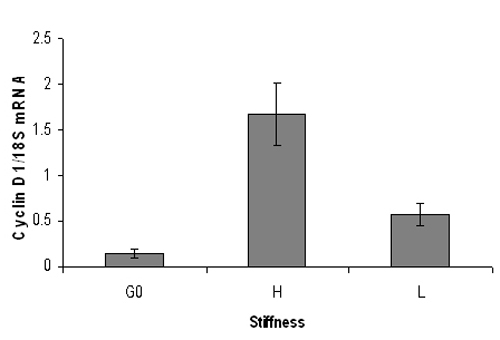
איור 3. נציג PCR כמותי תוצאה של cyclin D1 עכבר רמות ה-mRNA. סרום fibroblasts העכבר עובריים היו מורעבים מצופה על גבוה (3% acrylamide) או נמוך (0.3% acrylamide) הידרוג נוקשות מגורה עם FBS 10% עבור 9 שעות. לאחר מיצוי RNA, בזמן אמת, ניתוח כמותי PCR בוצע עבור cyclin D1 רמות mRNA (מנורמל ל 18S RNA). G0 cyclin D1 מייצג mRNA מתאי שקט. Cyclin D1 רמות ה-mRNA להגדיל באופן משמעותי על הידרוג נוקשה אך לא על הידרוג רך. הנתונים הם ממוצע + / - SD של שכפול PCR תגובות.
Discussion
מרכיב חיוני של תהליך פילמור הידרוג הוא להימנע היווצרות בועת אוויר אשר יאפשר תאים להיקשר coverslip הזכוכית ולא הידרוג ECM מצופה עצמו. זה ניתן למנוע על ידי בקפידה pipetting הפתרון פילמור לאחר vortexing ו חזותית ולוודא כי אין בועות אוויר הפכו לכוד בתוך הג'ל. אנחנו תמיד ממליצים על הכנ...
Disclosures
Acknowledgements
העבודה היא במעבדה שלנו נתמך על ידי מענקים מהמוסד הלאומי לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde, 70% | Sigma-Aldrich | G7776 | Store at -20°C |
| 3-APTMS (3-Aminopropyltrimethosysilane 97%) | Sigma-Aldrich | 281778 | Store at room temperature |
| SurfaSil Siliconizing Fluid | Thermo Fisher Scientific, Inc. | 42800 | Store at room temperature |
| NHS (N-hydroxysucinimide Ester) | Sigma-Aldrich | A-8060 | Store at 4°C Replace monthly |
| Albumin, bovine serum, essentially fatty acid free | Sigma-Aldrich | A6003-100G | Store at 4°C |
| Coverslips (25mm) | Fisher Scientific | 12-545-86 25 Cir 1D | |
| Coverslips (18mm) | Fisher Scientific | 12-545-84 18 Cir 1D |
References
- Beattie, D., Xu, C., Vito, R., Glagov, S., Whang, M. C. Mechanical analysis of heterogeneous, atherosclerotic human aorta. J Biomech Eng. 120, 602-607 (1998).
- Bernini, G. Arterial stiffness, intima-media thickness and carotid artery fibrosis in patients with primary aldosteronism. J Hypertens. 26, 2399-2405 (2008).
- Boonyasirinant, T. Aortic stiffness is increased in hypertrophic cardiomyopathy with myocardial fibrosis: novel insights in vascular function from magnetic resonance imaging. J Am Coll Cardiol. 54, 255-2562 (2009).
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Lee, R. T. Prediction of mechanical properties of human atherosclerotic tissue by high-frequency intravascular ultrasound imaging. An in vitro study. Arterioscler Thromb. 12, 1-5 (1992).
- Levental, K. R. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Paszek, M. J. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8, 241-254 (2005).
- Samani, A., Zubovits, J., Plewes, D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Phys Med Biol. 52, 1565-1576 (2007).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47, 1394-1400 (2008).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad Sci USA. 94, 13661-13665 (1997).
- Klein, E. A., Yung, Y., Castagnino, P., Kothapalli, D., Assoian, R. K. Cell adhesion, cellular tension, and cell cycle control. Methods Enzymol. 426, 155-175 (2007).
- Klein, E. A. Cell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Current Biology. 19, 1511-1518 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved