È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Studiare gli effetti di rigidità Matrix sulla funzione cellulare utilizzando acrilamide a base di idrogeli
In questo articolo
Riepilogo
L'effetto di rigidità substrati sulla funzione cellulare può essere modellato In vitro Utilizzando idrogel di poliacrilamide di varia conformità.
Abstract
Rigidità del tessuto è un importante determinante della funzione cellulare, e cambiamenti nella rigidità dei tessuti sono comunemente associati con fibrosi, cancro e malattie cardiovascolari 1-11. Approcci tradizionali cellule biologiche per studiare la funzione cellulare coinvolgono le cellule coltura su un substrato rigido (piatti di plastica o vetro coprioggetto) che non possono spiegare l'effetto di un ECM elastico o le variazioni di rigidezza ECM tra i tessuti. Per modellare condizioni in vivo nel rispetto dei tessuti in vitro, noi e altri usano ECM rivestite idrogel. Nel nostro laboratorio, l'idrogel si basano su poliacrilammide che possono mimare la gamma di conformità dei tessuti biologicamente visto 12. "Reattiva" coprioggetto sono generati da incubazione con NaOH seguita da aggiunta di 3-APTMS. Glutaraldeide è usato per cross-link del 3-APTMS e il gel di poliacrilammide. Una soluzione di acrilamide (AC), bis-acrilamide (Bis-AC) e persolfato di ammonio è usato per la polimerizzazione degli idrogel. N-hydroxysuccinimide (NHS) è incorporato nella soluzione CA per proteine crosslink ECM per l'idrogel. A seguito di polimerizzazione del idrogel, la superficie del gel è rivestita con una proteina ECM di scelta, come fibronectina, vitronectina, collagene, ecc
La rigidità di un idrogel può essere determinato da reologia o microscopia a forza atomica (AFM) e regolata variando la percentuale di AC e / o bis-CA nella soluzione di 12. In questo modo, la rigidità substrato può essere abbinata alla rigidità dei tessuti biologici che può anche essere quantificato mediante reologia o AFM. Le celle possono poi essere seminato in questi idrogel e colti sulla base delle condizioni sperimentali richieste. Imaging delle cellule e il loro recupero per l'analisi molecolare è semplice. Per questo articolo, si definisce substrati morbidi come quelli che hanno moduli elastici (E) <3000 Pascal e substrati rigidi / tessuti come quelli con E> 20.000 Pascal.
Protocollo
Preparazione
- Coprioggetto devono essere sterilizzati in autoclave.
- Acqua distillata o deionizzata deve essere utilizzato per preparare le soluzioni e per coprioggetto lavaggio.
- AC (40% w / v) e bis-CA (1% w / v) le soluzioni sono sterilizzate di 0,2 micron di filtrazione. Preparare persolfato di ammonio al 10% (APS; acqua 100μg/ml) poco prima dell'uso e filtro sterile. Sostituire la soluzione APS mensile.
- Reagenti chimici come 3-APTMS, cloroformio, glutaradehyde, NHS, e SurfaSil che non possono essere sterilizzati in autoclave sono conservati in una bottiglia assegnato utilizzati esclusivamente per la preparazione di idrogeli.
- Per ottenere risultati ottimali, gli idrogel deve essere utilizzato entro un paio di giorni dopo la notte di incubazione con la proteina appropriato ECM.
- Preparare una soluzione SurfaSil 10% in cloroformio (10 ml di solito è sufficiente per 20 lamelle in alto) in un tubo in polipropilene da 50 ml Falcon prima colata di idrogel. (Il nostro laboratorio siliconizes di solito i coprioggetti alto durante la fase di incubazione glutaraldeide 0,5%). Aggiungere i coprioggetti al tubo Falcon e rock per almeno 10 min. Decantare la soluzione SurfaSil e aria secca il coprioggetto sul Kimwipes nella cappa di sicurezza biologica dove l'idrogel sarà preparato.
- Preparare il calore inattivato soluzione BSA come segue: a 20 mg / ml soluzione di acidi grassi liberi BSA in PBS è incubato in un bagno d'acqua ° 68 C per 30 min. La soluzione è quindi sterile filtrato e conservato a 4 ° C.
Procedura
- Mettere uno strato di Parafilm nella metà inferiore di un 150 mm piastra di Petri.
- Posto fino a 9 da 25 mm coprioggetto sulla parte superiore del Parafilm e coprirli con 1 ml 0,1 M NaOH. Incubare per 3 minuti e poi aspirare con una linea a vuoto.
- Lavorare in una cappa chimica, posto 0,5 ml 3-APTMS su ogni vetrino. Incubare per 3 minuti e poi aspirare il APTMS. Se aspettate troppo a lungo, si formerà una schiuma.
- Sciacquare i coprioggetti una volta con 20 ml di acqua deionizzata nello stesso piatto. Togliere i coprioggetti dal piatto con pinze curve e trasferirle, con i loro trattati sul lato rivolto verso l'alto, ad un nuovo piatto da 150 mm. Lavare i coprioggetti con acqua deionizzata per tre volte, sul bilanciere, per 10 minuti ogni lavaggio. Se non si riesce a rimuovere tutti i APTMS, che reagirà con la glutaraldeide nel passaggio successivo e lasciare un precipitato bianco nuvoloso (Figura 1).
- Scongelare la glutaraldeide (~ 10 minuti prima dell'uso).
- Utilizzando pinze curve, trasferire i coprioggetti di un piatto pulito strati con Parafilm ed aspirare il liquido rimanente. Utilizzare una linea di vuoto o Kimwipe a cancellare l'acqua residua, se necessario.
- Coprire ogni copri completamente con 0,5 ml di glutaraldeide 0,5% in acqua deionizzata sterile e incubare per 30 minuti in una cappa chimica. Aspirare il glutaraldeide. Sciacquare e lavare i coprioggetti come al punto 4. Asciugare il coprioggetto completamente. [Si può fermare qui e lasciare il coprioggetto per diverse settimane in un luogo asciutto].
- Quando si è pronti per preparare il idrogel, utilizzare pinze curve per trasferire i coprioggetti, fino lato reattivo, ad un foglio di Parafilm che è stato registrato sulla superficie della cappa di sicurezza biologica. Assicurarsi che il coprioggetto sono piatte sulla superficie Parafilm.
- Preparare una soluzione satura NHS in toluene. (Sciogliere una piccola quantità di NHS in toluene sufficiente per l'esperimento particolare. Continuare ad aggiungere po 'NHS a poco fino a quando il SSN non si scioglie. La soluzione satura di solito è nuvoloso e rosa.)
- Quindi, preparare l', acrilamide bis-acrilamide, acqua e APS per raggiungere la percentuale di acrilammide desiderato. Aggiungere i reagenti in provette da microcentrifuga come indicato di seguito per un volume totale di 0.8ml.
- Poi, un aliquota alla volta, aggiungere il SSN e TEMED alla soluzione di 0,8 ml AC, vortice brevemente e versare IMMEDIATAMENTE 3-5 gel con 140 microlitri per coprioggetto all'interno della cappa di sicurezza biologica. Per quanto possibile, tutti i passi da questo punto deve essere eseguita in una cappa di sicurezza biologica. [Nota: lamelle di diverse dimensioni possono essere utilizzati basato sul bisogno. Se da 18 mm coprioggetto sono utilizzati, utilizzare ~ 33 ul di soluzione CA per coprioggetto e una da 18 mm coprioggetto top siliconata.]
Bis-AC (%) 0,3 (rigido) 0,15 0,06 0,03 (soft) microlitri microlitri microlitri microlitri Acqua 402 522 594 618 AC 150 150 150 150 Bis-AC 240 120 48 24 APS 8 8 8 8 TEMED 1 1 1 1 SSN 228 228 228 228 - Rapidamente il luogo siliconato da 25 mm coprioggetto sopra l'gel prima che inizi a polimerizzare. Aggiunta del coprioggetto superiore dovrebbe consentire l'AC per coprire completamente il fondo coprioggetto. Incubare questo "sandwich" a temperatura ambiente fino a quando il CA polimerizza. (Controllare la soluzione residua AC nella provetta per determinare quando la polimerizzazione si è verificato. Solito pochi minuti per i gel rigidi e un po 'più morbido per i più sarà sufficiente.).
- Cura ritirare il panino (guanti sterili su!) E sfilare il coprioggetto in alto fino a che sovrasta il gel polimerizzato. È quindi possibile staccare il gel. Se si attende troppo a lungo prima di togliere il copri superiore, il gel si strappare il vetrino è stato rimosso.
- Eliminare il coprioggetto in alto. Posizionare la parte inferiore del gel-coprioggetto (di seguito chiamato idrogel) in 6 pozzetti con 2 ml di PBS / bene. PBS può essere aggiunto prima o dopo il gel-coprioggetto in ciascun pozzetto. Lavare la idrogel con PBS per tre volte, su una sedia a dondolo, a 5 minuti a lavaggio.
- Ripetere i passaggi fino a 11-14 il numero richiesto di idrogel sono stati preparati.
- Coprire ogni idrogel con 2 ml di una soluzione di fibronectina (3 mg / ml in PBS) o proteine ECM altri (si veda Klein et al. 13 per maggiori dettagli.). La proteina ECM diventa un legame covalente con l'idrogel durante l'incubazione overnight a 4 ° C.
- Aspirare la soluzione di ECM e il blocco del NHS non ha reagito con 1mg/ml inattivato al calore di acidi grassi liberi nel siero BSA-multimediale gratuito per almeno 30 minuti a 37 ° C in un incubatore coltura cellulare. Sciacquare il idrogel una volta con PBS sterile o terreno di coltura cellulare.
- Cellule piatto nel mezzo di coltura contenente FBS appropriato. Il numero di cellule seminate sul idrogel deve essere determinato dall'utente in base al grado di diffusione delle cellule e di confluenza richiesto per la sperimentazione. Circa 10 5 cellule di solito è sufficiente per l'analisi western blotting e qPCR.
- Dopo il periodo di incubazione, la proteina cellulare o mRNA può essere estratto. I coprioggetti sono accuratamente rimosse dai pozzi con pinze curve e posto (cella rivolto verso il basso) sulla parte superiore di 100 gocce l di tampone di lisi che sono state intervallate (2-3cm) lungo un foglio di Parafilm sul banco di laboratorio. (Noi uso standard tampone campione SDS e TRIzol, rispettivamente, per preparare i campioni per blotting occidentale e per isolare l'RNA per qPCR.) Incubare le cellule con il tampone di lisi per esattamente un minuto. Togliere i coprioggetti e trasferire il tampone di lisi di una provetta. In alternativa per l'estrazione di RNA solo, l'utente può trasferire ogni idrogel ad un nuovo cambio a 6 pozzetti e aggiungere 1 ml di TRIzol / bene. Incubare per 3 minuti e rimuovere TRIzol soluzione per lo stoccaggio in una provetta.
Ulteriori informazioni sulle procedure quali immunofluorescenza, colorazione BrdU, trasfezione, ecc per le cellule seminate su idrogel è descritto in Klein et al. 2007 13.
Rappresentante Risultati
Lavaggio accurato delle coprioggetto seguenti aggiunta di APTMS è un passo importante nella produzione di "reattivo" coprioggetto. Se uno non riesce a rimuovere il APTMS completamente, reagirà con la glutaraldeide nel passaggio seguente e produrre un precipitato bianco torbido come si vede nella Figura 1A. Figura 1B mostra un coprioggetto adeguatamente lavati e asciugati. Se il precipitato, l'intera procedura deve essere riavviato dal principio come il vetrino non è più utilizzabile.
Dopo la formazione del idrogel e rivestimento con proteine ECM durante la notte, le cellule possono essere seminati il giorno successivo. Come mostra la Figura 2 mostra, vi è una netta differenza tra la diffusione delle cellule in idrogel rigido rispetto morbido. Come si può notare dalla colorazione falloidina nei fibroblasti embrionali di topo (MEF), le cellule diffuse in misura maggiore sul rigido rispetto a idrogel morbido. Infatti, la maggior parte delle cellule di legarsi a un idrogel morbido rimarrà compatto e collegare in modo meno efficiente.
Anche se solo morfologia MEF è illustrato nella figura 2, la differenza nella cella diffusione è coerente tra diverse altre linee cellulari testate 11-12,14.
I segreti del successo
- Una volta che la procedura viene avviata, è molto importante mantenere i coprioggetti con il lato "reattiva" e di tenere presente che parte è stato rivestito.
- I guanti dovrebbero essere indossati in ogni momento durante la procedura di fornire un ambiente di lavoro che sia il più sterile possibile.
- La maggior parte dei passi iniziali vengono eseguiti tra una cappa e il banco di laboratorio. Tutte le fasi successive alla rimozione glutaraldeide in eccesso dal coprioggetto devono essere eseguiti sotto una cappa di sicurezza biologica.
- A causa delle differenze nella cella Spreading (Figura 2), si consiglia di seminare il doppio del numero di celle idrogel morbido rispetto a idrogel rigida.
- Il processo di polimerizzazione AC è estremamente veloce. Per gli utenti prima volta, si può diminuire la quantità di APS o TEMED nella soluzione di prolungare il processo di polimerizzazione. Non cercare di preparare più di un paio di lamelle in una sola volta.
- Negli studi del ciclo cellulare in cui è richiesta la sincronizzazione in G0, di solito siero affamare le cellule in coltura di plastica, le celle e trypsinize reseed li idrogel di adempimenti diversi in presenza di mitogeni (FBS e / o fattori di crescita). Questa procedura garantisce che la popolazione di partenza di G0-sincronizzata delle cellule è identico in tutti i campioni. Tuttavia, per molti studi di trasduzione del segnale, il necessario periodo di stimolo mitogeno potrebbe non essere sufficientemente lungo per consentire l'attaccamento e la diffusione delle cellule. In questo caso, siero-affamare le cellule del idrogel e poi direttamente stimolarli con mitogeno.

Figura 1A. Impropriamente lavato coprioggetto. Dopo aggiunta di APTMS, coprioggetto è stato lavato per 1-2 minuti prima aggiunta della soluzione di glutaraldeide. Un precipitato si forma sul vetrino che non sia stata lavata secondo la procedura descritta in Procedura.

Figura 1B. Adeguatamente lavati coprioggetto. Aggiunta seguito di APTMS, coprioggetto è stato lavato per tre volte 10 minuti ciascuno, prima della soluzione di glutaraldeide. Non precipitare forma sul vetrino.
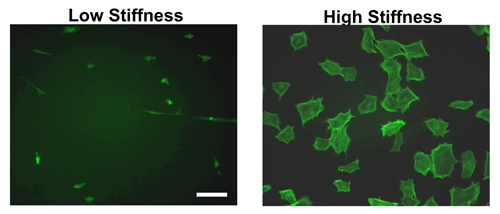
Figura 2. Morfologia delle cellule in idrogel di diversa rigidità. Fondata MEF sono state seminate su fibronectina rivestite di idrogel rigidità alto o basso per 9 ore. Dopo il periodo di incubazione, le cellule sono state fissate, permeabilizzate e colorati con FITC falloidina che si lega alla f-actina. MEF su gel di elevata rigidità mostra fibre stress e sono ben distribuiti rispetto a quelle seminate in idrogel bassa rigidità. Barra di scala = 50 micron.
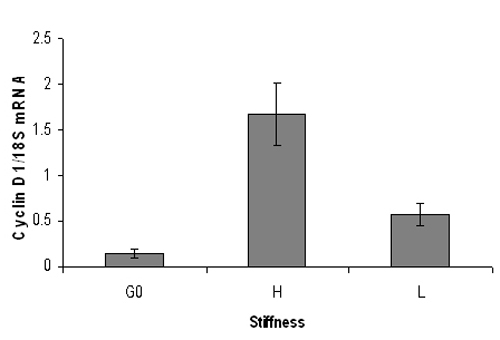
Figura 3. Rappresentante risultato PCR quantitativa del mouse livelli di mRNA della ciclina D1. Siero fibroblasti di topo affamato embrionali sono stati placcati su alta (3% di acrilammide) o bassa (0,3% di acrilammide) idrogeli rigidità e stimolati con 10% FBS per 9 ore. Dopo l'estrazione di RNA, analisi real-time PCR quantitativa è stata effettuata per livelli di mRNA della ciclina D1 (normalizzato a 18S RNA). G0 rappresenta ciclina D1 mRNA da cellule quiescenti. Ciclina D1 aumentare significativamente i livelli di mRNA in idrogel rigido ma non su idrogel morbido. I dati sono media + / - SD di duplicare reazioni di PCR.
Discussione
Un elemento cruciale del processo di polimerizzazione idrogel è quello di evitare la formazione di bolle d'aria che consentono alle cellule di legarsi al coprioggetto di vetro piuttosto che l'ECM rivestite stesso idrogel. Ciò può essere evitato con cura di pipettaggio la soluzione di polimerizzazione dopo vortex e visivamente fare in modo che bolle d'aria sono intrappolati nel gel. Noi consigliamo sempre la preparazione aggiuntiva "a caldo" coprioggetto e idrogeli per assicurare avere abbastanza...
Divulgazioni
Riconoscimenti
Il lavoro è il nostro laboratorio è supportato anche da finanziamenti del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde, 70% | Sigma-Aldrich | G7776 | Store at -20°C |
| 3-APTMS (3-Aminopropyltrimethosysilane 97%) | Sigma-Aldrich | 281778 | Store at room temperature |
| SurfaSil Siliconizing Fluid | Thermo Fisher Scientific, Inc. | 42800 | Store at room temperature |
| NHS (N-hydroxysucinimide Ester) | Sigma-Aldrich | A-8060 | Store at 4°C Replace monthly |
| Albumin, bovine serum, essentially fatty acid free | Sigma-Aldrich | A6003-100G | Store at 4°C |
| Coverslips (25mm) | Fisher Scientific | 12-545-86 25 Cir 1D | |
| Coverslips (18mm) | Fisher Scientific | 12-545-84 18 Cir 1D |
Riferimenti
- Beattie, D., Xu, C., Vito, R., Glagov, S., Whang, M. C. Mechanical analysis of heterogeneous, atherosclerotic human aorta. J Biomech Eng. 120, 602-607 (1998).
- Bernini, G. Arterial stiffness, intima-media thickness and carotid artery fibrosis in patients with primary aldosteronism. J Hypertens. 26, 2399-2405 (2008).
- Boonyasirinant, T. Aortic stiffness is increased in hypertrophic cardiomyopathy with myocardial fibrosis: novel insights in vascular function from magnetic resonance imaging. J Am Coll Cardiol. 54, 255-2562 (2009).
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Lee, R. T. Prediction of mechanical properties of human atherosclerotic tissue by high-frequency intravascular ultrasound imaging. An in vitro study. Arterioscler Thromb. 12, 1-5 (1992).
- Levental, K. R. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Paszek, M. J. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8, 241-254 (2005).
- Samani, A., Zubovits, J., Plewes, D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Phys Med Biol. 52, 1565-1576 (2007).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47, 1394-1400 (2008).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad Sci USA. 94, 13661-13665 (1997).
- Klein, E. A., Yung, Y., Castagnino, P., Kothapalli, D., Assoian, R. K. Cell adhesion, cellular tension, and cell cycle control. Methods Enzymol. 426, 155-175 (2007).
- Klein, E. A. Cell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Current Biology. 19, 1511-1518 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon