このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アクリルアミド系ハイドロゲルを用いた細胞機能のマトリックスの剛性の影響を研究
要約
細胞機能上の基層の剛性の影響をモデル化することができます in vitroで様々なコンプライアンスはのポリアクリルアミドハイドロゲルを使用。
要約
組織の剛性は、細胞機能の重要な決定因子であり、組織の硬さの変化は、一般的に線維症、癌、心血管疾患1月11日に関連付けられています。細胞機能を研究するために、従来の細胞生物学的なアプローチは、弾性ECMや組織間のECMの剛性の変動の影響を考慮することはできません堅い基層上の培養細胞を(プラスチック製の皿やガラスのカバースリップ)を伴います。 in vitroでの生体組織のコンプライアンスの条件でモデルに、我々と他のECMコーティングされたハイドロゲルを使用してください。当研究室では、ヒドロゲルは生物学的に12見た組織のコンプライアンスはの範囲を模倣することができるポリアクリルアミドに基づいています。 "リアクティブ"カバースリップは3 APTMSを加えて水酸化ナトリウムとのインキュベーションによって生成されます。グルタルアルデヒドは、3 APTMSとポリアクリルアミドゲルを架橋するために使用されます。アクリルアミド(AC)、ビスアクリルアミド(ビス- AC)および過硫酸アンモニウムの溶液をハイドロゲルの重合に使用されます。 N -ヒドロキシスクシンイミド(NHS)は、ハイドロゲルに架橋ECMタンパク質にACのソリューションに組み込まれています。ハイドロゲルの重合に続いて、ゲルの表面は、フィブロネクチン、ビトロネクチン、コラーゲンなどの選択肢のECM蛋白質で被覆されている
ハイドロゲルの剛性は、レオロジーや原子間力顕微鏡(AFM)によって決定され、溶液12にACおよび/ またはビス- ACの割合を変えることによって調整することができます。このように、基層の剛性は、レオロジーやAFMを用いて定量することができる生体組織の硬さに一致させることができます。次いで、細胞をこれらのヒドロゲルに播種し、必要な実験条件に基づいて培養することができる。分子解析のための細胞とその回復のイメージングは簡単です。この記事では、我々は20,000パスカル<3000パスカルと硬い基層/組織Eを持つものとして>弾性率(E)を有するものとして、ソフト基層を定義します。
プロトコル
準備
- カバースリップはオートクレーブする必要があります。
- 滅菌蒸留水または脱イオン水は、溶液を調製し、洗浄のカバースリップのために使用する必要があります。
- AC(40%w / v)とビス- AC(1%w / v)のソリューションは、0.2μmのろ過滅菌されています。使用直前および滅菌フィルターの前に、10%過硫酸アンモニウム(100μg/ml水APS)を準備する。毎月のAPSソリューションを交換してください。
- オートクレーブできないような3 - APTMS、クロロホルム、glutaradehyde、NHS、およびSurfaSilなどの化学試薬は、ヒドロゲルの調製のためにのみ使用される割り当てられた瓶に保管されています。
- 最良の結果を得るには、ハイドロゲルは、適切なECM蛋白質との一晩のインキュベーションの後数日以内に利用されるべきである。
- ハイドロゲルの注ぐ前に50ミリリットルポリプロピレンファルコンチューブにクロロホルム(10mlは通常十分なトップ20カバースリップ用です)の10%SurfaSilの溶液を調製します。 (私たちの研究室は、通常0.5%のグルタルアルデヒドのインキュベーションステップの間にトップカバースリップをsiliconizes)。少なくとも10分間ファルコンチューブやロックにカバースリップを追加。 SurfaSilソリューションをデカントし、空気は、ヒドロゲルが準備される生物学的安全キャビネットのキムワイプでカバーグラスを乾燥させる。
- 次のように熱不活化BSA溶液を調製します:PBSの脂肪酸フリーBSAの20 mg / mlの溶液を30分間68℃水浴中でインキュベートされる。次いで、この溶液を滅菌濾過し、4℃で保存されています
手順
- 150 mmのペトリ皿の下半分にパラフィルムの層を配置。
- パラフィルムの上に9 25 mmのカバースリップするまで置き、1 mlの0.1 M NaOHでそれらをカバー。 3分間インキュベートし、次いで真空ラインと吸引。
- 各カバースリップ上の場所0.5ミリリットルの3 APTMS、化学フードでの作業。 3分間インキュベートし、APTMSを吸引除去する。ここで時間をおきすぎている場合、泡が形成されます。
- 同じ皿で20 mLの脱イオン水で一度カバーグラスを洗浄します。曲がったピンセットを使って皿からカバーガラスを取り外し、それらの処理側が新たな150 mmディッシュに、上向きにし、それらを転送する。 10分ごとに洗浄するため、ロッカーに、脱イオン水で3回カバーグラスを洗ってください。あなたがすべてAPTMSを削除できなかった場合、それは次のステップでグルタルアルデヒドと反応し、白色の濁った沈殿物(図1)のままになります。
- グルタルアルデヒド(ご使用の前〜10分)を解凍。
- 湾曲鉗子を使用して、パラフィルムで積層しクリーンな皿にカバースリップを転送し、残りの液体を吸引除去する。必要に応じて残りの水をブロットに真空ラインまたはキムワイプを使用してください。
- 滅菌脱イオン水で0.5%グルタルアルデヒド0.5mlを完全にそれぞれのカバーをカバーし、化学フード中で30分間インキュベートする。グルタルアルデヒドを吸引除去する。リンスと手順4のようにカバーグラスを洗う。完全にカバーグラスを乾燥させます。[あなたが乾燥した地域でここに停止し、数週間のためにカバースリップを残すことができます]。
- あなたがハイドロゲルを準備する準備ができたら、生物学的安全キャビネットの表面にテープで留められているパラフィルムのシートに、カバーガラス、反応性側を転送するために湾曲したピンセットを使用してください。カバーガラスは、パラフィルムの表面に平らになっていることを確認します。
- トルエンの飽和NHS溶液を準備します。 (特定の実験のための十分なトルエンでNHSの少量を溶かす。NHSはもはや溶解しなくなるまでビットによってNHSのビットを追加していきます。飽和溶液は、通常、曇りとピンクです。)
- 次に、目的のアクリルアミドの割合に到達するアクリルアミド、ビスアクリルアミド、水とAPSを準備。 0.8ミリリットルの合計体積ため、以下に示すようにマイクロチューブ内の試薬を加える。
- その後、一度に分注し、NHSを追加し、0.8ミリリットルのACソリューションにTEMED、渦は簡単に、すぐに生物学的安全性のフードでカバースリップあたり140μlを使用して3から5のゲルを注ぐ。可能な限り、この点からすべてのステップは、生物学的安全キャビネット内で実行する必要があります。 [注:異なるサイズのカバースリップは必要性に基づいて利用することができます。直径18mmのカバースリップが使用されている場合は、〜33カバースリップ当りμlのACのソリューションと18 mmのトップシリコーンカバースリップを使用してください。]
ビス- AC(%) 0.3(硬い) 0.15 0.06 0.03(ソフト) μL μL μL μL 水 402 522 594 618 AC 150 150 150 150 ビス- AC 240 120 48 24 APS 8 8 8 8 TEMED 1 1 1 1 NHS 228 228 228 228 - それが重合を開始する前に迅速に各ゲルの上にシリコーン処理25 mmのカバースリップを配置。トップカバーの加算は、ACが完全に底カバースリップをカバーできるようにする必要があります。 ACが重合するまで室温でこの"サンドイッチ"をインキュベートする。 (重合がいつ発生したかを確認するためにマイクロ遠心チューブ中の残留ACのソリューションを確認してください。柔らかいもののための硬いゲルと少し長めのため通常数分で十分です。)。
- 慎重にサンドイッチを拾う(滅菌手袋で!)、それがオーバーハング重合ゲルをするまで、上部カバーを外します。その後、ゲルを離れてそれを取り外すことができます。あなたがトップカバーを取り外す前に、あまりにも長く待つ場合、カバースリップが削除される場合は、ゲルがリッピングされます。
- トップカバーを捨てる。ウェル2 mlのPBS / 6ウェルプレートに底ゲルカバースリップを(以下、ハイドロゲルと呼ばれる)に置きます。 PBSを各ウェルにゲルカバースリップの前または後に添加することができます。ロッカー、洗濯ごとに5分で、PBSで3回ヒドロゲルを洗ってください。
- ヒドロゲルの必要数が準備されるまで繰り返します11-14繰り返します。
- フィブロネクチン溶液(PBS中の3μg/ mlの)または他のECMタンパク質(Kleinらを参照してください。詳細については13。)2mlで各ハイドロゲルをカバー。 ECMタンパク質が共有結合し、4℃で一晩インキュベーション中にハイドロゲルにバインドするには
- 37℃最低℃で30分間インキュベーター内でCのための無血清培地に1mg/mlの熱不活性化脂肪酸フリーBSAでNHSを未反応のECMソリューションとブロックを吸引除去する。滅菌PBSまたは細胞培養培地で1回ヒドロゲルをすすぎます。
- FBSを含む適切な培養培地で細胞をプレート。ハイドロゲル上に播種する細胞の数は、実験に必要な拡散細胞とコンフルエントの度合いに基づいて、ユーザによって決定されるべきである。約10 5細胞は通常、ウェスタンブロットおよび定量PCR分析のために十分です。
- インキュベーション期間後、細胞のタンパク質またはmRNAを抽出することができます。カバースリップを慎重に曲がったピンセットを使用してウェルから除去し、実験台上にパラフィルムのシートに沿って(2〜3センチメートル)間隔をあけられているの溶解緩衝液100μlの液滴の上に(下にセル側)に配置されます。 (私たちは、ウェスタンブロッティングや定量PCR用RNAを分離するためのサンプルを準備するために、それぞれ、標準のSDSサンプルバッファーとTRIZOLを使用する。)正確に1分間溶解バッファーで細胞をインキュベートする。カバースリップを削除し、マイクロ遠心チューブに溶解用緩衝液を移す。また唯一のRNA抽出のために、ユーザーは新しい6ウェルプレートに各ハイドロゲルを転送し、TRIZOL /ウェルの1mlを追加することができます。 3分間インキュベートし、マイクロ遠心チューブに保存するためにトリゾールソリューションを削除する。
このような免疫蛍光、BrdU染色などの手順に関する追加情報は、ハイドロゲル上に播種細胞用トランスフェクション、等はKleinらに記載されています。 2007 13。
代表的な結果
APTMSの添加後、カバースリップの十分な洗浄は、"反応"カバーグラスを製造するのに重要なステップです。いずれかの完全にAPTMSを削除するには失敗した場合は、次の手順でグルタルアルデヒドと反応して、図1Aに示すように白い曇りの沈殿物が生成されます。図1Bは、適切に洗浄し、乾燥カバースリップを示しています。沈殿物が生じた場合はカバースリップは、使用できなくなったとして、全体の手順は、最初から再起動する必要があります。
ECMタンパク質とのハイドロゲルの形成とコーティングした後、一晩かけて、細胞は翌日播種することができます。図2に示すように、硬い対柔らかいヒドロゲルに拡散セルの間に明確な違いがあります。マウス胚性繊維芽細胞(MEF)のファロイジン染色で見られるようにソフトなハイドロゲルと比較して、細胞が硬い上に大きい程度に広がった。確かに、ソフトなハイドロゲルに取り付ける部分の細胞は、コンパクトなままとなり、少ない効率的に添付してください。
唯一のMEFの形態を図2に示されているが、拡散セル内の差は11-12,14をテストしたいくつかの他の細胞株に共通したものです。
成功の秘訣
- 手続きが開始されると、それは"反応性"側にカバースリップを維持し、コーティングされている側の心に留めておくことは非常に重要です。
- 手袋はできるだけ無菌である作業環境を提供するために、手順の間にすべての時に着用してください。
- 最初の手順のほとんどは、化学煙フード、実験室間で実行されます。カバーガラスから余分なグルタルアルデヒドを除去する以後のすべてのステップは、生物学的安全キャビネットの下で実行する必要があります。
- セルspreaの違いによる鼎(図2)、我々は硬いハイドロゲルと比較して柔らかいハイドロゲル上の細胞数の2倍のシードをお勧めします。
- ACの重合プロセスは非常に速いです。初めてご利用の場合、一つはAPSの量を減らすことができますまたは重合プロセスを延長するソリューションにTEMED。一度に少数のカバースリップ以上を準備しようとしないでください。
- G0での同期が必要とされる細胞周期の研究において、我々は通常血清飢餓細胞をプラスチック製の培養皿に、細胞をトリプシン処理し、マイトジェン(FBSおよび/または増殖因子)の存在下でさまざまなコンプライアンスはのヒドロゲルにそれらを再シード。この手順では、G0 -同期細胞の出発個体群はすべての試料において同一であることを保証します。しかし、多くのシグナル伝達の研究のために、必要なマイトジェン刺激期間は、細胞の付着と拡散を可能にするために十分な長さではありません。このケースでは、ヒドロゲルの細胞を血清飢餓とし、直接マイトジェンでそれらを刺激する。

図1A。不適切にカバースリップを洗浄した。APTMSを添加した後、カバースリップは、グルタルアルデヒド溶液の添加の前に1〜2分間洗浄した。沈殿物は、手順で説明した手順に従って洗浄されていないカバースリップ上に形成される。

図1B。適切にカバースリップを洗浄した。APTMSを添加した後、カバースリップは10分ごとにグルタルアルデヒド溶液の添加前に3回洗浄した。いいえ沈殿物はカバースリップに形成しない。
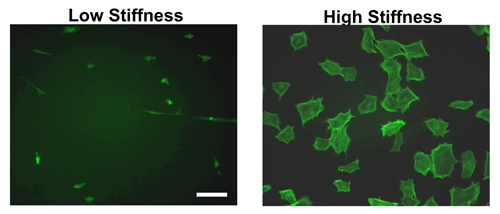
図2。剛性の異なるハイドロゲル上での細胞の形態。MEFSを設立は9時間のための高または低剛性のフィブロネクチンでコーティングされたハイドロゲル上に播種した。インキュベーション期間後、細胞は、固定透過性およびF -アクチンに結合するFITC -ファロイジンで染色した。高剛性ゲル上でMEFは、低剛性のハイドロゲル上に播種に比べてストレスファイバーを展示し、よく分散されています。スケールバー=50μmの。
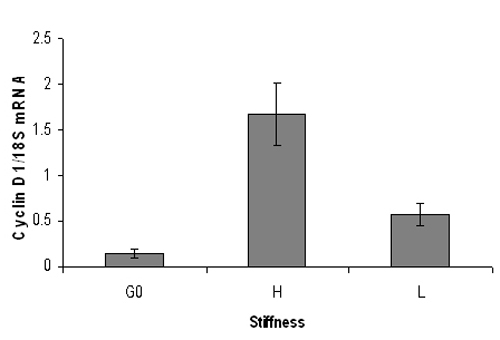
図3。マウスのサイクリンD1のmRNAレベルの代表的な定量的PCRの結果。血清飢餓マウス胚線維芽細胞は、(0.3%アクリルアミド)高い(3%アクリルアミド)や低剛性のハイドロゲル上に播種し、9時間を10%FBSで刺激した。 RNAの抽出に続いて、リアルタイム定量PCR解析は、サイクリンD1のmRNAレベル(18S RNAに正規化)を行った。 G0は静止細胞からサイクリンD1 mRNAを表します。サイクリンD1のmRNAレベルは有意に硬いヒドロゲル上ではなく、柔らかいヒドロゲルに増加する。 SD重複PCR反応の - データは、+ /を意味している。
ディスカッション
ハイドロゲルの重合プロセスの重要な要素は、細胞がガラスのカバースリップではなく、ECMコーティングされたハイドロゲル自体にバインドできるようにする気泡の形成を避けるためです。これは、慎重にボルテックスし、視覚的に気泡がゲル中に閉じ込められたとなっていないことを確認した後、重合溶液をピペッティングすることによって防ぐことができます。私たちは、常に実験のた?...
開示事項
謝辞
仕事は、私たちの研究室は、国立衛生研究所からの助成金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde, 70% | Sigma-Aldrich | G7776 | Store at -20°C |
| 3-APTMS (3-Aminopropyltrimethosysilane 97%) | Sigma-Aldrich | 281778 | Store at room temperature |
| SurfaSil Siliconizing Fluid | Thermo Fisher Scientific, Inc. | 42800 | Store at room temperature |
| NHS (N-hydroxysucinimide Ester) | Sigma-Aldrich | A-8060 | Store at 4°C Replace monthly |
| Albumin, bovine serum, essentially fatty acid free | Sigma-Aldrich | A6003-100G | Store at 4°C |
| Coverslips (25mm) | Fisher Scientific | 12-545-86 25 Cir 1D | |
| Coverslips (18mm) | Fisher Scientific | 12-545-84 18 Cir 1D |
参考文献
- Beattie, D., Xu, C., Vito, R., Glagov, S., Whang, M. C. Mechanical analysis of heterogeneous, atherosclerotic human aorta. J Biomech Eng. 120, 602-607 (1998).
- Bernini, G. Arterial stiffness, intima-media thickness and carotid artery fibrosis in patients with primary aldosteronism. J Hypertens. 26, 2399-2405 (2008).
- Boonyasirinant, T. Aortic stiffness is increased in hypertrophic cardiomyopathy with myocardial fibrosis: novel insights in vascular function from magnetic resonance imaging. J Am Coll Cardiol. 54, 255-2562 (2009).
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Lee, R. T. Prediction of mechanical properties of human atherosclerotic tissue by high-frequency intravascular ultrasound imaging. An in vitro study. Arterioscler Thromb. 12, 1-5 (1992).
- Levental, K. R. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Paszek, M. J. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8, 241-254 (2005).
- Samani, A., Zubovits, J., Plewes, D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Phys Med Biol. 52, 1565-1576 (2007).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47, 1394-1400 (2008).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad Sci USA. 94, 13661-13665 (1997).
- Klein, E. A., Yung, Y., Castagnino, P., Kothapalli, D., Assoian, R. K. Cell adhesion, cellular tension, and cell cycle control. Methods Enzymol. 426, 155-175 (2007).
- Klein, E. A. Cell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Current Biology. 19, 1511-1518 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved