Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersuchung der Auswirkungen von Matrix Stiffness auf Cellular-Funktion mit Acrylamid-basierte Hydrogele
In diesem Artikel
Zusammenfassung
Die Wirkung von Substraten Steifigkeit auf die zelluläre Funktion modelliert werden kann In-vitro- Verwendung von Polyacrylamid-Hydrogele unterschiedlicher nachzubessern.
Zusammenfassung
Tissue Steifigkeit ist eine wichtige Determinante für zelluläre Funktion und Veränderungen im Gewebe Steifigkeit sind häufig mit Fibrose, Krebs und Herz-Kreislauf-Erkrankung 1-11 verbunden. Traditionelle zellbiologische Ansätze zum Studium zellulärer Funktionen werden Zellkulturen auf einem starren Substrat (Plastikschalen oder Deckgläschen), die nicht für die Wirkung eines elastischen ECM oder die Variationen in ECM Steifigkeit zwischen Geweben erklären kann. Zur Modellierung in vivo Tissue Compliance-Bedingungen in vitro, verwenden wir und andere ECM-beschichteten Hydrogele. In unserem Labor werden die Hydrogele auf Polyacrylamid, die den Bereich des Tissue Verstöße gesehen biologisch 12 nachahmen kann basieren. "Reaktive" Deckgläser werden durch Inkubation mit NaOH durch Zugabe von 3-APTMS gefolgt generiert. Glutaraldehyd wird verwendet, um Vernetzung der 3-APTMS und das Polyacrylamidgel. Eine Lösung von Acrylamid (AC), Bis-Acrylamid (Bis-AC) und Ammoniumpersulfat ist für die Polymerisation des Hydrogels verwendet. N-Hydroxysuccinimid (NHS) in den AC-Lösung zur Vernetzung von ECM-Protein auf das Hydrogel eingebaut. Nach der Polymerisation des Hydrogels wird das Gel Oberfläche mit einer ECM-Protein der Wahl, wie Fibronektin, Vitronektin, Kollagen, etc. beschichtet
Die Steifigkeit eines Hydrogels kann durch Rheologie oder Rasterkraftmikroskopie (AFM) bestimmt und angepasst werden durch Variation der Anteil der AC-und / oder Bis-AC in der Lösung 12. Auf diese Weise können Substrat Steifigkeit, um die Steifigkeit von biologischen Geweben, die auch quantifiziert werden mit Hilfe der Rheologie oder AFM abgestimmt werden. Die Zellen können dann auf dieser Hydrogele und kultiviert auf die experimentellen Voraussetzungen basiert ausgesät werden. Imaging der Zellen und ihre Genesung für die molekulare Analyse ist einfach. Für diesen Artikel definieren wir weichen Substraten, wie solche mit Elastizitätsmoduln (E) <3000 Pascal und steife Substrate / Gewebe wie die mit E> 20.000 Pascal.
Protokoll
Vorbereitung
- Deckgläser sollten autoklaviert werden.
- Sterile Zugabe von destilliertem Wasser sollte verwendet werden, um Lösungen vorzubereiten und für das Waschen Deckgläser werden.
- AC (40% w / v) und Bis-AC (1% w / v)-Lösungen werden von 0,2 mu m sterilfiltriert. Bereiten Sie 10% Ammoniumpersulfat (APS; 100μg/ml Wasser) kurz vor dem Gebrauch und Sterilfilter. Ersetzen Sie die APS-Lösung monatlich.
- Chemische Reagenzien wie 3-APTMS, Chloroform, glutaradehyde, NHS und SurfaSil, die nicht zu autoklaviert werden in einem zugewiesenen Flasche ausschließlich für die Herstellung von Hydrogelen verwendet gehalten.
- Für beste Ergebnisse sollte Hydrogele innerhalb von ein paar Tage nach der Inkubation über Nacht mit den entsprechenden ECM-Protein eingesetzt werden.
- Bereiten Sie eine 10% SurfaSil Lösung in Chloroform (10 ml ist in der Regel ausreichend für 20 Top-Deckgläser) in einer 50 ml-Polypropylen-Falcon-Röhrchen vor der Hydrogel Gießen. (Unser Labor in der Regel siliconizes oben Deckgläser während der 0,5% Glutaraldehyd Inkubationsschritt). Fügen Sie die Deckgläser auf die Falcon-Röhrchen und Rock für mindestens 10 min. Dekantieren SurfaSil Lösung und an der Luft trocknen die Deckgläser auf Kimwipes in der biologischen Sicherheitswerkbank, wo die Hydrogele werden.
- Bereiten Sie die hitzeinaktiviertem BSA-Lösung wie folgt: 20 mg / ml Lösung von Fettsäuren frei BSA in PBS in einem 68 ° C Wasserbad für 30 min inkubiert. Die Lösung wird dann sterilfiltriert und bei 4 ° C gelagert
Verfahren
- Eine Schicht Parafilm auf der unteren Hälfte eines 150-mm-Petrischale.
- Legen Sie bis zu 9 25-mm-Deckgläschen auf dem Parafilm und decken Sie sie mit 1 ml 0,1 M NaOH. Inkubieren für 3 min und dann absaugen mit einem Vakuum-Leitung.
- Die Arbeit in einem chemischen Kapuze, statt 0,5 ml 3-APTMS auf jedem Deckglas. Inkubieren für 3 min und dann absaugen APTMS. Wenn Sie zu lange warten, wird ein Schaum zu bilden.
- Spülen Sie die Deckgläschen einmal mit 20 ml deionisiertem Wasser in einer Schüssel. Entfernen Sie die Deckgläser aus der Schüssel mit einer gebogenen Pinzette und übertragen Sie sie mit ihrem behandelnden-Seite nach oben, um eine neue 150-mm-Schale. Waschen Sie die Deckgläser mit entionisiertem Wasser dreimal auf die Wippe, für jeweils 10 Minuten abwaschen. Wenn Sie alle APTMS entfernen scheitern, wird es mit dem Glutaraldehyd in den nächsten Schritt zu reagieren und hinterlassen einen weißen Regen Niederschlag (Abb. 1).
- Auftauen Glutaraldehyd (~ 10 min vor Gebrauch).
- Mit einer gebogenen Pinzette, übertragen Sie die Deckgläser zu einer sauberen Schüssel mit Parafilm geschichtet und saugen alle verbleibenden Flüssigkeit. Verwenden Sie eine Saugleitung oder Kimwipe um das restliche Wasser-Blot, wie gebraucht.
- Cover jede Deckglas komplett mit 0,5 ml 0,5% Glutaraldehyd in sterilem, deionisiertem Wasser und Inkubation für 30 min in einem chemischen Kapuze. Saugen Sie das Glutaraldehyd. Spülen und waschen Sie die Deckgläschen wie in Schritt 4. Trocknen Sie die Deckgläser komplett. [Sie können hier aufhören und lassen Sie die Deckgläser für mehrere Wochen in einem trockenen Raum].
- Wenn Sie bereit sind, die Hydrogele herzustellen sind, verwenden einer gebogenen Pinzette auf die Deckgläser, reaktive Seite nach oben auf ein Blatt Parafilm, die auf der Oberfläche des biologischen Sicherheitswerkbank wurde mit Klebeband zu übertragen. Stellen Sie sicher, dass die Deckgläser flach auf den Parafilm Oberfläche.
- Bereiten Sie eine gesättigte NHS-Lösung in Toluol. (Man löst eine kleine Menge von NHS in ausreichend Toluol für die jeweilige Experiment. Halten Sie das Hinzufügen NHS Stück für Stück, bis der NHS nicht mehr auflöst. Die gesättigte Lösung ist in der Regel trübe und pink.)
- Als nächstes bereiten die Acrylamid, Bisacrylamid-, Wasser-und APS auf die gewünschte Acrylamid Prozentsatz zu erreichen. Fügen Sie die Reagenzien in Mikrozentrifugenröhrchen wie unten auf ein Gesamtvolumen von 0,8 ml skizziert.
- Dann, eines aliquoten zu einer Zeit, fügen Sie den NHS und TEMED auf die 0,8 ml AC-Lösung, kurz vortexen und SOFORT pour 3-5 Gele mit 140 ul pro Deckglas in die biologische Sicherheit Kapuze. Wann immer möglich, sollten alle Schritte von diesem Punkt in einer biologischen Sicherheitswerkbank durchgeführt werden. [Anmerkung: unterschiedliche Größe Deckgläser kann basierend auf Bedarf genutzt werden. Wenn 18-mm Deckgläser verwendet werden, verwenden ~ 33 ul AC-Lösung pro Deckglas und ein 18-mm top silikonisierten Deckglas.]
Bis-AC (%)0,3 (steif) 0,15 0,06 0,03 (weich) ul ul ul ul Wasser 402 522 594 618 AC 150 150 150 150 Bis-AC 240 120 48 24 APS 8 8 8 8 TEMED 1 1 1 1 NHS 228 228 228 228 - Schnell Ort der silikonisierten 25-mm Deckglas auf der jeweils gel, bevor es zu polymerisieren beginnt. Neben der Top Deckglas sollte es dem AC vollständig zu bedecken den Boden Deckglas. Inkubieren dieses "Sandwich" bei Raumtemperatur, bis die AC polymerisiert. (Überprüfen Sie die verbleibende AC-Lösung im Reaktionsgefäß zu bestimmen, wann Polymerisation stattgefunden hat. In der Regel ein paar Minuten für steife Gele und ein wenig mehr für weiche genügt.).
- Sorgfältig nehmen die Sandwich (sterile Handschuhe!) Und schieben Sie die obere Deckglas, bis es Überhänge der polymerisierten Gel. Sie können dann hebeln ihn aus dem Gel. Wenn Sie zu lange vor dem Entfernen der oberen Deckglas warten, wird das Gel rip als Deckglas wird entfernt.
- Entsorgen Sie die Top-Deckglas. Setzen Sie die untere Gel-Deckgläser (im Folgenden als das Hydrogel) in 6-well-Platten mit 2 ml PBS / well. PBS kann vor oder nach der Gel-Deckglas in jedes Well gegeben werden. Waschen Sie die Hydrogele mit PBS dreimal, auf einer Wippe, 5 min pro Waschgang.
- Wiederholen Sie die Schritte 11-14, bis die erforderliche Anzahl von Hydrogelen hergestellt worden sind.
- Cover jede Hydrogel mit 2 ml einer Fibronektin-Lösung (3 g / ml in PBS) oder andere ECM-Protein (siehe Klein et al. 13 für Details.). Die ECM-Protein kovalent an das Hydrogel bei Inkubation über Nacht gebunden bei 4 ° C
- Saugen Sie die ECM-Lösung und Block nicht umgesetzte NHS mit 1mg/ml hitzeinaktiviertem Fettsäuren frei BSA in serum-freien Medien für mindestens 30 min bei 37 ° C in einem Zellkulturbrutschrank. Spülen Sie die Hydrogele einmal mit sterilem PBS oder Zellkulturmedium.
- Platte Zellen in dem entsprechenden Kulturmedium mit FBS. Die Anzahl der Zellen auf das Hydrogel ausgesät sollten vom Anwender auf den Grad der Zelle ausbreitet und Konfluenz benötigt für Experimente bestimmt werden. Etwa 10 5 Zellen ist in der Regel ausreichend für Western-Blot-und qPCR-Analyse.
- Nach der Inkubationszeit kann Zelle Protein oder mRNA extrahiert werden. Die Deckgläser werden sorgfältig aus den Vertiefungen mit einer gebogenen Pinzette entfernt und (Zell-Seite nach unten) auf der Oberseite von 100 ul Tröpfchen Lysepuffer waren und nun nicht (2-3cm) an einem Blatt Parafilm auf dem Labortisch angeordnet. (Wir verwenden Standard-SDS-Probenpuffer und TRIzol jeweils um Proben für die Western-Blot vorzubereiten und RNA für die qPCR zu isolieren.) Inkubieren Sie die Zellen mit dem Lysepuffer für genau eine Minute. Deckgläser abnehmen und übertragen Sie die Lysepuffer zu einem Reaktionsgefäß. Alternativ zur RNA-Extraktion nur, kann der Benutzer jedes Hydrogel, um eine neue 6-Well-Platte übertragen und 1ml von TRIzol / well. Inkubieren für 3 Minuten und entfernen TRIzol Lösung für die Lagerung in einem Reaktionsgefäß.
Zusätzliche Informationen über Verfahren wie Immunfluoreszenz, wird BrdU-Färbung, Transfektion, etc. für die Zellen auf Hydrogele gesät in Klein et al. 2007 13.
Repräsentative Ergebnisse
Gründliches Waschen der Deckgläschen nach der Zugabe von APTMS ist ein wichtiger Schritt in der Herstellung von "reaktiven" Deckgläser. Wenn man die APTMS vollständig zu entfernen scheitert, wird es mit dem Glutaraldehyd in den folgenden Schritt reagieren und eine weiße trübe Niederschlag wie in Abbildung 1A zu sehen. Abbildung 1B zeigt eine richtig gewaschen und getrocknet Deckglas. Wenn der Niederschlag entsteht, muss die ganze Prozedur von vorne begonnen werden, da das Deckglas ist nicht mehr nutzbar.
Nach Hydrogelbildung und Beschichtung mit ECM-Proteine über Nacht, können die Zellen ausgesät den folgenden Tag. Wie Abbildung 2 zeigt, gibt es einen deutlichen Unterschied zwischen Zellausbreitung auf steifen gegenüber weichen Hydrogele. Wie von Phalloidin-Färbung in embryonalen Maus-Fibroblasten (MEFs) zu entnehmen ist, Zellen in einem größeren Ausmaß auf steifen verbreitet als zu weich Hydrogele verglichen. In der Tat werden die meisten Zellen eine Verbindung zu einem weichen Hydrogel bleiben kompakt und legen weniger effizient.
Obwohl nur MEF Morphologie in Abbildung 2 dargestellt ist, ist der Unterschied in der Zelle sich über viele andere Zelllinien konsequent getestet 11-12,14.
Secrets to Success
- Sobald die Prozedur gestartet wird, ist es sehr wichtig, die Deckgläser mit der "reaktiven" Seite halten und im Kopf behalten, welche Seite beschichtet wurde.
- Handschuhe sollten zu jeder Zeit während des Verfahrens ein Arbeitsumfeld zu schaffen, dass möglichst steril bereitzustellen getragen werden.
- Die meisten der ersten Schritte sind zwischen einem Laborabzug und dem Labortisch durchgeführt. Alle Schritte anschließendenzum Entfernen von überschüssigem Glutaraldehyd aus dem Deckgläschen sollte unter einer biologischen Sicherheitswerkbank durchgeführt werden.
- Aufgrund von Unterschieden in der Zelle ausbreitet (Abbildung 2), empfehlen wir Säen die doppelte Anzahl von Zellen auf weichen Hydrogele als zu steif Hydrogele verglichen.
- Die AC-Polymerisationsverfahren ist extrem schnell. Bei erstmaliger Benutzung, kann man verringern die Menge von APS oder TEMED in die Lösung der Polymerisation zu verlängern. Versuchen Sie nicht, mehr als ein paar Deckgläser auf einmal vorbereiten.
- In Zellzyklus Studien, in denen die Synchronisation in G0 erforderlich ist, wir in der Regel Serum-verhungern Zellen in Kunststoff-Petrischalen, trypsinize die Zellen und reseed sie auf Hydrogele unterschiedlicher Nachgiebigkeit in Gegenwart von Mitogene (FBS und / oder Wachstumsfaktoren). Dieses Verfahren stellt sicher, dass der Ausgangspunkt Bevölkerung von G0-synchronisierten Zellen identisch in allen Proben ist. Doch für viele Signaltransduktion Studien, können die erforderlichen Mitogenstimulation Zeit nicht lang genug sein, um für die Befestigung und Ausbreitung von Zellen zu ermöglichen. In diesem Fall haben wir Serum-verhungern die Zellen auf der Hydrogele und dann direkt zu stimulieren sie mit Mitogen.

Abbildung 1A. Falsch gewaschen Deckglas. Nach Zugabe von APTMS wurde Deckglas für 1-2 Minuten vor der Zugabe der Glutaraldehyd-Lösung gewaschen. Ein Niederschlag bildet sich auf dem Deckglas, die nicht nach den Schritten im Verfahren beschrieben wurde gewaschen.

Abbildung 1B. Richtig gewaschen Deckglas. Nach Zugabe von APTMS wurde Deckglas für dreimal jeweils 10 Minuten vor der Zugabe der Glutaraldehyd-Lösung gewaschen. Entsteht kein Niederschlag auf dem Deckglas.
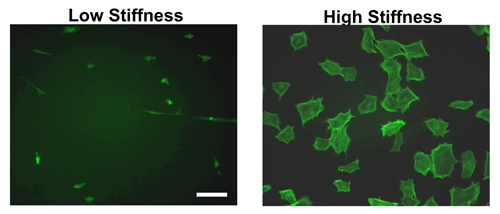
Abbildung 2. Morphologie der Zellen auf Hydrogele unterschiedlicher Steifigkeit. Etablierte MEFs auf Fibronektin-beschichteten Hydrogele hohe oder niedrige Steifigkeit für 9 Stunden wurden ausgesät. Nach der Inkubationszeit wurden die Zellen fixiert, permeabilisiert und mit FITC-Phalloidin, die f-Aktin bindet. MEFs auf hohe Steifigkeit Gele zeigen Stress-Fasern und sind gut verteilt im Vergleich zu denen auf geringe Steifigkeit Hydrogele ausgesät. Balken = 50 um.
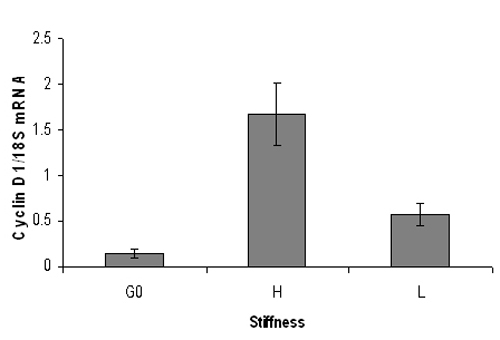
Abbildung 3. Vertreter quantitative PCR Ergebnis der Maus Cyclin D1-mRNA-Spiegel. Serum verhungert embryonalen Maus-Fibroblasten wurden auf hoch (3% Acrylamid) oder niedrig (0,3% Acrylamid) Steifigkeit Hydrogele verzinkt und stimuliert mit 10% FBS für 9 Uhr. Nach RNA Extraktion wurde real-time quantitative PCR-Analyse für Cyclin D1-mRNA-Spiegel (normiert auf 18S RNA) durchgeführt. G0 stellt Cyclin D1 mRNA aus ruhenden Zellen. Cyclin D1-mRNA-Spiegel signifikant erhöhen auf steifen Hydrogele, aber nicht auf weichen Hydrogele. Daten sind Mittelwerte + / - SD von doppelten PCR-Reaktionen.
Diskussion
Ein entscheidendes Element des Hydrogels Polymerisation wird die Luft Blasenbildung, die es Zellen, die Deckglas, anstatt die ECM-beschichteten Hydrogel sich binden zu vermeiden. Dies kann durch vorsichtiges Pipettieren der Polymerisationslösung nach Vortexen und visuell darauf achten, dass keine Luftblasen eingeschlossen werden in das Gel verhindert werden. Wir empfehlen immer, bereitet zusätzliche "reaktiven" Deckgläser und Hydrogele, um sicherzustellen, dass genug für Experimente.
Offenlegungen
Danksagungen
Die Arbeit ist unser Labor durch Zuschüsse aus dem National Institutes of Health unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde, 70% | Sigma-Aldrich | G7776 | Store at -20°C |
| 3-APTMS (3-Aminopropyltrimethosysilane 97%) | Sigma-Aldrich | 281778 | Store at room temperature |
| SurfaSil Siliconizing Fluid | Thermo Fisher Scientific, Inc. | 42800 | Store at room temperature |
| NHS (N-hydroxysucinimide Ester) | Sigma-Aldrich | A-8060 | Store at 4°C Replace monthly |
| Albumin, bovine serum, essentially fatty acid free | Sigma-Aldrich | A6003-100G | Store at 4°C |
| Coverslips (25mm) | Fisher Scientific | 12-545-86 25 Cir 1D | |
| Coverslips (18mm) | Fisher Scientific | 12-545-84 18 Cir 1D |
Referenzen
- Beattie, D., Xu, C., Vito, R., Glagov, S., Whang, M. C. Mechanical analysis of heterogeneous, atherosclerotic human aorta. J Biomech Eng. 120, 602-607 (1998).
- Bernini, G. Arterial stiffness, intima-media thickness and carotid artery fibrosis in patients with primary aldosteronism. J Hypertens. 26, 2399-2405 (2008).
- Boonyasirinant, T. Aortic stiffness is increased in hypertrophic cardiomyopathy with myocardial fibrosis: novel insights in vascular function from magnetic resonance imaging. J Am Coll Cardiol. 54, 255-2562 (2009).
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Duprez, D. A., Cohn, J. N. Arterial stiffness as a risk factor for coronary atherosclerosis. Curr Atheroscler Rep. 9, 139-144 (2007).
- Lee, R. T. Prediction of mechanical properties of human atherosclerotic tissue by high-frequency intravascular ultrasound imaging. An in vitro study. Arterioscler Thromb. 12, 1-5 (1992).
- Levental, K. R. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139, 891-906 (2009).
- Paszek, M. J. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8, 241-254 (2005).
- Samani, A., Zubovits, J., Plewes, D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples. Phys Med Biol. 52, 1565-1576 (2007).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47, 1394-1400 (2008).
- Pelham, R. J., Wang, Y. -. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad Sci USA. 94, 13661-13665 (1997).
- Klein, E. A., Yung, Y., Castagnino, P., Kothapalli, D., Assoian, R. K. Cell adhesion, cellular tension, and cell cycle control. Methods Enzymol. 426, 155-175 (2007).
- Klein, E. A. Cell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Current Biology. 19, 1511-1518 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten