Method Article
טכניקות מעבדה אספטיים: שיטות ציפוי
In This Article
Summary
כאשר עובדים עם התקשורת ריאגנטים המשמשים מיקרואורגניזמים תרבות, הטכניקה aseptic חייב להיות מתורגל כדי להבטיח זיהום ממוזער. מגוון שיטות ציפוי משמשים באופן שגרתי כדי לבודד, להפיץ, או חיידקים למנות ו הפאג, אשר כולם לשלב נהלים השומרים על עקרות של חומרים ניסיוניים.
Abstract
מיקרואורגניזמים נמצאים בכל משטחים דוממים יצירת מקורות בכל מקום אפשרי של זיהום במעבדה. הצלחת הניסוי מסתמך על היכולת של המדען לעקר משטחי עבודה וציוד, כמו גם למנוע מגע של כלים ופתרונות סטריליים עם לא סטריליים משטחים. כאן אנו מציגים את השלבים כמה שיטות ציפוי המשמשים באופן שגרתי במעבדה לבודד, להפיץ, או למנות מיקרואורגניזמים כגון חיידקים הפאג. כל חמש שיטות לשלב טכניקה מזוהם, או נהלים, כי לשמור על סטריליות של חומרים ניסיוניים. הנהלים שתוארו כוללים (1) רצף, ציפוי תרבויות לבודד מושבות חיידקים בודדים, (2) לשפוך, ציפוי ו (3) התפשטות, ציפוי על מנת לספור מושבות חיידקים קיימא (4) שכבות אגר רך לבודד הפאג ושלטים למנות, ו ( 5) העתק, ציפוי להעביר תאים מהצלחת אחד למשנהו בתבנית מרחבית זהה. נהלים אלה ניתן לבצע tהוא ספסל במעבדה, בתנאי שהם כרוכים פתוגניים שאינם זנים של מיקרואורגניזמים (רמת בטיחות ביולוגית 1, BSL-1). אם עובדים עם BSL-2 אורגניזמים, אז המניפולציות האלה חייב להתבצע בתוך ארון בטיחות ביולוגית. להתייעץ המהדורה העדכנית ביותר של בטיחות ביולוגית במעבדות מיקרוביולוגיות ביו (BMBL), כמו גם בטיחות חומרים גיליונות נתונים (MSDS) של חומרים זיהומיות על מנת לקבוע את סיווג Biohazard, כמו גם את אמצעי בטיחות ומתקנים הבלימה הנדרש מיקרואורגניזם הנדון. זני חיידקים ומניות הפאג ניתן לקבל החוקרים מחקר, חברות, ואוספים מתוחזק על ידי ארגונים מסוימים כגון אוסף התרבות האמריקאית סוג (ATCC). מומלץ לא להשתמש זנים פתוגניים כאשר לומדים את שיטות ציפוי שונים. על ידי ביצוע הליכים המתוארים בפרוטוקול זה, התלמידים צריכים להיות מסוגלים:
- נהלי ציפוי ללא contaminatiנג התקשורת.
- לבודד מושבות חיידקים בודדים בשיטת פס-ציפוי.
- להשתמש בשיטות לשפוך, ציפוי, פרוסים ציפוי כדי לקבוע את ריכוז החיידקים.
- לבצע שכבות אגר רך בעבודה עם הפאג.
- העברת תאים חיידקיים מהצלחת אחד לאחר באמצעות ההליך העתק-ציפוי.
- לאור ניסיוני המשימה, בחר את שיטת ציפוי מתאים.
Protocol
1. להכין סביבת עבודה בטוח וסטרילי
- להכיר את כל הכללים מעבדה ואזהרות הבטיחות שיש לנקוט בעבודה עם מיקרואורגניזמים. ללא קשר לסיווג Biohazard, כל החומרים הבאים במגע עם מיקרואורגניזמים נחשבים פסולת זיהומית ויש לחטא לפני סילוק. עקוב אחר הנחיות הבטיחות בהתאם אלו המתפרסמים בריאות הסביבה המוסדית מחלקות בטיחות, הקמת קיבול מתאימים לסילוק פסולת מיידית נכון של חומרים מזוהמים (biohazards).
- לעקר את כל הכלים, פתרונות, מדיה לפני השימוש בהם נהלים ציפוי.
- נקה את כל החומרים שהצטברו אזור העבודה שלך על הספסל מעבדה.
- ניקוי אזור העבודה עם חומר חיטוי כדי למזער את זיהום אפשרי.
- הגדרת צורב בונזן ולעבוד לאט, בזהירות, בכוונה תחילה בתוך שטח השדה הסטרילי שנוצר על ידי updraרגל של הלהבה.
- אם עובדים עם BSL-2 אורגניזמים, לקבוע מקום העבודה שלך בארון בטיחות ביולוגית. מבער בונזן לא ניתן להשתמש בו בתוך ארון, כי החום מהאש משבש את זרימת האוויר חיוני את הפונקציונליות שלו.
- מסדרים את כל ציוד נדרש הליך על ספסל במעבדה ליד שדה סטרילי. ודא שכל החומרים מסומנים כראוי. ארגון אזור העבודה על מנת למקסם את יעילות העבודה ולהימנע מתנועות מיותרות יהיה למזער את זמן החשיפה של חומרים מזהמים הנישאים באוויר ניסיוני.
- מניחים את מבער בונזן ימין שלך על הספסל.
- אגר מקום צלחות או צלחות פטרי שמאלה.
- סדר בתרביות תאים, צינורות, צלוחיות ובקבוקי במרכז הספסל.
- לשחרר את הפקקים של צינורות, צלוחיות ובקבוקי כך שניתן לפתוח בקלות במהלך מניפולציות הבאים ביד אחת.
- לשטוף ידיים ביסודיות עם סבון חיטוי חםמים לפני הטיפול מיקרואורגניזמים.
2. צלחת סדר פס: בידוד של מושבות חיידקים בשיטת Quadrant
הליך פס, צלחת נועד לבודד תרבויות טהור של חיידקים, או מושבות, מאוכלוסיות מעורבות של הפרדה מכני פשוט. מושבות יחיד מורכב ממיליוני תאים הגדלים אשכול על או בתוך צלחת אגר (איור 1). המושבה, שלא כמו תא בודד, גלוי לעין בלתי מזוינת. באופן תיאורטי, כל התאים במושבה נגזרות חיידק אחד בהתחלה שהופקדו על הצלחת ולכן מכונים שיבוט, או קבוצה של תאים זהים גנטית.
- חיידקים קיימים במגוון רחב של צורות וגדלים. לדוגמה, תאים בודדים Escherichia קולי הם בצורת מוט באורך ממוצע של 2 מיקרומטר ורוחב של 0.5 מיקרומטר תוך התאים סטרפטוקוקוס הם כדוריים בקוטר ממוצע של 1 מיקרומטר. כמה חיידקים (suפרק כ א coli) קיימים תאים בודדים, בעוד שאחרים יוצרים דפוסים שונים של האגודה. סטרפטוקוקוס, למשל, גדלים בזוגות או רשתות טופס או אוסף של תאים. מקובל להניח כי המושבה אחת נובעת תא בודד עובר ביקוע בינארי, עם זאת, הנחה זו אינה נכונה עבור אותם חיידקים באופן טבעי קיימים זוגות, שרשראות, או אשכולות או המתחלקים על ידי מנגנונים אחרים. לחלופין, אם חיידקים רבים מדי הם מצופה, ואז חופפים של תאים עלולה להתרחש ולהגדיל את ההסתברות של שניים או יותר חיידקים המקים את מה שנראה מושבה אחת. כדי למנוע סיבוכים אלה בתיאור או התרבויות ספירת חיידקים הגדלים על מצע מוצק, מושבות מכונים יחידות המושבה להרכיב (CFU).
נוהל פס, צלחת, תערובת של תאים מתפשט על פני בינוני חצי מוצק אגר מבוסס, מזין בצלחת פטרי כך פחות ופחות חיידקיםתאים מופקדים בנקודות נפרדים ורחוקים מאוד על פני השטח של המדיום, ובעקבות הדגירה, להתפתח מושבות. שיטת ברבע לבידוד מושבות בודדות מתערובת של תאים שיפורט כאן.
- רצף, ציפוי יכול להיות מושלם עם מספר מכשירים שונים (איור 2). לולאת מתכת ניתן שימוש חוזר מספר פעמים, והוא ישמש פס, ציפוי זני מעבדה שגרתיות. לולאות פלסטיק חד פעמיות זמינים מסחרית והם משמשים לעתים קרובות יותר כאשר עובדים עם BSL-2 זנים בארון בטיחות ביולוגית. מדענים מחקר רבים מעדיפים שימוש חד פעמי, מראש מעוקרות מקלות עץ או קיסמים שטוחים עבור ציפוי, פס. אלה הם אלטרנטיבה זולה לולאות פלסטיק חד פעמיות והוא יכול להיות שימושי במיוחד כאשר עובדים עם מדגם הסביבה כגון קרקע, כי סביר להניח מכיל נבג יוצרי חיידקים.
- חד פעמי מראש מעוקרות מקלות וקיסמי שיניים לא צריך להיות להטה עם מבער בונזן יום חמישישל מניעת aerosolization מיותר של נבג יוצרי חיידקים בין זיהום משטחים מעבדה או צלחות אגר עם נבגים.
- תווית סביב קצה התחתון (לא מכסה) של צלחת אגר עם שם לפחות שלך, תאריך, סוג של מדיום הגידול, ואת סוג של האורגניזם להיות מצופה על המדיום.
- הצלחות חייב להיות יבש לחלוטין ללא עיבוי על מכסה מראש מחומם לטמפרטורת החדר לפני ציפוי-פס. אם את הצלחות מאוחסנים 4 ° C, להסיר אותם כמה שעות או אפילו יום קודם. מורחים אותם החוצה, ערימות קטנות מעד של לא יותר מ 2-3 הצלחות ולאפשר להם להתייבש.
- המדגם ממנו פס, צלחת יהיה מחוסן יכול להיות או השעיה של תאים במרק או המושבה הקיים מהצלחת אחרת אגר. ראשית, מומלץ כי רק דגימה אחת לשמש כדי לחסן צלחת אחת. כדי לחסוך זמן וחומרים, צלחת אחת יכול לשמש מספר רב של samples אבל רק פעם אחת אתה הופך להיות בקיאים בכל נמרח דגימה אחת על צלחת.
- עבור ברבע הראשון, המדגם הוא הרים על פני כרבע משטח של המדיום באמצעות מהירה, חלקה, גב ו-ושוב בתנועה (לוח של איור 3). הרם את החצי התחתון של צלחת הפוכה מהספסל. העבר את הלולאה, מקל או קיסם הלוך ושוב פעמים רבות על פני אגר מן השפה אל מרכז הצלחת.
- אם הבידוד הוא תרחיף תאים, לקבל loopful עם לולאת מתכת או 5-10 μl עם micropipettor. הקפד או מערבולת מערבולת ההשעיה התא לפני הסרת aliquot עבור ציפוי. השתמש בטכניקה מזוהם בעת ביצוע שלב זה, בוערים לא רק את הלולאה, אלא גם את השפה של הבקבוק או צינור לפני ואחרי הסרת הבידוד. כמו כן, לא לגעת בדפנות צינור או בקבוק עם לולאה או חבית micropipettor. אם pipetting הבידוד, לוותר על ההשעיה התא appropriate מקום על הצלחת ואז להשתמש, לופ מקל או קיסם כדי להפיץ אותו ברבע הראשון של הצלחת.
- אם הבידוד הוא מושבה מהצלחת אחרת, לגעת בעדינות את המושבה עם לולאה, מקל או קיסם ומורחים אותו על גבי ברבע הראשון של הצלחת. הקפד לולאת מתכת הוא מקורר לפני שנוגעים המושבה. על מנת להבטיח הלולאה הוא לא חם מדי, לגעת בו קלות על צלחת אגר באזור המיועד שם נמרח לא תתרחש. רק כמה תאים יש צורך מהמושבה, לא את המושבה כולה.
- אם באמצעות לולאת מתכת, אש אותו באמצעות מבער בונזן לפני קבלת הבידוד לצלחת (לוח ב 'איור 3). התחל על 3-4 ס"מ של הלולאה, עם חוט בקצה החרוט כחול, החלק החם ביותר של הלהבה. מתכת צריך להיות אדום חם. הזז את החוט כך הלהבה מתקרב הלולאה. מניפולציה זו מונעת aerosolization של חיידקים שנשארו על לולאה משימוש הקודם.
- בוער הורגחיידקים (אם כי לא נבגים) וזרמים הסעה מן האוויר סוער למנוע מזהמים הנישאים באוויר אחרים להתיישב על חוט מתכת במהלך מניפולציות הבאים.
- אם באמצעות קיסם שטוח סטרילית, החזק את הקצה הצר בעדינות בין האגודל הקמיצה בזווית 10-20 ° עד בינוני, ולהשתמש סוף רחב פס של הרביעים. אם באמצעות לולאה או מקל עץ, להחזיק אותו כמו עיפרון באותה זווית. אל תלחץ כל כך חזק, כי חפירות לולאה, מקל או קיסם לתוך אגר.
- לאחר סיום הרבע הראשון, להפוך ולקבוע את הצלחת חזרה לתוך המכסה על הספסל. השלך את מקל או קיסם או מחדש אש לולאת מתכת כמתואר בשלב מס '4.
- להפוך את 90 צלחת פטרי ° עד פס ברבע השני. הרם את החצי התחתון של צלחת הפוכה מהספסל ואז לגעת, לופ מקל או קיסם ברבע הראשון לקראת סוף פס האחרון. באמצעות דפוס גב ושוב, לעבור ללאס1/2 לא של פסים ברבע הראשון ולאחר מכן לעבור ברבע השני ריק. הפוך והניחה את הצלחת לתוך המכסה על הספסל פעם אחת ברבע השני מלא.
- לולאה, מקל או קיסם אסור לחזור לתוך המחצית הראשונה של פסים ברבע הראשון שבו רוב הבידוד המקורי הופקד.
- הפלסטיק החדש לולאה, מקל עץ או קיסם יש להשתמש ברבע אחד.
- חזור על שלב # 6 פעמיים את הרביעים השלישי והרביעי.
- הקפד להשליך מקל או קיסם או מחדש אש לולאת מתכת בין רביע.
- לא לעבור ברבע הראשון כאשר נמרח ברבע הרביעי.
- דגירה צלחת הפוכה זאת עיבוי שמצטבר על המכסה לא לטפטף על המושבות.
3. יוצקים נוהל פלייט: ספירת תאים חיידקיים במדגם מעורב
שיטה זו לעתים קרובות הוא להשתמשד לספור את מספר מיקרואורגניזמים במדגם מעורבת, אשר מתווסף בינוני אגר מותכת לפני מיצוק שלה. את תוצאות תהליך מושבות מפוזרים באופן אחיד לאורך בינוני מוצק כאשר דילול מדגם המתאימה מצופה. טכניקה זו משמשת לביצוע עבירות צלחת בת קיימא, שבה המספר הכולל של יחידות המושבה להרכיב בתוך אגר ועל פני השטח של אגר על צלחת אחת הוא המנויים. ספירת צלחת קיימא לספק למדענים אמצעים סטנדרטיים כדי ליצור עקומות גדילה, כדי לחשב את ריכוז התאים בצינור שממנו המדגם היה מצופה, וכן לחקור את ההשפעה של סביבות שונות או תנאי הגידול על הישרדות תא החיידק או צמיחה.
- תווית סביב קצה התחתון (לא מכסה) של צלחת פטרי סטרילית אבל ריק עם שם לפחות שלך, תאריך, סוג של מדיום הגידול, ואת סוג של האורגניזם שיתווספו בינוני אגר מומסת.
- כלול את גורם לדילול אם Platלאינג דילולים סידוריים, או סידרה של דילולים חוזרים ונשנים, מה שגורם לירידה בריכוז שיטתי של תאים במדגם. הכנת דילולים סדרתיים היא הכרחית, אם מספר התאים במדגם עולה על הקיבולת של צלחת אגר, שבו מגוון סטטיסטית משמעותית היא 30-300 CFU. אם יש יותר מ 300 CFU על צלחת, ואז המושבות יהיה צפוף חופפים.
- להשיג צינור המכיל 18 מ"ל של מדיום אגר מומסת.
- בינוני אגר יש לוותר לתוך מבחנות מראש לעקר ב החיטוי. באותו יום הוא נחוץ לצורך הניסוי, אגר יש נמסה קיטור במשך 30 דקות עד שהוא מועבר אמבט מים 55 מעלות צלזיוס. רק אגר ככל שנדרש לצורך הניסוי יש נמס כמו שלא ניתן להשתמש בהן שוב ושוב.
- עשר דקות לפני שמזג צלחות, הצינורות של אגר נמס יש להעביר מן אמבט 55 ° C מים כדי לחסום בחום על עבודהספסל atory נקבע על 48 ° C. לאחר אגר מגיע לטמפרטורה, הוא מוכן לשפוך. אם אגר הוא חם מדי, החיידקים במדגם עלול להיהרג. אם אגר הוא מגניב מדי, המדיום יכול להיות גבשושי מוצקה אחת.
- להשיג המדגם שלך, שאמור להיות גם תרבות מרק או השעיה של תאים המיוצרים על ידי תאים ערבוב של המושבה לתוך המאגר או תמיסת מלח.
- דוגמאות ניתן לגזור מתוך סדרה דילול של מדגם יחיד.
- נפח דגימה להיות מצופה צריך להיות בין 0.1 ו - 1.0 מ"ל.
- פתח את המכסה של צלחת פטרי ריק, לוותר על המדגם שלך באמצע צלחת (פאנל של איור 4). סגור את המכסה.
- השתמש בטכניקה מזוהם במשך כל התהליך.
- השתמש באחת פיפטה micropipettor סרולוגית או להעביר דגימת שלך הצלחת. לשלוט על זרימת המדגם, כך שהוא לא לבזבז כסף על הצלחת.
- הסר את מכסה האמבטהדואר של אגר מומס, ולהעביר את השפה של הצינור פתוח דרך הלהבה של מבער בונזן.
- פתח את המכסה של צלחת פטרי שמכילה לדוגמה שלך ויוצקים אגר ב בקפידה (לוח ב 'איור 4). סגור את המכסה ואז לערבב את המדגם עם אגר ידי בעדינות מתערבל את הצלחת.
- אפשר אגר ביסודיות לחזק את הצלחת לפני היפוך במשך הדגירה.
4. צלחת סדר התפשטות: כינונה של מושבות חיידקים דיסקרטית עבור ספירת פלייט, העשרה, הבחירה, או הקרנה
טכניקה זו משמשת בדרך כלל מיקרואורגניזמים שונים הכלולים נפח דגימה קטנה, אשר משתרע על פני השטח של צלחת אגר, וכתוצאה מכך היווצרות של מושבות נפרדות יחולקו בצורה שווה על פני אגר כאשר ריכוז מתאים של תאים הוא מצופה. בנוסף שימוש בטכניקה זו על ספירת צלחת קיימא, בו המספר הכולל של יחידות המושבה להרכיב על שריםהצלחת לה הוא מנה והשתמש לחשב את ריכוז התאים בצינור שממנו המדגם היה מצופה, להפיץ, ציפוי נעשה שימוש באופן שגרתי ניסויים העשרה, בחירה ולאחר ההקרנה. התוצאה הרצויה עבור שלושת הניסויים הוא בדרך כלל זהה לזו של ספירת צלחת, בהם חלוקת מושבות נפרדות ויוצר על פני השטח של אגר. עם זאת, המטרה היא לא על מנת להבטיח את כל התאים קיימא יוצרים מושבות. במקום זאת, רק את אותם תאים בתוך אוכלוסיית בעלי גנוטיפ מסוים צריך לגדול. הליך הצלחת התפשטות יכולים להיות מועסקים על טכניקה פור הצלחת הניסוי ספירה אם המטרה הסופית היא לבודד מושבות לניתוח נוסף כי מושבות לגדול accessibly על פני אגר ואילו הם הופכים להיות מוטבע אגר עם הליך צלחת פור.
ישנן שתי אסטרטגיות המתוארים כאן הליך הצלחת התפשטות. (שיטה) 1 כולל שימוש פטיפון זכוכית או מתכת roד בצורת מקל הוקי. 2 (שיטה ב '), המכונה "שיטת קופקבנה", כולל רועדות מראש מעוקרות חרוזי זכוכית. שניהם להקל אפילו התפשטות תאים על פני השטח אגר.
השיטה: מורחים-ציפוי עם פטיפון וזכוכית או מוט מתכת
- תווית סביב קצה התחתון (לא מכסה) של צלחת אגר עם שם לפחות שלך, תאריך, סוג של מדיום הגידול, ואת סוג של האורגניזם להיות מצופה על המדיום.
- כלול את גורם לדילול אם ציפוי דילולים סדרתיים.
- הצלחות חייב להיות יבש לחלוטין ללא עיבוי על מכסה מראש מחומם לטמפרטורת החדר לפני ציפוי, התפשטות. אם את הצלחות מאוחסנים 4 ° C, להסיר אותם כמה שעות או אפילו יום קודם. מורחים אותם החוצה, ערימות קטנות מעד של לא יותר מ 2-3 הצלחות ולאפשר להם להתייבש.
- במרכז הצלחת על פטיפון (איור 5).
- להשיג לךמדגם R, שאמור להיות תרבות מרק או השעיה של תאים המיוצרים על ידי תאים ערבוב של המושבה לתוך המאגר או תמיסת מלח.
- דוגמאות ניתן לגזור מתוך סדרה דילול של מדגם יחיד.
- נפח דגימה להיות מצופה צריך להיות בין 0.1 ו - 0.2 מ"ל.
- פתח את המכסה של צלחת פטרי, וכן לוותר על המדגם שלך במרכז אגר. סגור את המכסה.
- השתמש בטכניקה מזוהם במשך כל התהליך.
- השתמש micropipettor להעביר דגימת שלך הצלחת. לשלוט על זרימת המדגם, כך שהוא לא לבזבז כסף על הצלחת.
- טובלים מוט זכוכית או מתכת מוט (שנקרא גם מפזר) לתוך הכוס של 70% (V / V) אתנול.
- זהירות: אין לטבול מפזר חם לתוך כוס של אלכוהול.
- אתנול צריך רק לגעת בחלק התחתון של מפזר ו 1 אינטש של גזע.
- מסננים להצית אתנול עודף ידי זה עובר דרך הלהבה של כמה לחמניותen צורב.
- הלהבה צריכה לנסוע לאורך מפזר ואת גזע שבא במגע עם אתנול כך מהר לכבות.
- גביע האש לתפוס אתנול צריך, לא להיבהל! מניחים כיסוי זכוכית מעל הכוס, אשר מהר לכבות את האש.
- פתח את מכסה צלחת אגר, מחזיקים את המכסה ביד שמאל עם האגודל והאצבע המורה. לקרר את מפזר על ידי נגיעה בו כדי אגר לאורך הקצה הקרוב שולי.
- אל תיגע אגר שבו תאים נוספו. מפזר חם יהרוג את התאים.
- עם יד שמאל (ועדיין מחזיק את מכסה צלחת אגר), לסובב את הפטפון לאט.
- למרות להימנע הטובה ביותר, אם אתה חייב לשים את המכסה כלפי מטה, ומניחים אותו עם הפנים כלפי מטה על משטח לחיטוי בתחום הסטרילי של מבער בונזן. עם מכסה הפונה למעלה, יש סיכוי גדול יותר של זיהום תנועת עצמים או ידיים, ליצור זרמי האוויר שגורמותמיקרואורגניזמים חלקיקי אבק לרדת אל פני השטח הפנימי של המכסה.
- עם יד ימין, החזק מפזר בעדינות על פני השטח של אגר ובהדרגה התפשט מדגם באופן שווה על פני הצלחת כולה. העבר את מפזר הלוך ושוב על פני צלחת כמו פטיפון מסתובב.
- אפשר מדגם לקלוט היטב (לפחות 5 דקות) לפני צלחת היפוך של הדגירה.
שיטה ב ': מורחים-ציפוי עם חרוזי זכוכית: "שיטת קופקבנה"
- תווית סביב קצה התחתון (לא מכסה) של צלחת אגר עם שם לפחות שלך, תאריך, סוג של מדיום הגידול, ואת סוג של האורגניזם להיות מצופה על המדיום.
- כלול את גורם לדילול אם ציפוי דילולים סדרתיים.
- פתח את מכסה צלחת אגר, מחזיקים את המכסה ביד שמאל עם האגודל והאצבע המורה. לאחר מכן פתח את שפופרת זכוכית או בקבוק המכיל מראש לעקר GLהתחת חרוזים. עם זכות הלהבה שלך ביד, שפת צינור או בקבוק ואז בזהירות לוותר 10-12 חרוזי זכוכית סטריליות על גבי צלחת אגר (איור 6). סגור את מכסה הבסיס, וכולם הלהבה שפת צינור או בקבוק שוב לפני החלפת מכסה והגדרת אותו בצד.
- יוצקים בעדינות את החרוזים מתוך צינור או בקבוק סנטימטרים ספורים מעל אגר כך החרוזים לא להקפיץ מתוך צלחת פטרי.
- השתמש חרוזי זכוכית כי הם 4 מ"מ קוטר. לעקר אותם בקבוקי זכוכית או מבחנות ב החיטוי ב 121 ° C על מחזור יבש (הגדרת כוח המשיכה) במשך 30 דקות.
- אחד היתרונות של שימוש חרוזים במקום מפזר הוא לא מכולות פתוחות של אתנול נדרשים עבור בוערים חזר.
- פתח את מכסה צלחת אגר, ו לוותר על המדגם שלך במרכז אגר. סגור את המכסה.
- השתמש בטכניקה מזוהם במשך כל התהליך.
- 100-150 aliquot μl המדגם לכל צלחת. זהנפח יקל גם התפשטות תאים. השתמש micropipettor להעביר דגימת שלך הצלחת. לשלוט על זרימת המדגם, כך שהוא לא לבזבז כסף על הצלחת.
- מורחים בעדינות על ידי מדגם רועד את החרוזים על פני השטח של אגר 6 עד 7 פעמים. על מנת להבטיח התאים להתפשט באופן שווה, השתמש בתנועה אופקית לרעוד.
- אל מערבולת את החרוזים או אחר כל התאים תהיה בסופו של דבר על שפת הצלחת.
- רמז: אם נעשה כראוי, הליך נשמע כמו "המאראקאס רועדות".
- סובב את הלוח 60 מעלות אופקית ואז ללחוץ שוב 6 עד 7 פעמים.
- סובב את הצלחת 60 ° בפעם השנייה אופקית לרעוד שוב. עד עכשיו, אתה צריך להשיג גם הפצת תאים על פני השטח אגר.
- בסיום התפשטות, ציפוי, המדגם צריך להיספג ולא את פני השטח של אגר צריך להיות יבש. יוצקים מעל את החרוזים מזוהמים לתוך מבחנה המכילה אוסף ניכרת כלור אקונומיקה 10%.
- לאלמחוק את חרוזי באשפה! החרוזים ששימשו יהיה שטופה autoclaved, מחדש לעקר אותם לשימוש חוזר.
- הערה: אם פני השטח אגר עדיין רטוב אחרי רועד שלוש פעמים, לאפשר הצלחת לשבת לכמה דקות כדי לאפשר לנוזלים להיספג על ידי אגר, ואז חזור על שלבים 4-6 עד # פני צלחת נראה יבש.
- להפוך את צלחת הדגירה.
5. אגר רך נוהל כיסוי: היווצרות הפלאק עבור בידוד ספירת הפאג (Assay רובד)
טכניקה זו משמשת בדרך כלל כדי לזהות ולכמת bacteriophage (פאג), או וירוסים חיידקים הנעים בגודל מ -100 עד 200 ננומטר. מיקרוסקופ אלקטרוני יש צורך לראות חלקיקים הפאג בודדים. עם זאת, נוכחות של חלקיקים הפאג זיהומיות ניתן לאתר כמו הפלאק בצלחת אגר (7 א איור). Phages לא יכול לשכפל מחוץ לתאים מארחים חיידקים שלהם, לכן הריבויגילוי ד דורש phages ערבוב תאים מארחים יחד לפני ציפוי. על הליך אגר רך כיסוי, נפח קטן, בדרך כלל בטווח של μl 50 עד 200 μl, ההשעיה הפאג הוא חילק לתוך צינור המכיל כ 10 8 חיידקים (תאים המארח) אשר מפוזרים באופן שווה 2.5-3.0 מ"ל של רך (0.5-0.7% [w / v]), אגר מזין מומסת. התערובת וכתוצאה מכך הוא שפך על פני (% 1.5-1.9 [w / v]) קשה צלחת אגר מזין. הצלחת הוא התנדנד מספיק על מנת להבטיח כי אגר רך מכסה את כל פני השטח של אגר קשה. אז הצלחת מונחת על משטח ישר עד השכבה העליונה אגר הספיקה לגבש ולאחר מכן ניתן למקם בחממה.
עם הזמן, ההשעיה של תאים חיידקיים מעונן, המכונה הדשא, הופך להיות גלוי בכל מדיום אגר רך (איור 7 ב). לוחות אם יוצרים הפאג מדביק אחד התאים חיידקים, משכפל בתוך התא הדואר, אז lyses התא לשחרר כמה שרק 100 phages צאצאי (aka, גודל פרץ). החלקיקים הפאג חדשים לפזר את אגר רך, מדביק חיידקים באזור המקיף את תא החיידק lysed. לאחר מחזורים רבים של זיהום תמוגה, ההשעיה מעונן תא החיידק על אגר רך נעלם, והשאיר שטח של ניקוי המכונה פלאק. השלט מכיל יותר מ -10 חלקיקים 9 הפאג, כולם זהים מבחינה גנטית החלקיקים הפאג המקורי זיהומיות. בגלל השלט נובעת החלקיקים הפאג אחת, וכתוצאה מכך מספר יחידות פלאק להרכיב (pfu) ניתן לספור ואת הריכוז המקורי, או titer, ההשעיה הפאג יכול להיות מחושב. סוג זה של הניסוי, המכונה assay פלאק, גם מספק למדענים אמצעים טופל כדי להפיק צעד אחד עקומות גדילה, לחקור מגוון הספציפיות המארח, וכן transduce תאים חיידקיים לניסויים גנטיים.
- הכינו את החיידקים מחוון: תרבות אקספוננציאלית גדל והולך של זן חיידקי המארח צריך להיות מוכנים להתנסות אגר רך כיסוי. המארחת לכל אחד יש דרישות משלו הצמיחה. בין ml 0.3 ו 0.5 מ"ל של תרחיף של חיידקים מחוון נדרש כל צלחת. אם בקבוק של חיידקים מחוון מוכן (למשל, 25 מ"ל), תרבות צריכה להיות מחולק aliquots קטנים יותר (למשל, 5 מ"ל aliquots חילק לתוך הברגה כתרים צינורות סטריליים) כדי לצמצם אפשרות של זיהום צולב. צינורות עשויים להיות כל הזמן על הקרח (ב 4 ° C) עד מוכן לשימוש בניסוי. השתמש בטכניקה אספטי לחסן מרק מזין סטרילי ואז דגירה על פי מפרט של זן חיידקי. תרבויות שאריות אמור להיות מושלך בסוף היום.
- הכינו צינורות ספיחה: מניחים שני צינורות microcentrifuge סטריליים במעמד. לתייג את המכסה של "הפאג" 1 הצינור למכסה של "שליטה" צינור 2.
- טיפוסידילולים ly סדרתי של lysates הפאג ערוכים מצופה ובמקרה צינורות microcentrifuge נוספים יתווספו המדף ומסומן עם גורמי דילול.
- מניות הפאג צריך להיעשות טרי הפלאק בודדות ומאוחסן על 4 ° C. כדי disaggregate חלקיקים phage, המניות יש לחמם עד טמפרטורת הסביבה לפני ביצוע הניסוי.
- מניות הפאג יש לטפל בעדינות - לא מערבולת או pipet במרץ.
- הוסף 50 μl של מדגם הפאג שלך צינור 1 ולאחר מכן להוסיף 50 μl של חיץ הפאג אל הצינור 2, אשר יהווה שליטה שלילי assay פלאק.
- השתמש בטכניקה אספטי לאורך כל המניפולציות של הפאג וחיידקים.
- לאחר מכן להוסיף 500 μl של חיידקים מחוון צינור כל ספיחה.
- תאים חיידקיים יישב אל החלק התחתון של הצינור אם יושב על הקרח או את הספסל לתקופות זמן ארוכות. אם התרבות לא לערבבאד לפני הסרת aliquot לניסוי, לא מספיק תאים חיידקיים יועבר צינור ספיחה. חייב להיות בכמות מספקת של מושבות חיידקים נוצרו אגר רך (כלומר, הדשא) כדי לאתר את הפלאק. במיקסר מערבולת בעדינות מחדש להשעות את החיידקים לתוך מחוון ההשעיה הומוגנית לפני העברת aliquots את צינורות ספיחה.
- מערבבים את התאים חיידקים הפאג ידי מצליף בעדינות את המבחנות.
- דגירה הפאג / תערובת חיידקים למשך 15-20 דקות (לא יותר מ -30 דקות) בטמפרטורה המתאימה זן מחוון.
- להכין אגר רך מאוזנת של מזון צלחות אגר קשה: בעוד ספיחה מתרחש, במקום שני צינורות אגר רך (נמס בעבר ומאוחסנים על 55 מעלות צלזיוס) בבלוק חימום על הספסל המעבדה שלך נקבע על 46-48 ° C.
- אגר רך נמס חייב להיות equilibrated לטמפרטורה של גוש חימום במשך 10-15 דקות. אם רך נמסאגר יושב יותר מ -15 דקות, הוא יתחיל לגבש וייצרו גושים כאשר שפכו על אגר קשה. אם אגר רך נמס יושב פחות מ -10 דקות, יהיה חם מדי כאשר הוסיף הפאג / תערובת חיידקים, להרוג תאים מארחים לפני ציפוי. כתוצאה מכך, הדשא לא יכול להיווצר משקעים מעטים, אם בכלל, עשוי להתגלות.
- הכן נוספים צינורות אגר רך אם ציפוי דילולים סדרתי של lysate הפאג.
- תווית סביב קצה התחתון (לא מכסה) של 2 מזין צלחת צלחות אגר קשה עם שם לפחות שלך, תאריך, סוג של מדיום הגידול, ו "הפאג" או "שליטה" המתאים צינורות ספיחה.
- כלול צלחות נוספות שכותרתו עם גורם לדילול אם ציפוי דילולים סדרתיים.
- צלחות אגר קשיחים חייב להיות יבש לחלוטין ללא עיבוי על מכסה מראש מחומם לטמפרטורת החדר לפני הוספת אגר רך. אם את הצלחות מאוחסנים 4 ° C, להסיר אותם כמה שעות או אפילו דהלפני y. מורחים אותם החוצה, ערימות קטנות מעד של לא יותר מ 2-3 הצלחות ולאפשר להם להתייבש. לחות יתר בשכבת אגר קשה יגרום לדילול של אגר רך, המאפשר הפאג לנטרל בקלות רבה יותר באמצעות אגר רך במהלך היווצרות הפלאק. כתוצאה מכך, גודל השלט יגדל.
- הצלחת ספיחה צינורות אחד בכל פעם, באופן הבא: השתמש micropipettor P1000 בסביבה נקייה מחיידקים, כדי להעביר את הפאג / חיידקים התערובת (צריך להיות כ 550 μl) לצינור אגר רך ואז לסובב אותו במהירות בין כפות הידיים כדי לערבב את התוכן. אל תנענעי את הצינור כך בועות אוויר מוצגים. מחזיק את הצינור ביד שמאל, פתח את מכסה צלחת אגר קשה עם יד ימין ומיד שופכים את כל התוכן של הצינור על פני השטח של צלחת אגר קשה. לפני סגירת המכסה, לטלטל את הצלחת בעדינות אך במהירות כדי להפיץ את אגר רך נמס על פני כל השטח של צלחתלפני זה יש זמן לחזק. הימנע מתיז אגר רך נמס על דפנות צלחת פטרי. סגור את המכסה.
- חזור על שלב # 9 לכל צינורות ספיחה, 1 הצינור בכל פעם.
- מניחים את הצלחות על משטח ישר, ולאפשר להם לעמוד באין מפריע עד אגר רך הוא התגבש.
- בדרך כלל 30 דקות מספיקה.
- הפוך את צלחות עבור הדגירה.
- הצלחות מרובות ניתן מוערמים יחד בנייר דבק ואז הפוך על הדגירה.
לאחר הדגירה, לוחות עשויים להיבדק על הפלאק. הביקורת השלילית צריך רק הדשא של חיידקים (אין חורים המעידים על הפלאק). לוחות להשתנות מבחינת המראה, הגודל, הצורה הכוללת. סוג הפאג נתון יכול להיות מבודד תערובת הטרוגנית של הפלאק על ידי בקפידה חבטות מרכז רובד 1 עם קיסם סטרילי להעביר את הבידוד כדי לא microcentrifuge סטריליתUbe המכיל 100-1000 μl של מרק או בולם הפאג. Lysate זה יכול להיות מצופה באותו אופן שתואר לעיל. לפחות 3 עד 6 רצופות יחיד פלאק isolations נחוצים על מנת להבטיח כי הפאג טהור התקבל. לעתים קרובות lysate חייב להיות מדולל על פני טווח גדול (10 -1 עד 10 -10) כדי למצוא titer שמייצר שאינן חופפות הפלאק על צלחת. המספר משתנה בהתאם לגודל השלט.
6. העתק נוהל צלחת: העברה של תאים מוטציות ההקרנה Auxotrophs
טכניקה זו מאפשרת השוואה של צמיחת תאים על צלחת העיקרי לוחות משניים, יצירת אמצעי תאים עבור מסך פנוטיפ לבחירה. הראשון העיקרי, או הורים, צלחת הוא מחוסן עם תאים או על ידי התפשטות, ציפוי דילול שמייצר מושבות בודדות או בהעברתם צלחת בתבנית מרחבית כפי שנקבע ע"י סימון הרשת. לוחות משניים המכילים התקשורת עם הצמיחה inhibitors או מדיה חסר תזונתי מסוים הם מחוסן עם תאים מן המושבות על הצלחת העיקרית. דפוס מרחבי של מושבות משוחזרת 1 על ידי לחיצה על פיסת קטיפה לצלחת הראשי. תאים חיידקיים לדבוק קטיפה כי יש להם זיקה גדולה יותר קטיפה מאשר אגר. הטבעה של תאים על קטיפה ואז מועבר צלחות משניים מרובים עם צמיחת תאים המשקף את דפוס המושבה זהה לזו של צלחת הראשי. במילים אחרות, זה כמו שיש חותמת גומי, שכפול דפוס הצמיחה מהצלחת אחד למשנהו. טכניקה זו יש יתרון משום שהוא מאפשר מספר רב יחסית של מושבות שיוקרנו בו זמנית עבור פנוטיפים רבים בניסוי אחד.
- הכינו צלחת העיקרית: תווית סביב קצה התחתון (לא מכסה) צלחת אגר עם שם לפחות שלך, תאריך, סוג של מדיום הגידול.
- סמן את הרשת בתחתית הצלחת עםלפחות שני קווים אנכיים במרווחים באותה מידה לפחות שני קווים אופקיים במרווחים לא פחות. מספר הריבועים שהתקבל.
- השתמש קיסם מראש לעקר ולחסן את כל ריבוע עם מדגם התא. עבור מדגם זה, DAB במרכז הכיכר. אין לכסות את הכיכר כולה עם תאים (איור 8) או אחר המדגם יהיה לגדול יותר כאשר מודגרות ולזהם ריבועים מסביב.
- כל ריבוע יהיה מחוסן עם מדגם אחר, נגזרת גם מתרבויות מרק או מושבות בצלחת אחרת.
- הפוך ואת דגירה הצלחת העיקרית, אשר ישמש מחסן התקשורת משניים שונים.
- לחסן צלחות משניים: מחסנית צלחת העיקרי וכל לוחות משניים. עם טוש, את סימן הכיוון בצד של הצלחות. ודא הסימן בצד התחתון של כל צלחת, לא את המכסה.
- להשיג בד קטיפה סטרילית ומניחים אותו על בלוק גלילי (Figure 9). נעל בד קטיפה במקום עם בעל. הערה סימן אוריינטציה בשכונה.
- הבלוק צריך להיות באותו גודל כמו התחתון של צלחת פטרי (בקוטר 10.2 ס"מ). זה צריך לבוא עם טבעת נעילה כי מהדק בד קטיפה לבלוק תוך ציפוי העתק.
- בד קטיפה (15.2 x 15.2 ס"מ מרובע) יש מראש לעקר. מחסנית 10 או 12 ריבועים נקיים ואז עוטפים בנייר אלומיניום ומניחים אותם החיטוי ב 121 ° C על מחזור יבש (הגדרת כוח המשיכה) במשך 30 דקות. לפני השימוש בהם בניסוי ציפוי העתק, לוודא שהם יבשים לחלוטין על ידי הצבת אותם בתנור חם למשך מספר שעות. שים לב ריבועים קטיפה ייתכן שיהיה צורך דה linted בנייר דבק לפני עיקור.
- ריבועים קטיפה ניתן להשתמש בהן שוב ושוב. לאחר ריבועים קטיפה בשימוש כבר חיטוי ב החיטוי, יש לשטוף במים רגיל מחדש עיקור כמתואר לעיל.
- הגוש הגליליK ו מלחציים יש לחטא בין השימושים עם שטיפה קצרה ב 70% (V / V) אתנול או כלור אקונומיקה 10%.
- להסיר את המכסה, להפוך את הצלחת העיקרית. בשורה סימן אוריינטציה על הצלחת עם סימן בשכונה. מנמיכים את הצלחת כך את פני השטח של אגר נמצא בקשר עם בד קטיפה ברחוב גלילי. קל אבל שווה ללחוץ עם קצות האצבעות שלך על הגב של הצלחת העיקרית ולאחר מכן מרימים בזהירות את הצלחת העיקרית מן הרחוב. החלף את המכסה על הצלחת.
- הרושם קטיפה של תאים מן הצלחת העיקרית ניתן לחסן כ 7-8 צלחות משניים לפני הופעה עם צרכים קטיפה חדשים להתבצע.
- חזור על שלב # 7 עם כל אחד משני לוחות.
- כביקורת חיובית, הצלחת האחרון בסדרה אמור להיות בינוני אגר שבו כל הזנים שנבדקו צריך לגדול. בדרך זו אתה יכול לאשר כי התאים הועברו כל PL משניאטס בסדרה. אחרת, חוסר צמיחה בינוני על מבחן מיוחד ניתן לייחס העברה לתא מספיק במקום הפנוטיפ של זן.
- כדי למנוע תוצאות חיוביות שגויות, הצלחות משניות יש לפחות הורה מן המצע הנוח ביותר. שאם לא כן, חומרים מזינים יכול להיות מועברים בין צלחות המאפשר לתאים לגדול על מצע שלילי.
- הפוך את צלחות דגירה.
- הערה: כאשר בודקים את הצלחות משנה של צמיחה, יש להקפיד להבחין בין צמיחה חותם. זו האחרונה היא תוצאה שלילית.
7. לנקות את שטח העבודה
- כבה את מבער בונזן ואז לשים את כל האספקה כולל תרבויות על לוחות או צינורות, מדיה נוספת, ריאגנטים אחרים.
- אל תאפשר תרבויות ישנים, בין אם על לוחות או צינורות, לצבור על ספסל במעבדה או במקומות אחסון. דגימות אלה, שהם מקורות ידועים לשמצה של זיהוםכגון תבניות ומינים חיידקים לא רצויים, אמור להיות מושלך ברגע שהם כבר לא צריך.
- המקום מזוהם labware (כפפות, טיפים פיפטה, kimwipes), זכוכית (צינורות, צלוחיות, בקבוקים), ופסולת מסוכנת (תרבויות חיידקים או פתרונות הפאג, צלחות בשימוש) לתוך כלי קיבול לסילוק נאות. כאשר עובדים עם לא פתוגניים א ' זן coli (BSL-1), רק ללא מדבקת פסולת מסוכנת נוצרת. בעת ביצוע הליכים אלה אותם עם אורגניזמים פתוגניים (BSL-2 ומעלה), פסולת מסוכנת מדבקת נוצר. ללא קשר לסיווג Biohazard, פסולת מסוכנת יש autoclaved או לחטא לפני שהיא נמחקת. פעל לפי ההנחיות המתוארות בסעיף BMBL (5 th ed.), כמו גם אלו המתפרסמים בריאות הסביבה המוסדית ואת מחלקת בטיחות לסילוק מיידי התקין של biohazards שנוצר במהלך הניסוי.
- נקו את אזור העבודה עם חומר חיטוי.
- לרחוץ ידייםביסודיות עם סבון חיטוי מים חמים לפני שעזב את המעבדה.
8. נציג תוצאות
רצף, צלחת טכניקה. יישום לדוגמה עבור ציפוי פס מוצג באיור 1. הליך זה משמש לבידוד מושבות חיידקים מ בתרביות תאים מעורבות הוא ללא ספק אחת הטכניקות החשובות ביותר על שני במיקרוביולוגיה וגנטיקה מולקולרית. כל מושבה מייצגת אוכלוסייה של תאים זהים גנטית. עבור יישומים רבים במורד הזרם קיים הכרח להתחיל עם המושבה בודד או התרבות חיידקים טהור שנוצר על ידי התקשורת יחסנו עם תאים של המושבה אחת. למשל, מורפולוגיה של תאים בודדים בתוך המושבה יכול להיבדק באמצעות מיקרוסקופ אור. זהות גנטית ניתן להקצות על ידי רצף למקטע קטן ריבוזומלי הגן RNA מ-DNA גנומי מבודד התרבות התא התחיל עם מושבת אחד.מאפיינים מטבוליים יכול להיות מתואר על ידי חשיפת תאים מבחני ביוכימיים ופיזיולוגיים שונים. רק על ידי ביצוע ניסויים כאלה עם תרבויות טהור 1 יכול להיות בטוח של תכונות המיוחסות מיקרואורגניזם מסוים. התוצאות לא מוסתר על ידי האפשרות תרבות מזוהם. טעויות טכניות עלולה להתרחש אם עקרות של המכשיר המשמש פס התאים על פני הצלחת לא נשמר לאורך כל ההליך. שוכח להבה לולאה או לאחזר קיסם טרי בין הרביעים להקשות לקבל מושבות בודדות. מינים מסוימים של חיידקים לא יכולים להיות מבודדים בתרבות טהור כפי שהם תלויים כאגודה שיתופית עם עוד מינים של חיידקים דרישות צמיחה מסוימים. המכונה syntrophs, יצורים אלה עשויים להיות רק גדל תחת שיתוף תרבות תנאים, כך המושבות (אם נוצרו) תמיד תהיה מורכבת של שניים או יותר מינים. אתגר נוסף נתקל במעבדה בעת ביצועפס, הצלחת ההליך עם חיידקים שמקורם דגימות סביבתיות היא כי תאים מציגים מאפיינים צמיחה החורגים מן זני מעבדה מסורתיים כמו א ' coli. זני חיידקים אלה עשויים לייצר מושבות שהן פילמנטיות (בניגוד אשכולות צפופים של תאים) עם סניפים הפרושים על פני חלק גדול של צלחת אגר, מסויד ו עקשן ולכן החדירה של מכשיר פס, צלחת, או מוקף קפסולה דביק כך מושבות בודדים לא ניתן להבחין. מאפיינים אלה מקשים על לטהר מושבות יחיד בטכניקת פס, הצלחת.
פור, צלחת טכניקה. בעזרת טכניקה פור, צלחת, המושבות ליצור בתוך אגר, כמו גם על פני השטח של המדיום אגר ובכך לספק אמצעי נוח לספור את מספר התאים קיימא במדגם. הליך זה נעשה שימוש במגוון רחב של יישומים תעשייתיים. לדוגמא, זה קריטי עבור Tre שפכיםהמפעל atment, האחראית על ניקוי פסולת נוזלית (כגון ביוב, נגר מן הסערה מנקז) שנוצר על ידי מאפיינים מקומיים, מסחר, תעשייה, כמו גם שיטות חקלאיות, לנתח דגימות מים לאחר תהליך טיהור נרחב. מי קולחים (שאינם ראויים לשתייה ומים) הוא שימוש חוזר במגוון דרכים - להשקיה של גידולים שאינם מזון בחקלאות, על שטיפה סניטריים מגורים, וכן מגדלי קירור תעשייתיות - כך הוא חייב להיות ללא כימיים זיהום מיקרוביאלי. שתיית מים (מים מתוקים) חייבים להיות מטוהרים לפי תקני EPA ו נבדק בשיטות ציפוי מיקרוביולוגיות המאפשרים ספירה של פתוגנים אנושיים ספציפיים. שמוצג באיור 10 הן מושבות חיידקים כתוצאה מתאי חיידקים בדגימת מים שנאספו מהקולר הציבור. זה חיידקים פתוגנים סביר המיוצרים מושבות אלה ניתן באמצעים טיהור למים מתוקים, עם זאת, החיידקים הם כלהיכן זיהום ואפילו פתוגניים שאינם זנים ניתן למזער בלבד, לא בוטלו לחלוטין. כדוגמה נוספת, חברת התרופות צריך להעריך את מידת זיהום מיקרוביאלי, או bioburden, של תרופה חדשה במהלך האחסון הייצור, ההובלה. באמצעות דגימת את התרופה במהלך שלבים שונים של התהליך דגימות ציפוי באמצעות ההליך פור, צלחת, עומס חיידקים, או מספר של חיידקים מזהמים, ניתן לקבוע בקלות. אמצעי זהירות לאחר מכן ניתן המציאו כדי לצמצם או למנוע זיהום מיקרוביאלי. אחת השגיאות הנפוצות ביותר טכניים המתרחשת בעת ביצוע הטכניקה פור, צלחת אינו מספיק ערבוב של המדגם עם המושבות אגר נמס גרימת גוש ביחד ובכך ספירת צלחת מדויק. עוד טעות נפוצה היא לשפוך אגר נמס כאשר הוא חם מדי, הרג רבים של תאים חיידקיים במדגם. טעות זה גם ישפיע על דיוק ספירת צלחת לתת מספרים כי מתחת מייצגים הדואר המספר הכולל של יחידות המושבה יוצרים במדגם.
מורחים-צלחת טכניקה. טכניקה להפיץ צלחת מקביל להליך פור, צלחת של השירות שלה כאמצעי לביצוע עבירות צלחת קיימא. עם זאת, כי המושבות היוצרים באמצעות טכניקה להפיץ צלחת מחולקים באופן שווה על פני השטח של המדיום אגר, תאים מן המושבות בודדים ניתן לבודד בשימוש המניפולציה הבאים (למשל, כאשר הבידוד על צלחת פס או מרק התרבות). שלושה יישומים נפוצים בו את הטכניקה להפיץ צלחת היא מרכיב חשוב הן ניסויים, העשרה הבחירה והמיון. בכל שלושת היישומים, סוג התא הרצוי ניתן להפריד את התערובת נתון מאוחר יותר לכל מספר, בדיקות ביוכימיות פיזיולוגיים, או גנטי.
ניסוי ההעשרה כוללת ציפוי תרבות מעורבת על בינוני או דוגרים צלחות בדוארתנאי nvironmental המטפח צמיחה של מיקרואורגניזמים אלה בתוך המדגם הממחישים את המאפיינים הרצויים מטבוליות, מאפייני הגידול, או התנהגויות. אסטרטגיה זו לא לעכב את הצמיחה של אורגניזמים אחרים, אבל התוצאות לעלייה במספר מיקרואורגניזמים הרצוי יחסית לאחרים בתרבות. לכן, המושבות היוצרים על הצלחת העשרת צפוי להציג תכונות פנוטיפי המשקפים את הגנוטיפ הרצוי. למשל, אם המטרה שלך היא לטפח חנקן הקיבוע חיידקים ממדגם סביבתי המכיל תערובת של יותר מ -1000 מינים שונים של חיידקים, ואז ציפוי מדגם על מצע חנקן חסר יעשיר עבור אותם חיידקים שיכולים לייצר תרכובת זו מ האווירה באמצעות יכולות מטבוליות הניתנים על ידי חבילה של הגנים הנדרשים לתיקון חנקן.
הניסוי כולל מבחר ציפוי תרבות מעורבת על המדיום הזה מאפשר רק תאים אלה, כי קוןTain גן מסוים או קבוצה של גנים לגדול. סוג זה של הניסוי הוא נפוץ במעבדות לביולוגיה מולקולרית כאשר להפוך זני חיידקים עם פלסמידים המכילים אנטיביוטיקה ההתנגדות גנים. אם המטרה שלך היא לטפח רק תאים רקומביננטי, או אלה בהצלחה לקח את הפלסמיד, ולאחר מכן ציפוי מדגם על בינוני כי כבר השלימו עם ריכוז מתאים של אנטיביוטיקה יבחר עבור אותם תאים התערוכה עמידות לתרופה מסוימת זו.
הניסוי כולל הקרנת ציפוי תרבות מעורבת על המדיום המאפשר את כל התאים קיימא לגדול, עם זאת, תאים עם גנוטיפ הרצוי ניתן להבדיל בין תאים אחרים המבוססים על הפנוטיפ שלהם. שוב, זה סוג ניסוי משותף מעבדות ביולוגיה מולקולרית בעת ביצוע מבחני mutagenesis או גנים שיבוט לתוך פלסמידים. הדוגמה הקלאסית, כפי שמוצג באיור 11, עושה שימוש בגן lacZ encoדינג β-galactosidase, אנזים זה מאפשר לתאים כדי לעכל X-Gal (5-bromo-4-כלורו-3-indolyl-β-D-galactopyranoside), אנלוגי המצע המצע הטבעי, לקטוז. המחשוף של X-גל של β-galactosidase תוצאות במוצר כחול מסיס. לכן, אם בינוני מכיל X-gal, ו מדגם המכיל תאים עם הגן או lacZ wild-type (תפקודית) או מוטציה (לא פעיל) הם מצופה על המדיום הזה, אז אחרי wild-type דגירה תאים מחסה lacZ תפקודית הגן יופיע פיגמנט כחול מושבות ואילו תאים מוטנטים עם הגן lacZ שאינם פונקציונליים יופיעו חסרות צבע ("לבן") המושבות.
בעיה טכנית נתקל לרוב כאשר 1 ללמוד כיצד לבצע את טכניקת להפיץ הצלחת אינה אחידה התפשטות של תאים על פני השטח אגר. בעת שימוש פטיפון ואת מוט זכוכית, מדגם עשוי להיקלט מהר מדי כך במושבות הצורה היחידה סמוך למרכז הצלחת. Wחן עושה את "שיטת קופקבנה", חרוזי הזכוכית הם הסתחררו במקום מזועזע על פני אגר. כתוצאה מכך, מושבות רבות לצמוח לאורך השפה החיצונית של הצלחת. בשני המקרים ההפצה כתוצאה של המושבות לא לנצל את שטח הפנים המלא זמין כל כך התאים רשאי גוש ביחד ולגדול לתוך מושבות חופפים עושה ספירת צלחת מדויק או הפרדה של סוגי תאים אינו עומד על הפרק.
אגר רך כיסוי טכניקה. הליך דומה הטכניקה להפיץ הצלחת פעם לספור מושבות חיידקים ניתן להשתמש כדי לספור את מספר הפאג. ואילו בין 30 ל 300 תאים חיידקיים מפוזרים על פני אגר על ספירת צלחת (CFU / ml), בין 100 ל 400 חלקיקים הפאג זיהומיות מעורבבים עם 10 8 עד 10 9 תאים המארח עבור ספירת פלאק (pfu / מ"ל) בתוך שכבת של אגר רך פרוש על פני השטח של אגר מזין קשה. אלא אם כן הוכיח אחרת, ההנחה היא בדרך כלל לאתא חיידקי כובע אחד מתחלק מצטבר של מספר גדול של תאים זהים גנטית באשכול אחד בשם המושבה. כפי שנאמר קודם לכן, הנחה זו אינה תקפה כאשר תאים גדלים בקבוצות (כלומר, זוגות, tetrads, שרשראות, או אשכולות) או להציג מאפייני צמיחה כגון כמוסות המעכבים היווצרות מושבה אחת. הנחה דומה נעשה על היווצרות הפלאק, בכך פלאק מייצג הפעילות של הפאג אחד. משפט זה נכון רק אם הפאג 1 מדביק חיידק. מה קורה אם מספר החלקיקים הפאג להדביק בחיידק בודד? בעיה זו קשורה פרמטר סטטיסטי חשוב, כי יש לקחת בחשבון בעת ביצוע ניסויים עם הפאג - ריבוי של זיהום (משרד הפנים) - מתאר את היחס בין החלקיקים הפאג זיהומיות למספר תאים מארחים במדגם. כי חלק לספוג התאים יותר הפאג בעוד תאים אחרים הפאג לספוג אחד בלבד, אם בכלל, אוכלוסייה של תאים המארח צריך להיות נגוע בשפל משרד הפנים (≤ 1) לאהו למזער את ההסתברות של תא יידבק על ידי יותר מ 1 החלקיקים הפאג. העסקת יחידת השלט יוצרים (pfu) כהגדרה תפקודית ימנע סיבוכים אלה בעת ביצוע ספירת פלאק לחשב titer מלאי הפאג.
כפי שניתן לראות בתרשים 12, מורפולוגיה רובד משתנה של הפאג שונה. הפאג יש ליצור לוחות קטנים (פאנל) בעוד אחרים להצמיח שלטים גדולים (לוח ב '). מספר משתנים משפיעים על גודל שלט. ישנן סיבות טכניות התורמים השונות הזאת. למשל, התקשורת שלם ושירותים עבה קשה אגר הפיתוח של לוחות גדולים יותר, כי התאים המארחים יכולים לשמר את הצמיחה הפאג לתקופה ארוכה יותר של זמן. ציפוי צפיפות גבוהה של תאים המארח (> 10 9 CFU לכל צלחת) יגרום לירידה בגודל השלט. שימוש בריכוזים נמוכים יותר של אגר רך יגדיל את קצב התפשטות החלקיקים הפאג של אגר רך ועל ידי כך להגדיל את הפלאק. כזכור הבקצב הזה דיפוזיה מוגברת עלולה להתרחש בשוגג אם צלחות אגר קשים לא לגמרי יבש כך עיבוי הלחות או עודף מנה מדלל את אגר רך כיסוי. זה פיקוח טכני יפיק תוצאות לא עקביות ביחס לגודל השלט של הפאג מסוים.
גודל השלט גם קשורה במספר אירועים התא המארח כולל היעילות של ספיחה, משך התקופה סמויה (טווח זמן של הפאג ספיחה כדי תמוגה של התא המארח), ואת גודל פרץ (מספר הצאצאים שפורסמו על ידי זיהום אחד). תערובת הטרוגנית של גדלים פלאק אפשר לראות אם חלקיקים הפאג להדביק תאים מארחים בשלבים שונים של התפתחות חיידקים. למשל, אלה לספוג בשלב מוקדם מעריכי את לוחות גדולים יותר עם הפאג צאצאים יותר מאלו לספוג בשלב מאוחר מעריכי. ככלל, הפאג ממס לייצר שלטים ברורים תוך lysogenic טופס הפלאק הפאג, העכורים. הוwever, חלק הפאג ממס לייצר דפוסים מעניינים כמו השלט "בול פגיעה" שמוצג באיור -12 ב. השלטים האלה ברורים מוקפים הילה עכור בגלל אותם תאים בקצה של השלט לא lysed באופן מלא או עשויים להיות עמידים הפאג זיהום. "עין השור" דפוס ציין עם הפאג ממוזג הוא שלט עם מרכז עכור מוקף בטבעת ברור. מורפולוגיה זה משקף את משרד הפנים ואת הפיזיולוגיה של התא המארח לגבי ההחלטה תמוגה-lysogeny. כאשר תאים נגועים 1 עם הפאג, משרד הפנים הוא נמוך תאים לצמוח במהירות בשל החומרים המזינים נמצאים בשפע: יחד זה מאפשר צמיחה ממס. ככל שהתאים יותר ויותר lysed, משרד הפנים עולה וכמה צורות פלאק ברורים. Lysogens במרכז השלט, לעומת זאת, ממשיכים לגדול, כי הם חסינים מפני תמוגה והוליד שלט ברור עם מרכז עכור.
הטכניקה כיסוי יכול להיות שונה עבור מבחני שלט עם וירוסים האיקריוטים. בתוךbacteriophage אותם דרך טופס הפלאק על הדשא של תאים חיידקיים של אגר רך, וירוסים האיקריוטים ליצירת פלאק על monolayer של תאים מכוסים על ידי ג 'ל. Monolayer הוא גיליון confluent של התאים הגדלים זה לצד זה על פני השטח של צלחת תרבות, נוגעים זה בזה אך לא גדל על גבי זה. כדי לבצע סוג זה של assay פלאק, aliquots של הנגיף מתווספים monolayers רגישים של התאים האיקריוטים. אז monolayer מכוסה בינוני agarose מבוסס חומר מזין - ג'ל זה מגביל את התפשטות וירוסים צאצאי שפורסמו מתוך תאים נגועים כדי תאים סמוכים בשכבה. בהתאם לכך, שטח כדור, או שלט, מיוצר המכילה תאים שנפגעו שחרור virions. כדי לסייע ויזואליזציה של לוחות צבעים, כי תאים חיים הכתם ניתן להחיל התרבות התא מתן הניגוד בין תאים נגועים נגוע.
טכניקה רכה אגר כיסוי משמש ניסויים אחרים מאשר מבחני פלאק. ראשית, הוא שלignificant לזכור כי אגר מזין הקשיח הוא מטריקס תמיכה המאפשרת צמיחה של חיידקים. שנית, אגר רך המשמש כיסוי יכול להיות בעל הרכב תזונתי שונה מאשר אגר קשה. בדרך זו אגר רך יכול לשמש כאמצעי זני חיידקים assay עבור מאפייני צמיחה שונים או מאפיינים מטבוליים. למשל, הטכניקה כיסוי משמש חיידקים מסך על היכולת להשפיל תאית (Teather ועץ 1982). מושבות יחיד גדלים על מצע שאינו סלקטיבי אגר קשה ואז רך אגר המכיל 0.1% (W / V) carboxymethyl תאית (CMC) משתרע על פני השטח של אגר קשה. לאחר הדגירה, הצלחות מוצפים כתם המאפשר הדמיה של אזורי סליקה סביב מושבות אגר רך. ניקוי נגרמת על ידי אנזימים hydrolytic המופרשים על ידי חיידקים מפרקים תאית במדיום. לאחרונה, טכניקה כיסוי נעשה שימוש כדי לזהות חיידקים לעכב את הצמיחה של methanogeחיידקים קדומים NIC למצוא כרס פנימית של בעלי חיים (Gilbert et al. 2010). מבודד חיידקים דגימות סביבתיות גדלים על תזונה בינונית קשה אגר אז מושבות הם overlayed עם רך אגר המכיל תרבות של methanogens. לאחר הדגירה, הצלחות נבדקות על אזורי עיכוב הצמיחה סביב המושבות. שיטה זו מזהה זני חיידקים המייצרים מעכבי של methanogens של אגר רך.
השגיאות הטכניות הנפוצות ביותר המתרחשות עם טכניקה רכה אגר אגר כיסוי נשפכים רכה מומסת או כאשר הוא חם מדי או קר מדי. אם זה חם מדי, בתאי חיידקים מעורב בינוני ייהרגו לפני ציפוי. אם זה מגניב מדי, אגר רך יהוו גושים כאשר שפכו על אגר קשה. בכל מקרה, התוצאות יהיו מעורפלים או בלתי קריא, במקרה הטוב.
Replica, צלחת סדר. העברת תרבויות מסוג אחד של חומר מזין בינונילאחר לבדוק דרישות הצמיחה הופך מייגע למדי אם יש יותר מאשר רק מספר זנים בודדים. ציפוי Replica היא שיטה המאפשרת הקרנה בו זמנית של מספר רב של מיקרואורגניזמים. למשל, לאחר mutagenizing תרבות של בר מסוג תאים, ניתן להפיץ-צלחת דילולים של התרבות להשיג צלחות עם מושבות בודדות. הצלחות עיקריות מכילים בינוני התומכת בצמיחה של כל התאים, כולל wild-type prototrophs, אשר לסנתז תרכובות כל הדרושים לצמיחה, auxotrophs מוטציה, אשר נושאים מוטציה גנטית במסלול ביוסינתטי עיבוד מהם מסוגל לסנתז תרכובות מסוימות חיוניים לצמיחה. על ידי ציפוי תערובת של תאים על גבי בינוני מלא, חומרי המזון החסרים ניתן לקחת את מהסביבה. כדי להבחין בין prototrophs ו auxotrophs, המושבות ניתן לשכפל על מדיום מינימלי. רק prototrophs יוכלו לגדול. כי הדפוס המרחבי של צלחת העיקרי נשמר, comparisעל הצלחת משני עם צלחת העיקרי מאפשר זיהוי של מושבות מוטציה. כדי לקבוע איזו תרכובת מוטנטים הם כבר לא מסוגל לסנתז, המושבות ניתן לשכפל על התקשורת מינימלי השלימו עם תרכובות מסוימות (למשל, חומצות אמינו, מקורות פחמן, ויטמינים וכו '). בדרך זו, מאות מושבות יכול להיות מוקרן בו זמנית באמצעות ההליך העתק-צלחת. אחת טעות טכנית שעלולה להתרחש היא באמצעות צלחות אגר, כי הם רטוב מדי, מה שגרם מושבות למרוח יחד לזהם את כל התרבויות על הצלחת. זה מייצר תוצאות, כי הם לא אמין לחלוטין. עוד טעות טכנית היא הפעלת לחץ רב מדי בעת העברת תאים קטיפה ללוחות משניים. שוב, לאחר דוגרים לוחות משניים, המושבות כתוצאה עשויים לחפוף לייצר צמיחה פנוטיפים המיוחסים לזיהום ולא auxotrophy.
לא כל wild-type מינים של חיידקים הם prototrophs, אז העתק-Pהליך מאוחר ניתן להשתמש בו זמנית מסך שונות wild-type זנים של דרישות צמיחה האופייניים. כפי שמוצג באיור 13, "מורח" של תאים מארבעה זנים שונים חיידקי Pseudomonas היו מצופה בשני עותקים על הצלחת הרשת מסומן המכיל התקשורת מלאים קראו YTA (פאנל). זנים של אז היו משוכפלים על שלוש צלחות משני לוחות (B, C, ו-D) מורכב בינוני מינימלית (MSA) השלים עם מקור פחמן שונה (acetamide, לקטוז, והוא גליצין, בהתאמה). התוצאות מראות כי שניים Pseudomonas 4 זנים (aeruginosa פ ו פ stutzeri) אינם מסוגלים לגדול על שלושת מקורות פחמן. כמו פקד, זנים היו משוכפלים על צלחת רביעית עם המדיום YTA לאשר התאים הועברו במהלך ההליך. מאז בכל ארבעת הזנים גדלים על צלחת מלאה YTA, הליקויים הציג צמיחה על שלוש צלחות הקודמים בסדרה הם אמינים. העתק-ציפוי התוצאות נספר בטבלה 1. טעות אחת עשה בדרך כלל הוא לפרש חותם הצמיחה על צלחת משני כתוצאה חיובית. כך, למשל, השווה את הפנוטיפ של פ ' aeruginosa לזה של פ ' stutzeri על MSA + acetamide (לוח ב '). זו האחרונה מציגה חותם של צמיחה, שהיא תוצאה שלילית, והוא יכול להתרחש אם חומרים מזינים מן הצלחת הקודם מועברים עם התאים הוריות. צמיחת תאים חדשה לא מתרחשת בגלל חומרי המזון החסרים אינם זמינים לתאים צאצאים. קל לבלבל חותם עם הצמיחה בפועל. במקרה של ספק, הניסוי יש לחזור באמצעות שיטה חלופית כגון פס, ציפוי תאים מן הצלחת העיקרית על התקשורת משניים.
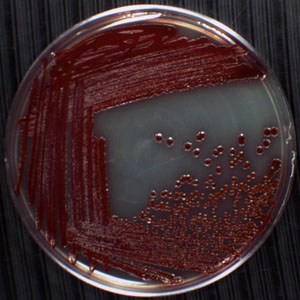
באיור 1. דוגמה מושבות בודדות על הצלחת. התחומים ורודים ליד במרכז הצלחת הן מושבות של Serratia marcescENS, גראם שלילי, בצורת מוט Proteobacterium ב Enterobacteriaceae המשפחה. בשל ההעדפה שלו עבור סביבות לחים, מיקרואורגניזם זה נפוץ גדל בפינות אמבטיות, כיורים כיור ב, ב לדיס אריח, ועל וילון מקלחת. ס marcescens קל לזהות מכיוון שהוא מייצר פיגמנט אדום בשם prodigiosin. המושבות על צלחת זו נוצרו באמצעות טכניקה פס, צלחת עם מושבות בודדות המופיעים הדגירה ברבע לאחר 4 ב 30 מעלות צלזיוס למשך 24 שעות. שאר שלושת הרביעים להראות צמיחה confluent שבו תאים שהופקדו על פני אגר התפתח במושבות חופפים.

מכשירים באיור 2. להשתמש בטכניקה פס, צלחת. מלמעלה למטה, הם הראו קיסמים (שטוח לא עגול), לולאה חוט, לולאה פלסטיק חד פעמיות, ומקלות עץ. קיסמים מועברים בדרך כללעל כוס זכוכית קטנה עם סיום רחב מכוסה בנייר כסף עד אז, כאשר autoclaved לעקר לפני השימוש. מקלות עץ מועברים ל -18 מבחנות מ"מ autoclaved מכן לחטא לפני השימוש.
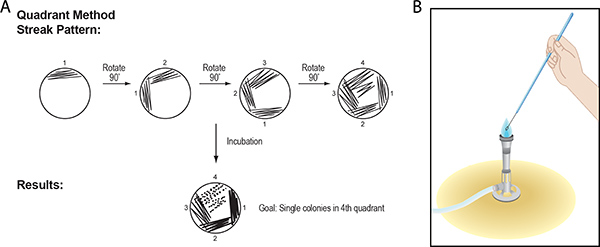
איור 3. () רצף, הצלחת הטכניקה בשיטת ברבע. לולאה מראש עיקור, מקל או קיסם משמש להפיץ את המדגם על פני רבע משטח אגר עם תנועה מהירה, חלקה האחורי-and-4, מן השפה אל מרכז הצלחת. פעולה זו חוזרת על כל אחד מארבעת הרביעים של הצלחת. לאחר הדגירה, צמיחת תאים מופיע בדרך של המכשיר בשימוש להפקיד את התאים על הצלחת. הפרדה מכנית של תאים במדגם מעורבת באמצעות טכניקה זו צריכה לגרום מושבות בודדות ברבע הרביעי (ראה איור 1, למשל). מושבות יחיד מכונים יחידות המושבה להרכיב (CFU). (ב) לולאת מתכת משמש ציפוי, פס, יש לעקר באמצעות להבת מבער בונזן לפני מגע עם הבידוד או בינוני אגר. נזכיר כי החלק החם ביותר של הלהבה הוא קצה הקונוס הכחול. מחזיק ידית של כלי, הצב את החוט באש על 3-4 ס"מ של הלולאה. תשאיר את זה מספיק זמן בשביל להיות חוט אדום חם. הזז את החוט כך הלהבה מתקרב הלולאה. הקפד לולאת מתכת הוא מקורר לפני שנוגעים הבידוד.

4. איור יוצקים-הצלחת השיטה. (א) בנפח קטן של המדגם (בין 0.1-1.0 מ"ל) היא לוותר בסביבה נקייה מחיידקים, עם שימוש מ"ל 5.0 סרולוגית פיפטה לתוך צלחת פטרי ריק אבל סטרילי. (ב) אגר מומסת equilibrated לטמפרטורה של כ 48 ° C הוא שפך אז עם מדגם לתוך צלחת פטרי. לאחר סגירת המכסה, צלחת הוא סובב בעדינות לערבב את המדגםנמס אגר. אגר מותר לחזק במשך כ 30 דקות ואז הם צלחות הפוכות על הדגירה.
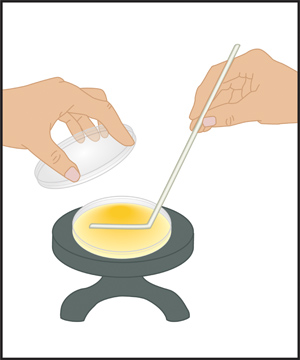
איור 5. מורחים-הצלחת הטכניקה עם פטיפון ו מפזר זכוכית. אחרי צלחת אגר מושם על פטיפון, נפח קטן של המדגם (0.1-0.2 מ"ל) היא לוותר על בסביבה נקייה מחיידקים, במרכז הצלחת באמצעות micropipettor. מפזר מעוקר על ידי טבילה אותו לתוך הכוס של אתנול ואז זה עובר דרך הלהבה של מבער בונזן להצית אתנול עודף. לפני יצירת קשר עם מדגם, מפזר צריך להיות מקורר על ידי נגיעה בו כדי אגר ליד שפת הצלחת. מפזר מועבר בעדינות קדימה ואחורה באמצעות מדגם פני הצלחת בעוד פטיפון הוא מסתובב לאט. פעולה זו מאפשרת הדרגתית אך גם התפשטות של המדגם על פני אגר. לאחר סגירת המכסה, הצלחת צריך להיות מוגדר על u הספסל העליוןndisturbed לפחות 5 דקות כדי לאפשר מדגם לספוג לחלוטין את אגר לפני צלחת היפוך של הדגירה.
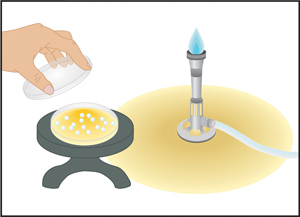
איור 6. מורחים-הצלחת הטכניקה עם חרוזי זכוכית (שיטת Copacabana). חרוזי זכוכית, כי כבר מראש מעוקרות ב החיטוי הם זרמו על פני השטח של צלחת אגר יושב על הספסל. נפח קטן של המדגם (100-150 μl) היא לוותר על בסביבה נקייה מחיידקים, במרכז אגר באמצעות micropipettor. עם מכסה צלחת סגור, תנועה אופקית רועד משמש להזיז בעדינות את החרוזים הלוך ושוב על פני צלחת 6 עד 7 פעמים, להפיץ את המדגם. פעולה זו חוזרת על עצמה לאחר סיבוב ° 60 צלחת. תנועה רועדת חוזר על עצמו בפעם השלישית לאחר סיבוב נוסף 60 °. לאחר המדגם לא נקלטו בינוני אגר, החרוזים הם שפכו לתוך מבחנה המכילה 10% אקונומיקה.צלחות ואז הם הפוכים על הדגירה.
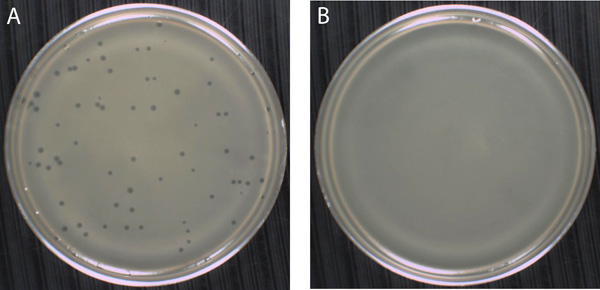
איור 7. רכים אגר טכניקה כיסוי שימוש לבודד למנות הפאג מבוסס על היווצרות הפלאק (המכונה גם assay פלאק). (א) נוכחותו של הפאג ניתן לאתר כאזורי של הסליקה, או לוחות, על השעיית confluent של מושבות חיידקים הגדלים אגר רך. הפאג T4 היא ארסית, פעמיים תקועים הפאג DNA מדביק המארח שלה, Escherichia coli, גורם לתאים פונדקאים כדי lyse ולשחרר הפאג הצאצאים. אחרי סיבובים רבים של זיהום תמוגה, ה שכנה תאים קולי באזור מיידית סביב התא המקורי המארח הנגוע נעלם והשאיר שלט המכיל מיליארדי חלקיקים הפאג T4. הפאג T4 מייצרת לוחות כי הם כ 1 מ"מ קוטר. בניסוי זה, 200 μl של דילול -5 10 של 2 x 10 המניות pfu / 8 מ"ל של הפאג T4היה מעורב עם כ 300 μl של א ' חיווי קולי תאים מוכן כתרבות, גדל באופן אקספוננציאלי aerated ב 37 ° C. גם הפאג וחיידקים נוספו צינור EHA רך אגר, מעורב, ואז שפכו על פני השטח של צלחת אגר EHA קשה. שים לב כי לא היה צורך לאפשר הפאג וחיידקים כדי לספוג לפני ציפוי במקרה זה. לאחר מתן אגר רך לגבש באין מפריע במשך 20 דקות, הצלחות היו הפוכים ועל מודגרות על 37 מעלות צלזיוס למשך 24 שעות. (ב) בהעדר הדבקה חלקיקים הפאג, התוצאות התפתחות חיידקים על ההשעיה מעונן של תאים אגר רך שבו מושבות נפרדים שאינם גלויים. במקום זאת, אפילו הדשא של תאים חיידקיים, במקרה זה ה קולי, טפסים ברחבי השכבה אגר שלמה הרך.
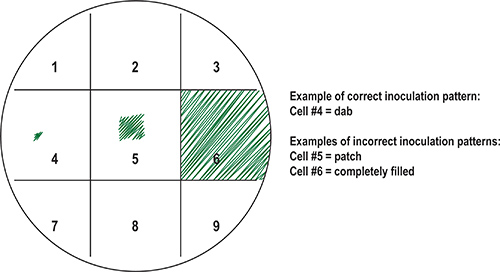
איור 8. הכנת צלחת הראשי (שני) עם דגימות חיידקים. כדי לשמור על דגימות מאורגנים, בתחתית הצלחת ניתן לסמן לרשת ו ריבועים כתוצאה ספורים. מדגם זה ניתן להקצות מרובע ברשת. המוצגים הם דוגמאות של דפוסי חיסון הנכונים לעומת שגוי. באופן אידיאלי, במספר קטן של תאים מועברים במרכז הכיכר באמצעות כלי חיסון סטרילית כמו קיסם כדי "טיפה" מדגם (תא מס '4). חיסון טעויות נפוצות, כגון אלה מתוארים בתא # 5 ("תיקון") של התא # 6 ("מילוי"), התוצאה של צמיחת יתר של חיידקים דגימות לאחר הדגירה, ריבועים סמוכים ולכן מזהמים.
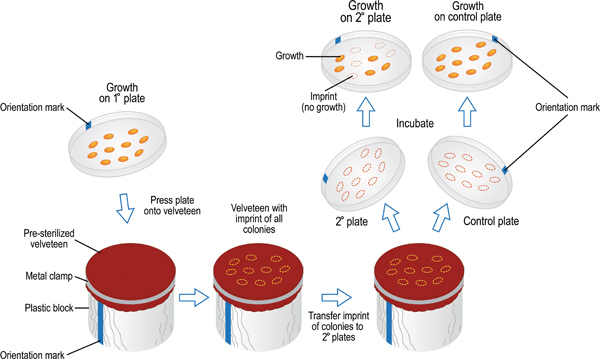
איור 9. Replica-צלחת טכניקה המשמשת להעברת תאים העיקרי צלחות משנה של מסכי פנוטיפ. סמן על הצלחת העיקרית מיושר עם הסימן על גוש קטיפה מכוסה ואז לאו האדום כדי לאפשר את פני השטח אגר ליצור קשר עם בד. התאים מועברים מהצלחת כדי קטיפה על ידי קלות אבל שווה לחיצה על הצלחת העיקרית עם קצות האצבעות. פעולה זו תשאיר חותם של דגימות תאים על קטיפה בתבנית מרחבית כמו צלחת הראשי. הליך דומה משמש להעברת תאים קטיפה לצלחת משני. כמה שרק 7-8 צלחות משניים ניתן מחוסן באמצעות אותו רושם ראשוני על הצלחת קטיפה. הצלחת האחרונה מחוסן מפני קטיפה צריכה לשמש השליטה חיובית. זה צריך להיות מדיום התומכת בצמיחה של כל הזנים שנבדקו, כדי להבטיח העברה לתא מספיק התרחש במהלך סדרה שלמה של הצלחות. לאחר הדגירה, צלחות משניים עשויים להיבדק והבקיע לצמיחה לעומת צמיחה לא. כך, מספר רב של זני חיידקים יכול להיות מוקרן בו זמנית בניסוי יחיד על צמיחה מדיומים שונים.
_upload/3064/3064fig10.jpg "/>
איור 10. התוצאה דוגמה באמצעות פור, הצלחת השיטה. המדגם 1.0 מ"ל מים שנאספו מזרקה השתייה הציבורית לוותר על צלחת פטרי סטרילית ריק. אבל אז נמס YTA מקורר נמזג לתוך צלחת עם המדגם. אגר הכיל גם 100 מיקרוגרם / מ"ל cycloheximide כדי למנוע צמיחה של שמרים ועובש שייתכן בדגימת מים. לאחר בעדינות לתערובת מתערבל, צלחת הונח על משטח ישר אגר הורשה לחזק לחלוטין. הצלחת הודגר על 37 מעלות צלזיוס למשך 48 שעות. המוצג הוא תוצאה של ניסוי זה. שים לב להבדל במראה של מושבות על פני השטח, אשר גדול עגול בצורת, לעומת בתת הקרקע מושבות, שהם קטנים מאוד לא סדיר לעצב בגלל בינוני הקרושה מעכב המושבה מתפשטת על פני השטח קטן.

איור 11. </ Strong> התוצאה דוגמה באמצעות התפשטות-הצלחת השיטה. "שיטת קופקבנה" שימש צלחת תערובת של תאים E. coli לניסוי ההקרנה. במקרה זה, בינוני צמיחה (LB) מכיל X-גל, כך תאים אלה מבטאים תפקודית β-galactosidase טופס האנזים מושבות כחולות ואילו אותם תאים עם מוטציה בגן lacZ וחסרת יכולת לבטא בצורה פונקציונלית β-galactosidase האנזים מושבות לבנות. המכונה לעתים קרובות "מסך כחול / לבן", שני סוגי מושבות ניתן להבחין בקלות על אותה צלחת זו מזו.

איור 12. התוצאה דוגמה assay באמצעות שלט רך אגר טכניקה כיסוי. המוצגים הם הפלאק נוצר על זן המארח Mycobacterium smegmatis mc 2 155 (ATCC 700084) על ידי ה-pH 2 שונהגיל: (א) Mycobacteriophage משחתות (ב ') MSSS Mycobacteriophage. הפאג אלה בודדו על ידי תלמידים במעבדה UCLA כמובן MIMG 103L באביב 2010. מ smegmatis הוא Actinobacterium פתוגניים שאינם והוא שייך למשפחה של mycobacteria הכוללת כמה פתוגנים כמה שידוע לגרום מחלות קשות כגון שחפת (מ שחפת, מ 'africanum, מ' בוביס) ו צרעת (leprae מ '). כ 50 μl של דילול -2 10 משחתות ו -3 של 10 דילול MSSS כל אחד היו מודגרות עם μl 500 מ ' smegmatis במשך 20 דקות ב 37 מעלות צלזיוס ואז מערבבים אותו עם MBTA (אגר רך) ושפך על MHA (אגר קשה) צלחות. לאחר מתן אגר רך לגבש באין מפריע במשך 20 דקות, הצלחות היו הפוכים ועל מודגרות על 37 מעלות צלזיוס למשך 48 שעות. שים לב מורפולוגיות פלאק שונים המיוצרים על ידי הפאג זה. משחתות () מהווה קטן (הקוטר הממוצע של מ"מ כ 1), שלטים ברורים מאפיין של הפאג ממוססבעוד MSSS (ב ') מפתחת "ועין השור" גדול הפלאק עם מרכזים ברורים מוקפים בהילה העכורה (קוטר ממוצע של כ 3.2 מ"מ). טבעת אביך יכולה להיות מורכבת של חיידקים עמידים הפאג זיהום. דפוס זה שונה מזה שנוצר על ידי הפאג lysogenic, אשר מייצרים לוחות העכורים.
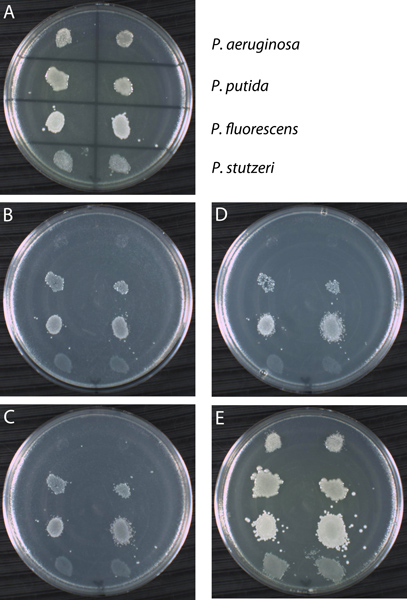
איור 13. התוצאה דוגמה באמצעות העתק, הצלחת ההליך. ארבעה זנים (Pseudomonas aeruginosa פ ', פ' putida, פ fluorescens, ופ stutzeri) נבדקו בשני עותקים לצמיחה על שלושה מקורות פחמן שונים: acetamide, לקטוז גליצין. (א) צלחת העיקרי הוא מדיום מלאה (YTA) מחוסן עם ארבעה זנים כפי שצוין. לאחר דגירה של 30 מעלות צלזיוס למשך 24 שעות, בכל ארבעת הזנים גדלים על YTA. הצלחת העיקרית ששימשה צלחת העתק אל מינימלית ליdium (MSA) השלים עם מקור פחמן יחיד: acetamide (ב '), לקטוז (C), ו - גליצין (ד'). הצלחת האחרון בסדרה היה בשליטה חיובית YTA צלחת (ה). כפי שניתן לראות, זנים מראים דפוסי הצמיחה משתנים בעקבות הדגירה על לוחות משניים. שים לב כי לעיתים קשה להבחין בין צמיחה חותם של תאים. למשל, להשוות את החותם שנוצר על ידי פ ' stutzeri על שלוש צלחות MSA לצמיחה לא על שלוש צלחות אותם על ידי פ ' aeruginosa. שתיהן תוצאות שליליות לעומת דפוסי הצמיחה הוצגו על ידי פ ' putida ופ fluorescens. עם זאת, כל הזנים גדלים על הצלחת תאים חיוביים בקרה המאשרים הועברו כל לוחות המשנה בסדרה. התוצאות של ניסוי זה הם נספר בטבלה 1.
| YTA (ראשונית) | MSA + acetamide | MSA + לקטוז | MSA + גליצין | YTA (שליטה) | |
| P. aeruginosa | + | - | - | - | + |
| פ putida | + | + | + | + | + |
| פ fluorescens | + | + | + | + | + |
| פ stutzeri | + | - | - | - | + |
טבלה 1. סיכום תוצאות העתק ציפוי. הצמיחה כפי סימן הפלוס (+) ולא ייצג צמיחה סימן מינוס (-). YTA הוא מדיום מלאה (tryptone אגר שמרים) ו MSA הוא מדיום מינימלי (מינימאלי אגר מלחים). הצלחות MSA נוספו עם מקור פחמן יחיד כמצוין.
Discussion
מיקרואורגניזמים culturing כוללת מספר שיטות ציפוי, כל אלה דורשים כי טכניקה אספטי להישמר לאורך כל מניפולציה של תאים מדיה. חמישה הליכים שונים תוארו בפרוטוקול זה. למרות הטכניקות האלה ציפוי משמשים באופן שגרתי כדי לתפעל חיידקים הפאג, הם גם יכולים להיות מיושמים על תרבית תאים יונקים מיקרואורגניזמים האיקריוטים נפוץ גנטיקה מולקולרית כמו שמרים (כלומר, cerevisiae Saccharomyces, קנדידה אלביקנס, pombe Schizosaccharomyces), אצות פרוטוזואה ( כלומר, Volvox, Chlamydomonas, אמבה, הסנדלית), ו נמטודות (כלומר, Caenorhabditis elegans). יש גם רבים (ועוד יותר מתוחכמת) וריאציות של כל שיטה ציפוי בהתאם המטרה האורגניזם הניסוי או על פי המחקר. לכן, חשוב לא רק כדי לבחור את הטכניקה המתאימה ביותר עבור מיקרואורגניזם הניסוי או יעד נתון, אלא גם כדי להתאים את המתודולוגיה לא כזהכובע תוצאות הניסוי כראוי להתמודד עם שאלת המחקר או בעיה.
חלק מהיישומים העדכניים ביותר של טכניקות ציפוי שנדונו בפרוטוקול זה כרוך כי ההתקדמות הטכנולוגית להניב תפוקה גבוהה תוצאות ניסויים ההקרנה ו גילוי תרופות. לדוגמה, רצף הגנום מרכזים להשתמש "שיטת קופקבנה" להתפשטות-ציפוי ספריות לשכפל, אשר א תאים קולי הפך עם פלסמידים המכילים קטעי דנ"א שמקורם הגנום של החיידק. בגלל עשרות צלחות גדולות (המכונה מגשים המבדק) מוכנים בבת אחת, אוטומטית צלחת שאכר משמש לנער את חרוזי זכוכית עבור אצווה שלמה של מגשים. יתר על כן, כאשר אתם בוחרים מושבות של הצלחות אלה לאחר הדגירה, בורר המושבה רובוטית משמש לאיסוף תאים ממושבות בהתאם הבידוד של מרק LB ב 384 גם microplates. עבור assay תפוקה גבוהה זה ההקרנה, עקרונות פרוצדורליים של p-התפשטותהטכניקה מאוחר להחיל אבל הטכנולוגיה מאפשרת צעדים שונים כדי להיות אוטומטי ו scaled כדי לאפשר מספר גדול של דגימות כדי לנתח בו זמנית תוך פרק זמן קצר.
חברות ביוטכנולוגיה ותרופות משקיעות משאבים רבים בפיתוח טכנולוגיה תפוקה גבוהה עבור הטכניקות הבסיסיות ביותר במיקרוביולוגיה וגנטיקה מולקולרית. למשל, יש הרב ערוצית micropipettors לבצע העברות בנפח של עד 8 או 12 דגימות בו זמנית. יש אפילו הם תחנות עבודה רובוטיות תמרון הראש 96 ערוצים פיפטה! מאמצים אלה כוללים רב תחומית צוותים של מדענים, זיווג ביולוגים שיש להם מומחיות מתודולוגית עם מהנדסים, מתכנתי מחשבים, אשר יכולה לפתח את המכשור הדרוש כדי לבצע את הפעולות המכניות הקשורות הניסויים. ללא תלות ביישום המחקר, המטרה המשותפת חברות המפתחות טכנולוגיות אלה היא אחת - כדי להפוך laboratoר"י תהליכים, כלים, מערכות ומכשירים, מה שהופך אותם פחות עבודה אינטנסיבית ויעילה יותר.
Disclosures
אין לי מה לחשוף.
Acknowledgements
תודה מיוחדת קורי סנדרס על עיצובים Iroc להכנת איורים וכדי קריס Reddi ו Bhairav השאה ב-UCLA להקמת תרבויות מדגם וסיוע עם דמויות. המימון לפרויקט זה סופק על ידי HHMI (HHMI גרנט מס '52006944).
Materials
| Name | Company | Catalog Number | Comments | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1. Yeast Tryptone Agar (YTA)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. If preparing tubes for the pour-plate procedure, allow the agar to cool to ~55°C then add 2.0 ml of 50 mg/ml cycloheximide. Aseptically dispense 18.0 ml of the melted agar per 18 mm tube then store at 4°C. The agar will solidify and will need to be melted in a steamer or microwave prior to use. 2. Minimal Salts Agar (MSA) + 0.1% (w/v) carbon source
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. * Carbon sources used for experiments presented in Figure 13 include acetamide, lactose, and glycine. ** Trace salts solution is prepared in 0.1 N HCl as follows. It is added to the base before sterilization (autoclave at 121°C for 20 minutes).
3. EHA soft agar (0.65 % w/v)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. 4. EHA hard agar (1.2% w/v)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. 5. 1X Middlebrook Top Agar (MBTA soft agar, 0.5% w/v)
Melt 50 ml of 2XTA and allow it to cool to ~55°C. Using aseptic technique, add the CaCl2 and 7H9 broth to the melted agar. Aseptically dispense 4.5 ml of the mixture per 13 mm tube and store in a 55°C incubator ≤7 days. Cooling MBTA to room temperature or 4°C will cause the CaCl2 to precipitate out of solution. * 100 mM CaCl2. stock must be stored at room temperature to prevent CaCl2 from precipitating out of solution. ** 7H9 liquid medium: Neat
Mix the base with water then add the glycerol while stirring. Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. *** 2X Middlebrook Top Agar (2XTA, 1.0% w/v)
Autoclave at 121°C for 20 minutes to sterilize. Dispense 50 ml aliquots into 100 ml bottles and store at 4°C. 6. Middlebrook 7H10 Agar Plates (MHA hard agar, 1.9% w/v)
Mix the agar base with water then add the glycerol while stirring. Heat the solution to boiling then stir for one minute to completely dissolve the base powder. Autoclave at 121°C for 20 minutes to sterilize. Allow the agar to cool to ~55°C then aseptically add the following reagents:
* AD supplement
Filter-sterilize this solution; do not autoclave. Store at 4°C. ** Filter-sterilize and store these solutions at 4°C for ≤60 days. 7. LB agar (1.5% w/v) + X-Gal (60 μg/ml)
Autoclave at 121°C for 20 minutes to sterilize. Allow the agar to cool to ~55°C then aseptically add 3.0 ml of 20 mg/ml X-Gal solution. Freshly prepare X-gal stock by dissolving 400 mg X-Gal in 20 ml dimethylformamide (DMF). Table of specific reagents:
Table of specific equipment:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
References
- Barker, K. At the Bench: A Laboratory Navigator. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. (1998).
- US Department of Health and Human Services (DHHS). Biosafety in Microbiological And Biomedical Laboratories (BMBL). , 5th, U.S. Government Printing Office. Washington DC. Available from: http://www.cdc.gov/biosafety/publications/bmbl5/index.htm (2009).
- Dulbecco, R., Vogt, M. Some problems of animal virology as studied by the plaque technique. Cold Spring Harbor Symp. Quant. Biol. 18, 273-279 (1953).
- Fields, B. N., Knipe, D. M., Chanock, R. M., Hirsch, M. S., Melnick, J. L., Monath, T. P., Roizman, B. Fields Virology. 1, 2nd, Raven Press. New York, NY. (1991).
- Gilbert, R. A., Ouwerkerk, D., Zhang, L. H., Klieve, A. V. Cooperative Research Center for Beef Genetic Technologies. In vitro detection and primary cultivation of bacteria producing materials inhibitory to ruminal methanogens. Journal of Microbiological Methods. 80, 217-218 (2010).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. BioTechniques. 23, 648-650 (1997).
- Karam, J. D. Molecular Biology of Bacteriophage T4. , ASM Press. Washington, DC. (1994).
- Knipe, D. M., Howley, P. M., Griffin, D. E., Lamb, R. A., Martin, M. A., Roizman, B., Straus, S. E. Fundamental Virology. , 4th, Lippincott, Williams, and Wilkins. Philadelphia, PA. (2001).
- Lederberg, J., Lederberg, E. M. Replica plating and indirect selection of bacterial mutants. J. Bacteriol. 63, 399-406 (1952).
- Miller, J. H. A Short Course in Bacterial Genetics: A Laboratory Manual and Handbook for Escherichia coli and related bacteria. , Cold Spring Harbor Laboratory Press. Plainview, NY. (1992).
- Mills, K. V., Gareau, J. R., Garcia, A. M. Low-cost modification to the Copacabana method for spreading transformation mixtures. BioTechniques. 39, 188(2005).
- Jordan, T., et al. RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , Howard Hughes Medical Institute. (2008).
- Sambrook, J., Russell, D. W. Molecular Cloning - A Laboratory Manual. , 3rd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. (2001).
- Sanders, E. R., Miller, J. H. I. Microbiologist: A Discovery-based Course in Microbial Ecology and Molecular Evolution. , ASM Press. Washington, DC. (2010).
- Slonczewski, J. L., Foster, J. W. Microbiology - An Evolving Science. , 2nd, W.W. Norton & Co., Inc. New York, NY. (2011).
- Teather, R. M., Wood, P. J. Use of Congo Red-Polysaccharide Interactions in Enumeration and Characterization of Cellulolytic Bacteria from the Bovine Rumen. Applied and Environmental Microbiology. 43, 777-780 (1982).
- Wise, K. Preparing Spread Plates Protocols. , Available from: http://www.microbelibrary.org/index.php/component/resource/laboratory-test/3085-preparing-spread-plates-protocols (2006).
- Worthington, M., Luo, R. Q., Pelo, J. Copacabana method for spreading E. coli and yeast colonies. BioTechniques. 30, 738-742 (2001).
- American Type Culture Collection (ATCC). , Available from: http://www.atcc.org/ (2012).
- EPA Microbiology Home Page. , Available from: http://www.epa.gov/nerlcwww/index.html (2012).
- The GENE Project: Laboratory Methods and Materials. , Available from: http://www.phys.ksu.edu/gene/g1.html (2012).
- Joint Genome Institute (JGI) Genome Sequencing Protocols: Library Plating Protocol. , Available from: http://www.jgi.doe.gov/sequencing/protocols/prots_production.html (2012).
- Microbial Genetics (maintained by Stanley Maloy at UCSD). , Available from: http://www.sci.sdsu.edu/~smaloy/MicrobialGenetics (2012).
- Organization of American States (OAS) Department of Sustainable Development (DSD). , Available from: http://www.oas.org/DSD/publications/Unit/oea59e/ch26.htm (2012).
- Public Health Agency of Canada: Material Safety Data Sheets (MSDS) for Infectious Substances. , Available from: http://www.phac-aspc.gc.ca/msds-ftss (2012).
- United States Environmental Protection Agency (EPA) Office of Water. , Available from: http://water.epa.gov (2012).
- American Society for Microbiology (ASM)'s Curriculum Recommendations Microbiology Majors Program. , Available from: http://www.asm.org/asm/index.php/unknown/asm-s-curriculum-recommendations-microbiology-majors-program.html (2012).
- Introductory Course in Microbiology. , Available from: http://www.asm.org/asm/index.php/unknown/asm-s-curriculum-recommendations-introductory-course-in-microbiology.html (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved