Method Article
Aseptik Laboratuvar Teknikleri: Kaplama Yöntemleri
Bu Makalede
Özet
Kültür mikroorganizmalar için kullanılan medya ve reaktifler ile çalışırken, aseptik tekniği kontaminasyonu minimize edilmiştir sağlamak için uygulanan olmalıdır. Kaplama yöntemleri çeşitli rutin bir şekilde, izole yaymak veya numaralandırma bakteri ve faj, deney malzemelerinin steriliteyi korumaya işlemleri dahil, her biri için kullanılır.
Özet
Mikroorganizmalar laboratuarda olası kirlenme kaynağı oluşturmak her yerde bulunan bir cansız yüzeyler üzerinde mevcut bulunmaktadır. Deneysel başarı çalışma yüzeyleri ve ekipmanları sterilize yanı sıra steril olmayan yüzeylere sahip steril aletler ve çözüm temasını önlemek için bir bilim yatmaktadır. Burada rutin, izole yaymak veya bu tür bakteri ve faj gibi mikroorganizmaların numaralandırmak için laboratuarda kullanılan çeşitli kaplama yöntemleri için adımları sunuyoruz. Tüm beş yöntemleri aseptik teknik veya deneysel malzemelerin steril muhafaza işlemleri dahil. Açıklanan prosedürler tek koloniler izole etmek (1) çizgi kaplama bakteri kültürleri, (2) dökün-kaplama ve (3) yayılma kaplama canlı bakteri kolonilerinin numaralandırmak için, faj ve enumerate plaklar izole etmek (4) yumuşak agar bindirmeleri ve include ( 5) kopya kaplama tabaktan özdeş bir mekansal desen başka hücrelere aktarmak için. Bu prosedürler, t yapılabilmektedirO laboratuar tezgah, onlar mikroorganizmaların patojenik olmayan suşlar (Biyogüvenlik Seviye 1, BSL-1) dahil sağladı. BSL-2 organizmalar ile çalışan, daha sonra bu manipülasyonlar bir biyogüvenlik kabini yer almalıdır. Biohazard sınıflandırma yanı sıra, söz konusu mikroorganizma için gerekli güvenlik önlemleri ve muhafaza tesisleri belirlemek Bulaşıcı maddeler için en güncel Mikrobiyolojik ve Biyomedikal Laboratuvarlarda Biyogüvenlik edition (BMBL) yanı sıra Malzeme Güvenlik Bilgi Formları (MSDS) danışın. Bakteriyel suşları ve faj stokları gibi Amerikan Tip Kültür Koleksiyonundan (ATCC) gibi belirli kuruluşlar tarafından yapılmaktadır araştırma araştırmacılar, şirketler ve koleksiyonları elde edilebilir. Bu çeşitli kaplama yöntemleri öğrenme zaman non-patojen suşları kullanılması tavsiye edilir. Bu protokolü açıklanan prosedürleri takip ederek, öğrenciler olmalıdır:
- Contaminati olmadan kaplama işlemleri gerçekleştirinng medya.
- Streak kaplama yöntemi ile tek bakteri kolonisi izole edin.
- Bakteri konsantrasyonunu belirlemek için dökün-kaplama ve yayılmasını kaplama yöntemlerini kullanın.
- Faj çalışırken yumuşak agar bindirmeleri gerçekleştirin.
- Aynı tabaktan kopya kaplama prosedürü kullanarak başka bakteri hücrelerinin aktarın.
- Deneysel bir görev verildiğinde, uygun kaplama yöntemi seçin.
Protokol
1. Güvenli ve Steril Workspace hazırlayın
- Mikroorganizmalar ile çalışırken alınması gereken tüm laboratuvar kuralları ve emniyet tedbirleri aşina olun. Ne olursa olsun biohazard sınıflandırma, mikroorganizmalar ile temas eden tüm malzemeler bulaşıcı atık olarak kabul edilir ve satışından önce dekontamine edilmelidir. Potansiyel olarak kontamine malzemeler derhal ve uygun şekilde bertaraf (biyolojik tehlikeler) için uygun atık kapları kurma kurumsal Çevre Sağlığı ve Güvenliği departmanları tarafından sağlanan, uygun güvenlik kurallarına uyun.
- Tüm araçlar, çözümler ve önceden kaplama işlemleri için bunları kullanarak medya sterilize edin.
- Laboratuvar tezgahı üzerinde çalışma alanı doldurmasını tüm malzemeleri uzak temizleyin.
- Bulaşma olasılığını en aza indirmek için dezenfektan ile çalışma alanı temizleyin.
- Bir Bunsen beki kurma ve yavaş çalışması, dikkatli ve bilinçli updra tarafından oluşturulan steril alan alanı içindealev ft.
- BSL-2 organizmalar ile çalışan, bir Biyogüvenlik kabin içinde çalışma alanı kurmak. Alev ısı işlevselliği için gerekli hava akımını bozar çünkü Bunsen beki kabinindeki kullanılamaz.
- Steril alanın yakınında laboratuvar tezgahı üzerinde işlem için gerekli tüm malzemeleri düzenleyin. Tüm malzemelerin düzgün etiketli emin olun. Iş verimliliği maksimize etmek ve gereksiz hareketleri önlemek için çalışma alanı organize havadaki kirleticilere deneysel malzemelerin pozlama süresini minimize edecektir.
- Bankta sağınızda Bunsen beki yerleştirin.
- Soluna Sıra agar plakaları veya Petri kapları.
- Hücre kültürleri, tüpler, şişeler ve tezgah merkezinde şişeleri düzenleyin.
- Tüpleri, şişeleri ve şişe kapakları böylece kolayca sonraki manipülasyonları sırasında tek elle açılabilir gevşetin.
- Antiseptik sabunla ve ılık suyla iyice ellerinizi yıkayınmikroorganizmalar kullanmadan önce su.
2. Streak Levha Prosedür: Quadrant Yöntemi Kullanma Bakteriyel Kolonileri İzolasyonu
Streak-plate prosedürü basit mekanik ayrımı ile karışık nüfusu saf bakteri kültürleri, ya da koloniler, izole etmek için tasarlanmıştır. Tek koloniler (Şekil 1) veya bir agar plaka içinde bir kümede büyüyen milyonlarca hücreden oluşur. Bir koloni, tek bir hücre aksine, çıplak gözle görülebilir. Teorik olarak, bir koloni bütün hücrelerin başlangıçta plaka üzerinde biriken tek bir bakteri elde edilir ve böylece bir klon, ya da genetik olarak özdeş hücre kümesi olarak adlandırılır.
- Bakteriler şekil ve boyutlarda çeşitli bulunmaktadır. Streptococcus Hücreler 1 um arasında bir ortalama çapa sahip küre şeklinde olan Örneğin, bireysel Escherichia coli hücreleri 2 um ve 0.5 um arasında bir ortalama genişliği uzunluğu çubuk şeklindedir. Bazı bakteriler (suE. olarak ch diğer esas farklı desenler oluşturmak iken. Streptococcus, örneğin, çift veya şekil zincir veya hücre kümeleri içinde büyümeye coli) tek bir hücre olarak mevcutturlar. Genellikle tek bir koloni ikili bölünme geçiren tek bir hücreden doğar varsayılır, ancak bu varsayım doğal çiftleri, zincirler ya da kümeleri veya diğer mekanizmalar tarafından bu bölme olarak var olan bakteriler için geçerli değildir. Çok bakteri kaplı, alternatif, daha sonra hücrelerin üst üste meydana gelen ve tek bir koloni gibi görünen yol açan iki veya daha fazla bakteri olasılığını artırabilir. Bir katı ortamda büyüyen bakteri kültürleri açıklayan veya numaralandırılıyor Bu komplikasyonlardan kaçınmak için, koloniler koloni oluşturan birim (kob) olarak adlandırılır.
Çizgi plaka işlem ile, hücrelerin bir karışımı, bir Petri kabı, bir yarı-katı, agar-bazlı besin ortamın yüzeyinin, öyle ki daha az ve daha az bakteri yayılırhücrelerin ortamın yüzeyinin üzerinde yaygın olarak ayrılmış iki noktasından çökelmiş ve, inkübasyon sonrasında, koloniler haline uygulanır. Hücrelerin bir karışımı tek koloniler izole edilmesi için çeyrek daire yöntem burada tarif edilecektir.
- Streak kaplama farklı enstrümanlar bir dizi (Şekil 2) ile gerçekleştirilebilir. Bir metal bir döngü defalarca tekrar kullanılabilir ve çizgi-kaplama rutin laboratuvar suşları için kullanılmaktadır. Tek kullanımlık plastik döngüler ticari olarak temin edilebilir ve bir Biyogüvenlik dolap içinde BSL2 suşları ile çalışırken, daha yaygın olarak kullanılmaktadır. Birçok araştırmacı streak-kaplama için tek, önceden sterilize edilmiş ahşap sopa veya düz kürdan kullanmayı tercih ediyoruz. Bunlar tek kullanımlık plastik döngüler için ucuz bir alternatif ve büyük olasılıkla sporlu bakteriler içeren böyle toprak gibi çevresel bir örneği ile çalışırken özellikle yararlı olabilir.
- Tek önceden sterilize çubukları ve kürdan Bunsen beki thu ile yakılmış olması gerekmezs sporlu bakteri ve sporları ile laboratuar yüzeyleri veya agar plaka çapraz kontaminasyon gereksiz aerosolizasyon önlenmesi.
- En azından adı, tarih, büyüme ortam türüne ve orta kaplama için organizmanın türü ile bir agar plaka altına (değil kapak) kenarı etrafında Etiket.
- Plakaları kapak ve çizgi-kaplama öncesinde oda sıcaklığına kadar önceden ısıtılmış üzerinde yoğunlaşma olmadan tamamen kuru olmalıdır. Plakalar 4 ° C'de saklanır, bunları hatta birkaç saat veya bir gün önce çıkarın. En fazla 2-3 tabak, küçük, düzgün yığınlar halinde onları yaymak ve onları kurutun.
- Çizgi plaka inoküle olacak olan örnek bir agar plaka et suyu içinde hücrelerinin bir süspansiyonu veya varolan bir koloni ya da olabilir. Başlamak için, bu sadece bir örnek, tek bir levha aşılamak için kullanılması tavsiye edilir. Zaman ve malzeme tasarrufu için, tek bir plaka çoklu örneklerinde için kullanılabilirlerles ama sadece bir kez bir plaka üzerinde bir örnek çizgiler yetkin hale.
- İlk çeyrek için numune alınır ve (Şekil 3 A Panel) hızlı, düzgün, geri ve ileri-hareketi kullanarak ortamın yüzeyinin dörtte biri yayılmıştır. Tezgah ters bir plakanın alt yarısını kaldırın. RIM plakasının merkezine agar yüzeyi boyunca ileri geri birçok kez döngü, sopa veya kürdan taşıyın.
- Inokulum hücre süspansiyonu ise, bir mikropipet ile bir metal halka veya 5-10 ul bir loopful elde edilir. Girdap veya vorteks kaplama için bir kısım çıkarmadan önce hücre süspansiyonu emin olun. Önce ve inokulum çıkarıldıktan sonra döngü değil, aynı zamanda şişe ya da tüpün kenar değil, sadece alev Bu adımı sırasında aseptik teknik kullanımı. Ayrıca, mikropipet ve loop veya namlu ile tüp veya şişe yüzüne dokunmayın. Inokulum pipetleme ise, approp üzerine hücre süspansiyonu dağıtmakplaka üzerinde yer riate ardından plakanın ilk kadranda üzerine yaymak için bir döngü, sopa veya kürdan kullanın.
- Inokulum başka bir plaka bir koloni varsa, yavaşça döngü ile koloni dokunmayın, çubuk veya kürdan ardından plakanın ilk çeyrek boyunca yayıldı. Metal bir döngü koloni dokunmadan önce soğutulur emin olun. Döngü çok sıcak değildir sağlamak için, herhangi bir çizgi oluşacaktır belirlenmiş bir alanda agar plaka üzerine hafifçe dokunun. Sadece bir kaç hücre koloni değil, tüm koloni ihtiyaç vardır.
- Metal bir halka kullanılması durumunda, bu alev plaka (Şekil 3 Panel B) için aşı almadan önce Bunsen brülör kullanarak. Mavi koni, alev sıcak parçası ucuna tel ile, döngü 3-4 inç hakkında başlayın. Metal sıcak kırmızı haline gelmelidir. Alev döngü yaklaşır böylece tel taşıyın. Bu manipülasyon önceki kullanımından döngü üzerinde kalan bakteri aerosolizasyon önler.
- Flaming öldürürısıtılmış hava bakteri (sporları rağmen) ve konveksiyon akımları izleyen manipülasyonlar sırasında metal tel üzerine yerleşmesini diğer havada uçuşan zararlıları engeller.
- Steril bir düz kürdan kullanıyorsanız, orta bir 10 ila 20 ° açıyla başparmak ve yüzük parmağı arasında hafifçe dar ucu tutun ve çizgi kadran için geniş ucunu kullanın. Bir döngü veya tahta sopa kullanıyorsanız, aynı açıda bir kalem gibi tutun. Döngü, sopa veya kürdan kazılar bu agar içine çok sert basmayın.
- İlk çeyrek tamamladıktan sonra, ters ve bankta plakası arka kapağını aşağı ayarlayın. Adım 4. de tarif edildiği gibi çubuk veya kürdan ya da yeniden alevin metal döngü atın.
- Streak ikinci çeyreğiyle Petri kabı 90 ° çevirin. Tezgah ters bir plakanın alt yarısını kaldırın ardından son çizgisinin sonuna ilk çeyreğiyle döngü, sopa veya kürdan dokunun. Geri ileri desen kullanarak, las üzerinde çaprazilk kadranda çizgiler t yarısı sonra boş İkinci çeyrek taşımak. Ters ve ikinci çeyrek dolu zamanlar bankta kapağına plaka geri ayarlayın.
- Döngü, sopa veya kürdan en özgün inokulum çökelmiştir ilk kadranda çizgileri ilk yarısında geri dönmek asla.
- Yeni plastik döngü, tahta çubuk veya kürdan her kadranda için kullanılmalıdır.
- Üçüncü ve dördüncü çeyrek daire için adım iki kez # 6 tekrarlayın.
- Sopa veya kürdan veya yeniden alev her kadranda arasındaki metal bir döngü elden emin olun.
- Dördüncü çeyrek çizgiler olduğunda ilk çeyrek girecek kaçının.
- Kapak üzerinde biriken yoğuşma kolonileri üzerinde damlama yapmaz böylece ters plaka inkübe edin.
3. Levha Prosedür dökün: Bakteriyel Hücre Sayımı Karışık Örneğinde
Bu yöntem genellikle kullandıklarıbir karışık numune içinde mikroorganizmaların sayısını saymak için d, ki önceki katılaştırma için bir erimiş agar ortamı ilave edilir. Işlem eşit uygun numune seyreltme kaplama da katı ortam içinde dağılmış kolonileri ile sonuçlanır. Bu teknik, agar içinde ve tek bir plaka üzerinde agar yüzeyi üzerinde koloni oluşturan birimlerin toplam sayısını numaralandırılmış olduğu yaşayabilir levha sayısı, gerçekleştirmek için kullanılır. Canlı plaka sayıları bilim adamları, büyüme eğrileri oluşturmak için örnek kaplandı hangi tüp hücrelerin miktarını hesaplamak için, ve bakteriyel hücre canlılığı ya da büyüme oranı üzerinde çeşitli ortamlarda veya büyüme koşullarının etkisini araştırmak için standartlaştırılmış bir yol sağlar.
- En azından adı, tarih, büyüme ortam türüne ve erimiş agar ortamına ilave edilmesi organizmanın türü ile bir steril ancak boş Petri kabı alt (değil kapak) kenarı etrafında Etiket.
- Seyreltme faktörü plat dahil edinseri seyreltmeler, ya da örnek olarak hücrelerin konsantrasyonuna sistematik bir azalma ile sonuçlanır tekrarlanan dilüsyon, bir dizi Ing. Örnek olarak hücrelerin sayısı istatistiksel olarak anlamlı bir aralık 30 ila 300 cfu olduğu agar plaka, kapasitesini aştığı takdirde seri dilüsyonları hazırlanması gereklidir. Bir plaka üzerinde 300'den fazla kob varsa, o koloni kalabalık ve çakışan olacaktır.
- Erimiş agar ortamında 18 ml ihtiva eden bir tüp elde edilir.
- Agar ortamında test tüpleri içine dağıtılır ve otoklavda önceden sterilize edilmelidir. Bunun bir deney için gerekli olan aynı gün, sonra agar bir 55 ° C lik bir su banyosuna aktarılmıştır 30 dakika için bir düdüklü tencere içinde eritilir gerekmektedir. Bu yeniden kullanılamaz olarak deney için gerekli olan ile aynı miktarda erimiş agar olmalıdır.
- On dakika plakaları dökülmeden önce, erimiş agar tüpler emek bir ısı bloğu 55 ° C su banyosuna transfer edilmelidir48 set ekspirayon tezgah ° C. Agar bu sıcaklık ulaştığında, bunu dökmek için hazır. Agar çok sıcak ise, örnek bakteri öldürüldüğü olabilir. Agar çok soğuk ise, orta bir kere katılaşmış topaklı olabilir.
- Bir kültür et suyu veya tuzlu su veya tampon içine bir koloniden karıştırma hücreleri tarafından üretilen bir hücre süspansiyonu ya da olması gereken, örnek elde edilir.
- Örnekler, tek bir numune bir seyreltme serilerinden elde edilebilir.
- Kaplanabilmektedir için örnek hacim 0.1 ve 1.0 ml arasında olması gerekir.
- Boş Petri kabı kapağını açın ve levha ortasına (Panel Şekil 4 A) içine numune dağıtmak. Kapağını kapatın.
- Bu işlem boyunca aseptik tekniğini kullanın.
- Plaka için örnek aktarmak için bir serolojik pipet veya mikropipet birini kullanın. Bu levha bir sıçrama değildir böylece numune akışını kontrol eder.
- Küvet kapağını çıkarınerimiş agar e ve Bunsen brülör alev sayesinde açık tüpün kenarına geçmek.
- Senin örnek içeren Petri kabı kapağını açın ve dikkatlice (Şekil 4 Panel B) agar dökün. Kapağını kapatın sonra yavaşça plaka dönen tarafından agar ile örnek karıştırın.
- Agar iyice inkübasyon için tersini plaka önce katılaşmaya bırakın.
4. Spread Plaka Prosedür: Tabak sayar, Zenginleştirme, Seçim veya Tarama için Ayrık Bakteriyel Kolonileri Oluşumu
Bu teknik genellikle hücrelerin uygun konsantrasyon kaplanmıştır zaman agar yüzeyi boyunca eşit olarak dağıtılmış ayrı koloniler oluşumu ile sonuçlanarak, bir agar plaka yüzey üzerine yayılır, küçük bir numune hacmi içinde bulunan mikroorganizmaları ayırmak için kullanılır. , Uygun bir plaka sayımları için bu tekniği kullanarak ek olarak, koloni sayısı bir şarkı üzerinde oluşturan birim hangile plaka numaralandırılır ve örnek kaplandı hangi tüp içinde hücrelerin konsantrasyonu hesaplamak için kullanılır, yaygın kaplama rutin zenginleştirme, seçim ve eleme deneylerinde kullanılır. Bu üç deney için istenilen sonucu genellikle ayrı koloniler agar bir dağıtım yüzeyi boyunca oluşturduğu içinde plaka sayımları için aynıdır. Bununla birlikte, bütün hedef yaşayan hücreler koloni oluşturmak sağlamak için değildir. Bunun yerine, belirli bir genotip sahip bir nüfus içinde sadece bu hücreleri büyümek gerekir. Kolonileri agar yüzeyine Erişilebilir büyümeye çünkü nihai hedef daha fazla analiz için koloniler izole ise yayma levhası yordamı bir numaralandırma deney için akma plaka tekniği üzerinde çalışan olabilir onlar dökmek plaka prosedürü ile agar gömülü hale oysa.
Yayılması plaka prosedürü için buraya açıklanan iki strateji vardır. İlk (A Yöntemi) bir pikap ve cam veya metal ro kullanımını gerektirird hokey sopası şeklinde. , "Copacabana yöntemi" olarak adlandırılan, (Yöntem B) ikinci bir sallama önceden sterilize edilmiş cam boncuklar içerir. Hem bile agar yüzeyi boyunca hücrelerin yayılmasını kolaylaştırır.
Yöntem A: bir pikap ve cam veya metal çubuk ile yayılır kaplama
- En azından adı, tarih, büyüme ortam türüne ve orta kaplama için organizmanın türü ile bir agar plaka altına (değil kapak) kenarı etrafında Etiket.
- Seyreltme faktörü seri dilüsyonları kaplama varsa ekleyin.
- Plakaları kapak ve yayılmasını kaplama öncesinde oda sıcaklığına kadar önceden ısıtılmış üzerinde yoğunlaşma olmadan tamamen kuru olmalıdır. Plakalar 4 ° C'de saklanır, bunları hatta birkaç saat veya bir gün önce çıkarın. En fazla 2-3 tabak, küçük, düzgün yığınlar halinde onları yaymak ve onları kurutun.
- Pikap Merkezi plaka (Şekil 5).
- Eğer eldebir kültür et suyu veya tuzlu su veya tampon içine bir koloniden karıştırma hücreleri tarafından üretilen bir hücre süspansiyonu olmalıdır r numune alınır.
- Örnekler, tek bir numune bir seyreltme serilerinden elde edilebilir.
- Kaplama için Numune hacmi 0.1 ve 0.2 ml arasında olmalıdır.
- Petri kabı kapağını açın ve agar merkezi üzerine senin örnek dağıtmak. Kapağını kapatın.
- Bu işlem boyunca aseptik tekniğini kullanın.
- Plaka için örnek aktarmak için bir mikropipet kullanın. Bu levha bir sıçrama değildir böylece numune akışını kontrol eder.
- % 70 oranında bir behere (v / v) etanol içine cam çubuk veya metal çubuk (aynı zamanda bir dağıtıcı olarak da adlandırılır) Dip.
- DİKKAT: alkol behere sıcak serpme daldırma Asla.
- Etanol sadece yayıcının alt kısmı ve gövde birinci inç temas gerekir.
- Bir Buns alev geçirilerek boşaltın ve aşırı etanol tutuşturmaktr brülör.
- Alev sonra hızla söndürmek etanol ile temas geldi serpme ve kök uzunluğu mutlaka gezmelisiniz.
- Etanol yakalamak yangın beher, panik yok edilmeli! Hızlı ateş sönecektir beher üzerine cam kapak, yerleştirin.
- Başparmak ve işaret parmağı ile sol elinizle kapağı tutan, agar plaka kapağını açın. Kenarına yakın kenarı boyunca agar dokunarak serpme soğutulur.
- Hücreler ilave edildi agar dokunmayın. Sıcak serpme hücrelerini öldürür.
- Sol elinizle (hala agar plaka kapağını tutarken), yavaşça pikap dönerler.
- En iyi kaçınılmalıdır rağmen size kapağını aşağı koymak gerekir, eğer bu Bunsen brülör steril alan içinde dezenfekte yüzeyinde aşağı bakacak şekilde yerleştirin. Yukarı dönük bir kapak ile, nesneler veya el hareketleri kirlenme büyük bir şans neden hava akımları oluşturarak, oradaMikroorganizmalar ve toz parçacıkları kapağın iç yüzeyine inmeye.
- Sağ elinizle, agar yüzeyine hafifçe serpme tutun ve yavaş yavaş tüm plaka üzerinde eşit örnek yayıldı. Pikap iplik gibi plaka üzerinde ileri geri serpme taşıyın.
- Örnek kuluçka için tersini plaka önce (en az 5 dakika) iyice emmesine izin verin.
Yöntem B: cam boncuk ile spread kaplama: "Copacabana Yöntemi"
- En azından adı, tarih, büyüme ortam türüne ve orta kaplama için organizmanın türü ile bir agar plaka altına (değil kapak) kenarı etrafında Etiket.
- Seyreltme faktörü seri dilüsyonları kaplama varsa ekleyin.
- Başparmak ve işaret parmağı ile sol elinizle kapağı tutan, agar plaka kapağını açın. Sonra önceden sterilize gl içeren cam tüp veya şişe açmakeşek boncuk. Sağ elini, alev ile tüp veya şişe ağız sonra dikkatli bir agar plaka üzerine 10-12 steril cam boncuk (Şekil 6) dağıtmak. Kap değiştirilmesi ve bir kenara çıkmadan önce bir kez daha plaka kapağı ve alev tüp veya şişe ağız kapatın.
- Boncuk Petri kabı dışarı sıçrama yok bu yüzden yavaşça agar üzerinde birkaç santimetre tüp veya şişe dışına boncuk dökün.
- Çapı 4 mm cam boncuklar kullanın. 30 dakika boyunca kuru döngüsü (yerçekimi ayarı) 121 ° C'de otoklavda cam şişe veya test tüpleri onları sterilize edin.
- Bunun yerine, bir dağıtıcı boncuklar kullanılarak bir avantajı, etanol, hiçbir açık kaplarda tekrarlanan yanan için gerekli olmasıdır.
- Agar plaka kapağını açın ve agar merkezi üzerine senin örnek dağıtmak. Kapağını kapatın.
- Bu işlem boyunca aseptik tekniğini kullanın.
- Plaka başına örnek tablet 100 ile 150 ul. Buhacmi bile hücrelerin yayılmasını kolaylaştırır. Plaka için örnek aktarmak için bir mikropipet kullanın. Bu levha bir sıçrama değildir böylece numune akışını kontrol eder.
- Nazikçe agar yüzeyinin 6-7 kez karşısında boncuklar sallayarak örnek yayılır. Hücreleri yayılır sağlamak için, yatay sallayarak hareket kullanın.
- Girdap boncuk ya da başka tüm hücreleri plaka kenarında sona erecek etmeyin.
- İPUCU: Eğer uygun şekilde yapılırsa, prosedür "sallayarak marakas" gibi geliyor.
- Plakası 60 ° çevirin ve sonra tekrar yatay olarak 6 ila 7 kez sallayın.
- Plakası 60 ° ikinci kez döndürün ve tekrar yatay sallayın. Artık, hatta agar yüzeyi boyunca hücrelerinin yayılmasını sağlamak gerekir.
- Yayılmasını kaplama bittiğinde, numune absorbe edilmeli ve agar yüzeyi kuru olmalıdır. % 10 çamaşır suyu içeren belirgin bir koleksiyon behere kontamine boncuklar kapalı dökün.
- Yapmaçöp boncuk atın! Kullanılan boncuklar tekrar kullanım için yeniden sterilizasyon onları, durulanır ve otoklavlanabilir edilecektir.
- NOT: agar yüzeyini üç kez salladıktan sonra hala ıslak ise, plaka plaka yüzeyi kuru görünene kadar adımları tekrarlayın # 4-6, sonra agar tarafından absorbe edilecek sıvı için izin vermek için birkaç dakika bekletin.
- Inkübasyon için plaka Invert.
5. Yumuşak Agar Overlay Prosedür: Faj izolasyonu ve sayımı için Plaketlerinin Formasyonu (Plaket Assay)
Bu teknik genellikle bakteriyofaj (faj), ya da bakteri virüsleri algılamak ve ölçmek için kullanılan 100 ila 200 nm arasında boyut olarak değişir. Bir elektron mikroskobu bireysel faj partikülleri görmek için gereklidir. Bununla birlikte, bulaşıcı faj partiküllerinin varlığı bir agar plakası üzerinde plak (Şekil 7A) şekilde tespit edilebilir. Bakteriyofaj kendi konak bakteri hücrelerinin dışında çoğaltmak değil, bu nedenle yayılım bird algılama kaplama öncesi karıştırma fajlar ve birlikte konak hücre gerektirir. Yumuşak agar kaplama işlemi için, bir faj süspansiyonunun genel olarak 50 ul 200 ul aralığında bir küçük hacimli, düz bir şekilde 2.5-3.0 arasında ml dağılmış 8 yaklaşık 10 bakteriler (konak hücreleri) ihtiva eden bir tüp içine dağıtılır yumuşak (0.5 ila 0.7% [w / v]), erimiş besin agar. Elde edilen karışım besleyici agar plaka bir katı ([ağırlık / hacim]% 1,5-1,9) yüzeyi üzerine dökülür. Plaka yumuşak agar agar sert tüm yüzey kaplamasını sağlamak için yeterince sarsıldı edilir. Üst agar tabakası katılaşmaya zaman olmuştur ve sonradan inkübatör yerleştirilebilir kadar Sonra plaka bir yüzeye yerleştirilir.
Zamanla, bakteri hücre bulutlu süspansiyon, bir çim olarak adlandırılan yumuşak agar ortamı (Şekil 7B) boyunca görünür hale gelir. Bir faj bakteri hücrelerinin biri bozar Plaketler oluştururlar, th içinde çoğaltırE hücre, daha sonra 100 kadar döl fajlar (aka, patlama boyutu) serbest hücre lysis oluşumunu. Yeni faj partikülleri erimiş bakteriyel hücre çevreleyen bölgede bakteri enfekte, yumuşak agar içine nüfuz ederler. Enfeksiyon ve lizis çoklu döngüsünden sonra, yumuşak agar bulutlu bakteriyel hücre süspansiyonu plak denilen açıklığın bir bölge bırakarak kaybolur. Her plak özgün enfeksiyöz faj Parçacık genetik olarak özdeş 10'dan fazla 9 faj parçacıkları, herşeyi içerir. Bir plak, tek bir faj parçacık ortaya çıkar, çünkü plak oluşturucu birim sonuçtaki sayısı (pfu) sayılabilir ve faj süspansiyonunun orijinal konsantrasyonu ya da titresi, hesaplanabilir. Bir plak tahlil adlandırılan deney, Bu tür aynı zamanda bilim adamları, tek adımlı büyüme eğrileri oluşturmak için ana sınıfı özgüllük araştırılması ve genetik deneyler için bakteri hücrelerine transdüksiyonu için standart bir yol sağlar.
- indikatör bakteri hazırlayın: bakteriyel konak suşu bir katlanarak büyüyen kültür yumuşak agar overlay deney için hazırlanmış olması gerekir. Her ev sahibi kendi büyüme gereksinimleri vardır. 0.3 ml ve gösterge bir bakteri süspansiyonu 0.5 ml arasında, her plaka için gereklidir. Gösterge bakteri bir şişeyi (örneğin, 25 ml) hazırlanmış ise, kültür çapraz bulaşma olasılığını en aza indirmek için daha küçük hacimde (örneğin, steril, vidalı kapaklı tüpler içine dağıtılır 5 ml alikot) ayrılabilir olmalıdır. Deney içinde kullanım için hazır olana kadar, tüpler buz (4 ° C'de) üzerinde muhafaza edilebilir. Steril besin suyu aşılamak için aseptik teknik kullanın ve ardından bakteri suşunun özelliklerine göre kuluçkaya yatmaktadır. Kalan kültürler gün sonunda atılmalıdır.
- Adsorpsiyon tüpleri hazırlayın: bir rafa iki steril mikrosantrifüj tüpleri yerleştirin. Ilk tüp "Faj" ve ikinci tüp "Kontrol" olarak kapağın kapak etiketleyin.
- Tipikfaj lizatları ly seri dilüsyonları hazırlandı ve ilave mikrosantrifüj tüpleri raf eklenir ve seyreltme faktörü ile etiketlenebilir ki bu durumda da kaplama vardır.
- Faj stokları tek plaklardan taze yapılmış ve 4 ° C'de muhafaza edilmelidir Faj partikülleri ayrıştırmak için, stok bir deney yapılmadan önce ortam sıcaklığına kadar ısıtılmalıdır.
- Faj stokları hafifçe ele alınmalıdır - girdap veya pipet şiddetle yok.
- Ilk tüp için faj örnek 50 ul ekle sonra plak deneyi için bir negatif kontrol olarak hizmet edecek ikinci tüp için faj tamponu 50 ul ilave edin.
- Faj ve bakteri tüm manipülasyonlar boyunca aseptik tekniğini kullanın.
- Sonraki her adsorpsiyon tüpüne indikatör bakteri 500 ul ekleyin.
- Uzun süre buz veya bankta oturan varsa Bakteriyel hücreler bir tüp altına razı olacak. Kültür karışım değilseönceden yeterli bakteri hücrelerinin adsorpsiyon tüpüne aktarılır, deney için bir kısım çıkarmadan ed. Plakların tespiti için yumuşak agar (yani, bir çim) oluşan bakteri kolonilerinin yeterli sayıda olmalıdır. Yavaşça adsorpsiyon tüplerine alikotları aktarmadan önce, homojen bir süspansiyon haline indikatör bakteri yeniden askıya bir vorteks karıştırıcı kullanınız.
- Tüpleri hafifçe iterek bakteri hücreleri ve faj karıştırın.
- Gösterge soybaşı için uygun bir sıcaklıkta, 15-20 dakika için faj / bakteri karışımı (fazla olmayan 30 dakika) inkübe edin.
- Besin yumuşak agar ve sert agar plakaları hazırlayın: adsorpsiyon, meydana yerde iken sizin laboratuvarlarda bir ısıtma bloğu iki yumuşak agar tüpleri (önceden eritilir ve 55 ° C'de saklanır) 46-48 ayarlanır ° C
- Erimiş yumuşak agar 10-15 dakika boyunca ısıtma bloğu sıcaklığına gelmesi gerekmektedir. Eğer erimiş yumuşakagar 15 dakikadan daha uzun oturur, katılaşmaya başlar ve sabit agar üzerine dökülür zaman öbekler şeklinde olacaktır. Erimiş yumuşak agar az 10 dakika oturur ise, önce kaplama ev sahipliği hücrelerini öldürme, faj / bakteri karışımı ilave edildiğinde çok sıcak olacak. Sonuç olarak, bir çim oluşturamaz ve çok az veya hiç plaklar tespit olabilir.
- Faj lizat seri dilüsyonları kaplama varsa ek yumuşak agar tüpleri hazırlayın.
- En azından adınızı, tarihi, büyüme ortamının tipini ve "Faj" veya adsorpsiyon tüpleri karşılık "Kontrol" ile iki besin sabit agar plaklarına plakanın alt (değil kapak) kenarında Etiket.
- Seyreltme faktörü seri dilüsyonları kaplama varsa etiketli ek plakalar dahil.
- Sabit agar plakaları kapak ve yumuşak agar eklemeden önce oda sıcaklığına kadar önceden ısıtılmış üzerinde yoğunlaşma olmadan tamamen kuru olmalıdır. Plakalar 4 ° C'de saklanır, bunları birkaç saat ya da hatta ortadan kaldırmak day önce. En fazla 2-3 tabak, küçük, düzgün yığınlar halinde onları yaymak ve onları kurutun. Sert agar tabakasında Aşırı nem faj plak oluşumu sırasında yumuşak agar yoluyla daha kolay yayılmasını sağlayarak, yumuşak agar seyreltme neden olacaktır. Sonuç olarak, plak boyutunu artırır.
- Levha adsorpsiyon tüpler gibi birer birer şöyle: aseptik sonra hızla içeriği karıştırmak için ellerinizi avuçlarınızın döndürün yumuşak agar tüpüne faj / bakteri karışımı (yaklaşık 550 ul olmalıdır) aktarmak için P1000 mikropipet kullanın. Hava kabarcıkları tanıtıldı böylece tüp sallamayın. Sol elinizle tüpü tutarak, sağ eliniz ile sert bir agar plaka kapağını açın ve hemen sert bir agar plaka yüzeyine tüp içeriğinin tamamını dökün. Kapak kapatmadan önce yavaşça plaka kaya fakat hızla plakanın tüm yüzeyi üzerinde eritilmiş yumuşak agar yaymakkatılaşması zamanı var önce. Petri kabı dökülen erimiş yumuşak agar sıçramasına kaçının. Kapağını kapatın.
- Tüm adsorpsiyon borular için adım # 9, bir defada bir tüp tekrarlayın.
- Düz bir yüzeye yerleştirin ve plakaları yumuşak agar katılaşmış kadar onları rahat bekletin.
- Genellikle 30 dakika için yeterlidir.
- Inkübasyon için plakaları çevirir.
- Çoklu plakaları yığılmış ve inkübasyon için ters sonra birlikte bantlanmış olabilir.
Inkübasyon sonrasında, plakalar plaklar için kontrol edilebilir. Negatif kontrol bakterilerin sadece bir çim (plaklar göstergesidir hiçbir delik) sahip olmalıdır. Plaketler boyut, şekil ve genel görünüm açısından farklılık gösterir. Verilen bir faj tip dikkatlice steril bir kürdanla bir plağın merkezinde delme ve bir steril mikrosantrifüj t inokulum aktararak plakların bir heterojen karışım izole edilebilir,Ube et suyu ya da faj tampon 100-1000 ul içeren. Bu lizat yukarıda tarif edilen aynı prosedür kullanılarak kaplanabilmektedir. En az 3 ila 6 ardışık tek-plak izolasyonu saf bir faj elde edilmiş olmasını sağlamak için gereklidir. Genellikle lizat bir plaka üzerinde örtüşmeyen plaklar üreten bir titreye bulmak için geniş bir ürün yelpazesi (10 -1 10 -10) üzerinde seyreltilmelidir. Numarası plak boyutuna bağlı olarak değişir.
6. Replica Levha Prosedür: Eleme Mutantlar ve Auxotrophs için Hücre Transferi
Bu teknik, seçilebilir bir fenotip için ekran hücreleri için bir araç üreten ikincil plakalar bir plaka üzerinde birincil hücre büyümesinin karşılaştırma izin verir. İlk birincil veya ana, plaka ya tek koloniler üreten bir seyreltme yayıldı-kaplama veya ızgara işaretler tarafından belirtilen bir mekansal desen bir tabak onları aktararak hücreleri ile inoküle edilir. Büyüme inhib ile medya içeren İkincil plakalarıBelirli bir besin yoksun itors veya medya birincil plaka üzerinde koloniler hücreleri ile inoküle edilir. Kolonilerin mekansal desen birincil plakasına kadife bir parça basarak ilk üretilir. Onlar agar daha kadife için daha fazla yakınlık var çünkü Bakteriyel hücreler kadife uygun. Kadife üzerinde hücrelerin baskı sonra birinci plaka ve aynı koloni model yansıtan hücre büyümesi ile birden fazla ikincil plakalara transfer edilmiştir. Diğer bir deyişle, başka bir plaka büyüme kalıp kopyalayan bir lastik damga olması gibi. Bu koloniler nispeten büyük bir kısmı tek bir deney birçok fenotip için eş zamanlı olarak taranması için izin verir, çünkü bu teknik avantajlıdır.
- En azından adınızı, tarihi, ve büyüme ortamının tipini bir agar plaka alt (değil kapak) kenarında Etiket: Primer plaka hazırlayın.
- Ile alt plaka üzerinde bir ızgara kapalı işaretleyinen az iki eşit aralıklı dikey çizgiler ve en az iki eşit aralıklı yatay çizgiler. Sayı çıkan kareler.
- Bir hücre örneği ile her kare aşılamak için önceden sterilize kürdan kullanın. Her numune için, dab meydanın ortasında. Hücreleri ile tüm kare (Şekil 8) örtmeyin ya da başka bir örnek inkübe zaman Overgrow ve çevreleyen kareler kirlenir.
- Her kare başka bir plaka üzerinde broth kültürleri veya kolonilerden birini türetilmiş farklı bir örnek ile inoküle edilir.
- Invert ve çeşitli ikincil ortamı aşılamak için kullanılır birinci plaka, inkübe edilir.
- İkinci plaka inoküle: birinci plaka ve orta plaka her yığın. Bir işaretleyici ile, plakaların yan üzerinde bir oryantasyon işareti yapmak. Işareti her plaka değil, kapağın alt tarafında olduğundan emin olun.
- Steril bir pamuklu kadife kumaş alın ve silindirik blok (F üzerine yerleştirinŞEKIL 9). Tutucu ile yerine kadife kumaş kilitleyin. Blok yönü işareti unutmayın.
- Blok bir Petri kabı alt (10.2 cm çap) ile aynı boyutta olması gerekir. Bir kilitleme halkası ile gelmesi gerektiğini blok ise çoğaltma kaplama için kelepçeler kadife kumaş.
- Kadife kumaş (15,2 x 15,2 cm kare) önceden sterilize edilmelidir. Daha sonra 30 dakika boyunca kuru döngüsü (ağırlık ayarı) üzerinde 121 ° C'de otoklavda koyun 10 ya da 12 kare sonra temiz bir alüminyum folyo ile sarılmasıdır yığın. Bir kopya kaplama deneyde bunları kullanmadan önce, bir kaç saat boyunca sıcak bir fırında yerleştirerek tamamen kuru olduğundan emin olun. Kadife kareler sterilizasyondan önce maskeleme bandı ile de-linted olması gerektiğini unutmayın.
- Velveteen kareler yeniden kullanılabilir. Kullanılan kadife kareler otoklavda dekontamine edildikten sonra, onlar düz su ile durulanmalıdır edilmeli ve yukarıda açıklandığı gibi yeniden sterilize.
- Silindirik blokk ve kelepçe (v / v) etanol veya% 10 oranında klor ağartma% 70, durulama bir kısa olan kullanımlar arasında dezenfekte edilmelidir.
- Kapağını kaldırın ve birincil plakası ters. Blok işareti ile plaka üzerinde yönlendirme işareti sıraya. Agar yüzeyinin silindirik blok kadife kumaş ile temas halinde olduğu, böylece plaka alçaltın. Hafifçe ancak eşit birincil plakasının arkasına parmak uçları ile bastırın ve sonra dikkatlice blok uzakta birincil plakasını kaldırın. Plaka üzerindeki kapağı değiştirin.
- Birinci plaka hücre kadife izlenim yapılması için yeni bir kadife ihtiyacı olan bir izlenim önce yaklaşık 7-8 orta plaka aşılamak için kullanılabilir.
- Ikincil levhaların her bir ayak 7. tekrarlayın.
- Pozitif kontrol olarak, serinin son plaka, test edilen bütün suşlar büyümek gerekir hangi agar ortamı olmalıdır. Bunu hücreleri teyit edebilir Bu şekilde tüm ortaöğretim pl transfer edildiseri ates. Aksi takdirde, belirli bir test ortamında büyüme eksikliği yetersiz hücre transferi yerine gerginlik bir fenotip atfedilen olabilir.
- Yanlış pozitif önlemek için, ikincil plakaları en gelen en uygun yüzeye sipariş edilmelidir. Aksi takdirde, besin hücrelerine olumsuz bir ortamda büyümeye izin levhaları arasında transfer olabilir.
- Plakaları ve inkübe Invert.
- Not: büyüme için ikincil plakaları teftiş zaman, büyüme ve baskı arasındaki farkı ayırt ediniz. İkincisi, bir negatif bir sonuçtur.
7. Work Space temizleniyor
- Bunsen beki kapatın sonra tabaklarda veya tüpleri, ekstra medya ve diğer reaktifler kültürleri dahil olmak üzere tüm malzemeleri bir kenara.
- Laboratuvar tezgahı üzerinde veya depolama yerlerinde birikmesine plakaları veya tüp olsun eski kültürlerin, izin vermeyin. Kirlenme meşhur kaynaklarıdır Bu numunelerkalıpları ve istenmeyen bakteri türleri gibi, en kısa sürede de artık ihtiyaç olarak atılmalıdır.
- Yeri uygun bertaraf yuvasına Laboratuvar (eldivenler, pipet uçları, Kimwipes), cam (tüpler, şişeler, şişeler), ve tehlikeli atıklar (bakteri kültürleri veya faj çözümleri, kullanılan levha) kirlenmiştir. Bir patojen olmayan E. ile çalışırken coli suşu (BSL-1), sadece bulaşıcı olmayan tehlikeli atık üretilir. Patojen organizmalar (BSL-2 veya üzeri) ile bu aynı işlemleri esnasında, bulaşıcı tehlikeli atık üretilir. Ne olursa olsun biohazard sınıflandırılması, tehlikeli atıklar otoklava ya atılıncaya dezenfekte edilmelidir. BMBL açıklanan yönergelere (5. Ed.) Yanı sıra bir deney sırasında oluşan biyolojik tehlikeler hemen ve uygun şekilde bertaraf için kurumsal Çevre Sağlığı ve Güvenliği bölümü tarafından sağlanan izleyin.
- Dezenfektan ile çalışma alanı temizleyin.
- Ellerinizi yıkayıniyice laboratuardan ayrılmadan önce antiseptik sabun ve ılık su ile yıkayın.
8. Temsilcisi Sonuçlar
Leke yapmayan plaka Teknik. Kaplama çizgi için örnek bir uygulaması Şekil 1 'de gösterilmiştir. Bu prosedür, karışık hücre kültürlerinde bakteri kolonileri izole etmek için kullanılan ve bugüne kadar mikrobiyoloji ve moleküler genetik alanında master için en önemli tekniklerden biridir. Her koloni genetik olarak özdeş olan hücrelerin bir nüfusu temsil eder. Birçok downstream uygulamalar için tek bir koloni ya da tek bir koloni hücreleri ile medya inokülasyon tarafından üretilen saf bakteri kültürü biriyle başlamak zorunludur. Örneğin, bir koloni içindeki tek tek hücrelerin morfolojisi bir ışık mikroskobu kullanılarak kontrol edilebilir. Genetik kimlik tek bir koloni ile başlayan bir hücre kültürü izole edilen genomik DNA küçük alt birimi RNA gen sıralanmasıyla atanabilir.Ve metabolik özelliklerinin çeşitli biyokimyasal ve fizyolojik testler hücreleri tabi tutarak tarif edilebilir. Sadece saf kültürler ile böyle deneyler yaparak biri belirli bir mikroorganizmaya atfedilen özellikleri emin olabilirsiniz. Elde edilen sonuçlar, kültür kontamine olma olasılığını tarafından örtülmüştür değildir. Çizgi plaka üzerinde hücreleri için kullanılan enstrümanın kısırlık prosedürü boyunca muhafaza değilse Teknik hatalar oluşabilir. Alev bir döngü unutmak veya kadran zor tek koloniler elde etmek için yapmak arasında bir taze kürdan almak. Belli büyüme gereksinimleri için başka bir bakteri türü ile bir işbirliği ilişkisi bağımlı gibi bazı bakteri türlerinin saf kültürde izole edilemez. Syntrophs olarak adlandırılan, bu organizmaların yalnızca ko-kültür koşullarında yetiştirilen olabilir, bu nedenle koloniler (oluşmuş ise) her zaman iki veya daha fazla türün oluşacaktır. Yaparken diğer zorluk laboratuvarlarda karşılaşılançevresel numunelerden elde bakteriler ile streak-plate prosedür hücreleri, E. gibi geleneksel laboratuvar suşları sapma büyüme özellikleri sergilemek olduğunu coli. Böyle bakteri suşlarının agar plaka büyük bir bölümü yayılmış şubeleri ile (as hücrelerin sıkı kümeler aksine) ipliksi olan koloniler üretebilir, kalsifiye ile streak-plate cihazı ile penetrasyon dolayısıyla refrakter veya yapışkan bir kapsül ile çevrilidir öyle ki bireysel koloniler ayırt edilemez. Bu özellikleri onu zor çizgi plaka tekniği ile tek koloniler arındırmak için yapmak.
Akma-plaka Teknik. Pour-plaka tekniği ile, koloniler agar içinde hem de agar ortamı böylece bir numune içinde yaşayan hücrelerin sayısını saymak için uygun bir araç sağlar yüzeyinde oluşturur. Bu prosedür, bir endüstriyel uygulamalar çeşitli kullanılır. Örneğin, bir atık su tre için kritik önem taşıryoğun saflaştırma işlemi takiben su numuneleri analiz etmek, evsel, ticari ve endüstriyel özellikleri yanı sıra tarım uygulamaları tarafından oluşturulan (örneğin, kanalizasyon, run-off fırtına Süzgeçleri) sıvı atık temizleme sorumludur, olgunun bitki. Tarım gıda dışı ürünlerin sulanması için, konutlarda sıhhi kızarması için, ve endüstriyel soğutma kulelerinde - - Tedavi atıksu (non-içme suyu) çeşitli şekillerde yeniden kullanılabilecek böylece kimyasal ve mikrobiyal kontaminasyon arındırılmış olmalıdır. İçme suyu (içme suyu) EPA standartlarına göre arındırılmalıdır ve özel insan patojenleri numaralandırılmasına izin mikrobiyolojik kaplama yöntemleri kullanılarak test edilmiştir. Şekil 10'da gösterildiği gibi bakteri hücreleri kaynaklanan bakteri kolonileri, bir halka açık çeşme suyu alınan bir numune içinde mevcut edilir. Bu koloniler içme suyu arıtma tedbirleri verilen üretilen olası bakteriyel patojenler olmakla birlikte, mikroplar her vardırNerede ve hatta non-patojen suşları tarafından kontaminasyon sadece tamamen elimine değil, minimize edilebilir. Başka bir örnek olarak, bir ilaç şirketi üretim, depolama ve taşıma sırasında yeni bir ilacın mikrobiyal kontaminasyonu veya biyolojik yük, derecesini değerlendirmek gerekir. Işlem ve akma-plaka prosedürü kullanarak kaplama örnekleri arasında çeşitli fazları sırasında ilaç alınarak, mikrobiyal, yük veya bulunan bakterilerin sayısını, kolayca tespit edilebilir. İhtiyati tedbir sonra mikrobiyal kontaminasyonu en aza indirmek veya ortadan kaldırmak için tasarlanmış olabilir. Pour-plaka tekniği yaparken oluşur en yaygın teknik hatalardan biri kümelenmesine erimiş agar neden koloniler birlikte böylece plaka sayıları eksik yapma ile örnek karıştırma yetersizdir. Çok sıcak olduğunda diğer sık hata örnekteki bakteri hücrelerinin birçok öldürme, erimiş agar döküyor. Bu hata ayrıca sayılar altında temsil inci veren plaka sayıları doğruluğunu etkileyecektirnumunedeki koloni oluşturan birim e toplam sayısı.
Spread-plaka Tekniği. Yayılması-plaka tekniği uygulanabilir plaka sayım gerçekleştirmek için bir araç olarak kendi programında pour-plaka prosedürü benzerdir. Yayma levhası tekniği kullanılarak koloni oluşturan eşit agar ortamı yüzeyi boyunca dağıtılmıştır Ancak, çünkü tek tek kolonilerden gelen hücreler (örn., sonraki deney manipülasyon izole edilebilir ve kullanılabilir bir çizgi plaka ya da bir için aşı malzemesi olarak broth kültürü). Yayılmasını plaka tekniği önemli bir bileşeni olduğu üç ortak uygulamaları zenginleştirme, seçimi ve tarama deneyler vardır. Her üç uygulamalarda, arzu edilen hücre tipi karışımından ayrılabilir ve daha sonra biyokimyasal ve fizyolojik ya da genetik test herhangi bir sayıda tabi tutulmuştur.
Bir zenginleştirme deney bir ortam üzerinde bir karma kültür kaplama veya e plakalar inkübe içeriristenen metabolik özellikleri, büyüme özellikleri veya davranışları gösteren örnek içinde bu mikroorganizmaların gelişmesini desteklerler nvironmental koşulları. Bu strateji, kültür içinde diğerlerine göre arzu edilen mikroorganizmaların sayısında bir artış diğer organizmalar ancak sonuç büyümesini inhibe etmez. Böylece, bir zenginleştirme plaka oluşturan koloniler olasılıkla istenen genotip yansıtacak fenotipik özellikler göstermektedir. Örneğin, hedef sonra bir nitrojen-eksik ortam üzerinde numune kaplama, 1000'den fazla farklı bakteri türünün bir karışımı içeren bir çevresel örnek azot bağlayıcı bakteriler yetiştirmek için ise, bu bileşik üretebilir, bu bakterilerin zenginleştirecek azot sabitleme için gerekli genleri bir paketi tarafından sağlanan metabolik yeteneklerini kullanarak bir atmosfer.
Bir seçim deney yalnızca bu hücreler olduğunu con sağlayan bir ortam üzerinde bir karma kültür kaplama içerirbüyümek için gen, belirli bir gen veya bir dizi tain. Antibiyotik direnç genleri içeren plazmid ile bakteri suşları dönüştürürken deneyi Bu tip moleküler biyoloji laboratuvarlarında yaygındır. Hedef sadece rekombinant hücreler ya da başarılı bir şekilde, daha sonra uygun bir antibiyotik konsantrasyonu ile takviye edilmiş bir ortam üzerinde, örnek kaplama özellikle bu ilaca karşı direnç sergileyen hücreler için plazmid seçecektir aldı ki bu yetiştirmek için ise.
Bir tarama deneyi, tüm canlı hücre çoğalmasını sağlayan bir ortam üzerinde bir karışık kültür kaplama içerir, ancak arzu edilen genotip ile hücrelerin fenotipini göre diğer hücrelerden ayırt edilebilir. Plazmidler içine mutagenez deneyleri veya klonlama genlerin gerçekleştirirken Yine, bu tür denemelerde moleküler biyoloji laboratuvarlarında yaygındır. Klasik bir örnek, Şekil 11 'de gösterildiği gibi, lacZ geni ENCO kullanırding β-galaktosidaz ve bu enzimin hücrelerde, doğal substratın, laktoz bir substrat analoğu (5-bromo-4-kloro-3-indolil-β-D-galactopyranoside) X-Gal metabolize izin verir. Bir çözünmeyen mavi ürün olarak β-galaktosidaz sonuçlar, X-Gal bölünmesiyle. Bu nedenle, bir orta X-gal içeren ve bir ya da vahşi tip (işlevsel) veya mutant (non-fonksiyonel) lacZ geni olan hücreler içeren bir örnek daha sonra bir işlevsel lacZ yataklık inkübasyon vahşi tür hücrelerinde ardından, bu ortam üzerinde kaplama halinde işlevsel olmayan bir lacZ geni mutant hücrelerin unpigmented ("beyaz") koloniler olarak görünecektir ise gen mavi pigmentli koloniler olarak görünecektir.
Teknik bir problem agar yüzeyi boyunca hücrelerinin yayılmasını yayılmasını plaka tekniği gerçekleştirmek için nasıl düzensiz olduğunu öğrenmek zaman ilk en sık rastlanan. Bir pikap ve cam çubuk kullanırken, örnek çok hızlı gibi koloniler sadece plakasının merkezine yakın oluştururlar absorbe edilebilir. Wtavuk "Copacabana Yöntemi" yapıyor, cam boncuklar swirled yerine agar yüzeyi boyunca çalkalanır. Sonuç olarak, birçok koloniler plaka dış kenarı boyunca büyür. Her iki durumda da kolonilerin çıkan dağıtım hücreleri yığın birlikte olabilir ve hücre tipleri olanaksız plaka sayıları eksik veya ayrım yapmadan örtüşen kolonileri içine büyümeye yüzden mevcut tüm yüzey alanı yararlanmak değildir.
Yumuşak Agar Overlay Tekniği. Bakteri kolonileri saymak için kullanılan levha yayma tekniği ile benzer bir prosedür çetelesini faj sayı için kullanılır. 30 ila 300 bakteri hücreleri plaka sayısı (cfu / ml) için agar yüzeyi üzerinde yayılmış ise, 100 ila 400 bulaşıcı faj partiküllerinin bir tabaka içinde plak sayısı için 10 Ağustos - 10 Eylül taşıyıcı hücrelerin (pfu / mL) ile karıştırılır yumuşak agar sert besin agar yüzeyine yayıldı. Aksi halde gösterilen sürece, genel olarak kabul edilmektedir tşapka, tek bir bakteri hücresinin bir koloni olarak adlandırılan tek bir kümede genetik olarak özdeş hücreleri çok sayıda böler ve birikir. Daha önce tartışıldığı gibi hücreler (yani, çift, tetrads, zincirler veya kümeler) demet büyür veya tek koloni oluşumunu engellemek, kapsüller gibi büyüme özellikleri görüntülediğinizde, bu varsayım geçerli değildir. Benzer bir varsayım plak formasyonu için yapılmıştır, ki içinde, her bir plak tek bir faj aktivitesini temsil eder. Tek faj bir bakterinin bozar sadece bu ifade doğrudur. Birden faj parçacıkları tek bir bakteri bulaşması durumunda ne olur? Enfeksiyon (MOI) çokluğu - - bir numune içinde konak hücrelerin sayısını bulaştırıcı faj partiküllerinin oranını tanımlayan Bu sorun, faj ile deneyler göz önünde bulundurulması gereken önemli bir parametre istatistiksel ile ilgilidir. Diğer hücreler adsorbe sadece bir ya da hiç faj iken, konak hücre popülasyonunun bir düşük İB (≤ 1) t, bazı hücreler adsorbe birden fazla faj enfekte edilmesi gerektiğindenBir hücre tek bir faj parçacık daha fazla tarafından enfekte olma olasılığı en aza indirmek o. Bir faj stok titre hesaplamak için plak sayımları yaparken işlevsel bir tanım olarak plak oluşturan birim (pfu) çalışanı bu komplikasyonları önler.
Şekil 12'de gösterildiği gibi, levha morfoloji farklı faj için değişmektedir. Diğerleri büyük plaklar (panel B) doğuran Bazı faj küçük plaklar (panel A) üretir. Değişkenler bir dizi plak boyutunu etkilemez. Bu değişikliklere katkıda teknik nedenleri vardır. Örneğin, tam medya ve büyük plakların kalın sert agar destek gelişimi ana hücrelerin daha uzun bir süre için faj büyümeyi sürdürmek çünkü. Konak hücreleri yüksek bir kaplama yoğunluğu (plaka başına> 10 9 cfu), plak boyutunda bir azalmaya neden olacaktır. Yumuşak agar daha düşük konsantrasyonlarda kullanılması, yumuşak agar içinde faj parçacık difüzyon hızını artırmak ve böylece plakların boyutunu artırır. Inci hatırlayınSabit agar plakaları tamamen bindirmesine yumuşak agar sulandırır çanak şekilde yoğunlaşma veya aşırı nemin kurumasını değilseniz bu artmış difüzyon hızında istemeden oluşabilir. Bu teknik gözetim, belirli bir faj için plak boyutu ile ilgili tutarsız sonuçlar üretecektir.
Plak boyutu da adsorpsiyon verimliliği, latent dönem (konak hücre lizis için faj adsorpsiyon gelen) bir zaman dilimi süreleri ve patlama boyutuna (tarafından yayımlanan döl sayısı dahil konak hücre olayların bir dizi ile ilgilidir Tek bir enfeksiyon). Faj partiküllerinin bakteriyel büyüme farklı aşamalarında konak hücreleri enfekte eğer plak boyutları bir heterojen karışımı görülebilir. Örneğin, erken üstel aşamasında olanlar olduğunu adsorbe daha fazla döl faj ile büyük plaklar yaptığınız geç üstel fazda adsorbe. Genel bir kural olarak, litik faj lysogenic faj formu bulanık plaklar ise net plaklar üretmek. HoWever, bazı litik faj gibi Şekil 12B gösterilen "boğa gözü" plak gibi ilginç desenleri üretmek. Plak kenarında bu hücreleri tamamen parçalanır değildir veya enfeksiyon faj direnç olabilir çünkü bu açık plaklar bulanık bir hale ile çevrilidir. Ilıman faj gözlenen bir "boğa gözü" desen net bir halka ile çevrili bir bulanık merkezi ile bir plaket olduğunu. Bu, morfoloji İB ve lizis-lysogeny karar ile ilgili konak hücre fizyolojisi yansıtır. Hücreleri ilk faj ile enfekte olduğunda, İçişleri Bakanlığı düşüktür ve besin bol çünkü hücreleri hızla büyüyor; birlikte bu litik büyüme kolaylaştırır. Daha fazla ve daha fazla hücre parçalanır gibi, İçişleri Bakanlığı artar ve net bir plak oluşur. Bir bulanık merkezi ile açık bir plak doğuran lizis bağışıklık çünkü plak merkezinde Lysogens, ancak büyümeye devam ediyor.
Bindirme tekniği ökaryotik virüsler plak deneyleri için modifiye edilebilir. Içindeyumuşak agar içinde bakteri hücrelerinin bir çim üzerinde aynı şekilde bakteriyofaj şekil plaklar, ökaryotik virüsler bir jel ile kaplanmış hücreler bir tek tabakalı plakalar üzerinde oluşturur. Bir tek tabaka, bir kültür çanak yüzeyi üzerinde yan yana artan birbirlerine temas fakat birbiri üstüne artan olmayan hücrelerin bir konfluent tabakasıdır. Plak deneyi Bu tür gerçekleştirmek için, virüs hacimde ökaryotik hücre mono tabakaları duyarlı ilave edilir. Sonra tek tabakalı bir agaroz tabanlı besi ile kaplıdır - Bu jel monolayer bitişik hücrelere enfekte hücrelerinden salınan döl virüslerin yayılmasını sınırlandırır. Buna göre, bir küresel alanı, ya da plak, virionlar serbest bırakarak, hasarlı hücreler içeren üretilir. Leke canlı hücreleri enfekte olmuş ve enfekte olmamış hücreler arasındaki kontrast hücre kültürü uygulanabilir ki plaklar, boyalar görselleştirme yardımcı olmak için.
Yumuşak agar kaplama tekniği plak testlere göre daha başka deneyler için kullanılmıştır. İlk olarak, ssert besin agar bakteri üremesini izin veren bir destek matrisi olduğunu hatırlamak ignificant. İkinci olarak, kaplama için kullanılan yumuşak agar-agar sert farklı bir besin kompozisyonu olabilir. Bu şekilde, yumuşak agar çeşitli büyüme özellikleri ya da metabolik özellikleri için test bakteri suşunun için bir araç olarak hizmet edebilir. Örneğin, üst tabaka tekniği selüloz (Teather ve Wood 1982) parçalayabilen için ekran bakteriler için kullanılır. Tekli koloniler sonra yumuşak agar karboksimetil selüloz (CMC), sert agar yüzeye yayılır% 0.1 (w / v) içeren, seçici olmayan bir katı agar ortamında yetiştirilir. Inkübasyondan sonra, plakalar yumuşak agar içinde kolonilerin etrafında açıklığın bölgeleri görselleştirme izin veren leke ile doludur edilir. Açıklığın ortamda selüloz parçalayarak bakterilerin salgıladığı hidrolitik enzimler tarafından neden olur. Daha yakın zamanda, üst tabaka tekniği methanoge büyümesini inhibe bakteri tespit etmek için kullanılmıştırnic Archaea hayvancılık rumen (Gilbert ve ark. 2010) bulundu. Çevresel numunelerden Bakteriyel izolatlar sonra koloniler yumuşak agar metanojenler bir kültürü içeren çakıştırılmıştır olan bir sabit agar besin ortamında yetiştirilmektedir. Inkübasyondan sonra, plaklar kolonilerin etrafında büyüme inhibisyon zonları için denetlenmektedir. Bu yöntem, yumuşak agar içinde metanojenler inhibitörleri üretmek bakteri suşları tanımlar.
Çok sıcak veya çok soğuk olduğu ya da ne zaman yumuşak agar bindirme tekniği ile ortaya en yaygın teknik hatalar erimiş yumuşak agar yağıyor. Çok sıcak ise, bakteri hücreleri ortamda karışık kaplama öncesinde öldürülecektir. Çok serin ise sabit agar üzerine dökülür, o zaman yumuşak agar öbekler şeklinde olacaktır. En az iki durumda da, sonuç belirsiz ya da okunamaz olacaktır.
Replica plakalı Prosedürü. Besi yeri tipinden bir kültür aktarmaSadece birkaç suş daha varsa başka büyüme gereksinimlerini test etmek oldukça zahmetli olur. Çoğaltma kaplama mikroorganizmaların büyük sayıda eş zamanlı olarak izin veren bir tarama yöntemidir. Örneğin, vahşi tip hücre kültürü mutagenizing sonra, bir plaka-yayılmış olabilir kültür seyreltmeleri tek koloniler plakalar ile elde edilir. Birincil plakaları büyümesi için elzem özel bileşikleri sentezlemek için bu mümkün kılan bir biyosentetik yolda bir genetik mutasyonu taşıyan yabani-tip büyüme için gerekli olan tüm bileşikleri sentezlemek prototrophs, ve mutant auxotrophs de dahil olmak üzere tüm hücrelerin büyümesini destekleyen bir ortam içerir. Tam bir ortam üzerine hücre karışım kaplama olarak, eksik besin ortamı yukarı alınabilir. Prototrophs ve auxotrophs ayırt etmek için, koloniler minimal bir ortam üzerine çoğaltılmış olabilir. Sadece prototrophs büyümek mümkün olacak. Birinci plaka mekansal kalıp korunmuş olduğu için, comparisPrimer plaka ile sekonder plaka üzerinde mutant kolonilerin tanımlama sağlar. Mutantların artık sentezleme yeteneğine sahip olan bileşik belirlemek için, spesifik koloni bileşikler (örn., amino asitler, karbon kaynağı, vitaminler, vb) ilave edilmiş en az bir ortama çoğaltılabilir. Bu şekilde, koloniler yüzlerce kopya plaka prosedürü kullanarak, aynı anda taranabilir. Oluşabilecek bir teknik hata koloniler birlikte smear plakasının tüm kültürlerin kirlenmesine neden çok ıslak agar plaklarına kullanıyor. Bu tamamen güvenilmez sonuçlar üretir. Ikincil plakalarına kadife hücreleri aktarırken diğer teknik hata çok fazla baskı uygulamaktadır. Yine, sekonder plakalar kuluçkaya sonra, sonuçta meydana gelen kolonilerin daha ziyade oksotrofi vs kontaminasyonu ile ilişkilendirilmiştir büyüme fenotipi üreten çakışabilir.
Tüm yabani-tip mikrobik türler prototrophs, bu nedenle kopya-pGeç işlem aynı anda karakteristik büyüme gereksinimleri için farklı vahşi-tip suşları taranması için de kullanılabilir. Şekil 13 de gösterildiği gibi, (panel A) YTA olarak adlandırılan tam kültür ortamı içeren bir ızgara işaretli plaka üzerinde kopya halinde ekildi dört farklı Pseudomonas bakteri suşları hücre "taneleri". Suşlar sonra üç ikincil plakalar üzerine çoğaltılır (panel B, C ve D), farklı bir karbon kaynağı (asetamid, laktoz, ve glisin, sırasıyla) ilave edilmiş en az orta (MSA) oluşmaktadır. Sonuçlar dört Pseudomonas suşlarının ikisinde (P. aeruginosa ve P. stutzeri) bu üç karbon kaynaklarının üzerinde büyüyen aciz olduğunu göstermektedir. Kontrol olarak, hücre suşları işlem boyunca aktarıldı teyit etmek için YTA orta ile dördüncü bir plaka üzerine tekrarlanmıştır. Dört suş YTA kontrol plaka üzerinde büyümek yana, büyüme eksikliği serinin önceki üç tabak sergilenen güvenilir. Çoğaltma kaplama sonuçları Tablo 1'de edilmektedir. Sık yapılan bir hata, bir pozitif sonuç olarak ikincil bir plaka üzerinde bir büyüme damgasını yorumluyor. Örneğin, P. fenotipi karşılaştırın P. aeruginosa buna MSA üzerinde stutzeri + asetamit (panel B). Ikincisi negatif bir sonuç büyüme, bir künye görüntüler ve önceki plakası besinlerin ebeveyn hücreler ile aktarılır oluşabilir. Eksik besin döl hücreleri için geçerli değildir çünkü hiçbir yeni hücre büyümesi meydana gelir. Bu gerçek büyüme ile bir künye karıştırmayın kolaydır. Şüpheniz varsa, deney ikincil medya üzerine birincil plakadan çizgisiz kaplama hücreleri gibi alternatif bir yöntem kullanarak tekrar edilmelidir.
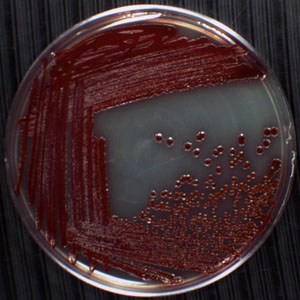
Şekil 1. Bir plaka üzerinde tek bir koloni örneği. Plakasının merkezine yakın pembe küreler Serratia marcesc kolonileri vardırens, Enterobacteriaceae ailesinin bir Gram negatif, çubuk şeklinde Proteobacterium. Nemli ortamlar için kendi tercihine bağlı olarak, bu mikroorganizmanın yaygın kiremit harç, ve duş perdeleri, lavabo havzalarda, küvet köşelerinde büyüyen bulunur. S. marcescens bu prodigiosin denilen kırmızımsı pigment üretir beri tanımak kolaydır. Bu plaka üzerinde koloniler 24 saat boyunca 30 ° C 'de dördüncü çeyrek daire izleyen inkübasyon görünen tek bir koloni ile, çizgi-plaka tekniği kullanılarak oluşturulmuştur. Diğer üç kadran hücrelere örtüşen kolonileri haline agar yüzeyinde biriken hangi birleşik gelişim göstermektedir.

Şekil 2. Aletleri streak-plate yöntemi için kullanılan. Yukarıdan aşağıya, kürdan (yuvarlak değil yassı), bir tel döngü, tek kullanımlık plastik döngü, ve tahta sopalarla vardır gösterilir. Kürdan tipik olarak aktarılırKullanmadan önce sterilize etmek için otoklava zaman aşağı sonra folyo ile kaplı geniş ucu ile küçük bir cam behere. Tahta çubuklar daha sonra kullanımdan önce sterilize etmek için otoklava 18 mm test tüplerine aktarılır.
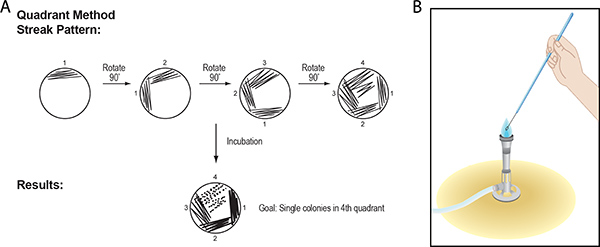
Şekil 3. Kadranda yöntemini kullanarak (A) Streak-plaka tekniği. Önceden sterilize döngü, çubuk, plaka ya da kürdan merkezine kenarından, bir hızlı, düz, geri ve dördüncü hareket ile agar yüzeyinden yaklaşık dörtte biri boyunca numune yaymak için kullanılır. Bu işlem, levha dört çeyrek her biri için tekrarlanır. Inkübasyon sonrasında, hücre büyümesi plaka hücreleri yatırmak için kullanılan aracın yol boyunca görünür. Bu teknik kullanılarak, bir karışık numune içinde hücrelerin mekanik olarak (örnek için bakınız Şekil 1) dördüncü çeyrek daire içinde tek bir koloni ile sonuçlanmalıdır. Tek koloni (cfu koloni oluşturan birim olarak adlandırılır). (B), bir metal döngü çizgi-kaplama için kullanıldığı zaman, bu inokulum ya da agar ortamı ile temas öncesinde bir Bunsen yakıcının alev kullanılarak sterilize edilmesi gerekmektedir. Alev sıcak parçası mavi konik ucu olduğunu hatırlayın. Enstrümanın Kolu tutarak, döngü 3-4 santim alev tel yerleştirin. Kırmızı ısınmasına tel için yeterince uzun bırakın. Alev döngü yaklaşır böylece tel taşıyın. Metal bir döngü inokulum dokunmadan önce soğutulur emin olun.

Şekil 4. Dökün-plaka tekniği. (A) örnek küçük bir hacim (ml 1,0-0,1 arasında) 5.0 ml serolojik pipet kullanarak boş ama steril Petri kabına aseptik sürülür. (B) yaklaşık 48 arasında bir sıcaklığa dengelenmiş ve erimiş agar ° C 'de numune ile Petri çanağı içine dökülür. Kapağını kapattıktan sonra, plaka yavaşça örnek mix ve swirled edilirerimiş agar. Agar sonra plakaları inkübasyon için ters çevrilir yaklaşık 30 dakika boyunca katılaşmaya bırakılır.
5 Şekil. Spread-plaka tekniği bir pikap ve cam serpme ile. Agar plaka bir döner tabla üzerine yerleştirildikten sonra, numune küçük bir hacim (0.1 'den 0.2 ml) bir mikropipet kullanılarak plak merkezi üzerine aseptik olarak dağıtılır. Serpme sonra fazla etanol tutuşturmak için Bunsen brülör alev geçirilerek etanol bir behere batırarak sterilize edilir. Numune ile temas etmeden önce, dağıtıcı levha kenarına yakın agar dokunarak soğutulması gerekmektedir. Pikap yavaş dönüyor ise serpme hafifçe plaka üzerinde örneklem yoluyla ileri ve geri hareket ettirilir. Bu eylem yavaş ama bile agar yüzeyi boyunca örnek yayılmasını sağlar. Kapağını kapattıktan sonra, plaka tezgah üst u ayarlanması gerekirörnek inkübasyon için ters çevirme plakasına önce agar içine tamamen absorbe etmek için izin vermek için en az 5 dakika süreyle ndisturbed.
Şekil 6. Cam boncuk (Copacabana Yöntemi) ile Yayılması-plaka tekniği. Bir otoklav içinde önceden sterilize edilmiştir cam boncuklar tezgah üstünde duran bir agar plaka yüzey üzerine dökülür. Örnek küçük bir miktarda (100-150 ul) bir mikropipet kullanılarak agar üzerine merkez aseptik olarak dağıtılır. Plaka kapağı kapalı şekilde, yatay bir sallama hareketi yavaşça levha ileri ve geri 6-7 kez boncuklar hareket ettirmek için kullanılır, örnek yayma. Bu eylem plakası 60 ° döndürmeyi sonra tekrarlanır. Sallayarak hareket başka bir 60 ° rotasyon sonrası üçüncü kez tekrarlanır. Örnek tamamen agar ortamı içine absorbe edildikten sonra, boncuklar% 10 ağartıcı ihtiva eden bir beher içine kapalı dökülür.plakalar sonra kuluçka için ters çevrilir.
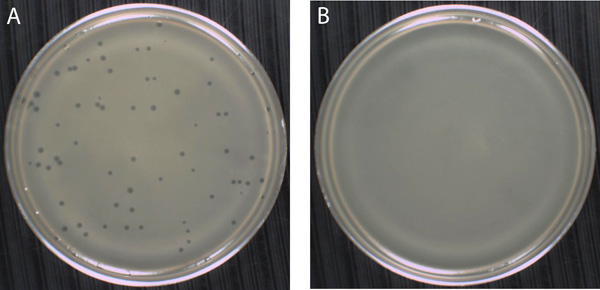
Şekil 7. Plak oluşumu (aynı zamanda bir plak tahlil adlandırılır) esas faj izole ve numaralandırmak için kullanılan Soft-agar çakıştırma tekniği. (A) faj varlığı, yumuşak agar içinde gelişen bakteri kolonileri konfluent bir süspansiyon üzerine, temizleme bölgeleri, veya plaklar ile tespit edilebilir. T4 Faj konak hücreleri döl faj lyse ve çıkarmasına sebep olan konak, Escherichia coli, enfekte bir düşmanca, çift iplikli DNA faj olduğunu. Enfeksiyon ve lizis, komşu E. sayıda mermi sonra Orijinal bulaştıkları hücreyi çevreleyen hemen alanında coli hücreleri T4 faj partiküllerinin milyarlarca içeren bir plak bırakarak kaybolur. T4 Faj çapı yaklaşık 1 mm plaklar üretir. Bu deneyde, bir faj, 2 x 10 8 pfu / ml stok, 10 -5 seyreltme 200 ul T4E. yaklaşık olarak 300 ul ile karıştırılır coli göstergesi hücreleri 37 ° C'de bir katlanarak büyüyen, havalandırmalı kültür olarak hazırlanan Faj ve bakteri, sonra bir EHA sert agar levhasının yüzeyi üzerine döküldü ve karışık bir EHA yumuşak agar tüp, ilave edilmiştir. Bu faj ve bakteriler bu durumda, kaplama önce adsorbe izin vermek için gerekli olmadığına dikkat ediniz. Yumuşak agar 20 dakika boyunca rahatsız edilmeden katılaştırmak için izin verdikten sonra, plakalar 24 saat boyunca 37 ° C 'de ve ters inkübe edildi. (B) ayrı koloniler görünür olmadığı, yumuşak agar içinde bir hücre bulutlu süspansiyon içinde faj partikülleri, bakteri büyüme sonuçları enfekte yokluğunda. Bunun yerine, bu durumda, bakteri hücrelerinin bile çim, E. Tüm yumuşak agar katman boyunca coli, formlar.
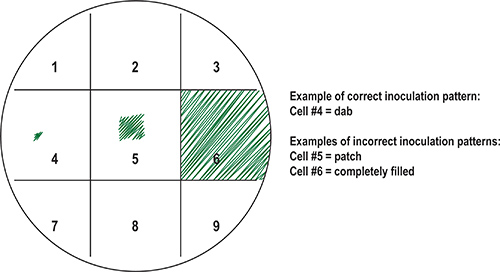
Şekil 8. Bakteriyel örnekleri ile primer plaka (master) hazırlanması. Organize örnekleri tutmak için, plakanın alt bir ızgara içine işaretlenir ve çıkan kareler sayılı edilebilir. Her numune ızgara üzerinde bir kare atanabilir. Gösterilen Doğru karşısında yanlış aşılama desen örnekleridir. İdeal olarak, küçük bir hücre sayısı, "DAB" için bir örnek kürdan (hücre # 4) gibi bir steril aşılama aracı kullanarak meydan merkezine aktarılmaktadır. Böyle hücre # 5 ("patch") ve hücre # 6 ("dolgu") tasvir gibi Yaygın aşılama hataları, inkübasyon sonrası bakteri örnekleri büyümesi sonucu, dolayısıyla kontamine bitişik kareler.
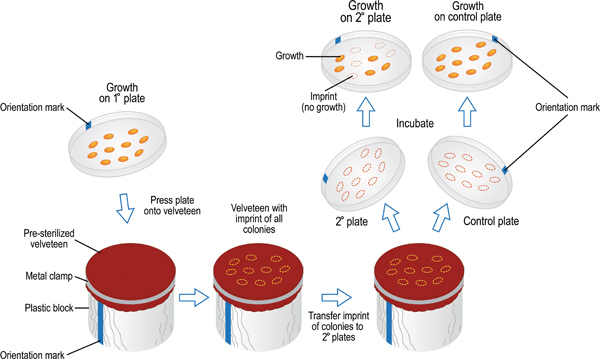
Şekil 9. Fenotipi ekranlar için ikincil plakaları birincil hücreleri aktarmak için kullanılan çoğaltma plaka tekniği. Primer plaka işareti daha sonra kadife kaplı blok lowe üzerindeki işaret ile aynı hizaya agar yüzeyini bezle temas sağlamak için kırmızı. Hücreler hafifçe tarafından plaka kadife transfer ama eşit parmak uçları ile primer plaka üzerine bastırarak edilir. Bu işlem, ana levha ile aynı uzaysal desen kadife ile ilgili hücre örneklerinin bir iz bırakır. Aynı prosedür kadife ikincil bir plaka hücre transfer etmek için kullanılır. Gibi çok sayıda 7-8 gibi ikincil plakalar kadife ile ilgili aynı temel levha izlenim ile inoküle edilebilir. Kadife inoküle son plaka pozitif kontrol olarak hizmet etmelidir. Bu plakalar, tüm seri boyunca meydana yeterli hücre aktarımını sağlamak, test edilen tüm suşların büyümesini destekleyen bir ortam olmalıdır. Inkübasyon sonrasında, ikincil plakaları hiçbir büyüme karşısında büyüme için teftiş ve atılır olabilir. Böylece, birden çok bakteri suşları tek bir deneyde çeşitli büyüme ortamları aynı anda taranabilir.
_upload/3064/3064fig10.jpg "/>
10 Şekil. Pour-plak tekniği kullanılarak Örnek sonuç. Bir sebil toplanan su bir 1.0 ml örnek steril bir boş Petri akar edildi. Daha sonra erimiş ancak soğutulmuş YTA numune ile çanak içine döküldü. Agar da 100 mikrogram / su numunesi mevcut olabilir maya ve küf gelişimini engellemek için ml sikloheksimid içeriyordu. Karışıma yavaşça dönen sonra, plaka bir düz yüzey üzerine ayarlandı ve agar tamamen katılaşmaya bırakıldı. Levha 48 saat boyunca 37 ° C'de inkübe edildi. Gösterilen Bu deneyin sonucudur. Katılaştırılmış ortam alt yüzey olarak yayılan koloni inhibe çünkü çok küçük düzensiz şekil ve yüzey şekli ve geniş dairesel koloniler, karşı alt yüzey koloniler, bir görünüş halinde fark not edin.

11 Şekil. </ Strong> yayma plak tekniği kullanılarak Örnek sonuç. "Copacabana Yöntemi" plaka bir tarama deneyi için E. coli hücreleri oluşan bir karışım kullanıldı. Bu durumda, büyüme ortamı (LB) X-Gal içerir, bu yüzden, bir fonksiyonel β-galaktosidaz enzim şekil mavi koloniler eksprese eden bu hücreleri ise, bu lacZ geni içinde bir mutasyon ile hücreler ve bir işlevsel β-galaktosidaz enzim şeklinde ifade böylece yapamaz beyaz koloniler. Çoğu zaman, bir "beyaz / siyah ekran" olarak anılacaktır, koloniler iki tip kolayca aynı plaka üzerinde birbirinden ayırt edilebilir.

Şekil 12. Yumuşak agar bindirme tekniği kullanılarak plak tahlil örneği sonucudur. Gösterilen iki farklı ph konak suşu Mycobacterium smegmatis'in mc 2 155 (ATCC 700084) üzerinde oluşan plaklar vardıryaş: (A) Mycobacteriophage Destroyers ve (B) Mycobacteriophage MSSS. Bu faj 2010 baharında UCLA laboratuar dersi MIMG 103L öğrenciler tarafından izole edildi. M. smegmatis'in patojen olmayan bir Actinobacterium ve tüberküloz (M. tuberculosis, M. africanum, M. bovis) ve cüzam (M. leprae) gibi ciddi hastalıklara neden olduğu bilinen bir kaç patojenler içeren mikobakteri bir aile aittir. Muhriplerinin bir 10 -2 seyreltme ve MSSS her biri bir 10 -3 seyreltme yaklaşık 50 ul M. 500 ul ile inkübe edildi 37. az 20 dakika boyunca smegmatis ° C 'de MBTA (yumuşak agar) ile karıştırılır ve plakaları (sert agar) MHA üzerine döküldü. Yumuşak agar 20 dakika boyunca rahatsız edilmeden katılaştırmak için izin verdikten sonra, plakalar 48 saat boyunca 37 ° C 'de ve ters inkübe edildi. Her bir faj tarafından üretilen farklı morfolojiler plak not edin. Destroyers (A) küçük formları (yaklaşık 1 mm ortalama çap), litik faj açık plaklar karakteristikMSSS (B) bulanık bir halo (yaklaşık 3.2 mm ortalama çap) ile çevrili açık merkezleri ile büyük bir "boğa gözü" plaklar gelişir ise. Puslu halka enfeksiyon faj dirençli bakterilerin oluşan edilebilir. Bu desen bulanık plaklar üretmek lysogenic faj, oluşturduğu bu farklıdır.
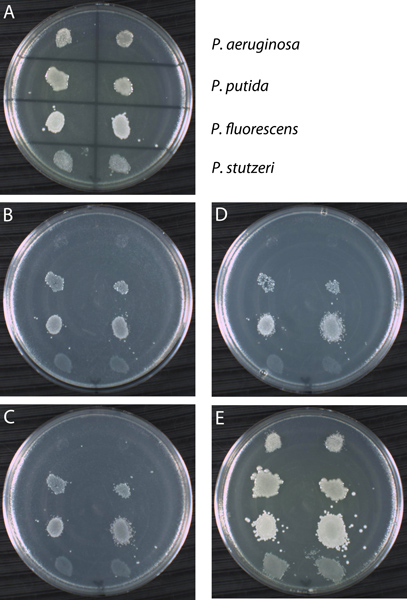
Şekil 13. Kopya plaka prosedürü kullanarak Örnek sonuç. Asetamid, laktoz ve glisin: Dört Pseudomonas suşları (P. aeruginosa, P. putida, P. fluorescens ve P. stutzeri) üç farklı karbon kaynaklarına büyüme için kopya halinde test edilmiştir. (A) temel levhası olarak gösterilen dört suşu ile inoküle edilmiş bir tam bir ortam (YTA) 'dir. 24 saat için 30 ° C sıcaklıkta inkübasyon sonrasında, tüm dört suş YTA büyür. Birinci plaka üzerine en az me kopya plaka kullanılmıştırsodyum (MSA), bir tek karbon kaynağı ile tamamlanmıştır: asetamit (B), laktoz (C) ve glisin (D). Seri olarak geçen levha, pozitif bir kontrol YTA plaka (E) idi. Gösterildiği gibi, suşların ikincil plakalar üzerinde inkübasyon sonrasında değişken büyüme modelleri göstermektedir. Bazen büyüme ve hücre bir iz ayırt etmenin zor olduğunu unutmayın. Örneğin, S. tarafından oluşturulan baskı karşılaştırmak P. tarafından aynı üç tabak üzerinde büyüme üç MSA plakaları stutzeri aeruginosa. Hem P. tarafından sergilenen büyüme modelleri ile karşılaştırıldığında negatif sonuçlar putida ve P. fluorescens. Ancak, tüm suşlar pozitif kontrol plakası doğrulayan hücreleri üzerinde büyümeye serideki tüm ikincil plakaları aktarılmıştır. Bu deneyin sonuçları Tablo 1 de gösterilmiştir.
| YTA (Birincil) | MSA + asetamid | MSA + laktoz | MSA + glisin | YTA (Kontrol) | |
| P. aeruginosa | + | - | - | - | + |
| P. putida | + | + | + | + | + |
| P. fluorescens | + | + | + | + | + |
| P. stutzeri | + | - | - | - | + |
Çoğaltma kaplama sonuçları Tablo 1. Özeti. (-) Büyüme artı işareti (+) ve eksi işareti olarak temsil hiçbir büyüme olarak gösterilir. YTA tam bir ortam (maya tripton agar) ve MSA en az bir ortam (minimal tuzları agar) 'dir. Belirtildiği gibi MSA plakaları tek bir karbon kaynağı ile takviye edilmiştir.
Tartışmalar
Mikroorganizmalar aseptik teknik hücreleri ve medya manipülasyonu boyunca muhafaza gerektirir her hangi kaplama yöntemleri, bir dizi içerir. Beş farklı prosedürler bu protokolü açıklanan edildi. Bu kaplama teknikleri rutin bakteri ve faj işlemek için kullanılıyor olsa da, onlar da (yaygın, maya (yani, Saccharomyces cerevisiae, Candida albicans, Schizosaccharomyces pombe), yosun gibi moleküler genetik biliminde kullanılan ve protozoa memeli hücre kültürü ve ökaryotik mikroorganizmalar için uygulanabilir yani, Volvox, Chlamydomonas, Amoeba, Paramecium) ve nematod (yani, Caenorhabditis elegans). Ayrıca çalışma kapsamında deneysel hedef veya organizmaya bağlı olarak her bir kaplama metodu çok sayıda (ve hatta daha sofistike) varyasyonları vardır. Bu nedenle, yalnızca metodoloji, t, belirli bir deney ya da hedef mikroorganizma için en uygun yöntem seçmek için değil, aynı zamanda özel olarak değil önemlidirşapka deney sonuçları uygun araştırma sorusu veya sorunu çözmek.
Bu protokolde ele kaplama tekniklerinin en güncel uygulamaların bazıları tarama ve ilaç keşfi deneyler için high-throughput sonuçlar teknolojik gelişmeler içerir. Örneğin, genom dizileme merkezleri E. olan, yayılma kaplama klon kütüphaneler için "Copacabana Yöntemi" kullanmak coli hücreleri, bir mikroorganizma genomu elde edilen DNA fragmanları içeren plazmidler ile transforme. Büyük plaka onlarca (bioassay tepsiler olarak da adlandırılır) aynı anda hazırlanır, çünkü otomatik bir plaka çalkalayıcısı tepsilerin bütün parti için cam boncuklar çalkalamak için kullanılır. Ayrıca, inkübasyon sonrasında, bu plakalar koloniler seçerken, robotik bir koloni toplayıcı 384-kuyucuklu mikroplaklar LB et suyu için aşı malzemesi olarak uygun kolonilerden gelen hücreler toplamak için kullanılır. Bu yüksek hacimli tarama testi, yayılma-p usul ilkeleri içinGeç yöntem uygulanır, ancak farklı teknoloji adımlar otomatik olarak gerçekleşir ve aynı anda ve kısa bir zaman dilimi içerisinde analiz edilecek numuneler çok sayıda izin şekilde ölçeklendirilir izin verir.
Biyoteknoloji ve ilaç firmaları mikrobiyoloji ve moleküler genetik alanında en temel teknikleri için high-throughput teknolojisinin geliştirilmesinde önemli kaynaklar yatırım. Örneğin, Bir seferde 8 veya 12 örnek için ses transferleri gerçekleştirmek için çok kanallı Mikropipetler vardır. Hatta robotik iş istasyonları manevrası 96-kanallı pipet kafa vardır! Bu çabalar deneyler ile ilişkili mekanik işlemleri gerçekleştirmek için gerekli enstrümantasyon gelişebilir mühendisler ve bilgisayar programcıları ile metodolojik uzmanlığa sahip biyologlar eşleştirme, bilim adamlarının çok disiplinli takımlarda içerir. Ne olursa olsun araştırma uygulama, bu teknolojilerin gelişmekte şirketleri tarafından paylaşılan hedefi aynıdır - Laboratories'in otomatikleştirmek içinry süreçleri, araçları, sistemleri ve araçları, bunları yoğun az emek ve daha verimli hale getirmek.
Açıklamalar
Ben ifşa etmek başka bir şey var.
Teşekkürler
Örnek kültürleri kurma ve rakamlar ile yardım için illüstrasyonlar hazırlamak ve Kris Reddi ve UCLA Bhairav Şah için IROC Designs Cori Sanders özel teşekkürler. Bu proje için Harçlar HHMI (HHMI Hibe No 52006944) tarafından sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1. Yeast Tryptone Agar (YTA)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. If preparing tubes for the pour-plate procedure, allow the agar to cool to ~55°C then add 2.0 ml of 50 mg/ml cycloheximide. Aseptically dispense 18.0 ml of the melted agar per 18 mm tube then store at 4°C. The agar will solidify and will need to be melted in a steamer or microwave prior to use. 2. Minimal Salts Agar (MSA) + 0.1% (w/v) carbon source
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. * Carbon sources used for experiments presented in Figure 13 include acetamide, lactose, and glycine. ** Trace salts solution is prepared in 0.1 N HCl as follows. It is added to the base before sterilization (autoclave at 121°C for 20 minutes).
3. EHA soft agar (0.65 % w/v)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. 4. EHA hard agar (1.2% w/v)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. 5. 1X Middlebrook Top Agar (MBTA soft agar, 0.5% w/v)
Melt 50 ml of 2XTA and allow it to cool to ~55°C. Using aseptic technique, add the CaCl2 and 7H9 broth to the melted agar. Aseptically dispense 4.5 ml of the mixture per 13 mm tube and store in a 55°C incubator ≤7 days. Cooling MBTA to room temperature or 4°C will cause the CaCl2 to precipitate out of solution. * 100 mM CaCl2. stock must be stored at room temperature to prevent CaCl2 from precipitating out of solution. ** 7H9 liquid medium: Neat
Mix the base with water then add the glycerol while stirring. Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. *** 2X Middlebrook Top Agar (2XTA, 1.0% w/v)
Autoclave at 121°C for 20 minutes to sterilize. Dispense 50 ml aliquots into 100 ml bottles and store at 4°C. 6. Middlebrook 7H10 Agar Plates (MHA hard agar, 1.9% w/v)
Mix the agar base with water then add the glycerol while stirring. Heat the solution to boiling then stir for one minute to completely dissolve the base powder. Autoclave at 121°C for 20 minutes to sterilize. Allow the agar to cool to ~55°C then aseptically add the following reagents:
* AD supplement
Filter-sterilize this solution; do not autoclave. Store at 4°C. ** Filter-sterilize and store these solutions at 4°C for ≤60 days. 7. LB agar (1.5% w/v) + X-Gal (60 μg/ml)
Autoclave at 121°C for 20 minutes to sterilize. Allow the agar to cool to ~55°C then aseptically add 3.0 ml of 20 mg/ml X-Gal solution. Freshly prepare X-gal stock by dissolving 400 mg X-Gal in 20 ml dimethylformamide (DMF). Table of specific reagents:
Table of specific equipment:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Referanslar
- Barker, K. At the Bench: A Laboratory Navigator. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. (1998).
- US Department of Health and Human Services (DHHS). Biosafety in Microbiological And Biomedical Laboratories (BMBL). , 5th, U.S. Government Printing Office. Washington DC. Available from: http://www.cdc.gov/biosafety/publications/bmbl5/index.htm (2009).
- Dulbecco, R., Vogt, M. Some problems of animal virology as studied by the plaque technique. Cold Spring Harbor Symp. Quant. Biol. 18, 273-279 (1953).
- Fields, B. N., Knipe, D. M., Chanock, R. M., Hirsch, M. S., Melnick, J. L., Monath, T. P., Roizman, B. Fields Virology. 1, 2nd, Raven Press. New York, NY. (1991).
- Gilbert, R. A., Ouwerkerk, D., Zhang, L. H., Klieve, A. V. Cooperative Research Center for Beef Genetic Technologies. In vitro detection and primary cultivation of bacteria producing materials inhibitory to ruminal methanogens. Journal of Microbiological Methods. 80, 217-218 (2010).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. BioTechniques. 23, 648-650 (1997).
- Karam, J. D. Molecular Biology of Bacteriophage T4. , ASM Press. Washington, DC. (1994).
- Knipe, D. M., Howley, P. M., Griffin, D. E., Lamb, R. A., Martin, M. A., Roizman, B., Straus, S. E. Fundamental Virology. , 4th, Lippincott, Williams, and Wilkins. Philadelphia, PA. (2001).
- Lederberg, J., Lederberg, E. M. Replica plating and indirect selection of bacterial mutants. J. Bacteriol. 63, 399-406 (1952).
- Miller, J. H. A Short Course in Bacterial Genetics: A Laboratory Manual and Handbook for Escherichia coli and related bacteria. , Cold Spring Harbor Laboratory Press. Plainview, NY. (1992).
- Mills, K. V., Gareau, J. R., Garcia, A. M. Low-cost modification to the Copacabana method for spreading transformation mixtures. BioTechniques. 39, 188(2005).
- Jordan, T., et al. RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , Howard Hughes Medical Institute. (2008).
- Sambrook, J., Russell, D. W. Molecular Cloning - A Laboratory Manual. , 3rd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. (2001).
- Sanders, E. R., Miller, J. H. I. Microbiologist: A Discovery-based Course in Microbial Ecology and Molecular Evolution. , ASM Press. Washington, DC. (2010).
- Slonczewski, J. L., Foster, J. W. Microbiology - An Evolving Science. , 2nd, W.W. Norton & Co., Inc. New York, NY. (2011).
- Teather, R. M., Wood, P. J. Use of Congo Red-Polysaccharide Interactions in Enumeration and Characterization of Cellulolytic Bacteria from the Bovine Rumen. Applied and Environmental Microbiology. 43, 777-780 (1982).
- Wise, K. Preparing Spread Plates Protocols. , Available from: http://www.microbelibrary.org/index.php/component/resource/laboratory-test/3085-preparing-spread-plates-protocols (2006).
- Worthington, M., Luo, R. Q., Pelo, J. Copacabana method for spreading E. coli and yeast colonies. BioTechniques. 30, 738-742 (2001).
- American Type Culture Collection (ATCC). , Available from: http://www.atcc.org/ (2012).
- EPA Microbiology Home Page. , Available from: http://www.epa.gov/nerlcwww/index.html (2012).
- The GENE Project: Laboratory Methods and Materials. , Available from: http://www.phys.ksu.edu/gene/g1.html (2012).
- Joint Genome Institute (JGI) Genome Sequencing Protocols: Library Plating Protocol. , Available from: http://www.jgi.doe.gov/sequencing/protocols/prots_production.html (2012).
- Microbial Genetics (maintained by Stanley Maloy at UCSD). , Available from: http://www.sci.sdsu.edu/~smaloy/MicrobialGenetics (2012).
- Organization of American States (OAS) Department of Sustainable Development (DSD). , Available from: http://www.oas.org/DSD/publications/Unit/oea59e/ch26.htm (2012).
- Public Health Agency of Canada: Material Safety Data Sheets (MSDS) for Infectious Substances. , Available from: http://www.phac-aspc.gc.ca/msds-ftss (2012).
- United States Environmental Protection Agency (EPA) Office of Water. , Available from: http://water.epa.gov (2012).
- American Society for Microbiology (ASM)'s Curriculum Recommendations Microbiology Majors Program. , Available from: http://www.asm.org/asm/index.php/unknown/asm-s-curriculum-recommendations-microbiology-majors-program.html (2012).
- Introductory Course in Microbiology. , Available from: http://www.asm.org/asm/index.php/unknown/asm-s-curriculum-recommendations-introductory-course-in-microbiology.html (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır