Method Article
無菌実験技術:めっき法
要約
文化微生物に使用されるメディアや試薬を扱う場合は、無菌操作は、汚染が最小化されていることを確認するために練習する必要があります。メッキの様々な方法が日常的に、分離、伝播または列挙細菌やファージ、実験材料の無菌性を維持する手順を組み込むすべてがために使用されます。
要約
微生物は、実験室での汚染の可能性のユビキタスソースを作成するすべての無生物表面上に存在しています。実験の成功は、作業面や機器を消毒するだけでなく、非滅菌表面と滅菌機器やソリューションの接触を防ぐために科学者の能力に依存しています。ここでは日常的に分離、伝播、あるいは細菌やファージなどの微生物を列挙するために実験室で使用されるいくつかのメッキ方法の手順を提示します。すべての5つのメソッドは、無菌操作、または実験材料の無菌性を維持する手順が組み込まれています。説明する手順は、単一のコロニーを分離する(1)筋メッキ細菌培養、(2)注ぐメッキ(3)拡散メッキ可能な細菌のコロニーを列挙するために、ファージおよび列挙プラークを単離するために(4)ソフト寒天オーバーレイ、および(含まれてい5)レプリカメッキ同一の空間的なパターンで別のプレートから細胞を転送します。これらの手順は、tで実行することができます彼の実験室のベンチは、彼らが微生物の非病原性株(バイオセーフティレベル1、BSL-1)を含む提供した。 BSL-2の生物を扱う場合、これらの操作はバイオセーフティーキャビネットで行われなければなりません。バイオハザード分類と同様に、問題の微生物に必要な安全上の注意と封じ込め施設を決定するために感染性物質用の最新の微生物とバイオメディカル研究所におけるバイオセーフティの版(BMBL)だけでなく、 化学物質等安全データシート (MSDS)を参照してください。菌株とファージ株は、 アメリカンタイプカルチャーコレクション (ATCC)などの特定の組織によって維持され、研究調査官、企業、およびコレクションから取得することができます。それは、様々なめっき法を学習するときに非病原性菌株を使用することをお勧めします。このプロトコルに記載されている手順に従うことによって、学生のことができるようになります。
- contaminatiなく、メッキの手順を実行しますngのメディア。
- ストリークめっき法により、単一の細菌のコロニーを分離します。
- 細菌の濃度を決定するために注ぐメッキと拡散メッキメソッドを使用します。
- ファージで作業する場合、ソフト寒天オーバーレイを実行します。
- 1プレートからレプリカメッキプロシージャを使用して別の細菌細胞を転送します。
- 実験的なタスクが割り当てられ、適切なメッキ方法を選択します。
プロトコル
1。安全で無菌スペースを準備します。
- 微生物を扱うときにとられるすべての実験室でのルールや安全上の注意事項に精通している。かかわらず、バイオハザード分類、微生物と接触するすべての材料は感染性廃棄物とみなされ、廃棄前に汚染除去しなければなりません。潜在的に汚染物質の迅速かつ適切な処分(バイオハザード)の適切な廃棄容器を設定し、制度環境·健康·安全部門によって提供されるに従い、安全性のガイドラインに従ってください。
- 前のメッキの手続きのためにそれらを使用するすべての機器、ソリューション、およびメディアを殺菌する。
- 実験台上で作業領域を乱雑にすべての材料を取り除く。
- 汚染の可能性を最小限に抑えるために消毒して作業領域をきれいにします。
- 慎重に、ゆっくりとブンゼンバーナーや作業を設定し、意図的にupdraによって作成された無菌のフィールドエリア内炎のフィート
- BSL-2の生物を扱う場合には、バイオセイフティ·キャビネットにワークスペースを設定します。火炎からの熱は、その機能に不可欠な空気の流れを中断させるためブンゼンバーナーは、キャビネットの内部で使用することはできません。
- 滅菌したフィールドの近くの実験ベンチ上の手続きに必要なすべての電源を配置します。すべての材料が適切にラベル付けされていることを確認します。作業効率を最大化し、不要な動きを避けるために、作業領域を整理すると、空気中の汚染物質への、実験材料の露光時間を最小限に抑えることができます。
- ベンチの上に右手にブンゼンバーナーを配置します。
- 左に寒天プレートやペトリ皿を置きます。
- ベンチの中央に細胞培養、チューブ、フラスコ、ボトルを配置します。
- 彼らは簡単に、後続の操作時に片手で開くことができるようにチューブ、フラスコ、ボトルのキャップを緩めます。
- 防腐剤石鹸と温水で十分に手を洗う微生物を取り扱う前に、水。
2。ストリークプレート手順:象限法を用いた細菌コロニーの単離
ストリークプレート手順は、単純な機械的分離による混合集団から、純粋な細菌の培養、またはコロニーを分離するために設計されています。単一のコロニー( 図1)または寒天プレート内のクラスタに増殖する細胞の数百万人で構成されています。コロニーは、単一のセルとは異なり、肉眼で見えるようになります。理論的には、コロニー内のすべてのセルは、最初にプレート上に堆積し、単一の細菌に由来されており、したがって、クローン、または遺伝的に同一の細胞のクラスターと呼ばれています。
- 細菌は形や大きさの様々に存在しています。 連鎖球菌細胞が1μmの平均粒径を有する球状いる間たとえば、個々の大腸菌細胞は2μmと0.5μmの幅の平均の長さで棒状である。いくつかの細菌(SUE.としてCH他の関連の明確なパターンを形成しながら、 大腸菌 ) は、単一の細胞として存在しています。 連鎖球菌は 、例えば、ペアまたはフォーム鎖または細胞のクラスターに成長する。それは一般的に単一コロニーが二分裂を経て、単一細胞から生じることが想定されるが、この仮定は自然にペア、チェーン、またはクラスタや他のメカニズムによってその格差として存在し、それらの細菌には当てはまりません。あまりにも多くの細菌がメッキである場合あるいは、その後、細胞の重なりが発生し、単一コロニーに見えるものを生み出して二つ以上の細菌の確率を高める可能性があります。固形培地上で生育する細菌培養を記述または列挙するときに、これらの合併症を避けるために、コロニーは、 コロニー形成単位(CFU)と呼ばれています。
ストリークプレート手順では、細胞の混合物をペトリ皿の中の半固体寒天ベースの栄養培地の表面のように少なくなり、細菌に広がっている細胞を培地の表面に広く区切られた点で堆積し、インキュベーションした後、コロニーへと発展しています。細胞の混合物から単一のコロニーを単離するための象限法はここで説明されます。
- ストリークめっきは、さまざまな楽器の数( 図2)を達成することができます。金属製のループが複数回再使用することができ、ストリークめっきルーチンの実験室株のために利用されています。使い捨てのプラスチック製のループは市販されており、バイオセーフティキャビネットにBSL-2株を扱う場合、より一般的に使用されています。多くの研究者達は、ストリークメッキ用使い捨て、あらかじめ滅菌木の棒やフラット爪楊枝を使用して好む。これらは使い捨てのプラスチック製のループへの安価な代替手段であり、可能性芽胞形成菌を含む土壌等の環境試料を扱う場合に特に役立ちます。
- 使い捨ての事前滅菌スティックや爪楊枝は、ブンゼンバーナー木で叩かれる必要はありませんsは芽胞形成菌や胞子の実験室での表面または寒天プレートの交差汚染の不必要なエアロゾル化を防止します。
- 少なくともあなたの名前、日付、増殖培地の種類、培地上に播種する生物の種類と寒天プレートの底部(いない蓋)のエッジの周りのラベル。
- プレートは蓋とストリークめっき前に室温に予め温めておいた上で凝縮することなく完全に乾燥しなければなりません。プレートを4℃で保存されている場合、それらも数時間または前の日を削除します。以上より2〜3プレートの小さな千鳥スタックでそれらを広げ、それらを乾燥させます。
- 縞板を接種されるからサンプルは、別の寒天プレートから培養液中の細胞懸濁液、または既存の植民地のどちらかである可能性があります。開始するには、それは1つだけサンプルが単一のプレートに接種するために使用することをお勧めします。時間と材料を節約するために、単板は、複数のSAMPに使用することができますLESは一度だけあなたは、プレート上の1つのサンプルをストリーキングで堪能になる。
- 第一象限では、サンプルがピックアップされ、行ったり来たりの、滑らかで、急激な動き( 図3のパネル)を使用して媒体の表面の約4分の1以上に広がる。ベンチからの反転プレートの下半分を持ち上げます。プレートの中心にリムから寒天表面を横切って前後に何度もループ、スティック、または爪楊枝を移動します。
- 接種は、細胞懸濁液である場合は、ピペットを用いた金属ループまたは5〜10μlの白金耳を取得します。渦や渦めっきのアリコートを取り外す前に、細胞懸濁液を必ず。この手順を実行中にループだけでなく、前と接種物を除去した後、ボトルやチューブのリムだけでなく、炎、無菌技術を使用しています。また、ピペットのループやバレルとチューブやボトルの側面に触れないでください。接種をピペッティングした場合、appropに細胞懸濁液を分注するプレートの第一象限にそれを広めるために、ループスティックや爪楊枝を使用して、プレート上で行われriate。
- 接種は、別のプレートからコロニーであれば、静かにプレートの第一象限の上に広げてから、ループ、スティックや爪楊枝でコロニーをタッチします。金属製のループがコロニーに触れる前に冷却されることを確認してください。ループが高すぎないことを確認するには、noストリーキングは発生しません指定されたエリア内の寒天プレート上に軽くタッチします。わずか数細胞はコロニー全体ではなく、コロニーから必要とされている。
- 金属製のループを使用している場合、炎はそれがプレート( 図3のパネルB)の接種を取得する前に、ブンゼンバーナーを使用します。青錐体、炎の最も熱い部分の先端に針金で、ループ3〜4インチ約を開始します。金属はレッドホットになるはずです。炎がループに近づくように、線を移動します。この操作は、前回の使用からループに残された菌のエアロゾル化を防ぐことができます。
- 炎は殺す熱せられた空気から細菌(芽胞ませんが)と対流電流は、その後の操作中に金属線の上に沈降から他の空気中の汚染物質を防ぐことができます。
- 滅菌した平らな楊枝を使用している場合は、培地中に10〜20°の角度で親指と薬指の間に静かに狭い方の端を保持し、ストリークに象限をワイド端を使用しています。ループや木の棒を使用している場合は、同じ角度で鉛筆のようにそれを保持します。ループ、スティックや爪楊枝の発掘その寒天に懸命に押さないでください。
- 第一象限を完了した後、ベンチの上に蓋にバックプレートを反転し、上下セット。ステップ#4で説明したようにスティックや爪楊枝や再炎の金属ループを廃棄してください。
- ストリーク第二象限のにペトリ皿に90°回します。ベンチからの反転プレートの下半分を持ち上げ、最後のストリークの終わりに近い第一象限にループ、スティックや爪楊枝をタッチします。バック前後のパターンを使用して、ラスベガスを渡る第一象限におけるストリークのトンの半分は、空の第二象限に移動します。第二象限がいっぱいになると反転して戻ってベンチで蓋にプレートを設定します。
- ループは、スティックや爪楊枝は、最も独創的な接種が堆積した第一象限におけるストリークの前半に戻ってはいけません。
- 新しいプラスチックのループ、木の棒や爪楊枝は、各象限を使用する必要があります。
- 3番目と4番目の象限のために二度、ステップ#6を繰り返します。
- スティックや爪楊枝や再炎各象限の間に金属製のループを処分するようにしてください。
- 第四象限をストリーキングときに第一象限に入ることは避けてください。
- 蓋に溜まった結露がコロニーに滴下しないように逆さまにプレートをインキュベートします。
3。プレートの手順を注ぐ:混合サンプルの細菌細胞の列挙を
このメソッドは頻繁に使用することです前にその固化溶融寒天培地に追加された混合試料中の微生物の数をカウントするには、d。プロセス均一に適切なサンプル希釈がメッキされた固体培地全体に分散コロニーの結果。この手法は、寒天内で、単一のプレート上の寒天の表面上のコロニー形成単位数の合計が列挙されている実行可能なプレートカウントを実行するために使用されます。実行可能なプレートカウントは、科学者、成長曲線を生成するためのサンプルがメッキされたチューブ内で細胞の濃度を計算するために、細菌細胞の生存や成長率の様々な環境や成長条件の影響を調べるために標準化された手段を提供します。
- 少なくともあなたの名前で滅菌が空のペトリ皿の底(いない蓋)のエッジの周りのラベル、日付、増殖培地の種類、生物の種類は、溶かした寒天培地に添加することができます。
- プラットフォームであれば希釈係数が含まれてい段階希釈するか、サンプル中の細胞濃度の系統的な減少をもたらす繰り返さ希釈系列を、ING。サンプル中の細胞数が統計的に有意な範囲は30から300 CFUである寒天プレートの容量を超える場合は希釈系列を準備する必要があります。プレート上で300以上のCFUがある場合は、コロニーは混雑と重複になります。
- 溶かした寒天培地18mlの入ったチューブを取得します。
- 寒天培地を試験管に分注し、オートクレーブで事前に滅菌する必要があります。それは実験のために必要されているのと同じ日に、寒天は、その後55°Cのウォーターバスに転送さ30分間蒸し器で溶融する必要があります。それが再使用できないので、実験に必要とされる量だけ寒天が溶けなければなりません。
- 十分のプレートを注ぐ前に、溶かした寒天のチューブは、労働力の上にヒートブロックを55°Cのウォーターバスから転送する必要があります48で設定されatoryベンチ℃に寒天は、この温度に達すると、それが注ぐ準備ができています。寒天が高すぎる場合には、試料中の細菌が殺されるかもしれません。寒天があまりにもクールであれば、媒体は一度固化したゴツゴツかもしれません。
- ブロス培養または緩衝液または生理食塩水にコロニーから混合細胞により産生された細胞の懸濁液のいずれかであるべきで、サンプルを入手してください。
- サンプルは単一のサンプルの希釈系列から導出することができる。
- メッキされるサンプル量は0.1〜1.0ミリリットルでなければなりません。
- 空のペトリ皿の蓋を開き、プレートの中央( 図4のパネル)にサンプルを分注する。蓋を閉じます。
- この手順全体の無菌技術を使用しています。
- プレートにサンプルを転送するために血清ピペットやピペットのいずれかを使用します。それはプレートの外にかからないように、サンプルの流れを制御する。
- 浴槽からキャップを外し溶かした寒天のe、およびブンゼンバーナーの炎によって開管の縁を渡します。
- あなたのサンプルを含むペトリ皿の蓋を開き、慎重に( 図4のパネルB)に寒天を注ぐ。静かにプレートを旋回して寒天でサンプルをミックスして蓋を閉じます。
- 寒天は、徹底的にインキュベーションの反転プレートの前に固化することができます。
4。拡散プレート手順:プレートカウント、濃縮、選択またはスクリーニングのための離散細菌コロニーの形成
この手法は一般的に細胞の適切な濃度がめっきされる場合寒天表面に均等に分散離散コロニーが形成され、その結果、寒天プレートの表面に広がっている小さな試料体積内に含まれている微生物を分離するために使用されています。実行可能なプレートカウントのためにこのテクニックを使用することに加えて、コロニーの総数が歌うの単位を形成するル板が列挙され、試料がメッキされたチューブ内で細胞の濃度を計算するために使用され、拡散メッキは日常的に濃縮、選択、およびスクリーニング実験に使用されています。これらの3つの実験のための望ましい結果は、通常、離散的コロニーの分布は、寒天の表面を横切って形成しているプレートカウント用と同じです。しかし、目標は、 すべての生細胞がコロニーを形成することを確認することではありません。代わりに、特定の遺伝子型を持つ集団内の細胞のみが成長する必要があります。彼らは流動プレートプロシージャを使用して寒天に埋め込まれているになるのに対し、コロニーが寒天の表面に利用しやすく成長するので、最終目標は、さらに分析するためにコロニーを分離する場合、拡散板の手順は、列挙型の実験のために流動プレート技術を介して使用することができる。
拡散板の手順については、ここで説明する2つの方法があります。最初の(メソッド)はターンテーブル、ガラスや金属、ROの使用を含むdはホッケースティックのような形。 "コパカバーナ法"と呼ばれ、(B法)二つ目は、あらかじめ滅菌したガラスビーズを振っ含まれます。両方でも、寒天表面を横切って細胞の拡散を容易にします。
方法:ターンテーブル、ガラスや金属棒で拡散メッキ
- 少なくともあなたの名前、日付、増殖培地の種類、培地上に播種する生物の種類と寒天プレートの底部(いない蓋)のエッジの周りのラベル。
- 連続希釈液をメッキする場合は、希釈率が含まれています。
- プレートは蓋と拡散メッキの前に室温に予め温めておいた上で凝縮することなく完全に乾燥しなければなりません。プレートを4℃で保存されている場合、それらも数時間または前の日を削除します。以上より2〜3プレートの小さな千鳥スタックでそれらを広げ、それらを乾燥させます。
- ターンテーブルの中央にプレート( 図5)。
- を取得するブロス培養または緩衝液または生理食塩水にコロニーから混合細胞により産生された細胞の懸濁液でなければなりませんrのサンプル。
- サンプルは単一のサンプルの希釈系列から導出することができる。
- メッキされるサンプル量は0.1〜0.2ミリリットルでなければなりません。
- ペトリ皿の蓋を開き、寒天の中央にサンプルを分注する。蓋を閉じます。
- この手順全体の無菌技術を使用しています。
- プレートにサンプルを転送するためにピペットを使用しています。それはプレートの外にかからないように、サンプルの流れを制御する。
- 70%(v / v)エタノールのビーカーにガラス棒または金属棒(また、ヒートスプレッダと呼ばれる)を浸します。
- 注意:アルコールのビーカーにホットスプレッダを浸してはいけません。
- エタノールは、スプレッダーの下の部分と茎の最初のインチに触れる必要があります。
- パンの炎を通過させることにより過剰のエタノールを排出し、発火ENバーナー。
- 炎はすぐに消滅させるエタノールと接触したスプレッダーと茎の長さを移動する必要があります。
- エタノールのビーカーは、慌てないで、火災をキャッチする必要があります!すぐに火を消すでしょうビーカー、上にカバーガラスを配置します。
- 親指と人差し指で、左手で蓋を保持し、寒天プレートの蓋を開きます。リムに近い端に沿って寒天に触れることによってスプレッダを冷却する。
- 細胞が追加された寒天に触れないでください。ホットスプレッダーは、細胞を殺すでしょう。
- 左手で(まだ寒天プレートの蓋を保持しながら)、ゆっくりとターンテーブルを回転させる。
- あなたは蓋を下に置く必要がある場合は、最高の、避けていますが、ブンゼンバーナーの滅菌フィールド内の消毒表面上に伏せて置きます。上向きに蓋をし、オブジェクトや手の動きからの汚染の大きなチャンスが原因となる空気の流れを作成し、そこにある蓋の内側表面に降りるように微生物やほこりの粒子。
- 右手で、寒天の表面にそっとスプレッダーを保持し、徐々にプレート全体に均等にサンプルを広げた。ターンテーブルが回転しているようにプレートを行き来スプレッダーを移動します。
- サンプルでは、インキュベーションのために反転プレートの前に徹底的に(少なくとも5分)を吸収することができます。
方法B:ガラスビーズを用いた拡散メッキ: "コパカバーナ法"
- 少なくともあなたの名前、日付、増殖培地の種類、培地上に播種する生物の種類と寒天プレートの底部(いない蓋)のエッジの周りのラベル。
- 連続希釈液をメッキする場合は、希釈率が含まれています。
- 親指と人差し指で、左手で蓋を保持し、寒天プレートの蓋を開きます。その後、あらかじめ滅菌GLを含有するガラス管またはボトルを開くお尻のビーズ。右手、炎管または瓶の縁にして慎重に寒天プレート( 図6)に10月12日滅菌ガラスビーズを分注する。キャップを交換し、それを脇に設定する前に、もう一度プレートの蓋を閉じ、炎管または瓶の縁。
- ビーズはペトリ皿の外にバウンスしないように静かに数センチの寒天の上にチューブまたはボトルのビーズを注ぐ。
- 直径4 mmであるガラスビーズを使用しています。 30分間乾燥したサイクル(重力の設定)で121℃でオートクレーブ内のガラスのボトルや試験管内で、それらを滅菌する。
- 代わりに、スプレッダのビーズを使用する利点の1つは、エタノールの開いているコンテナが繰り返さ燃えるために必要されていないことです。
- 寒天プレートの蓋を開き、寒天の中央にサンプルを分注する。蓋を閉じます。
- この手順全体の無菌技術を使用しています。
- プレートあたりのサンプルのアリコートを、100から150μL。このボリュームがあっても細胞の拡散が容易になります。プレートにサンプルを転送するためにピペットを使用しています。それはプレートの外にかからないように、サンプルの流れを制御する。
- 静かに寒天の表面に6から7回にわたってビーズを振盪することによってサンプルを広げた。細胞が均等に広がるようにするために、水平方向の揺れのモーションを使用しています。
- ビーズまたは他のすべての細胞がプレートエッジで終わりますスワールしないでください。
- ヒント:適切に行われた場合、手順は "振るマラカス"のように聞こえる。
- プレート60°回転して水平に再び六から七回振る。
- プレート60°回目を回して水平にもう一度振る。今では、あなたも寒天の表面を横切って細胞の拡散を達成する必要があります。
- 拡散メッキが完了したら、サンプルが吸収されるべきであり、寒天の表面が乾燥しなければなりません。 10%の塩素系漂白剤を含む顕著なコレクションのビーカーに汚染されたビーズをオフに注ぐ。
- しないでくださいゴミ箱にビーズを捨てる!使用ビーズは、繰り返し使用のためにそれらを洗浄し、オートクレーブ処理、再滅菌されます。
- 注:寒天表面を3回振った後、まだ濡れている場合は、プレートがプレート表面が乾燥されるまでの手順を繰り返し#4-6その後、寒天に吸収される液体に許可するために数分間座ってすることができます。
- インキュベーションのためにプレートを反転します。
5。軟寒天オーバーレイ手順:ファージの単離および列挙体プラークの形成(プラークアッセイ)
この手法は、一般にバクテリオファージ(ファージ)、または細菌ウイルスを検出し、定量化するために使用されている100から200 nmの大きさの範囲。電子顕微鏡は、個々のファージ粒子を参照するために必要です。しかし、感染性ファージ粒子の存在は、寒天プレート上のプラーク ( 図7A)として検出することができます。ファージは、その宿主細菌細胞外に複製することはできませんので、伝播dの検出は、めっき前に混合ファージと一緒に宿主細胞を必要とします。軟寒天オーバーレイ手順については、ファージ懸濁液を、一般的に50μlのから200μlの範囲で小さなボリュームは、均等の2.5〜3.0ミリリットルに分散している約10 8細菌(宿主細胞)を含むチューブに分注しているソフト(0.5から0.7パーセント[W / V])、溶かした寒天培地。得られた混合物は、ハードディスク(1.5から1.9パーセント[W / V])の栄養寒天プレートの表面上に注がれています。プレートは、軟寒天は、ハード寒天の表面全体を覆うことを確認するために十分に揺られています。トップアガー層が固化する時間がありました、その後、インキュベーターに配置することができますまで、プレートが平らな面に配置されます。
時間が経つにつれて、 芝生と呼ばれる細菌細胞の濁った懸濁液は、軟寒天培地( 図7B)を通して見えるようになります。ファージは、細菌細胞のいずれかを感染した場合プラークが形成され、目の中に複製されます電子セルは、その後、多くの100として子孫ファージ(別名、 バーストサイズ ) を放出細胞を溶解。新しいファージ粒子が溶解した細菌細胞を周囲に細菌を感染させ、軟寒天中に拡散。感染と溶解の複数のサイクルの後、軟寒天で曇った細菌の細胞懸濁液は、プラークと呼ばれるクリアゾーンを残して、消えます。各プラークは、元の感染性ファージ粒子へのすべての遺伝的に同一の10以上の9ファージ粒子が含まれています。プラークは、単一のファージ粒子から生じているため、 プラーク形成単位(pfu)の結果の数をカウントすることができ、ファージ懸濁液の初期濃度、または力価を算出することができます。プラークアッセイと呼ばれる実験、また、このタイプの科学者に、ワンステップの成長曲線を生成するための宿主域特異性を調べるために、遺伝子実験のために細菌細胞を形質導入するために標準化された手段を提供します。
- の指標菌を準備します。細菌宿主株の指数関数的に成長して文化は軟寒天オーバーレイ実験のために準備する必要があります。各ホストは、独自の成長要件を満たす必要があります。 0.3ミリリットルと指標菌の懸濁液0.5 mlの間では、各プレートが必要になります。指標細菌のフラスコ(例えば、25ミリリットル)を用意されている場合は、文化が交差汚染の可能性を最小限に抑えるために小型のアリコート(例えば、滅菌スクリューキャップチューブに分注し5ミリリットルのアリコート)に分割する必要があります。実験で使用する準備が整うまで、チューブを氷(4℃)に保持されることがあります。菌株の仕様に従ってインキュベートし、滅菌ブイヨンに接種するために無菌テクニックを使用しています。残りの培養物は、一日の終わりに破棄する必要があります。
- 吸着管を準備します。ラックに2台の滅菌マイクロ遠心チューブを置きます。第一管 "ファージ"と第二の管 "コントロール"の蓋の蓋にラベルを付けます。
- 典型的なファージ溶解物のLY 希釈系列を調製し、追加のマイクロチューブをラックに追加し、希釈率で標識されるであろう場合にはメッキが施されています。
- ファージ株は、単一のプラークから新鮮な作られ、4℃で保存してください。ファージ粒子を分解するために、株式は、実験を実行する前に周囲温度に温めなければなりません。
- ファージ株は優しく扱われるべきである - 激しくボルテックスあるいはピペットません。
- 最初の試験管にファージ試料の50μlを追加してプラークアッセイのためのネガティブコントロールとして機能する第二の管にファージバッファー50μlを加える。
- ファージや細菌のすべての操作を通して無菌技術を使用しています。
- 次の各吸着管に指標菌の500μlを添加します。
- 長期間氷やベンチに座っている場合、細菌細胞は、チューブの底に沈殿します。文化がミックスされていない場合事前に十分な菌体を吸着管に転送され、実験のためにアリコートを削除するにED。プラークを検出するためのソフト寒天(すなわち、芝生)に形成され細菌コロニーの十分な数が存在する必要があります。吸着管にアリコートを転送する前に、均質な懸濁液に静かに再懸濁する指標菌にボルテックスミキサーを使用しています。
- 軽くチューブをフリックすることによって細菌細胞やファージを混在させること。
- 指示菌株の適切な温度で15-20分間ファージ/細菌混合物(30分以上しない)インキュベートします。
- 栄養軟寒天とハード寒天プレートを準備します。吸着が発生している間、場所2軟寒天チューブを(以前に55℃で溶融し、格納されています)加熱ブロックで46から48に設定され、ラボのベンチ℃で
- 溶かした軟寒天は10-15分間加熱ブロックの温度に平衡化する必要があります。溶けたソフトであれば寒天は15分以上座っている、それが固化し始め、ハード寒天の上に注が時塊を形成します。溶かした軟寒天が10分未満座っている場合、ファージ/細菌混合物に添加するときには、めっき前に宿主細胞を殺し、あまりに高温になります。その結果、芝生は形成しないことがあり、ほとんどまたはまったくプラークが検出される可能性がある。
- ファージ溶解液の希釈系列をメッキする場合は、追加のソフト寒天のチューブを準備します。
- 少なくともあなたの名前を持つ2つの栄養素ハード寒天プレートプレートの底(いない蓋)のエッジの周りのラベル、日付、増殖培地、および "ファージ"の種類や吸着管に対応する "制御"を参照してください。
- 連続希釈液をメッキする場合、希釈率で標識された追加のプレートが含まれています。
- ハード寒天プレートは蓋とソフト寒天を追加する前に室温に予め温めておいた上で凝縮することなく完全に乾燥しなければなりません。プレートを4℃で保存されている場合は、それらの数時間を削除するか、さらにダyの前に。以上より2〜3プレートの小さな千鳥スタックでそれらを広げ、それらを乾燥させます。ハード寒天層の過剰な水分は、ファージは、プラーク形成時の軟寒天を通じて、より容易に拡散することができ、柔らかい寒天希釈の原因になります。その結果、プラークサイズが大きくなります。
- 次のように当時のプレート吸着管1:無菌的に柔らかい寒天チューブにファージ/細菌混合物(約550μlのでなければなりません)転送するためにP1000ピペットを使用して、その後急速にコンテンツを混在させることがあなたの手の手のひらの間に回転させます。気泡が導入されるようにチューブを振らないでください。左手でチューブを保持し、右手でハード寒天プレートの蓋を開けて、 すぐにハード寒天プレートの表面に真空管の内容全体を注ぐ。蓋を閉じる前に、板の表面全体に溶かした軟寒天を広めるために、優しく、しかし急速に板を揺するそれが固化する時間を持って前に。ペトリ皿の側面に溶けたソフトアガーをはねないようにしてください。蓋を閉じます。
- すべての吸着管のステップ#9を、一度に1つのチューブを繰り返します 。
- レベルの表面にプレートを置き、柔らかい寒天が固化されるまで、それらを静置することができます。
- 通常30分で十分です。
- インキュベーションのためにプレートを反転します。
- 複数のプレートが積み上げられ、インキュベーションのために反転して一緒にテープで固定することができます。
インキュベーション後、プレートはプラークを検査することができます。ネガティブコントロールは、細菌の唯一の芝生(プラークの示す無穴)を持っている必要があります。プラークはサイズ、形状、および全体的な外観の点で異なります。与えられたファージタイプは慎重に滅菌爪楊枝で1プラークの中心を打ち抜き、滅菌遠心tに接種を転送することによって、プラークの不均質な混合物から単離することができるUBEはブロスまたはファージバッファの100から1000μlを含む。このライセートは、上記と同じ手順を使用してめっきすることができる。少なくとも3から6までの連続した単一プラークアイソレーションは、純粋なファージが得られていることを確認するために必要です。頻繁にライセートをプレート上に重複しないプラークを生成する力価を見つけるために広い範囲(10 -1〜10 -10)を介して希釈しなければならない。番号は、プラークのサイズによって異なります。
6。レプリカプレート手順:スクリーニング変異と栄養要求のためにセルの転送
この手法は、選択可能な表現型の画面のセルに生成手段、二次板への主なプレート上に細胞増殖の比較を可能にします。最初のプライマリまたはマスター、プレートは、単一のコロニーを生成する拡散メッキ希釈するか、グリッドマークで指定された空間的なパターンでプレートにそれらを転送することにより、どちらの細胞を接種されています。成長inhibでメディアを含む二次プレート特定の栄養素が欠けているitorsやメディアは、プライマリ·プレート上のコロニーから細胞を接種されています。コロニーの空間パターンは、主板にベルベットの部分を押すことにより、第一に再現されています。彼らは寒天よりもベルベットのために高い親和性を持っているので、細菌の細胞はベルベットに準拠しています。ベルベットのセルの刻印は、その後、主板と同じコロニーのパターンを反映して細胞増殖を持つ複数の二次板に転送されます。言い換えれば、それは別のプレートから成長パターンを複製する、ゴム印のようなものです。それはコロニーの数が比較的多いが、一回の実験で多くの表現型を同時にスクリーニングすることができるため、この手法は、有利である。
- 少なくともあなたの名前、日付、および増殖培地の種類と寒天プレートの底部(いない蓋)のエッジの周りレーベル:主プレートを準備します 。
- プレートの底面にグリッドをオフにマーク少なくとも二つの等間隔の縦線と少なくとも二つの等間隔の水平線。数値結果の正方形。
- 細胞サンプルでそれぞれの正方形に接種するために事前に滅菌爪楊枝を使用しています。各サンプルについて、DAB広場の中心。細胞と全体の正方形( 図8)をカバーしていないか、または他のサンプルは、培養時に生い茂ると周囲の正方形を汚染します。
- 各正方形は別のプレート上ブロス培養物またはコロニーのいずれかから派生した、異なるサンプルを接種されます。
- 逆に、様々な二次メディアに接種するために使用される主要なプレートをインキュベートします。
- 二次プレートに接種:主板とすべてのセカンダリプレートをスタック。マーカーで、プレートの側面に方向マークを付けます。マークは、それぞれのプレートの下側ではなく、蓋の上にあることを確認してください。
- 無菌の別珍の布を入手して、円筒形のブロック(Fの上に置きますigure 9)。ホルダーのある場所で別珍の布をロックします。ブロックの向きのマークに注意してください。
- ブロックは、ペトリ皿の底(10.2 cmの直径)と同じサイズである必要があります。それはレプリカメッキしながらブロックにクランプ別珍の布をそのロックリングに付属しています。
- 別珍布(15.2×15.2センチ角)は、事前に滅菌しなければならない。その後121℃オートクレーブ内に配置℃で乾燥したサイクル(重力の設定)で30分間アルミホイルでラップして10または12きれいな正方形を積み重ね。レプリカメッキ実験で使用する前に、彼らは数時間のために温かいオーブンにそれらを置くことによって完全に乾燥していることを確認してください。別珍の正方形が滅菌前にマスキングテープでデLINTEDする必要があるかもしれないことに注意してください。
- 別珍の正方形を再使用することができます。使用別珍の広場は、オートクレーブで除染された後、上記のように、彼らは普通の水でリンスする必要があり、再滅菌した。
- 円筒形ブロックkとクランプは70%(v / v)エタノールまたは10%の塩素系漂白剤で洗い流し短いと使用の間に消毒しなければならない。
- 蓋を外し、主板を反転させる。ブロックのマークがプレート上方向マークを並べる。寒天の表面は円筒形のブロックの別珍布と接触しているように、プレートを下げます。軽くでも均等に主要なプレートの背面にあるあなたの指先で押し、その後慎重にブロックから離れて、主プレートを持ち上げます。プレートに蓋を交換してください。
- 主要なプレートからの細胞のベルベットの印象は、新しいビロードの印象がなされる必要がある前に、約7〜8の二次プレートに接種することができます。
- 二次板のそれぞれに、ステップ#7を繰り返します。
- ポジティブコントロールとして、シリーズの最後のプレートは、試験した全ての株が成長するべきでは寒天培地でなければなりません。あなたは細胞がすべてのセカンダリPLに転送されたことを確認することができますこの方法でシリーズのATES。それ以外の場合は、特定のテスト媒体の成長の欠如は、不十分なセル転送ではなく、株の表現型に起因する可能性があります。
- 誤検出を避けるために、二次板は、少なくともから最も有利な基板に発注する必要があります。それ以外の場合は、栄養素は細胞が不利な培地で生育することができ、プレート間で転送することができます。
- プレートとインキュベートを反転します。
- 注:成長のための二次プレートをみると、成長と押印を区別するようにしてください。後者は負の結果です。
7。ワークスペースのクリーンアップ
- その後、ブンゼンバーナーをオフにしてプレート上やチューブの文化、余分なメディア、および他の試薬を含むすべての電源を片付ける。
- 古い文化は、プレート上かどうかをチューブに、実験台上または記憶領域内に蓄積することはできません。汚染の悪名高い源であるこれらのサンプルは、金型や不要な細菌種などは、できるだけ早くそれらが不要になったとして廃棄する必要があります。
- 場所は、適切な処分レセプタクルに実験器具(手袋、ピペットチップ、キムワイプ)、ガラス製品(チューブ、フラスコ、ボトル)、有害廃棄物(細菌培養またはファージ·ソリューションを、使用されるプレート)が汚染された。非病原性大腸菌で作業する場合大腸菌株(BSL-1)は、唯一の非感染性の有害廃棄物が生成されます。病原微生物(BSL-2以上)と同じ手順を実行する場合は、感染有害廃棄物が生成されます。かかわらず、バイオハザード分類、有害廃棄物はオートクレーブまたはそれが破棄される前に消毒しなければならない。 BMBLで説明するガイドライン( 第 5 回エド。)だけでなく、実験中に生成されたバイオハザードの即時かつ適切な処分のためにあなたの機関の環境衛生および安全部門によって提供されるものに従ってください。
- 消毒剤で作業領域をきれいにします。
- 手を洗う徹底的に研究室を離れる前に防腐剤石鹸と暖かい水で。
8。代表的な結果
縞板技術。ストリークめっき用のサンプルアプリケーションは、 図1に示されています。この手順は、混合細胞培養液からの細菌コロニーを分離し、微生物学、分子遺伝学で習得するまでで最も重要な技術の一つであるために使用されます。各コロニーは遺伝的に同一である細胞の集団を表しています。多くの下流のアプリケーションではそれが単一コロニーまたは単一コロニー由来の細胞で、メディアを接種することにより生成された純粋な細菌培養のいずれかで開始することが不可欠です。例えば、コロニー内の個々の細胞の形態は光学顕微鏡を使用して検査することができます。遺伝的同一性は、単一のコロニーを始め細胞培養から単離したゲノムDNAからの小サブユニットリボソームRNA遺伝子の配列決定により割り当てることができます。と代謝特性は様々な生化学的および生理学的アッセイに細胞を付すことにより説明することができます。唯一の純粋な文化とこのような実験を行うことにより、一つは特定の微生物に起因する特定のプロパティにすることができます。結果は文化が汚染されている可能性によって隠されていません。筋板を越えた細胞を使用する装置の無菌性は、プロシージャ全体で維持されていない場合、技術的なエラーが発生する可能性があります。炎にループを忘れるか、それが困難なシングルコロニーを得るために行うの象限の間に新鮮な爪楊枝を取得します。彼らは一定の成長率の要件については、別の細菌種の協同組合に依存しているとして、いくつかの細菌種は、純粋培養で分離することはできません。 syntrophsと呼ばれ、これらの生物は、共培養条件下で増殖させることができるので、コロニーが(形成されている場合)、常に2つ以上の種で構成されます。実行時に研究室で遭遇したもう一つの課題環境試料から派生した細菌とストリークプレートの手順では、細胞がそのようなE.などの伝統的な実験室株から逸脱して生育特性を示すことである大腸菌 。このような菌株は、寒天プレートの大部分に広がる支店を持つ(細胞のタイトなクラスターとは対照的に)糸状石灰化とストリークプレート楽器浸透に難治性であるため、コロニーを生成したり、付箋カプセルに囲まれたことがありますように個々のコロニーを識別することはできません。これらの特性は、それが困難なストリークプレート法により、単一のコロニーを精製することを確認します。
注ぐプレート技術は流動プレート手法では、コロニーは、このように、試料中の生細胞数をカウントする便利な手段を提供して寒天培地の表面上だけでなく、寒天内に形成されます。この手順は、様々な産業用途に使用されています。例えば、それは廃水TREのために重要である大規模な精製工程後に水サンプルを分析するため、国内の商業、工業所有権などの農業慣行によって生成された液体廃棄物(例えば、下水、排水溝嵐からオフを実行)、クリーンアップの責任ですatment工場。下水処理水(非飲用水)は、様々な方法で再利用されます - 農業における非食糧作物の灌漑のために、住宅の衛生洗浄用、工業用冷却塔に - それは、化学物質と微生物汚染の自由でなければなりません。飲料水(飲料水)は、EPAの基準に従って精製しなければならず、特定のヒト病原体の列挙を許可し、微生物学的めっき法を用いてテストされています。 図10に示すように、公共の水飲み場から採取した水試料中に存在する細菌細胞から生じる細菌のコロニーがあります。それは、これらのコロニーは飲料水の浄化措置を与えられた生産性は低い細菌性病原体であるが、微生物はすべてのです。どこにも非病原性株による汚染は、完全に排除しない、最小限に抑えることができます。別の例として、製薬会社は、生産、貯蔵および輸送中に新しい薬の微生物汚染、またはバーデンの程度を評価する必要があります。流動プレート手続き、微生物負荷、または汚染細菌数を使用して、プロセスやめっき試料のさまざまな段階で薬剤をサンプリングすることによって、容易に決定することができます。予防策は、その後微生物汚染を最小限に抑えたり、排除するために考案することができます。流動プレート技法を実行するときに発生する最も一般的な技術のいずれかのエラーが溶けた寒天は、それによって不正確なプレートカウントを作る一緒に凝集したコロニーを引き起こすとサンプルの混合が不十分である。それが熱すぎるときに、別の頻繁なエラーは、サンプル中の細菌細胞の多くを殺し、溶かした寒天を注いでいる。この間違いは、また数字の下の表す番目のことを与えてプレートカウントの精度に影響を与えますサンプル中のコロニー形成単位の電子総数。
拡散板技術。拡散板技術は、現実的なプレートカウントを実行するための手段として、そのユーティリティの流動板プロシージャに似ています。拡散板技術を用いて形成するコロニーが均等に寒天培地の表面全体に分散されているのでしかし、個々のコロニーからの細胞(例えば、その後の実験操作で分離して使用することができるストリークプレートまたはのための接種物としてブロス培養)。拡散板技術は重要なコンポーネントである3つの一般的なアプリケーションでは、濃縮、選択およびスクリーニング実験です。 3つのすべてのアプリケーションでは、所望の細胞タイプが混合物から分離することができ、後の生化学的、生理学的、または遺伝学的検査は、任意の数に供した。
濃縮実験は培地上で混合培養をメッキまたはeでプレートをインキュベートすることが含まれ希望の代謝特性、生育特性、または行動を示すサンプル内のこれらの微生物の増殖を支持nvironmental条件。この戦略は、文化の中で他人に対して所望の微生物の数の増加の他の生物が、結果の成長を阻害しない。したがって、濃縮プレート上に形成したコロニーは、おそらく、目的の遺伝子型を反映した表現型特性を示す。例えば、あなたの目標は、窒素欠乏培地上にサンプルをめっき、1000以上の異なる細菌種の混合物を含む環境試料からの窒素固定細菌を育成する場合から、この化合物を生成することができ、それらの細菌を濃縮します。窒素を固定するために必要な遺伝子のスイートで提供される代謝機能を使用して雰囲気。
選択実験は、それらの細胞が消費でき培地上で混合培養をメッキ含む成長する遺伝子の特定の遺伝子または一連のtain。抗生物質耐性遺伝子を含むプラスミドで菌株を形質転換したときにこの種の実験は、分子生物学の研究室で一般的です。あなたの目標は、唯一の組換え細胞、または正常にプラスミドを取ったものを育成する場合には、抗生物質の適切な濃度で補充された媒体上にサンプルをめっきすると、この特定の薬剤に抵抗性を示すこれらの細胞のために選択されます。
スクリーニング実験は、すべての生細胞が成長することができ培地上で混合培養をメッキ含むが、所望の遺伝子型を持つ細胞は、その表現型に基づいて、他の細胞と区別することができます。プラスミドに突然変異誘発アッセイまたはクローニング遺伝子を実行するときに、再度、この種の実験は、分子生物学の研究室で一般的です。古典的な例は、 図11に示すように、lacZ遺伝子ENCOを使用しています鼎β-ガラクトシダーゼ、この酵素は、細胞は、その天然基質、乳糖の基質アナログ(5 - ブロモ-4 - クロロ-3 - インドリル-β-D-ガラクトピラノシド)X-Galを代謝することができます。不溶性の青色製品のβ-ガラクトシダーゼの結果X-Galの切断。したがって、媒体はX-galを含まれており、どちらかの野生型(機能)または変異体(非機能)lacZ遺伝子を持つ細胞を含む試料は、その後の機能lacZを保有するインキュベーション野生型細胞に続いて、この培地上に播種されている場合非機能するlacZ遺伝子の変異体の細胞は無着色( "白")コロニーとして表示されますが、遺伝子は青色素コロニーとして表示されます。
第一拡散板の技術を実行する方法を学習するときに最も頻繁に発生する技術的な問題は、寒天の表面を横切って細胞の広がりが不均一である。ターンテーブルとガラス棒を使用する場合は、サンプルがあまりにも速くコロニーのみが板の中央付近に形成するように吸収されることがあります。 W鶏は "コパカバーナ方法"をやって、ガラスビーズを渦巻いたのではなく、寒天表面全体に動揺しています。その結果、多くのコロニーがプレートの外側の縁に沿って成長します。どちらの場合ではコロニーの結果の分布は、細胞が一緒に塊があり、細胞の種類不可能のプレートカウントが不正確または区別すること重複コロニーに成長するので、利用可能な完全な表面積を活用していません。
柔らかい寒天重層法 。細菌のコロニーをカウントするために使用される拡散板の技術に似たプロシージャは、集計にファージの数を使用することができます。 30〜300細菌の細胞はプレートカウント(CFU / ml)を寒天表面に広がっているのに対し、100〜400感染性ファージ粒子が層内にプラークをカウントするため8月 10日から9月 10日までの宿主細胞(PFU / ml)を混合して軟寒天のハード寒天培地の表面全体に広がった。そうでなければ実証されていない限り、それは一般的にtを想定されます帽子は、単一の細菌細胞はコロニーと呼ばれる単一のクラスタ内の遺伝的に同一の細胞を大量に分割して蓄積する。前述のように細胞が束に成長する(つまり、ペア、四分子、チェーン、またはクラスタ)または単一のコロニー形成を阻害するカプセルなどの成長特性を表示するときは、この仮定は有効ではありません。同様の仮定がプラーク形成のために作られ、その各プラークは、単一のファージの活性を表しています。 1ファージが1細菌に感染した場合にのみ、このステートメントはtrueです。複数のファージ粒子は、単一の細菌に感染した場合はどうなりますか?感染多重度(MOI) - - サンプルの宿主細胞の数に感染性ファージ粒子の比を表すこの問題は、ファージを用いた実験を行う際に考慮しなければならない重要な統計パラメータに関連している。他の細胞に吸着するだけ、あるいはまったくファージ一方、宿主細胞の集団は、低MOI(≤1)Tでいくつかの細胞が吸着する複数のファージを感染させなければならないためセルが複数のファージ粒子によって感染される可能性を最小限にO。ファージストックの力価を計算するためにプラークカウントを実行するときに機能的な定義として、プラーク形成単位(PFU)を採用すると、これらの合併症を回避することができます。
図12に示すように、プラークの形態は異なるファージによって異なります。他の大型プラーク(パネルB)を生じさせながら、いくつかのファージは、小さなプラークを(パネル)を生成します。変数の数は、プラークの大きさに影響を与えます。この変動に寄与する技術的な理由があります。たとえば、完全なメディアと大きなプラークの厚さの硬質寒天のサポートの開発は、宿主細胞が長時間ファージの成長を維持することができるからです。宿主細胞(プレート当たり> 10 9 CFU)の高播種密度は、プラークサイズの縮小の原因となります。柔らかい寒天の低濃度を使用すると、軟寒天でのファージ粒子の拡散速度を増加させ、それによってプラークのサイズが大きくなります。目を思い出してくださいハード寒天プレートが完全にオーバーレイの軟寒天を希釈皿のように結露や余分な水分を乾燥されていない場合、この増加した普及率では、意図せず発生する可能性があります。この技術的監督は、特定のファージのプラークサイズに関して矛盾した結果を生成します。
プラークサイズは、吸着の効率化、潜伏期間の長さ(ファージ吸着から宿主細胞の溶解までの時間スパン)、およびバーストサイズ(含む宿主細胞イベントの数によって放出子孫の数に関連しています単一の感染症)。ファージ粒子は、細菌の成長のさまざまな段階で宿主細胞に感染する場合、プラークの大きさの不均質な混合物が観察されることがあります。例えば、初期の指数期中にこれらのその吸着後半対数期に吸着するものよりも多くの子孫ファージを大きなプラークを作る。一般的なルールとして、溶菌ファージが溶原ファージフォーム濁ったプラークをしながら明確なプラークを生成します。ホーwever、いくつかの溶菌ファージは、 図12Bに示すように、 "雄牛の目"プラークとして興味深いパターンを生成します。プラークの端にそれらの細胞が完全に溶解されていないか、感染をファージに耐性がある可能性があるため、これらの明確な斑は、濁ったハローに囲まれています。溶原性ファージで観察された "牛の目"パターンは、クリアリングに囲まれた濁った中心とプラークです。この形態は、MOIと溶解·溶原性の判断に関して、宿主細胞の生理機能を反映しています。細胞が最初にファージに感染しているとき、MOIが低く、栄養素が豊富にあるので、細胞は急速に成長し、一緒に、これは溶解成長を促進します。より多くの細胞が溶解されるため、MOIが増加し、明確なプラークを形成する。プラークの中心にある溶原菌は、しかし、彼らは濁った中心との明確なプラークを生じさせる溶解に免疫があるので、成長を続けている。
オーバーレイ技術は真核生物のウイルスのプラークアッセイのために変更することができます。で軟寒天中での細菌細胞の芝生の上で同じようにバクテリオファージのフォーム斑、真核生物のウイルスは、ゲルで覆われた細胞の単層上でプラークを形成します。単層は、培養皿の表面に並んで成長し、お互いに触れることなく互いの上に成長していない細胞のコンフルエントなシートです。プラークアッセイのこのタイプを遂行するために、ウイルスのアリコートは、真核細胞の感受性の単層に追加されます。その後、単分子層は、アガロースベースの栄養培地で覆われている - このゲルは、単層に隣接する細胞に感染した細胞から放出される子孫ウイルスの拡散を制限します。したがって、球状領域、またはプラークは、ビリオンの放出によって損傷した細胞を含む生成されます。染色生細胞は、感染と非感染細胞との間のコントラストを提供する細胞培養にも適用できることを斑、色素の可視化を支援する。
ソフト寒天オーバーレイ技術はプラークアッセイ以外の実験のために使用されています。まず、sであるハード寒天培地は細菌の増殖を可能にするサポートマトリックスであることを覚えてignificant。第二に、オーバーレイに使用するソフト寒天は、ハード寒天とは異なる栄養組成を持つことができます。このように、ソフト寒天は、様々な成長特性や代謝特性のためのアッセイ菌株の手段として機能することができます。例えば、オーバーレイ技術はセルロース(Teatherとウッド1982)分解する能力の画面細菌に使用されます。単一コロニーを、ソフト寒天を含む0.1%(w / v)のカルボキシメチルセルロース(CMC)は、ハード寒天の表面に広がっている非選択的なハード寒天培地上に成長されています。インキュベーション後、プレートを軟寒天中でのコロニーの周囲にクリアゾーンの可視化を可能にし、その染色でフラッディングされます。クリアは、培地中にセルロースを分解する細菌によって分泌される加水分解酵素によって引き起こされます。最近では、オーバーレイ技法はmethanogeの成長を阻害する細菌を検出するために使用されています家畜のルーメン内で見つかったNICの古細菌(ギルバートら 2010)。環境サンプルからの細菌分離株はその後コロニーはソフト寒天メタンの文化を含有するオーバーレイされているハード寒天栄養培地上に生育しています。インキュベーション後、プレートはコロニーの周り成長阻害のゾーンに対して検査されます。このメソッドは、軟寒天中のメタン菌の阻害剤を生産する菌株を識別します。
それが高すぎたり低すぎたりクールだとき、ソフト寒天オーバーレイ技法で発生する最も一般的な技術的なエラーのいずれかの溶融ソフト寒天を注いでいる。それはあまりにも高温になっている場合は、細菌の細胞は培地に混合し、めっき前に殺される。それはあまりにもクールである場合は、ハード寒天の上に注が時、ソフト寒天は、塊を形成します。最高の状態でどちらの場合も、結果があいまいまたは判読できないでしょう。
レプリカプレート手順 。栄養培地の1つの型からの文化を転送するほんの数株以上がある場合は、別の成長要件をテストするためには非常に面倒になります。レプリカメッキは、微生物の大量の同時スクリーニングを可能にする方法です。例えば、野生型細胞の培養物を突然変異誘発した後、1は、単一のコロニーでプレートを取得するために文化の希釈プレート広がる可能性があります。主要なプレートは、成長のために不可欠な特定の化合物を合成するためにそれらができないレンダリング生合成経路の遺伝子変異を運ぶ野生型の成長に必要なすべての化合物を合成prototrophs、および変異体栄養要求を含むすべての細胞の成長をサポートするメディアが含まれています。完全培地に細胞の混合物をメッキすることにより、不足している栄養素は環境から撮影することができます。 prototrophsと栄養要求を区別するために、コロニーを最小培地上に複製することができます。のみprototrophsが成長することができます。主要なプレートの空間パターンが維持されるため、comparis主要なプレートを有する二次プレートの上の変異コロニーの同定を可能にする。変異体は、もはや合成することができるはありませんどの化合物を決定するために、コロニーは、特定の化合物(例えば、アミノ酸、炭素源、ビタミン類等)を添加した最少培地上に複製することができます。この方法では、コロニーの数百のレプリカプレートプロシージャを使用して同時にスクリーニングすることができる。発生する可能性が一つ技術的なエラーは、プレート上のすべての文化を汚染して一緒にスメアにコロニーを引き起こして、あまりにも濡れている寒天プレートを使用しています。これは完全に信頼できない結果を生成します。別珍からセカンダリプレートに細胞を転送するときに別の技術的なエラーがあまりにも多くの圧力を適用している。再び、二次プレートをインキュベートした後、得られたコロニーは、汚染ではなく、栄養要求性に起因する成長の表現型を生産重なる可能性があります。
すべてではない野生型の微生物種がprototrophsているので、レプリカの-p後半の手順を同時に特性の成長要件については、別の野生型株をスクリーニングするために使用することができます。 図13に示すように、4つの異なる緑膿菌株から細胞の"塗り" YTA(パネル)と呼ばれる完全なメディアを含むグリッドマークの付いたプレート上に重複して播種した。株は、その後3つのセカンダリプレート上に複製された(パネルB、C、およびD)は、異なる炭素源(アセトアミド、ラクトース、グリシン、それぞれ)を添加した最少培地(MSA)で構成されていた。結果は、4つの緑膿菌の2( 緑膿菌とP. stutzeri)は 、これらの3つの炭素源に生育不能であることを示している。コントロールとして、株は細胞が手順を通して転送されていることを確認するYTA培地で4プレート上にレプリケートされていました。 4つのすべての株がYTA制御板上に成長するので、直列に前述の3つのプレート上に展示され、成長欠陥が信頼できる。レプリカメッキ結果を表1に集計しています。一般的に作られたものにエラーが肯定的な結果として二次プレート上で成長の跡を解釈しています。たとえば、Pの表現型を比較するP.のものと緑膿菌 MSAにstutzeri +アセトアミド(パネルB)。後者は否定的な結果であり、前板からの栄養素が親細胞と転送された場合に発生する可能性が成長の跡を表示します。不足している栄養素は子孫細胞に利用できないため、新しい細胞の成長は発生しません。それは、実際の成長と押印を混同するのは簡単です。疑問がある場合は、実験は、二次メディアに主板からストリークめっき細胞などの代替方法を使用して、繰り返されるべきである。
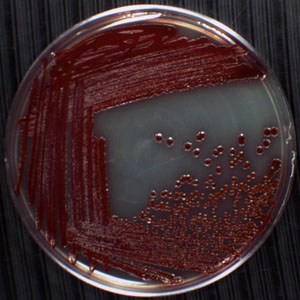
図1プレート上の単一コロニーの例。プレートの中央付近にピンクの球は、 セラチアmarcescのコロニーです。ENS、腸内細菌科のグラム陰性菌、棒状のプロテオバクテリア。湿った環境を好むため、この微生物は、一般的に浴槽のコーナーでは、シンクの洗面台で、タイルグラウトで、シャワーカーテンに成長して検出された。S.マルセッセンスはプロジギオシンと呼ばれる赤みを帯びた色素を生成するので認識するのは簡単です。このプレート上のコロニーは24時間、30℃で4象限以下のインキュベーションに表示される単一のコロニーで、ストリークプレート技術を用いて生成されました。他の3つの象限は、細胞が重なってコロニーへと発展して寒天表面上に堆積されたコンフルエントな成長を示しています。

図2。インスツルメンツ筋板技術に使用されます。上から下へ、爪楊枝(ラウンドない平坦化)、ワイヤループ、使い捨てのプラスチック製のループ、そして木の棒も表示されます。つまようじは、通常、転送されます。ワイド端で小さなガラスのビーカーに使用する前に滅菌するオートクレーブときにホイルで覆われてダウン。木製のスティックは、その後、使用前に滅菌するオートクレーブ18mmの試験管に転送されます。
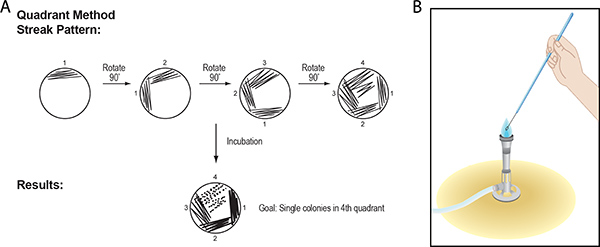
図3象限法を用いて(A)ストリークプレート技法。あらかじめ滅菌ループは、スティックや爪楊枝は、プレートの中心にリムから迅速、スムーズに、話を戻すと、第四運動と寒天表面の四分の一を越えてサンプルを広めるために使用されています。このアクションは、プレートの4つの象限のそれぞれについて繰り返されます。インキュベーション後、細胞増殖は、プレート上に細胞を堆積するために使用される楽器のパスに沿って表示されます。このテクニックを使用して混合試料中の細胞の機械的分離(例えば図1を参照)第四象限内の単一のコロニーになるはずです。単一コロニーをコロニー形成単位(cfuと呼ばれています。) (B)金属製のループがストリークめっきに使用される場合は、接種または寒天培地と接触する前にブンゼンバーナーの火炎を用いて滅菌する必要があります。炎の最も熱い部分は青錐体の先端であることを思い出してください。楽器のハンドルを保持、ループ3〜4インチ約炎で線を配置します。レッドホットになるためのワイヤに十分な長さのままにします。炎がループに近づくように、線を移動します。金属製のループが接種に触れる前に冷却されることを確認してください。

図4。注ぎ板技術。 (A)サンプルの小さな体積(ミリリットル1.0から0.1の間)5.0ミリリットル血清学的ピペットを使用して、空が滅菌ペトリ皿に無菌的に分配される。 (B)約48の温度に平衡化溶融寒天°Cは、サンプルのペトリ皿に注ぎます。蓋を閉じた後、プレートを穏やかにサンプルを混ぜるために旋回されており、溶かした寒天。寒天は、その後、プレートをインキュベーションのために反転され、約30分間固化されています。
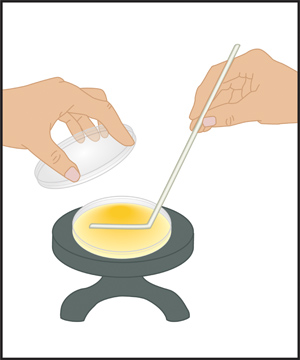
図5:ターンテーブル、ガラススプレッダーと拡散板の技術。寒天プレートがターンテーブル上に配置された後、サンプルを少量(0.1〜0.2ml)をピペットを用いてプレートの中央に無菌的に分配される。スプレッダーは、過剰のエタノールを点火するブンゼンバーナーの炎を通過させること、エタノールのビーカーに入れ、それを浸漬することにより滅菌されています。サンプルとの接触を行う前に、スプレッダーは、プレートの縁の近くに寒天に触れることによって冷却されるべきである。ターンテーブルがゆっくりと回転している間にスプレッダを穏やかにプレート全体にサンプルを前後に移動されます。このアクションは、徐々にでさえ寒天表面を横切ってサンプルの拡散を可能にします。蓋を閉じた後、プレートをベンチトップuに設定する必要がありますサンプルでは、インキュベーションの反転プレートの前に寒天に完全に吸収することができるようにするには、少なくとも5分間ndisturbed。
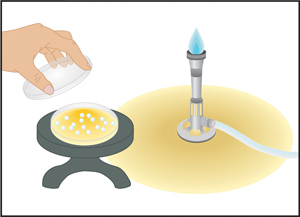
図6。ガラスビーズ(コパカバーナ法)と拡散板技術。オートクレーブにあらかじめ滅菌されたガラスビーズをベンチの上に座っている寒天プレートの表面に注がれる。サンプルの小さなボリュームは(100〜150μl)をピペットを用いて寒天培地の中央に無菌的に分配される。プレートの蓋を閉じた状態で、水平方向の揺れ動きが静かにプレートを行き来6から7倍にビーズを移動するために使用され、サンプルを拡散。このアクションは、プレート60°回転した後に繰り返されます。揺れ動きは、他の60°回転後に三回繰り返されます。サンプルが完全に寒天培地に吸収された後、ビーズが10%の漂白剤を含むビーカーに注ぎされています。ザ次いで、プレートをインキュベーションに反転されています。
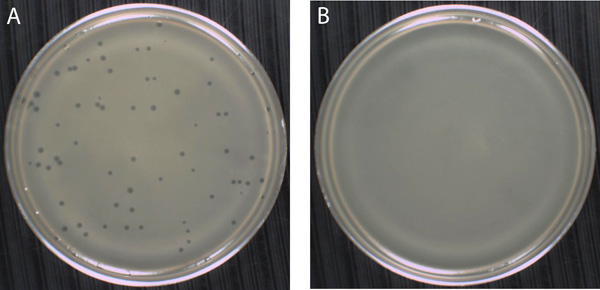
図7プラークの形成(またプラークアッセイとも呼ばれる)に基づいて、ファージを分離し、列挙するために使用ソフト寒天オーバーレイ技法。 (A)ファージの存在は、軟寒天で成長細菌コロニーのコンフルエントサスペンションに、クリアのゾーン、またはプラークとして検出することができます。 T4ファージは、子孫ファージを溶解し、解放するために宿主細胞を引き起こし、そのホスト、 大腸菌に感染する病原性、二本鎖DNAファージである。感染と溶解の複数のラウンド後、近隣のE.元の感染した宿主細胞を囲むすぐ近くに大腸菌細胞は T4ファージ粒子数十億を含むプラークを残して消える。 T4ファージは直径約1 mmであるプラークを生成します。この実験では、T4ファージの2×10 8 pfu / mlの株式の10 -5希釈液200μlでEの約300μlで混合した大腸菌のインジケーター細胞は37℃で指数関数的に成長し、通気培養のように調製しファージや細菌の両方がその後EHAハード寒天プレートの表面に注ぎ、混合、EHA軟寒天チューブに追加されました。それはファージと細菌がこのケースでは、めっき前に吸着できるようにする必要はありませんでしたことに注意してください。軟寒天で20分間邪魔されずに固化させた後、プレートを24時間37℃で反転し、インキュベートした。 (B)、離散コロニーが表示されていないされている軟寒天中での細胞の濁った懸濁液中にファージ粒子、細菌の増殖の結果を感染の有無で。代わりに、このケースでは、細菌の細胞にも芝生は、E.大腸菌 、全体の柔らかい寒天層全体の形。
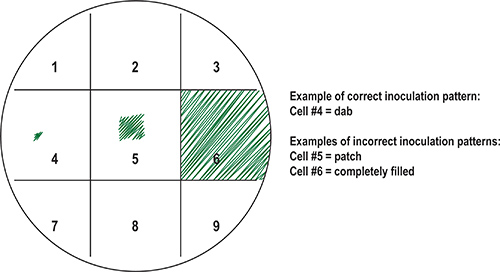
図8。細菌サンプルを使用して、プライマリプレート(マスター)の調製。サンプルでは、整理するために、プレートの底部はグリッドにマークされ、その結果の正方形は、番号することができます。各サンプルは、グリッド上の正方形を割り当てることができます。示すように、適切な対誤った接種パターンの例です。理想的には、少数の細胞がこのような "DAB"サンプル(セル#4)に爪楊枝のような滅菌接種ツールを使用して、広場の中央に転送されます。その結果、隣接する正方形を汚染するようなセル#5( "パッチ")とセル#6( "フィル")、インキュベーション後の細菌サンプルの異常増殖の結果に示されているものなど、一般的な接種ミス、、。
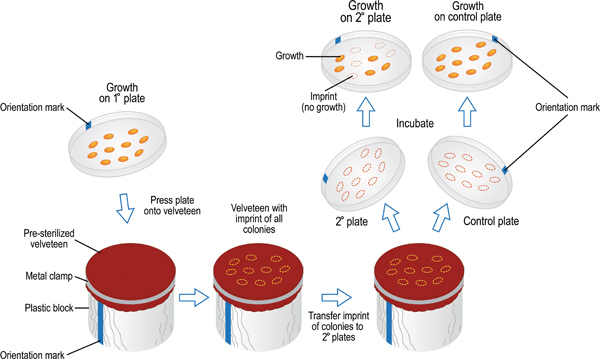
図9。表現型スクリーンの二次板へのプライマリからのセルを転送するために使用されるレプリカプレート法。主要なプレートのマークは、ロウその後別珍覆われたブロック上のマークに揃えられます寒天表面が布に連絡できるようにする赤。細胞は軽くなく均等に指の先端を使用してプライマリプレートを押し下げて、プレートからの別珍に転送されます。このアクションは、主板と同じ空間パターンの別珍の細胞サンプルの痕跡を残します。同じ手順は、別珍からセカンダリプレートに細胞を転送するために使用されます。 7月8日二次板のように多くは別珍に同じプライマリプレート印象を用いて接種することができます。別珍から接種された最後のプレートは、ポジティブコントロールとして役立つべきである。それは、プレートのシリーズ全体を通して発生した十分なセル転送を確保するため、すべてのテストされた株の成長をサポートしている培地である必要があります。インキュベーション後、二次プレートは成長なし対成長のために検査し、得点することができます。したがって、複数の菌株は、単一の実験でいくつかの成長媒体で同時にスクリーニングすることができる。
_upload/3064/3064fig10.jpg "/>
図10の例流動プレート技術を使用して結果を。公共の水飲み場から採取した水1.0mlのサンプルは滅菌空のペトリ皿に分注した。その後溶けが冷却YTAは、サンプル皿に注ぎ入れた。寒天は、水試料中に存在している可能性があり、酵母やカビの増殖を防ぐために100μg/ mlのシクロヘキシミドを含有していた。優しくミックスに渦巻く後、プレートを平らな面に設定されていると寒天が完全に固化させた。プレートを37℃で48時間インキュベートした。この実験の結果が示されています。固化した培地は、サブ表面に拡散コロニーを抑制するために非常に小さく、不規則な形状表面形状に、大規模かつ円形コロニー、対サブ表面のコロニーの外観の違いに注意してください。

図11。 </ strong>の拡散板の技術を使用した例の結果。 "コパカバーナ方法は、"プレートスクリーニング実験のための大腸菌細胞の混合物をするために使用されました。このケースでは、増殖培地(LB)はX-Galを含んでいるので、機能的なβ-ガラクトシダーゼ酵素のフォーム青色のコロニーを発現する細胞中にそれらのlacZ遺伝子の変異を持つ細胞と機能的なβ-ガラクトシダーゼ酵素の形を表現するため、できない白色コロニー。多くの場合、 "白/ブルースクリーン"と呼ばれる、コロニーの2つのタイプが容易に同じプレート上で互いに区別することができます。

図12の例のソフト寒天オーバーレイ技術を用いてプラークアッセイの結果。示されている2つの異なるpHによって宿主株マイコスメグマチス MC 2 155(ATCC 700084)上に形成されたプラークは年齢:(A)Mycobacteriophageデストロイヤーと(B)MycobacteriophageのMSSS。これらのファージは、2010年春にUCLA研究室コースMIMG 103Lの学生により単離した。 M.スメグマチスは、非病原性Actinobacteriumであり、そのような結核( 結核菌、M. africanum、M.ボビス )とハンセン病(M.らい )のような深刻な病気を引き起こすことが知られているいくつかの病原体を含むマイコバクテリアのファミリーに属しています。駆逐艦の10 -2希釈およびMSSS各10 -3希釈の約50μlのMの500μlでインキュベートした。 37℃で20分間スメグマチス °Cその後MBTA(軟寒天)と混合し、MHA(ハード寒天)プレートに注いだ。軟寒天で20分間邪魔されずに固化させた後、プレートを48時間37℃で反転し、インキュベートした。各ファージによって生成された個別のプラークの形態に注意してください。駆逐艦()は、小さなフォーム(約1ミリメートルの平均直径)、溶菌ファージの特性を明確プラークMSSS(B)は混濁ハロー(約3.2ミリメートルの平均直径)で囲まれた明確なセンターと大規模な "牛の目"プラークを開発している。かすんだリングは、感染をファージに耐性のある細菌で構成されることがあります。このパターンは、濁ったプラークを生成する溶原性ファージによって形成されているとは区別されます。
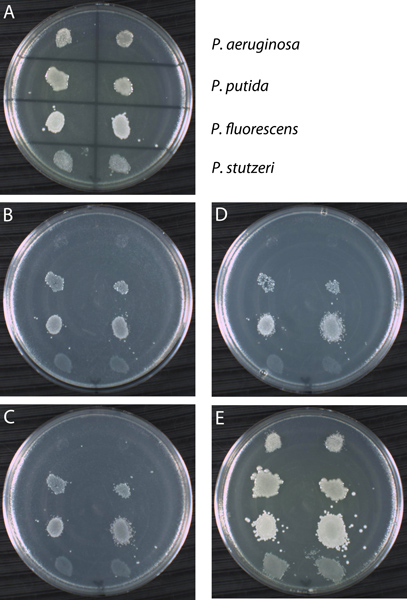
図13。レプリカプレートプロシージャを使用して例の結果です。アセトアミド、ラクトース、グリシン:四シュードモナス菌株が( 緑膿菌、P.プチダ、P.フルオレッセンス、およびP. stutzeri)には3種類の炭素源に成長のための複製で試験した。 (A)主なプレートが示すように、4株を接種した完全培地(YTA)です。 24時間30℃でインキュベーションに続いて、4つのすべての株がYTAで育つ。主要なプレートは、最低限の私の上にレプリカプレートに使用されたアセトアミド(B)、乳糖(C)、グリシン(D):dium(MSA)は、単一の炭素源を添加した。シリーズの最後のプレートは、陽性対照YTAプレート(E)であった。に示すように、株は二次プレート上でインキュベーションした後の変数の成長パターンを示しています。それは成長と細胞のインプリントを区別することが困難であることに注意してください。例えば、P.によって生成されたプリントを比較するP.の同じ3つのプレート上で成長なしの3つのMSAプレート上stutzeri緑膿菌 。どちらも、P.によって示された成長パターンに比べて否定的な結果であるプチダおよびP.オレッ 。ただし、すべての株はポジティブコントロールプレートを確認する細胞に成長するにはシリーズのすべてのセカンダリプレートに移した。この実験の結果を表1にされています。
| YTA (プライマリ) | MSA + アセトアミド | MSA + 乳糖 | MSA + グリシン | YTA (コントロール) | |
| 緑膿菌 | + | - | - | - | + |
| P.プチダ | + | + | + | + | + |
| P.フルオレッセンス | + | + | + | + | + |
| P. stutzeri | + | - | - | - | + |
表1。レプリカメッキ結果の概要。 ( - )成長率はプラス記号(+)とマイナス記号として表されて成長なしとして示された。 YTAは、完全培地(酵母トリプトン寒天培地)であり、MSAは最少培地(最小限の塩寒天)です。 MSAプレートは示されているように、単一の炭素源を添加した。
ディスカッション
培養微生物は無菌操作は、細胞とメディアの操作を通して維持されている必要がありますすべてはめっき法、数が含まれます。 5つの異なる手順は、このプロトコルで説明されました。これらのめっき技術が日常的に細菌やファージを操作するために使用されていますが、彼 らはまた、(一般的に、酵母(例えば、 サッカロミセス·セレビシエ(Saccharomyces cerevisiae)、カンジダ·アルビカンス(Candida albicans)、シゾサッカロミセス·ポンベ )、藻類などの分子遺伝学で使用され、原生動物、哺乳類培養細胞および真核微生物に適用することができますすなわち、 ボルボックス、クラミドモナス、アメーバ、ゾウリムシ )、および線虫(すなわち、 線虫Caenorhabditis elegans)。また、研究対象の実験的な目標や生物に応じて、各めっき法の(そして、さらに洗練された)多数のバリエーションがあります。したがって、それは唯一の方法論のようなtを与えられた実験やターゲット微生物のための最も適切な方法を選択しても調整しないようにすることが重要である帽子の実験結果は、適切に調査、質問や問題に対処します。
このプロトコルで説明しためっき技術の最新のアプリケーションのいくつかは、スクリーニングや創薬実験のための高スループットの結果をもたらす技術の進歩を含んでいます。たとえば、ゲノムシークエンシングセンターはE.ある拡散メッキのクローンライブラリの"コパカバーナ方法"を、使用大腸菌細胞は、微生物のゲノム由来のDNA断片を含むプラスミドで形質転換した。大規模なプレート(バイオアッセイトレイと呼ばれる)の数十を一度に用意されているため、自動プレートシェーカーは、トレイのバッチ全体のためにガラスビーズを振るために使用されます。また、インキュベーション後に、これらのプレートからコロニーを選択する際に、ロボットコロニーピッカーは、384ウェルマイクロプレートのLBブロスのための接種物として適切なコロニーから細胞を収集するために使用されています。このハイスループットスクリーニングアッセイ、拡散pの手続きの原則のために後半技術が適用されますが、技術は様々なステップを自動化すると同時に、短い時間枠内で分析される多数のサンプルを許可するようにスケーリングすることができます。
バイオテクノロジーと製薬会社は、微生物学、分子遺伝学における最も基本的な技術のためのハイスループット技術の開発にかなりのリソースを投資しています。例えば、一度に最大8または12サンプルのボリューム転送を実行するためにマルチチャンネルmicropipettorsがあります。さらに96チャンネルピペットヘッドを操縦するロボットワークステーションがあります!これらの取り組みは、実験に関連付けられている機械的な操作を実行するために必要なインスツルメンテーションを開発することができ、エンジニアやコンピュータプログラマと方法論の専門知識を持っている生物学者のペアリングは、科学者の学際的なチームを含んでいます。かかわらず、研究アプリケーションの、これらの技術を開発する企業で共有される目標は同じです - laboratoを自動化するRYプロセス、ツール、システム、機器、それらを集中的かつ効率的に少ない労働力となっています。
開示事項
私は、開示することは何もありません。
謝辞
サンプルの培養を設定し、数字を支援するためのイラストを準備し、クリスReddiとカリフォルニア大学ロサンゼルス校(UCLA)BhairavシャーするためにはIROCデザインでコリ·サンダース氏に感謝します。このプロジェクトの資金は、HHMI(ハワードグラント番号52006944)によって提供されていました。
資料
| Name | Company | Catalog Number | Comments | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1. Yeast Tryptone Agar (YTA)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. If preparing tubes for the pour-plate procedure, allow the agar to cool to ~55°C then add 2.0 ml of 50 mg/ml cycloheximide. Aseptically dispense 18.0 ml of the melted agar per 18 mm tube then store at 4°C. The agar will solidify and will need to be melted in a steamer or microwave prior to use. 2. Minimal Salts Agar (MSA) + 0.1% (w/v) carbon source
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. * Carbon sources used for experiments presented in Figure 13 include acetamide, lactose, and glycine. ** Trace salts solution is prepared in 0.1 N HCl as follows. It is added to the base before sterilization (autoclave at 121°C for 20 minutes).
3. EHA soft agar (0.65 % w/v)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. 4. EHA hard agar (1.2% w/v)
Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. 5. 1X Middlebrook Top Agar (MBTA soft agar, 0.5% w/v)
Melt 50 ml of 2XTA and allow it to cool to ~55°C. Using aseptic technique, add the CaCl2 and 7H9 broth to the melted agar. Aseptically dispense 4.5 ml of the mixture per 13 mm tube and store in a 55°C incubator ≤7 days. Cooling MBTA to room temperature or 4°C will cause the CaCl2 to precipitate out of solution. * 100 mM CaCl2. stock must be stored at room temperature to prevent CaCl2 from precipitating out of solution. ** 7H9 liquid medium: Neat
Mix the base with water then add the glycerol while stirring. Autoclave at 121°C for 20 minutes to sterilize. Store at 4°C. *** 2X Middlebrook Top Agar (2XTA, 1.0% w/v)
Autoclave at 121°C for 20 minutes to sterilize. Dispense 50 ml aliquots into 100 ml bottles and store at 4°C. 6. Middlebrook 7H10 Agar Plates (MHA hard agar, 1.9% w/v)
Mix the agar base with water then add the glycerol while stirring. Heat the solution to boiling then stir for one minute to completely dissolve the base powder. Autoclave at 121°C for 20 minutes to sterilize. Allow the agar to cool to ~55°C then aseptically add the following reagents:
* AD supplement
Filter-sterilize this solution; do not autoclave. Store at 4°C. ** Filter-sterilize and store these solutions at 4°C for ≤60 days. 7. LB agar (1.5% w/v) + X-Gal (60 μg/ml)
Autoclave at 121°C for 20 minutes to sterilize. Allow the agar to cool to ~55°C then aseptically add 3.0 ml of 20 mg/ml X-Gal solution. Freshly prepare X-gal stock by dissolving 400 mg X-Gal in 20 ml dimethylformamide (DMF). Table of specific reagents:
Table of specific equipment:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
参考文献
- Barker, K. At the Bench: A Laboratory Navigator. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. (1998).
- US Department of Health and Human Services (DHHS). Biosafety in Microbiological And Biomedical Laboratories (BMBL). , 5th, U.S. Government Printing Office. Washington DC. Available from: http://www.cdc.gov/biosafety/publications/bmbl5/index.htm (2009).
- Dulbecco, R., Vogt, M. Some problems of animal virology as studied by the plaque technique. Cold Spring Harbor Symp. Quant. Biol. 18, 273-279 (1953).
- Fields, B. N., Knipe, D. M., Chanock, R. M., Hirsch, M. S., Melnick, J. L., Monath, T. P., Roizman, B. Fields Virology. 1, 2nd, Raven Press. New York, NY. (1991).
- Gilbert, R. A., Ouwerkerk, D., Zhang, L. H., Klieve, A. V. Cooperative Research Center for Beef Genetic Technologies. In vitro detection and primary cultivation of bacteria producing materials inhibitory to ruminal methanogens. Journal of Microbiological Methods. 80, 217-218 (2010).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. BioTechniques. 23, 648-650 (1997).
- Karam, J. D. Molecular Biology of Bacteriophage T4. , ASM Press. Washington, DC. (1994).
- Knipe, D. M., Howley, P. M., Griffin, D. E., Lamb, R. A., Martin, M. A., Roizman, B., Straus, S. E. Fundamental Virology. , 4th, Lippincott, Williams, and Wilkins. Philadelphia, PA. (2001).
- Lederberg, J., Lederberg, E. M. Replica plating and indirect selection of bacterial mutants. J. Bacteriol. 63, 399-406 (1952).
- Miller, J. H. A Short Course in Bacterial Genetics: A Laboratory Manual and Handbook for Escherichia coli and related bacteria. , Cold Spring Harbor Laboratory Press. Plainview, NY. (1992).
- Mills, K. V., Gareau, J. R., Garcia, A. M. Low-cost modification to the Copacabana method for spreading transformation mixtures. BioTechniques. 39, 188(2005).
- Jordan, T., et al. RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , Howard Hughes Medical Institute. (2008).
- Sambrook, J., Russell, D. W. Molecular Cloning - A Laboratory Manual. , 3rd, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. (2001).
- Sanders, E. R., Miller, J. H. I. Microbiologist: A Discovery-based Course in Microbial Ecology and Molecular Evolution. , ASM Press. Washington, DC. (2010).
- Slonczewski, J. L., Foster, J. W. Microbiology - An Evolving Science. , 2nd, W.W. Norton & Co., Inc. New York, NY. (2011).
- Teather, R. M., Wood, P. J. Use of Congo Red-Polysaccharide Interactions in Enumeration and Characterization of Cellulolytic Bacteria from the Bovine Rumen. Applied and Environmental Microbiology. 43, 777-780 (1982).
- Wise, K. Preparing Spread Plates Protocols. , Available from: http://www.microbelibrary.org/index.php/component/resource/laboratory-test/3085-preparing-spread-plates-protocols (2006).
- Worthington, M., Luo, R. Q., Pelo, J. Copacabana method for spreading E. coli and yeast colonies. BioTechniques. 30, 738-742 (2001).
- American Type Culture Collection (ATCC). , Available from: http://www.atcc.org/ (2012).
- EPA Microbiology Home Page. , Available from: http://www.epa.gov/nerlcwww/index.html (2012).
- The GENE Project: Laboratory Methods and Materials. , Available from: http://www.phys.ksu.edu/gene/g1.html (2012).
- Joint Genome Institute (JGI) Genome Sequencing Protocols: Library Plating Protocol. , Available from: http://www.jgi.doe.gov/sequencing/protocols/prots_production.html (2012).
- Microbial Genetics (maintained by Stanley Maloy at UCSD). , Available from: http://www.sci.sdsu.edu/~smaloy/MicrobialGenetics (2012).
- Organization of American States (OAS) Department of Sustainable Development (DSD). , Available from: http://www.oas.org/DSD/publications/Unit/oea59e/ch26.htm (2012).
- Public Health Agency of Canada: Material Safety Data Sheets (MSDS) for Infectious Substances. , Available from: http://www.phac-aspc.gc.ca/msds-ftss (2012).
- United States Environmental Protection Agency (EPA) Office of Water. , Available from: http://water.epa.gov (2012).
- American Society for Microbiology (ASM)'s Curriculum Recommendations Microbiology Majors Program. , Available from: http://www.asm.org/asm/index.php/unknown/asm-s-curriculum-recommendations-microbiology-majors-program.html (2012).
- Introductory Course in Microbiology. , Available from: http://www.asm.org/asm/index.php/unknown/asm-s-curriculum-recommendations-introductory-course-in-microbiology.html (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved