A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דופמין Dynamics Presynaptic בתוך פרוסות המוח striatal עם Voltammetry סריקה מהירה מחזורי
* These authors contributed equally
In This Article
Summary
שימוש מהיר סריקה מחזורית voltammetry למדוד עורר חשמלית הדינמיקה דופמין presynaptic ב striatal פרוסות המוח.
Abstract
מחקר מקיף התמקדה הנוירוטרנסמיטר דופמין בגלל חשיבותו מנגנון הפעולה של תרופות של התעללות (קוקאין למשל אמפטמין ו), תפקיד אותו ממלא מחלות פסיכיאטריות (לדוגמא סכיזופרניה הפרעת קשב והיפראקטיביות), ואת מעורבותה ניוונית מחלות כמו פרקינסון מחלת הנטינגטון. בתנאים פיסיולוגיים נורמליים, דופמין ידוע להסדיר פעילות הקוגניציה של תנועה, למידה, להשפיע רגשית, הפרשת הורמון נוירואנדוקריניים. אחד צפיפות הגדולה של נוירונים דופאמין בתוך בסטריאטום, אשר ניתן לחלק לשני אזורים נפרדים neuroanatomical המכונה גרעין האקומבנס ו-caudate putamen. המטרה היא להדגים פרוטוקול כללי voltammetry מהיר סריקה מחזורית פרוסה (FSCV) בתוך בסטריאטום העכבר. FSCV היא טכניקה מוגדרת היטב אלקטרוכימיים מתן הזדמנות למדוד שחרור דופאמין ספיגת בזמן אמת דiscrete אזורים במוח. סיבי פחמן microelectrodes (בקוטר של כ 7 מיקרומטר) משמשים FSCV לזהות חמצון דופאמין. היתרון של שימוש FSCV אנליטיים לזהות דופמין הוא ברזולוציה הטמפורלית משופרת של 100 אלפיות ו ברזולוציה מרחבית של פחות מעשרה מיקרונים, מתן מידע משלים ב microdialysis vivo.
Protocol
1. ניסויית יסודות
אלקטרודה ייצור
- ישנם מספר רב של סיבי פחמן microelectrodes שיטות ייצור שכן רוב נעשות בתוך הבית. בדרך כלל מה מכתיב את הפרטים ייצור אלקטרודה היא טכניקה אלקטרו המוחלת על האלקטרודה (למשל לעומת amperometry FSCV). עבור FSCV, microelectrodes יכול להתבצע בתוך הבית באמצעות ההליך הבא בן שלושה שלבים. לקבלת תיאור מלא יותר של ייצור סיבי פחמן אלקטרודה, ראה מאמר האחרונות יופיטר 1. עם זאת, לציין כי אלקטרודות המתוארים להלן הם גלילי סיבי פחמן microelectrodes, אשר דורשים צעדים פחות לפברק לעומת הסיבים microelectrodes amperometric חמצני מן הפרוטוקול הנ"ל. זה פרוטוקול פשוט אינו מחייב רותחים סיבי פחמן בתוך אצטון, אש ליטוש הנימים זכוכית, או באמצעות אפוקסי לאטום את צומת הזכוכית סיבים.
- באמצעות ואקום יניקה aspirאכלו סיבי פחמן (7 מיקרומטר קוטר; גודפלו Oakdale, PA) לתוך כוס בורוסיליקט נימי עם microfilament (אורך 10 ס"מ, 1.2 מ"מ od, מ"מ 0.68 id; מערכות בבוקר, Carlsborg, WA).
- מניחים את נימי מושחל לתוך חולץ את האלקטרודה (Narishige, טוקיו, יפן) שבו נימי נמשך במחצית. הגדרות פלט עבור חולץ את האלקטרודה לעשות להשתנות מהמעבדה למעבדה. עבור הפניה, הגדרות פלט שלנו חולץ הם 90.7 מגנט הראשי, תת מגנט 23.2, 53.4 ו עבור החימום. הגדרות הפלט צריך להיות מעודן אמפירי כדי ליצור להתחדד זכוכית הוא כ 4.4 מ"מ אורך, עם חותם הדוק סביב סיבי פחמן.
- תחת מיקרוסקופ (אולימפוס, טוקיו, יפן), חתוך את סיבי פחמן (באמצעות להב סכין המנתחים) הארכת מקצה זכוכית המאפשר כ 5-20 מיקרומטר של סיבים פחמן לבלוט מממשק סגורה היטב.
הפתרון הכנה
שלושה סוגים של והנוזל מלאכותיbrospinal נוזל (aCSF) הפתרונות צריכים להיות מוכנים מראש, הכל מים (18 MΩ ס"מ) ultrapure.
- סוכרוז-aCSF ניתן להכין לפחות יום אחד לפני חיתוך. חיץ סוכרוז-aCSF מורכב (מ"מ): 180 סוכרוז, 30 NaCl, KCl 4.5, 1.0 MgCl 2, 26 NaHCO 3, 1.2 לאא 2 PO 4, ו 10 D-גלוקוז (pH 7.4) ויש מחומצן באמצעות 95 % O CO 2 / 5% 2 במשך 15 דקות 2. אם מוכן מראש, הפתרון ניתן לשמור בקירור ב 4 ° C עד 1 בשבוע.
- פתרון ACSF להקלטות voltammetric צריכים להיות מוכנים ביום הניסוי. הפתרון aCSF מורכב (מ"מ): 126 NaCl, KCl 2.5, 2.4 CaCl 2, 1.2 MgCl 2, 25 NaHCO 3, 1.2 לאא 2 PO 4, 11 D-גלוקוז, 0.4 חומצה אסקורבית (pH 7.4). במהלך הניסוי, על ידי חמצן מבעבעת O2 עם 95% / 5% CO 2 בטמפרטורת החדר.
- Modified-aCSF פתרון כיולים אלקטרודה מכיל (מ"מ): 2.5 KCl, NaCl 126, 1.2 לאא 2 PO 4, 2.4 CaCl 2, 1.2 MgCl 2, 25 NaHCO 3 (pH 7.4) ו יכולים להישמר לתקופה של עד שבוע, ללא קירור או חמצון.
אלקטרודה כיול
- הכדאיות אלקטרודה ורגישות נקבעת על ידי מראש שלאחר כיול, בהתאמה, באמצעות זרם "T-cell" שמכיל 3 יציאות עם אלקטרודה התייחסות אטום (Ag / AgCl). Microelectrode מפוברק הוא הוריד לתוך "תא-T" הזרימה. יציאת כניסת מחוברת משאבה מזרק, ומאפשר זרימה רציפה של שינוי, aCSF בקצב הזרימה של 2 mL / min. הנמל השלישית של "תא-T" מחובר מזרק מלא דופמין 3 מיקרומטר, תוצרת שונה, aCSF.
- כדי לכייל מראש, מאפשרות פתרון שונה aCSF לזרום במשך כ 3-7 שניות, ולאחר מכן באופן ידני להזריק 1-2 מ"ל של תקן דופמין 3 מיקרומטר. עבור כל אלקטרודהלהיות מכויל מראש, לחזור על כיול לפחות 3 פעמים בממוצע הזרמים המקסימלי המתקבל כל אחד.
- מיד לאחר הניסוי voltammetry פרוסה (ראה סעיף 3), אלקטרודה היא שלאחר מכויל באותו אופן כפי שתואר לעיל.
- גורם כיול (השתמשו מאוחר יותר במהלך ניתוח הנתונים) נקבעת על ידי חלוקת חמצון דופאמין הממוצע הנוכחי (NA) על ידי ריכוז של רמת הדופמין. לדוגמה, התגובה הנוכחית מחולק 3 בעת שימוש רגיל דופמין 3 מיקרומטר.
2. פורסים הכנה
- יוצקים 10 מ"ל של aCSF סוכרוז לתוך כוס מקום קטן בתוך דלי קרח. בנוסף, דבק מקום מיידיות (Loctite 404) בתוך דלי קרח בהישג יד.
- הכן סכין גילוח וכלי הנדרשים לניתוח, כגון מלקחיים, מרית, ומספריים, על ידי מנקים אותם עם כרית אלכוהול.
- הקורבן עכבר בחנק CO 2 ב צ'ה גז קטניםmber, ואחריו עריפת ראש מיידית באמצעות מספריים חדים. להסיר במהירות את המוח כולו. מניחים את המוח בכוס של aCSF קר כקרח סוכרוז למשך כ 10 דקות.
- בינתיים, מכינים Vibratome עבור חיתוך. ראשית, מקום קצת קרח כתוש באמבטיה הדגימה. מקם את תא הדגימה והדק להחזיק אותו במקומו. מוסיפים קרח יותר סביב חדר הדגימה כדי למלא את הפערים, מוודא קרח לא נכנס לתא. הנח את סכין הגילוח לנקות מחזיק את הלהב על Vibratome ולמלא את תא הדגימה עם aCSF קר כקרח סוכרוז.
- כדי להגדיר משטח עבודה להכנת המוח, לשפוך כמה aCSF סוכרוז קר על פיסת מגבת נייר, כי הושם על צלחת פטרי הפוכה. שימוש במלקחיים להעביר את המוח על צלחת פטרי מוכן. עבור פרוסות העטרה, לחתוך את המוח הקטן לאורך ציר המדיאלי, לרוחב, בסכין גילוח וזורקים. זה יוצר בסיס שטוח שיכול להיות מודבקת על הבמה Vibratome.
- מקוםטיפת דבק Loctite (ממוקם בדלי קרח במהלך שלב 1) על הבמה את הדגימה. מיד להדביק את הקצה השטוח של המוח מוכן על הבמה, כמו שמירה על אותה זקוף ככל האפשר. מניחים את הבמה בחדר הדגימה והדק את הבורג, להבטיח כי המוח הוא שקוע לגמרי aCSF סוכרוז בחדר.
- שימוש בפקדים הקדמי של Vibratome להתאים את הבמה כך סכין גילוח קווי עם החלק העליון של המוח. פרמטרים אופטימליים Vibratome מתקבלים על ידי קביעת תדירות ומהירות לנמוך. מהירויות תחתון הם העדיפו לצמצם את הכוח של הלהב מן מועך את המוח, אשר נצפו במהירויות גבוהות. עובי פורסים מוגדר 400 מיקרומטר.
- פרוסות הראשונים לא יכיל את הסטריאטום. חזור על חיתוך עד פרוסות המכיל את הסטריאטום מתקבלים. לאחר באזור striatal הוא הגיע (אישר ידי ציוני דרך אנטומיים), להשתמש במברשת צבע כדי להרים את הפרוסה ומניחים מבחנה עםמחומצן, בטמפרטורת החדר aCSF. בדרך כלל, ניתן לקבל 3-4 פרוסות המכיל את מורכבות striatal כך caudate ו-putamen גרעין האקומבנס כלולים.
- אפשר הפרוסות להסתגל ב aCSF מחומצן בטמפרטורת החדר למשך שעה לפחות לפני השימוש 1 לניסויים.
3. הקלטות Voltammetric מ פרוסות
בעוד פרוסות הם דוגרים, חדר הקלטה פרוסה יכול להיות מוכן.
- קחו צינור המחובר לתא הקלטה הטבילה (Custom מדעי, דנוור, CO) ומניחים oxygenating, טמפרטורה aCSF החדר. הגדר את משאבת זלוף (מרלו ווטסון מוגבל, Falmouth, אנגליה) לשיעור הזרימה של 1 מ"ל / דקה. הגדר את בקר הטמפרטורה ל 32 ° C. לאחר aCSF ממלא בעל שהותקן פרוסה (שונה בשלב רשת דיסק), להכין אותו הפרוסה על ידי הסרת כל בועות אוויר באמצעות מחט המזרק (מחט BD השדרה).
- אמבטיה הממשלה את הפרוסה על ידי ציור ואקום עלצינורות יצוא (המוביל פסולת נוזלית בקבוק זכוכית) באמצעות מזרק כדי להתחיל לזרום. מניחים kimwipe לשמש הפתיל על קצה מחזיק את הפרוסה לשלוט גלישת מאגר.
- לאחר דגירה 1 שעה, להעביר את פרוסות לבעל פרוסה בחדר הקלטה, אשר perfused ברציפות עם 95% O 2 / 5% CO 2 חדר aCSF הטמפרטורה.
- להטביע את Ag / AgCl הפניה אלקטרודה מחזיק את הפרוסה (מודבק למכסה של החדר פרוסה) ולחבר את האלקטרודה באמצעות קליפ תנין לשלב את הראש.
- אלקטרודת Ag / AgCl התייחסות יכול להתבצע בבית על ידי אילגון (1 V) חוט כסף 250 מיקרומטר (AM מערכות, Carlsborg, WA) ב 1 M HCl למשך 5 דקות להפקיד שכבה דקה של AgCl על פני השטח של חוט כסף.
- מנמיכים את מגרה אלקטרודה טונגסטן (פלסטיק אחת, Roanoke, VA) אל פני השטח של הפרוסה המוח striatal. אלקטרודה מגרה יוצר קשר עם הפרוסה כפי שהוא מונח על גבישל זה, אבל לא צריך לנקב את הפרוסה. בשנת שלנו ניסיוני הגדרת, הגירוי נוצר על ידי ממריץ Neurolog.
- סיבי פחמן microelectrode עובד חוזר מלא עם פתרון KCl 150 מ"מ באמצעות מחט BD השדרה. חוט להוביל מוכנס אז (סקוויירס אלקטרוניקה, קורנליוס, OR), אשר מחובר אל הבמה ראש רעש נמוכה ChemClamp potentiostat (תאגידים דגן, מיניאפוליס, מינסוטה) באמצעות קליפ תנין. אלקטרודה עובד ממוקם כ 100-200 מיקרומטר הרחק אלקטרודות גירוי דו קוטבית, על 75 מיקרומטר עמוק לתוך הפרוסה.
- גירויים חשמליים, שימוש או יחיד (monophasic, 350 μA, 60 הרץ, ו 4 ms רוחב פולס) או מרובות (למשל 5 פעימות, 350 μA, 20 הרץ, ו 4 ms רחב), קטניות, מועברות על ידי האלקטרודה לעורר גירוי עצבי לשחרר 3.
- כדי למדוד דופמין עורר חשמלית באמצעות FSCV, צורת גל משולש מוחל על האלקטרודה. פרמטרים אופייניים עבור DOPזיהוי אמין: הפוטנציאל של microelectrode סיבי פחמן מתקיים V -0.4 לעומת אלקטרודת Ag / AgCl התייחסות, ramped להגביל חיובית של 1.2 V, הביא ואז חזרה למטה V -0.4 בקצב סריקה של 400 V / s .
- פרוסה הוא מגורה חשמלית כל 5 דקות ומדידות voltammetric של בזרימת הדופמין וכתוצאה מכך עשויים למשך 15 שניות.
- אחרי לפחות שלוש יציב גירוי חשמלי לשחרר הקלטות דופמין (ההפרש בין גובה שיא הוא <10%), המכיל aCSF סוכן תרופתי של הריבית perfused בקצב זרימה של 1 מ"ל / דקה על הפרוסה במשך 30 דקות כדי להשיג אפקט מקסימלי. הקלטות דופמין מגורה חשמלית נעשים כל 5 דקות במהלך זלוף תרופתי.
4. ניתוח נתונים
עקבות הנוכחי לעומת זמן המתקבל כתוצאה פרוסה ניתן להתאים על ידי רגרסיה ליניארית לקבוצה של מיכאליס-Menten משוואות מבוסס, כפי שתואר על ידי Wightmanועמיתים תוכנה שנכתב LabVIEW (National Instruments, אוסטין, טקסס) 4-6. ב תוכנה זו, עקבות הנוכחי לעומת הזמן ניתן להתאים על ידי שינוי שני פרמטרים, V max (ננומטר / s; המקביל לשיעור של ספיגת ידי טרנספורטר דופאמין כמו שהפגינו בשלב יורד של עקבות) וריכוז דופמין לכל הדופק (ננומטר ; המקביל למקסימום גובה שיא). ערך מ 'ק', משקף את הזיקה של דופמין עבור טרנספורטר דופאמין, מוגדר 160 ננומטר לא השתנה. לאחר כיול של האלקטרודה גורם נקבעת לאחר הניסוי נדרש לפני הולם. תוכנת LabVIEW מכיל מקדם הקביעה (R 2) פרמטר כדי לקבוע מטיב ההתאמה (R 2 ערכים> 0.8 משמשים).
5. נציג תוצאות
FSCV שימש כדי לבחון יחיד הדופק, שחרור הדופמין גירוי חשמלי ספיגת ב-caudate לשיםאמן (CPU), גרעין האקומבנס (NAC) הליבה, NAC פגז בעכברים. תוצאות נציג שמוצג באיור 1A להפגין מגרשים הנוכחי (או ריכוז) לעומת הזמן. החץ האדום מציין כאשר גירוי חשמלי מוחל על הפרוסה ואחריו עלייה מקבילה בהיקף של הנוכחי לייחס שינויים בריכוז הדופמין ב microelectrode סיבי פחמן. התהליך השולט במהלך גירוי חשמלי היא שחרור דופאמין, אך תהליכים אחרים כגון ספיגת ודיפוזיה לתרום שיא הגובה הכולל נצפתה גם כן. השלב היורד מפסגת מיוחסת בעיקר ספיגה חוזרת של נוירוטרנסמיטרים על ידי טרנספורטר מאז גירוי עצבי הופסק 7. עם זאת, ריקבון השיא אינה מוגבלת ספיגה חוזרת, כמו הדיפוזיה ואת חילוף החומרים גם לתרום לירידה הנוכחית. זה כבר הניחו כי מאז סרגל הזמן של מדידות אלקטרו היא עניין של שניות, הוא FSCV מהר מדי כדי למדוד contributions מן המטבוליזם 7. אלה עקבות הנוכחי לעומת הזמן, ציר y מומר ריכוז (מיקרומטר) באמצעות גורם שלאחר ניסוי כיול. הבלעה עבור איור 1 א הרקע מופחתים בהתאמה voltammograms מחזורית עבור עקבות הנוכחי לעומת הזמן. שרטוט הנוכחית נמדד (ציר y) כנגד הפוטנציאל להחיל האלקטרודה (ציר x), דופמין מזוהה באופן כימי עם שיא חמצון שנצפה 0.6 V ו לשיא הפחתה המקביל quinone-Ortho דופמין הוא ציין ב - 0.2 V לעומת אלקטרודת Ag / AgCl התייחסות. הייצוג השלישי של נתוני משתמש תלת מימדי פסאודו צבע העלילה (1B איור) שילוב של מידע משני עקבות הנוכחי לעומת הזמן ואת voltammogram מחזורית כדי ליצור עלילה אחת. בעלילה צבע פסאודו נציג, הזמן הוא להתוות שניות לאורך ציר ה-x, מתח להחיל microelectrode סיבי פחמן הוא עובד בגרף לאורך ציר ה-Y, ו הנוכחי מיוצג false צבע לאורך ציר ה-z. בשל גודלו הקטן של סיבי פחמן microelectrodes (~ 7 מיקרומטר קוטר), הדינמיקה דופמין גירוי חשמלי ניתן להבחין באזורים אנטומיים נפרדים של בסטריאטום (CPU מול NAC הליבה מול NAC פגז; איור 2).
היתרון של שימוש פרוסות העטרה striatal היא שזה מבטל תרומות הגופים תא דופמין, ומאפשרת חקירה של דינמיקה דופמין presynaptic. השליטה Presynaptic שחרור דופאמין ספיגת אינה מוגבלת אך ורק autoreceptor דופמין או פונקציות טרנספורטר כפי שאחרים הראו 16, 17. Heteroreceptors של מערכות אחרות גם לווסת את הנוירוטרנסמיטר דופמין הדינמיקה 18, 19. עקבות הנציג הנוכחי לעומת הזמן שמוצג באיור 3A להוכיח שכאשר מטופלים עם פרוסות 1 מיקרומטר quinpirole (D2/D3 אגוניסט קולטן) במשך 30 דקות, ירידה שחרור הדופמין חשמלית עורר הוא ציין. מצד שני, כאשר המצעעבור טרנספורטר דופאמין, כמו מתאמפטמין, הוא perfused על הפרוסה במשך 30 דקות, אין הבדל לשחרור דופמין הוא ציין (איור 3B). ריקבון השיא מוסט ימינה, אשר מזוהה בדרך כלל עם שינויים קינטיקה טרנספורטר דופאמין (K מ ') 3. לבסוף, איור 3C הוא זכר נציג עקבות הנוכחית לעומת פעם אחת את הפרוסה כבר שטוף 100 ng / mL שמקורם במוח פתרון neurotrophic (BDNF) פקטור, אשר כבר שיערו להשפיע על שחרור דופאמין הדינמיקה 20, 21. מ זכר זה מייצג, ניתן לראות כי BDNF יש את היכולת לשפר את שחרור הדופמין חשמלית מעוררים. יחדיו, אלה טיפולים תרופתיים להדגיש את התועלת של FSCV לחקור את הדינמיקה דופאמין בתוך בסטריאטום.
המגבלה העיקרית של שימוש פרוסות המוח לחקור את הדינמיקה דופמין presynaptic ידי FSCV היא neurocircuitry מהמוח שלם הולך לאיבוד.עם FSCV פרוסה אי אפשר לחקור את ההשפעות של נוירוטרנסמיטרים מאזורים אחרים במוח, ולכן קשה להבין את תרומתם של מערכות אלה על הפונקציונליות של האזור הנחקר (כגון הסטריאטום) או להעריך את רמות הדופמין לא מגורה. עם זאת, ההתקדמות הטכנית האחרונות FSCV אפשרה למדידות חולף דופמין (עם או בלי גירוי חשמלי) בתוך נע בחופשיות חולדות בתגובה ממשל עצמי תרופתי, מניפולציה, או חידוש 22-24. בסך הכל, פרוסה FSCV מספק מידע רב ערך על הדינמיקה דופמין presynaptic, צימוד FSCV תוצאות פרוסה טכניקות neurochemical משלימים כגון microdialysis, electrophysiology, ו / או לנוע בחופשיות FSCV מציע מבט מקיף יותר של תפקוד עצבי במוח.
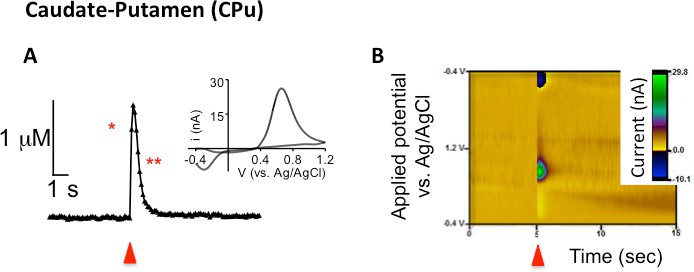
באיור 1. חשמלית, עורר dopaminשחרור דואר שנמדדו באמצעות גירוי FSCV הבאים הדופק יחיד בתוך פרוסות CPU הגב מעכברים C57Bl/6J. (א) ריכוז לעומת עקבות הזמן שבו שחרור הדופמין היה עורר על ידי הדופק יחיד (חץ אדום). כוכבית אחת מייצג את הגורמים שתורמים לעליית ריכוז, שהיא בעיקר שחרור דופאמין, אך ספיגת ודיפוזיה גם לתרום. כוכבית כפול מייצג את האות לשיא לחזור המחקר, בעיקר בשל ספיגת אלא גם תורם דיפוזיה. הבלעה מציגה את voltammograms מחזורית המקביל. (ב) צבע נציג מגרשים מן הזמן להציג הגב CPU (ציר x), להחיל פוטנציאל microelectrode סיבי פחמן לעומת אלקטרודת Ag / AgCl הפניה (ציר y), ואת הנוכחי צבע מדומה.
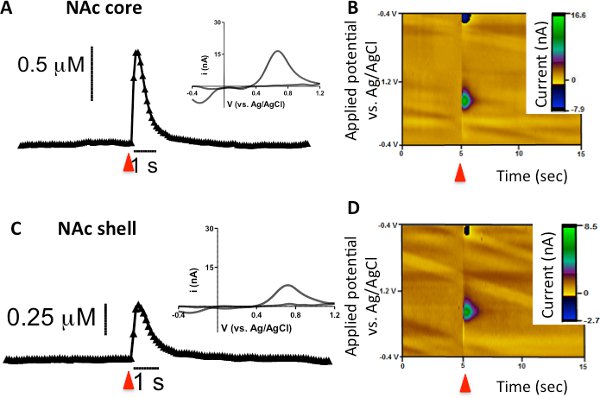
2. איור דופמין לשחרר עורר על ידי הדופק גירוי חשמלי יחיד (מסומן בחץ אדום) בליבת NACופצצות מעכברים C57Bl/6J. (A ו-C) ריכוז לעומת עקבות הזמן voltammograms המתאימים מחזורית (הבלעה) מן הליבה NAC ופצצות. (B ו-D) כפי שתואר קודם לכן, חלקות בצבע נציג הליבה NAC ופצצות.
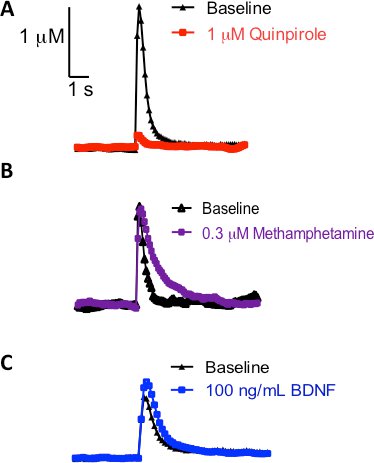
איור 3 עקבות נציג אחרי הפרוסה טופל עם סוכן תרופתי במשך 30 דקות. בכל המקרים, דופק יחיד שימש לעורר שחרור הדופמין המעבד. (א) בקשה של אגוניסט קולטן דופמין D2, quinpirole (אדום זכר) בהשוואה לטיפול טרום (זכר שחור). (ב) זלוף מתאמפטמין (זכר סגול) בהשוואה לטיפול טרום (זכר שחור). (ג) היכולת של המוח גורם הנגזרות neurotrophic להשפיע על הדינמיקה דופמין (כחול זכר) בהשוואה לטיפול טרום (זכר שחור).
Discussion
הפרוטוקול המובא כאן מדגים כיצד להכין ולהשתמש העטרה עכבר פרוסות המוח לניסויים FSCV. אמנם שיטה זו היא ספציפית קבלת ומדידת הדינמיקה דופמין, נוירוטרנסמיטרים אחרים כמו אדנוזין, מי חמצן, נוראדרנלין, וסרוטונין להיות במעקב in vivo או במבחנה עם 3 FSCV, 8 - 11. FSCV ניתן להש...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
במימון המכון הלאומי על אלכוהול התעללות ועל אלכוהוליזם (NIAAA; AA-016967 ו AA016967-01S1: TAM), וויין סטייט להתחיל כספים, ויין סטייט תוכנית המחקר גרנט. התוכן הוא באחריות הבלעדית של המחברים ואינו מייצג את הדעות הרשמיות של NIAAA או מכוני הבריאות הלאומיים.
Materials
| Name | Company | Catalog Number | Comments |
| שם | חברה | מספר CAS | |
מגיב | |||
אשלגן כלוריד | דיג | 7447407 | |
נתרן כלורי | EMD כימיקלים | 7647145 | |
מגנזיום כלוריד | דיג | 7791186 | |
סידן כלוריד | דיג | 10035048 | |
סודיום ביקרבונט | EMD כימיקלים | 144558 | |
פוספט נתרן, Dibasic | EMD כימיתs | 7558794 | |
D-גלוקוז | דיג | 50997 | |
חומצה אסקורבית | דיג | 50817 | |
סוכרוז | דיג | 57501 | |
|
| ||
חומרים | מוכר | מספר קטלוגי | |
סיבי פחמן | גודפלו Oakdale, הרשות הפלסטינית | ||
זכוכית נימי | AM מערכות Carlsborg WA. | 602000 | |
חוט כסף | A-M Systems Carlsborg WA. | 787000 | |
טונגסטן מגרה אלקטרודה | פלסטיק אחת, Roanoke, VA | ||
חוט פלטינה | |||
עופרת חוט | סקוויירס אלקטרוניקה, קורנליוס, או | ||
Loctite 404 מיידיות דבק | Hankal קורפ רוקי היל CT. | ||
להב התער | העולם דיוק אינסטרומנטס פלורידה. | ||
BD מחט בעמוד השדרה | BD מערכות רפואיות, Franlin Lake, NJ | REF 405234 | |
כירורגי Blade | בטיחות נוצה גילוח בע"מ. יפן | ||
תוכנה | מוכר | מספר קטלוגי | |
TH תוכנה | ESA Inc, Chelmsford, MA | ||
מכשיר | מוכר | מספר קטלוגי | |
הקלטה הטבילה קאמרית | אישית מדעיים, דנוור, CO | ||
Neorolog המבודד הגירוי | Digitmeter, הרטפורדשייר, אנגליה | ||
בקר טמפרטורה אוטומטית | וורנר Instrument Corporation | ||
מיקרוסקופ (SZX7) | אולימפוס | ||
מיקרוסקופ | דיג | ||
Vibratome 3000 חתך מערכת | סט לוהוא, מיזורי. | ||
זלוף משאבה | ווטסון מוגבל מרלו, Falmouth Cornwall - אנגליה | H110708 | |
Micropipette חולץ | Narishige, טוקיו, יפן | ||
ChemClamp potentiostat | דגן תאגידים, במיניאפוליס, מינסוטה. |
References
- Pike, C. M., Grabner, C. P., Harkins, A. B. Fabrication of Amperometric Electrodes. J. Vis. Exp. (27), e1040-e1040 (2009).
- Lack, A. K., Diaz, M. R., Chappell, A., DuBois, D. W., McCool, B. A. Chronic ethanol and withdrawal differentially modulate pre- and postsynaptic function at glutamatergic synapses in rat basolateral amygdala. J. Neuropyhysiol. 98, 3185-3196 (2007).
- John, C. E., Jones, S. R. Voltammetric characterization of the effect of monoamine uptake inhibitors and release on dopamine and serotonin uptake in mouse caudate-putamen and substantia nigra slices. Neuropharmacology. 52, 1596-1605 (2007).
- Wightman, R. M., Amatore, C., Engstrom, R. C., Hale, P. D., Kistensen, E. W., Kuhr, W. G., May, L. J. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25, 513-523 (1988).
- Wightman, R. M., Zimmerman, J. B. Control of dopamine extracellular concentration in rat striatum by impulse flow and uptake. Brain. Res. Brain. Res. Rev. 15, 135-144 (1990).
- Jones, S. R., Garris, P. A., Kilts, C. D., Wightman, R. M. Comparison of dopamine uptake in the basolateral amygdaloid nucleus, caudate-putamen, and nucleus accumbens of the rat. J. Neurochem. 64, 2581-2589 (1995).
- Michael, D. J., Wightman, R. M. Electrochemical monitoring of biogenic amine neurotransmission in real time. J. Pharm. Biomed. Anal. 19, 33-46 (1999).
- Pajski, M. L., Venton, B. J. Adenosine release evoked by short electrical stimulations in striatal brain slices is primarily activity dependent. A.C.S. Chem. Neurosci. 1, 775-787 (2010).
- Sanford, A. L., Morton, S. W., Whitehouse, K. L., Oara, H. M., Lugo-Morales, L. Z., Roberts, J. G., Sombers, L. A. Voltammetric detection of hydrogen peroxide at carbon fiber microelectrodes. Anal. Chem. 82, 5205-5210 (2010).
- Park, J., Kile, B. M., Wightman, R. M. In vivo voltammetric monitoring of norepinephrine release in the rat ventral bed nucleus of the stria terminalis and anteroventral thalamic nucleus. Eur. J. Neurosci. 30, 2121-2133 (2009).
- Hashemi, P., Dankoski, E. C., Petrovic, J., Keithley, R. B., Wightman, R. M. Voltammetric detection of 5-hydroxytryptamine release in the rat brain. Anal. Chem. 81, 9462-9471 (2009).
- Borue, X., Cooper, S., Hirsh, J., Condron, B., Venton, B. J. Quantitative evaluation of serotonin release and clearnece in drosophila. J. Neuroscience. Methods. 179, 300-308 (2009).
- Vickrey, T. L., Condron, B., Venton, B. J. Detection of endogenous dopamine changes in drosophila melanogaster using fast-scan cyclic voltammetry. Anal. Chem. 81, 9306-9313 (2009).
- Makos, M. A., Han, K. A., Heien, M. L., Ewing, A. G. Using in vivo electrochemistry to study the physiological effects of cocaine and other stimulants on the drosophila melanogaster dopamine transporter. A.C.S. Chem Neurosci. 1, 74-83 (2009).
- Budygin, E. A., John, C. E., Mateo, Y., Daunais, J. B., Friedman, D. P., Grant, K. A., Jones, S. R. Chronic ethanol exposure alters presynaptic dopamine function in striatum of monkeys: a preliminary study. Synapse. 50, 266-268 (2003).
- Jones, S. R., Gainetdinov, R. R., Jaber, M., Giros, B., Wightman, R. M., Caron, M. G. Profound neuronal plasticity in response to inactivation of the dopamine transporter. PNAS. 95, 4029-4034 (1998).
- Kennedy, R. T., Jones, S. R., Wightman, R. M. Dynamic observation of dopamine autoreceptor effects in rat striatal slices. J. Neurochem. 59, 449-445 (1992).
- Rice, M. E., Cragg, S. J. Nicotine amplifies reward-related dopamine signals in striatum. Nat. Neurosci. 7, 583-584 (2004).
- Zhang, L., Doyon, W. M., Clark, J. J., Phillips, P. E., Dani, J. A. Controls of tonic and phasic dopamine transmission in the dorsal and ventral. 76, 396-404 (2009).
- Paredes, D., Grnaholm, A. C., Bickford, P. C. Effects of NGF and BDNF on baseline glutamate and dopamine release in the hippocampal formation of the adult rat. Brain. Res. 11141, 56-64 (2007).
- Goggi, J., Puller, I. A., Carney, S. L., Bradford, H. F. Signalling pathways involved in the short-term potentiation of dopamine release by BDNF. Brain. Res. 968, 156-161 (2003).
- Cheer, J. F., Wassum, K. M., Heien, M. L., Phillips, P. E., Wightman, R. M. Cannabinoids enhance subsecond doapmine relese in the nucleus accumbens of awake rats. J. Neurosci. 24, 4393-4400 (2004).
- Phillips, P. E., Stuber, G. D., Heien, M. L., Wightman, R. M., Carelli, R. M. Subsecond dopamine release promotes cocaine seeking. Nature. 422, 614-618 (2003).
- Robinson, D. L., Heien, M. L., Wightman, R. M. Frequency of dopamine concentration transients increases in dorsal and ventral striatum of male rats duing introduction of conspecifics. J. Neurosci. 22, 10477-10486 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved