Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dynamique présynaptique de la dopamine dans le striatum avec des tranches de cerveau de voltampérométrie cyclique à balayage rapide
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L'utilisation de voltampérométrie cyclique balayage rapide pour mesurer la dynamique évoquée électriquement présynaptique de la dopamine dans le striatum des tranches de cerveau.
Résumé
Des recherches approfondies ont porté sur la dopamine, un neurotransmetteur en raison de son importance dans le mécanisme d'action de l'abus des drogues (cocaïne et d'amphétamines par exemple), le rôle qu'elle joue dans les maladies psychiatriques (schizophrénie et de trouble d'hyperactivité avec déficit de l'attention), et son implication dans dégénératives troubles comme le Parkinson et la maladie de Huntington. Sous des conditions physiologiques normales, la dopamine est connue pour réguler l'activité locomotrice, la cognition, l'apprentissage, affectent émotionnel, et la sécrétion d'hormones neuroendocrines. Une des plus grandes densités de neurones dopaminergiques est dans le striatum, qui peut être divisé en deux régions distinctes neuroanatomiques connu comme le noyau accumbens et le noyau caudé-putamen. L'objectif est d'illustrer un protocole général pour la voltamétrie cyclique tranche de balayage rapide (FSCV) dans le striatum de souris. FSCV est une technique bien définie électrochimique fournissant l'occasion de mesurer la libération de dopamine et de l'absorption en temps réel dans drégions du cerveau iscrete. Microélectrodes en fibre de carbone (diamètre de ~ 7 pm) sont utilisés dans FSCV pour détecter l'oxydation de dopamine. L'avantage d'utiliser des analyses pour détecter FSCV dopamine est sa résolution temporelle accrue de 100 millisecondes et une résolution spatiale de moins de dix microns, fournissant des informations complémentaires à la microdialyse in vivo.
Protocole
1. L'essentiel expérimentale
Fabrication des électrodes
- Il existe de nombreuses méthodes de fabrication de fibre de carbone microélectrodes car la plupart sont fabriqués en interne. Typiquement ce que dicte les détails de fabrication de l'électrode est la technique électrochimique qui est appliqué à l'électrode (par exemple, ampérométrie vs FSCV). Pour FSCV, microélectrodes peuvent être faites en interne en utilisant les trois étapes suivant la procédure. Pour une description plus complète de la fabrication d'électrodes en fibre de carbone, voir un article récent JOVE 1. Toutefois, notez que les électrodes décrit ci-dessous sont cylindriques microélectrodes en fibre de carbone, qui nécessitent moins d'étapes pour fabriquer par rapport à la fibre de carbone microélectrodes ampérométrique du protocole susmentionné. Ce protocole simplifié ne nécessite pas bouillir la fibre de carbone dans l'acétone, poli-feu dans les capillaires de verre, ou en utilisant époxy pour sceller la jonction en fibre de verre.
- Utiliser ASPIR aspirationmangé une fibre de carbone (diamètre de 7 um; Goodfellow Oakdale, PA) dans un verre borosilicate capillaire avec microfilaments (longueur 10 cm, od 1,2 mm, 0,68 mm id; systèmes AM, Carlsborg, WA).
- Placer le capillaire filetée dans l'extracteur d'électrode (Narishige, Tokyo, Japon) où le capillaire est tiré de moitié. Paramètres de sortie pour l'extracteur d'électrodes varient d'un laboratoire à l'. Pour référence, nos paramètres de sortie pour l'extracteur sont 90,7 aimant principal, 23,2 sous-aimant, et 53,4 pour le chauffage. Les paramètres de sortie doit être empiriquement raffiné pour produire un cône de verre qui est d'environ 4,4 mm de longueur, avec un joint étanche autour de la fibre de carbone.
- Sous un microscope (Olympus, Tokyo, Japon), les garnitures en fibre de carbone (en utilisant une lame de scalpel) s'étendant de la pointe de verre permettant d'environ 50 à 200 um de la fibre de carbone pour dépasser de l'interface hermétiquement fermés.
Préparation de la solution
Trois types de cérémonies artificiellecéphalorachidien fluide (ACSF) les solutions doivent être préparées à l'avance, le tout dans ultrapure (18 MQ cm) d'eau.
- Saccharose aCSF peut être préparé au moins un jour avant le tranchage. Le tampon de saccharose-aCSF consiste (en mm): 180 saccharose, 30 NaCl, KCl 4,5, 1,0 MgCl 2, 26 NaHCO3, 1,2 NaH 2 PO 4, et 10 D-glucose (pH 7,4) et doit être oxygéné à l'aide 95 O% de CO 2 / 5% 2 pendant 15 minutes 2. Si préparé à l'avance, la solution peut être conservée au réfrigérateur à 4 ° C pendant 1 semaine.
- Solution de l'ACSF pour les enregistrements voltamétriques devrait être préparée le jour de l'expérience. La solution se compose de aCSF (en mM): NaCl 126, KCl 2,5, 2,4 CaCl2, 1,2 MgCl 2, 25 NaHCO3, 1,2 NaH 2 PO 4, 11 D-glucose, l'acide ascorbique 0,4 (pH 7,4). Au cours de l'expérience, oxygéner par barbotage avec 95% d'O2 / 5% de CO 2 à température ambiante.
- Mise à jour-solution pour les étalonnages aCSF électrode contient (en mM): 2,5 KCl, NaCl 126, 1,2 NaH 2 PO 4, 2,4 CaCl2, 1,2 MgCl 2, et 25 NaHCO 3 (pH 7,4) et peut être conservé pendant une semaine au maximum, sans réfrigération ou de l'oxygénation.
Étalonnage de l'électrode
- La viabilité des électrodes et la sensibilité est déterminée par pré-et post-étalonnage, respectivement, en utilisant un flux "des cellules T» contenant 3 ports avec une électrode de référence scellés (Ag / AgCl). Les microélectrodes fabriqué est descendu dans le flux "des cellules T". L'orifice d'entrée est relié à une pompe à seringue, permettant un flux continu d'modifiée aCSF à un débit de 2 mL / min. Le troisième port de la "cellule T" est relié à une seringue remplie avec 3 uM dopamine, faites dans modifiée aCSF.
- Pour pré-calibrer, permettent modifiés solution aCSF de circuler pendant environ 3 - 7 secondes, et ensuite manuellement injecter 1-2 ml de la norme dopamine 3 uM. Pour chaque électrodeêtre pré-calibré, répéter l'étalonnage d'au moins 3 fois et la moyenne des courants maximaux obtenus à partir de chacun.
- Immédiatement après l'expérience de voltampérométrie tranche (voir section 3), l'électrode est post-calibré de la même manière que décrit ci-dessus.
- Le facteur d'étalonnage (utilisé plus tard durant l'analyse de données) est déterminé en divisant l'oxydation dopamine moyenne actuelle (nA) par la concentration de la norme de dopamine. Par exemple, la réponse actuelle est divisée par 3 en utilisant une norme de dopamine 3 uM.
2. Préparation de Slice
- Verser 10 ml de saccharose en aCSF un petit bécher et placer dans un seau à glace. En outre, les adhésifs lieu instantanée (Loctite 404) dans le seau à glace, à portée de main.
- Préparer une lame de rasoir et les outils nécessaires pour la dissection, comme une pince, spatule et des ciseaux, en essuyant les nettoyer avec une compresse imbibée d'alcool.
- Sacrifice de la souris par le CO 2 asphyxie dans un gaz de petite chambre, suivie par la décapitation immédiate avec des ciseaux pointus. Supprimer rapidement l'ensemble du cerveau. Placez le cerveau dans le bécher de aCSF sucrose glacée pendant 10 minutes environ.
- En attendant, préparez Vibratome pour le tranchage. D'abord, placer de la glace écrasée dans le bain spécimen. Position de la chambre de l'échantillon et serrer à le tenir fermement en place. Ajouter plus de glace autour de la chambre spécimen à combler les lacunes, en s'assurant pas de glace pénètre dans la chambre. Placez la lame de rasoir nettoyée dans le support de lame sur le Vibratome et remplir la chambre de spécimen avec du saccharose aCSF glacée.
- Pour mettre en place un plan de travail pour préparer le cerveau, versez un peu de saccharose aCSF froid sur un morceau de serviette en papier qui a été placée sur un plat de Pétri retournées. Pince en utilisant le transfert du cerveau sur le plat préparé Pétri. Pour les tranches coronales, couper le cervelet dans l'axe médio-latéral avec une lame de rasoir et jetez-les. Cela crée une base plate qui peut être apposé sur la scène Vibratome.
- Placezune baisse de la colle Loctite (placé dans le seau à glace pendant l'étape 1) sur la scène spécimen. Immédiatement, apposer le bout plat du cerveau préparé sur la scène, le garder aussi droite que possible. Placez la scène dans la chambre de l'échantillon et serrer la vis, assurant que le cerveau est complètement immergé dans le aCSF saccharose dans la chambre.
- Utilisation des commandes sur le devant de la scène Vibratome ajuster la sorte que les lignes lame de rasoir, avec le haut du cerveau. Les paramètres optimaux pour la Vibratome sont obtenus par réglage de la fréquence et la vitesse à faible. La réduction des vitesses sont préférables afin de minimiser la force de la lame d'écraser le cerveau, qui est observée à des vitesses plus élevées. Épaisseur de la tranche est fixé à 400 um.
- Les tranches de quelques premières ne contiennent pas le striatum. Répétez le tranchage jusqu'au tranches contenant le striatum sont obtenus. Une fois la région striatale est atteint (confirmé par des repères anatomiques), utilisez un pinceau pour soulever la coupe et le placer dans un bécher avecoxygénée, à température ambiante aCSF. Typiquement, on peut obtenir 3 à 4 tranches contenant le complexe striatal de telle sorte que le noyau caudé-putamen et du noyau accumbens sont inclus.
- Autoriser les tranches de s'acclimater au aCSF oxygénée à température ambiante pendant au moins 1 heure avant d'utiliser pour des expériences.
3. Enregistrements à partir de tranches voltampérométrique
Alors que les tranches sont en incubation, la chambre d'enregistrement tranche peut être préparé.
- Prenez tube relié à la chambre d'enregistrement de submersion (Custom scientifique, Denver, CO) et les placer dans oxygénant, aCSF température ambiante. Réglez la pompe à perfusion (Watson Marlow Limited, à Falmouth, en Angleterre) à un débit de 1 mL / min. Réglez le régulateur de température à 32 ° C. Après aCSF remplit le titulaire tranche sur mesure (modifié stade de disques mesh), de le préparer pour la tranche en supprimant les bulles d'air en utilisant une seringue sans aiguille (BD épinière aiguille).
- Premier bain de tranche en faisant le vide sur letuyau d'écoulement (conduisant à la bouteille en verre des déchets liquides) à l'aide d'une seringue pour commencer à couler. Placer un Kimwipe d'agir comme une mèche sur le bord du porte-tranche pour le contrôle de dépassement de tampon.
- Après 1 heure d'incubation, transférer les tranches au titulaire tranche dans la chambre d'enregistrement, qui est continuellement perfusées avec 95% d'O 2 / 5% CO 2 aCSF température ambiante.
- Immerger l'électrode de référence Ag / AgCl dans le support de tranche (scotchée à couvercle de chambre de tranche) et de connecter l'électrode en utilisant une pince crocodile à l'étape de la tête.
- L'électrode de référence Ag / AgCl peut être faite en interne par anodisation (1 V) un fil d'argent 250 um (AM Systems, Carlsborg, WA) dans 1 M HCl pendant 5 minutes pour déposer une fine couche de AgCl sur la surface de la fil d'argent.
- Basse l'électrode de stimulation de tungstène (Plastics One, Roanoke, Virginie) à la surface de la tranche du cerveau du striatum. L'électrode de stimulation est en contact avec la tranche car il repose sur le dessusd'elle, mais ne devrait pas percer la tranche. Dans notre dispositif expérimental, la stimulation est générée par un stimulateur NeuroLOG.
- Les microélectrodes en fibre de carbone de travail est remblayée avec une solution 150 mM de KCl en utilisant une aiguille à ponction lombaire BD. Un fil de plomb est alors inséré (Squires Electronics, Corneille, OR), qui est relié à l'étape de la tête de l'faible bruit ChemClamp potentiostat (Sociétés Dagan, Minneapolis, MN) en utilisant une pince crocodile. L'électrode de travail est placé environ 100 à 200 um loin de la stimulation des électrodes bipolaires, environ 75 um en profondeur dans la tranche.
- Stimulations électriques, en utilisant soit unique (monophasique, 350 pA, 60 Hz, et 4 ms de largeur d'impulsions) ou multiples (par exemple 5 impulsions, 350 pA, 20 Hz, et 4 ms de large) des légumineuses, sont livrés par l'électrode de stimulation pour évoquer neurotransmetteur version 3.
- Pour mesurer la dopamine évoquée électriquement à l'aide FSCV, une forme d'onde triangle est appliquée à l'électrode. Les paramètres typiques pour le DOPDétection amine: le potentiel de la microélectrode en fibre de carbone est tenue à -0,4 V par rapport à une électrode de référence Ag / AgCl, rampe à une limite positive de 1,2 V, puis ramené à -0,4 V à une vitesse de balayage de 400 V / s .
- La tranche est stimulé électriquement toutes les 5 minutes et les mesures de voltampérométrie de l'efflux de dopamine qui en résultent sont faites pour 15 secondes.
- Après au moins trois enregistrements stables stimulé électriquement la libération de dopamine (différence entre la hauteur du pic est <10%), aCSF contenant un agent pharmacologique d'intérêt est perfusé à un débit de 1 mL / min sur la tranche de 30 minutes pour obtenir un effet maximal. Enregistrements dopamine stimulé électriquement sont faites toutes les 5 minutes pendant la perfusion pharmacologiques.
4. L'analyse des données
Résultant des traces actuelles en fonction du temps obtenu à partir de la tranche peut être adapté par régression non linéaire à un ensemble de Michaelis-Menten équations basées, comme décrit par Wightmanet ses collègues dans les logiciels écrits en LabVIEW (National Instruments, Austin, TX) 4-6. Dans ce logiciel, les traces actuelles en fonction du temps peut être équipé en faisant varier deux paramètres, V max (Nm / s, correspondant aux taux d'absorption par le transporteur de la dopamine comme en témoigne la phase descendante de la trace) et la concentration de dopamine par impulsion (nM ; correspondant au maximum la hauteur du pic). La valeur de K m, ce qui reflète l'affinité de la dopamine pour le transporteur de la dopamine, est fixé à 160 nm et non modifiés. Après l'étalonnage de l'électrode facteur qui est déterminé après l'expérience est nécessaire avant la pose. Le logiciel LabVIEW contient le coefficient de détermination (R 2) paramètre pour déterminer la qualité de l'ajustement (R 2> 0,8 sont utilisés).
5. Les résultats représentatifs
FSCV a été utilisée pour examiner une seule impulsion, stimulé électriquement la libération de dopamine et de l'absorption dans le noyau caudé-faireAmen (CPU), le noyau accumbens (NAc) de base, et NAC coquille chez la souris. Les résultats représentatifs de la figure 1A démontrent parcelles actuelles (ou concentration) en fonction du temps. La flèche rouge indique le moment où la stimulation électrique est appliquée à la tranche suivie par une hausse correspondante de la quantité de courant attribuable aux changements dans la concentration de dopamine dans la microélectrode en fibre de carbone. Le processus prédominant lors de la stimulation électrique est la libération de dopamine, mais d'autres processus tels que l'absorption et la diffusion de contribuer à la hauteur de pic observée globalement aussi bien. La phase descendante du pic est principalement attribuable à la recapture du neurotransmetteur par son transporteur car la stimulation neuronale a été arrêté 7. Cependant, la désintégration de pointe n'est pas limité à la recapture, comme la diffusion et le métabolisme aussi contribuer à la diminution du courant. Il a été postulé que depuis l'échelle de temps des mesures électrochimiques est une question de secondes, FSCV est trop rapide pour mesurer contributions du métabolisme 7. Dans ces traces actuelles en fonction du temps, l'axe des y est convertie à la concentration (M) en utilisant le facteur d'étalonnage d'après-expérience. L'encart de la figure 1A est le contexte respectifs soustrait voltampérogrammes cycliques pour les traces du courant en fonction du temps. Tracer le courant mesuré (axe Y) contre le potentiel appliqué à l'électrode (en abscisse), la dopamine est chimiquement identifiés avec un pic d'oxydation observé à 0,6 V et un pic de réduction correspondante de la dopamine-ortho-quinone est observée à - 0,2 V par rapport à une électrode de référence Ag / AgCl. La troisième représentation des données utilise un modèle tridimensionnel de pseudo-couleurs parcelle (figure 1B) en combinant les informations à la fois des traces de courant en fonction du temps et le voltamogramme cyclique pour former une seule parcelle. Dans le représentant pseudo-couleurs intrigue, le temps est tracée en quelques secondes le long de l'axe x, la tension appliquée à la microélectrode en fibre de carbone de travail est tracée le long de l'axe y, et le courant est représenté comme falcouleurs soi long de l'axe z. En raison de la faible taille des microélectrodes en fibre de carbone (~ 7 m de diamètre), la dynamique de la dopamine stimulé électriquement peuvent être détectés dans des régions anatomiques discrètes du striatum (CPU par rapport NAc de base par rapport NAc coquille; figure 2).
Un avantage d'utiliser des tranches coronales striatum est qu'il élimine les contributions des corps cellulaires dopaminergiques, et permet une étude de la dynamique présynaptique de la dopamine. Le contrôle présynaptique de la libération de dopamine et de l'absorption n'est pas strictement limité à des autorécepteurs de dopamine ou de fonctions transporteur comme d'autres ont montré 16, 17. Hétérorécepteurs d'autres systèmes de neurotransmetteurs modulent également la dopamine dynamique 18, 19. Traces Représentant du courant en fonction du temps indiqué dans la figure 3A démontrent que lorsque les tranches sont traitées avec 1 uM (agoniste des récepteurs D2/D3) quinpirole pendant 30 minutes, une diminution de la libération de dopamine évoquée électriquement est observée. D'autre part, quand un substratpour le transporteur de la dopamine, comme la méthamphétamine, est perfusée sur la tranche de 30 minutes, aucune différence dans la libération de dopamine est observée (figure 3B). La décroissance de pointe est décalée vers la droite, qui est généralement associée à des altérations dans la cinétique de transporteur de la dopamine (K m) 3. Enfin, la figure 3C est une trace représentant de la trace courante en fonction du temps une fois que la tranche a été baigné dans une 100 ng / mL brain-derived neurotrophic factor (BDNF) solution, qui a émis l'hypothèse d'influencer la dynamique de la libération de dopamine 20, 21. A partir de cette trace représentative, on peut constater que le BDNF a la capacité d'améliorer la libération de dopamine électriquement évoqués. Pris ensemble, ces traitements pharmacologiques souligner l'utilité de sonder la dynamique FSCV dopamine dans le striatum.
La principale limitation de l'utilisation de tranches de cerveau pour étudier la dynamique présynaptique de la dopamine par FSCV est que les circuits neuronaux d'un cerveau intact est perdu.Avec FSCV tranche, il est impossible d'étudier les effets des neurotransmetteurs à partir d'autres régions cérébrales, ce qui rend difficile de comprendre les contributions de ces systèmes sur la fonctionnalité de la région à l'étude (par exemple, le striatum) ou pour évaluer les niveaux de dopamine non-stimulés. Toutefois, les récents progrès techniques dans FSCV a permis de dopamine mesures transitoires (avec et sans stimulation électrique) dans les rats se déplaçant librement, en réponse à une manipulation, pharmacologiques auto-administration, ou la nouveauté de 22 à 24. Globalement, tranche FSCV fournit des informations précieuses sur la dynamique de la dopamine présynaptique, et le couplage des résultats FSCV tranche pour les techniques neurochimiques complémentaires tels que la microdialyse, l'électrophysiologie, et / ou se déplaçant librement FSCV offre une vue plus globale de fonctionnement des neurotransmetteurs dans le cerveau.
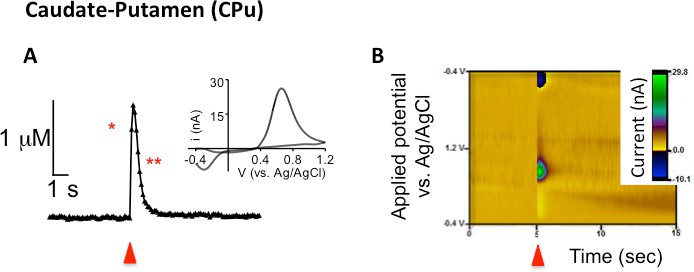
Figure 1. Électriquement évoqués dopaminee communiqué mesurée à l'aide FSCV suivantes seule impulsion de stimulation dans les tranches CPu dorsale de souris C57BL/6J. (A) La concentration en fonction de trace du temps dans lequel la libération de dopamine a été évoqué par une seule impulsion (flèche rouge). Le seul astérisque représente les facteurs qui contribuent à l'augmentation de la concentration, qui est essentiellement la libération de dopamine, mais l'absorption et la diffusion y contribuent également. Le double astérisque représente le signal de pointe retour aux valeurs de base, principalement due à l'absorption, mais aussi la diffusion contribue. En médaillon affiche le voltampérogrammes cycliques correspondants. (B) parcelles de couleur représentant de la durée d'affichage CPu dorsale (axe x), appliquée potentiel de la microélectrode en fibre de carbone par rapport électrode de référence Ag / AgCl (axe Y), et le courant dans la pseudo-couleur.
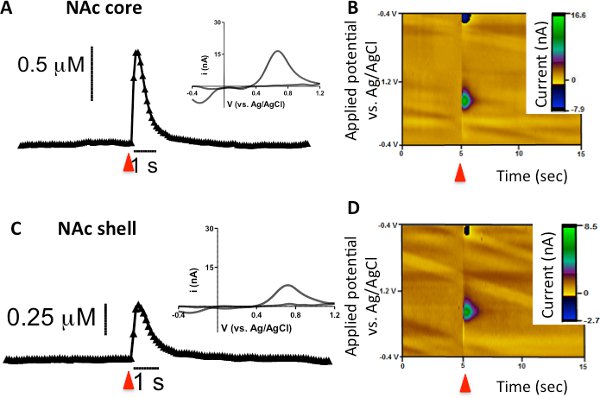
La libération de dopamine Figure 2. Évoqués par une impulsion de stimulation électrique unique (indiqué par la flèche rouge) dans le noyau NAcet la coque de la souris C57BL/6J. (A et C) La concentration en fonction du temps et des traces de leur voltampérogrammes cyclique correspondant (en médaillon) à partir du noyau NAC et coquille. (B et D) Comme décrit précédemment, les parcelles en couleur représentative de la CNA et de coeur coquille.
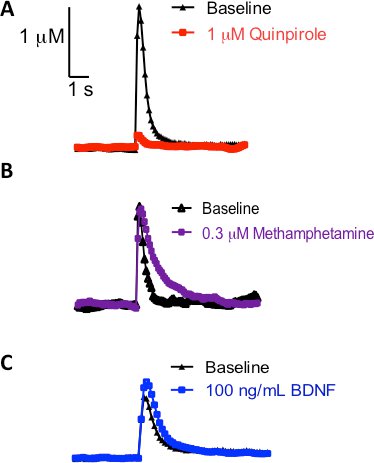
La figure 3 retrace représentant, après la tranche a été traité avec un agent pharmacologique pendant 30 minutes;. Dans tous les cas, une seule impulsion a été utilisé pour évoquer la libération de dopamine dans le CPU. (A) Application de l'agoniste du récepteur D2 de la dopamine, quinpirole (trace rouge) par rapport aux pré-traitement (traces noires). (B) de perfusion de méthamphétamine (oligo-violet) par rapport à pré-traitement (traces noires). (C) la capacité du facteur neurotrophique dérivé du cerveau pour influencer la dynamique de la dopamine (bleu trace) par rapport à pré-traitement (traces noires).
Discussion
Le protocole présenté ici montre comment préparer et utiliser des tranches de cerveau de souris pour des expériences FSCV coronale. Bien que cette méthode est spécifique à l'obtention et la mesure de la dynamique de la dopamine, d'autres neurotransmetteurs tels que l'adénosine, le peroxyde d'hydrogène, la noradrénaline et la sérotonine ont été suivis in vivo ou in vitro avec FSCV 3, 8 - 11. FSCV peut être utilisé pour surveiller certains de ces autres neurotran...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Le financement fourni par le National Institute on Alcohol Abuse and Alcoholism (NIAAA, AA-016 967 et AA016967-01S1; TAM), Wayne State University fonds de démarrage, et la Wayne State University Research Grant Programme. Le contenu est exclusivement la responsabilité de leurs auteurs et ne représentent pas les vues officielles de NIAAA ou les National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Société | Numéro CAS | |
Réactif | |||
Chlorure de Potassium | Fisher | 7447407 | |
Le chlorure de sodium | EMD Chemicals | 7647145 | |
Le chlorure de magnésium | Fisher | 7791186 | |
Le chlorure de calcium | Fisher | 10035048 | |
Le bicarbonate de sodium | EMD Chemicals | 144558 | |
Phosphate de sodium dibasique | EMD chimiques | 7558794 | |
D-glucose | Fisher | 50997 | |
L'acide ascorbique | Fisher | 50817 | |
Saccharose | Fisher | 57501 | |
|
| ||
Matériaux | Vendeur | Numéro de catalogue | |
La fibre de carbone | Goodfellow Oakdale, PA | ||
Capillaires en verre | AM Systems Carlsborg WA. | 602000 | |
Fil d'Argent | A-M Systems Carlsborg WA. | 787000 | |
Électrode de tungstène stimulante | Plastics One, Roanoke, Virginie | ||
Fil de platine | |||
Le plomb métallique | Electronics Squires, Corneille, OU | ||
Adhésif Loctite 404 instantanée | Hankal Corp Rocky Hill CT. | ||
Lame de rasoir | Mondiale de précision Instruments Inc Floride. | ||
BD épinière aiguille | BD Medical Systems, Franlin Lake, NJ | REF 405234 | |
Lame chirurgicale | Plume de rasoirs de sûreté Co. LTD. Le Japon | ||
Logiciel | Vendeur | Numéro de catalogue | |
Logiciel de TH | ESA Inc, Chelmsford, MA | ||
Instrument | Vendeur | Numéro de catalogue | |
Chambre d'enregistrement de submersion | Personnalisé scientifique, Denver, CO | ||
Sectionneur de relance Neorolog | Digitmeter, Hertfordshire, Angleterre | ||
Régulateur de température automatique | Warner Instrument Corporation | ||
Microscope (SZX7) | Olympus | ||
Microscope | Fisher | ||
Système de sectionnement Vibratome 3000 | Saint-Louest, MO. | ||
Pompe à perfusion | Watson Marlow Limited, Falmouth Cornouailles - Angleterre | H110708 | |
Micropipette extracteur | Narishige, Tokyo, Japon | ||
ChemClamp potentiostat | Sociétés Dagan, Minneapolis, MN. |
Références
- Pike, C. M., Grabner, C. P., Harkins, A. B. Fabrication of Amperometric Electrodes. J. Vis. Exp. (27), e1040-e1040 (2009).
- Lack, A. K., Diaz, M. R., Chappell, A., DuBois, D. W., McCool, B. A. Chronic ethanol and withdrawal differentially modulate pre- and postsynaptic function at glutamatergic synapses in rat basolateral amygdala. J. Neuropyhysiol. 98, 3185-3196 (2007).
- John, C. E., Jones, S. R. Voltammetric characterization of the effect of monoamine uptake inhibitors and release on dopamine and serotonin uptake in mouse caudate-putamen and substantia nigra slices. Neuropharmacology. 52, 1596-1605 (2007).
- Wightman, R. M., Amatore, C., Engstrom, R. C., Hale, P. D., Kistensen, E. W., Kuhr, W. G., May, L. J. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25, 513-523 (1988).
- Wightman, R. M., Zimmerman, J. B. Control of dopamine extracellular concentration in rat striatum by impulse flow and uptake. Brain. Res. Brain. Res. Rev. 15, 135-144 (1990).
- Jones, S. R., Garris, P. A., Kilts, C. D., Wightman, R. M. Comparison of dopamine uptake in the basolateral amygdaloid nucleus, caudate-putamen, and nucleus accumbens of the rat. J. Neurochem. 64, 2581-2589 (1995).
- Michael, D. J., Wightman, R. M. Electrochemical monitoring of biogenic amine neurotransmission in real time. J. Pharm. Biomed. Anal. 19, 33-46 (1999).
- Pajski, M. L., Venton, B. J. Adenosine release evoked by short electrical stimulations in striatal brain slices is primarily activity dependent. A.C.S. Chem. Neurosci. 1, 775-787 (2010).
- Sanford, A. L., Morton, S. W., Whitehouse, K. L., Oara, H. M., Lugo-Morales, L. Z., Roberts, J. G., Sombers, L. A. Voltammetric detection of hydrogen peroxide at carbon fiber microelectrodes. Anal. Chem. 82, 5205-5210 (2010).
- Park, J., Kile, B. M., Wightman, R. M. In vivo voltammetric monitoring of norepinephrine release in the rat ventral bed nucleus of the stria terminalis and anteroventral thalamic nucleus. Eur. J. Neurosci. 30, 2121-2133 (2009).
- Hashemi, P., Dankoski, E. C., Petrovic, J., Keithley, R. B., Wightman, R. M. Voltammetric detection of 5-hydroxytryptamine release in the rat brain. Anal. Chem. 81, 9462-9471 (2009).
- Borue, X., Cooper, S., Hirsh, J., Condron, B., Venton, B. J. Quantitative evaluation of serotonin release and clearnece in drosophila. J. Neuroscience. Methods. 179, 300-308 (2009).
- Vickrey, T. L., Condron, B., Venton, B. J. Detection of endogenous dopamine changes in drosophila melanogaster using fast-scan cyclic voltammetry. Anal. Chem. 81, 9306-9313 (2009).
- Makos, M. A., Han, K. A., Heien, M. L., Ewing, A. G. Using in vivo electrochemistry to study the physiological effects of cocaine and other stimulants on the drosophila melanogaster dopamine transporter. A.C.S. Chem Neurosci. 1, 74-83 (2009).
- Budygin, E. A., John, C. E., Mateo, Y., Daunais, J. B., Friedman, D. P., Grant, K. A., Jones, S. R. Chronic ethanol exposure alters presynaptic dopamine function in striatum of monkeys: a preliminary study. Synapse. 50, 266-268 (2003).
- Jones, S. R., Gainetdinov, R. R., Jaber, M., Giros, B., Wightman, R. M., Caron, M. G. Profound neuronal plasticity in response to inactivation of the dopamine transporter. PNAS. 95, 4029-4034 (1998).
- Kennedy, R. T., Jones, S. R., Wightman, R. M. Dynamic observation of dopamine autoreceptor effects in rat striatal slices. J. Neurochem. 59, 449-445 (1992).
- Rice, M. E., Cragg, S. J. Nicotine amplifies reward-related dopamine signals in striatum. Nat. Neurosci. 7, 583-584 (2004).
- Zhang, L., Doyon, W. M., Clark, J. J., Phillips, P. E., Dani, J. A. Controls of tonic and phasic dopamine transmission in the dorsal and ventral. 76, 396-404 (2009).
- Paredes, D., Grnaholm, A. C., Bickford, P. C. Effects of NGF and BDNF on baseline glutamate and dopamine release in the hippocampal formation of the adult rat. Brain. Res. 11141, 56-64 (2007).
- Goggi, J., Puller, I. A., Carney, S. L., Bradford, H. F. Signalling pathways involved in the short-term potentiation of dopamine release by BDNF. Brain. Res. 968, 156-161 (2003).
- Cheer, J. F., Wassum, K. M., Heien, M. L., Phillips, P. E., Wightman, R. M. Cannabinoids enhance subsecond doapmine relese in the nucleus accumbens of awake rats. J. Neurosci. 24, 4393-4400 (2004).
- Phillips, P. E., Stuber, G. D., Heien, M. L., Wightman, R. M., Carelli, R. M. Subsecond dopamine release promotes cocaine seeking. Nature. 422, 614-618 (2003).
- Robinson, D. L., Heien, M. L., Wightman, R. M. Frequency of dopamine concentration transients increases in dorsal and ventral striatum of male rats duing introduction of conspecifics. J. Neurosci. 22, 10477-10486 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon