É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Pré-sináptica de dopamina Dynamics em fatias de cérebro estriado com Fast-scan voltametria cíclica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Usando fast-scan voltametria cíclica para medir eletricamente evocado dinâmica pré-sinápticos em fatias de cérebro estriado.
Resumo
Extensa pesquisa centrou-se no neurotransmissor dopamina devido à sua importância no mecanismo de ação das drogas de abuso (por exemplo, cocaína e anfetaminas), o papel que ela desempenha nas doenças psiquiátricas (por exemplo, esquizofrenia e Déficit de Atenção e Hiperatividade), e seu envolvimento na degenerativas doenças como mal de Parkinson e doença de Huntington. Em condições fisiológicas normais, a dopamina é conhecida por regular a atividade locomotora, cognição, aprendizagem, afetam emocional e secreção de hormônios neuroendócrinos. Uma das maiores densidades de neurônios de dopamina está dentro do corpo estriado, que pode ser dividido em duas distintas regiões neuroanatômicas conhecida como nucleus accumbens eo núcleo caudado-putamen. O objetivo é ilustrar um protocolo geral para a fatia de voltametria cíclica fast-scan (FSCV) dentro do striatum mouse. FSCV é um bem definidas técnica eletroquímica proporcionando a oportunidade de medir a liberação de dopamina e absorção em tempo real em dregiões do cérebro iscrete. Microeletrodos de fibra de carbono (diâmetro de ~ 7 mm) são usados em FSCV para detectar oxidação da dopamina. A vantagem analítica de utilizar FSCV para detectar a dopamina é a sua resolução melhorada temporal de 100 milissegundos e resolução espacial de menos de dez microns, fornecendo informações complementares no microdiálise in vivo.
Protocolo
1. Fundamentos experimentais
Fabricação de eletrodos
- Existem inúmeros microeletrodos de fibra de carbono métodos de fabricação mais uma vez são feitas in-house. Normalmente o que determina os detalhes de fabricação de eletrodos é a técnica eletroquímica que é aplicada ao eletrodo (por exemplo, amperometria vs FSCV). Para FSCV, microeletrodos podem ser feitas em casa usando o procedimento de três etapas seguintes. Para uma descrição mais completa de carbono de fabricação de eletrodos de fibra, ver um artigo recente JOVE 1. No entanto, note que os eletrodos descritos abaixo são microeletrodos de carbono cilíndricos de fibra, que exigem menos passos para fabricar versus o microeletrodos de carbono amperométrico fibra do protocolo acima mencionado. Este protocolo simplificado não exige a ferver a fibra de carbono em acetona, fogo-de polimento dos capilares de vidro, ou usar epóxi para vedar a junção de fibra de vidro.
- Usando aspir sucção a vácuocomeu uma fibra de carbono (diâmetro de 7 mm; Goodfellow Oakdale, PA) em um vidro de borosilicato capilar com microfilamentos (comprimento 10 cm, od 1,2 mm, id milímetros 0,68; sistemas AM, Carlsborg, WA).
- Coloque o capilar enfiado no puxador de eletrodo (Narishige, Tóquio, Japão), onde o capilar é puxado pela metade. Configurações de saída para o extrator eletrodo variam de laboratório para laboratório. Para referência, as nossas configurações de saída para o extrator são 90,7 magneto principal, 23,2 imã sub-, e 53,4 para o aquecedor. As definições de saída deve ser empiricamente refinado para gerar um cone de vidro que é de aproximadamente 4,4 milímetros de comprimento, com uma vedação em torno da fibra de carbono.
- Sob um microscópio (Olympus, Tokyo, Japão), a guarnição da fibra de carbono (usando uma lâmina de bisturi) que se estende da ponta de vidro permitindo que cerca de 5-20 mM de fibra de carbono para se projetam a partir da interface hermeticamente fechado.
Preparação solução
Três tipos de cere artificialespinhal fluido (ACSF) as soluções devem ser preparadas com antecedência, tudo em água ultrapura (18 mohms cm).
- ACSF sacarose pode ser preparado, pelo menos, um dia antes do corte. O buffer de sucrose-ACSF consiste de (em mM): 180 sacarose, 30 NaCl, 4,5 KCl, 1,0 MgCl 2, 26 NaHCO 3, 1,2 NaH 2 PO 4, e 10 D-glicose (pH 7,4) e deve ser oxigenado com 95 CO% O 2 / 5 2% por 15 minutos 2. Se preparado com antecedência, a solução pode ser mantido refrigerado a 4 ° C por até 1 semana.
- ACSF solução para gravações voltamétricos deve ser preparada no dia do experimento. A solução consiste em ACSF (em mM): 126 NaCl, 2,5 KCl, 2,4 CaCl 2, 1,2 MgCl 2, 25 NaHCO 3, 1,2 NaH 2 PO 4, 11 D-glicose, ácido ascórbico 0,4 (pH 7,4). Durante o curso do experimento, oxigenação por borbulhamento com 95% O2 / 5% CO 2 à temperatura ambiente.
- Modified-ACSF solução para calibrações eletrodo contém (em mM): 2,5 KCl, 126 NaCl, 1,2 NaH 2 PO 4, 2,4 CaCl 2, MgCl 2 1,2 e 25 NaHCO 3 (pH 7,4) e pode ser mantido por até uma semana, sem refrigeração ou oxigenação.
Calibração do eletrodo
- Viabilidade eletrodo e sensibilidade é determinada pela pré e pós-calibração, respectivamente, utilizando um fluxo de "células T", contendo 3 portas com um eletrodo de referência selado (Ag / AgCl). O microeletrodo fabricada é abaixado no fluxo "de células T". A porta de entrada é conectado a uma bomba de seringa, permitindo um fluxo contínuo de modified-ACSF a uma vazão de 2 mL / min. A terceira porta do "t células" é conectado a uma seringa cheia com 3 dopamina M, feita em modified-ACSF.
- Para pré-calibrar, permitem modificada solução ACSF a fluir por cerca de 3-7 segundos, e então manualmente injetar 1-2 mL do padrão de dopamina 3 mM. Para cada eletrodode ser pré-calibrados, repita a calibragem pelo menos 3 vezes ea média das correntes máxima obtida de cada um.
- Imediatamente após o experimento de voltametria fatia (ver secção 3), o eletrodo é pós-calibrados da mesma forma como descrito acima.
- O fator de calibração (mais tarde utilizado durante a análise de dados) é determinado dividindo-se a oxidação de dopamina média atual (nA) pela concentração do padrão de dopamina. Por exemplo, a resposta atual é dividido por 3 quando se usa um padrão de dopamina 3 mM.
2. Preparação fatia
- Despeje 10 ml de ACSF sacarose em um copo pequeno e coloque em um balde de gelo. Além disso, o adesivo instantâneo lugar (Loctite 404) no balde de gelo, dentro do alcance.
- Prepare uma lâmina de barbear e as ferramentas necessários para a dissecção, como fórceps, espátula e tesoura, limpando-os limpos com uma compressa embebida em álcool.
- Sacrifício do mouse por asfixia CO 2 em um cha de gás pequenosmber, seguido por decapitação imediata usando uma tesoura afiada. Remover rapidamente o cérebro inteiro. Coloque o cérebro em copo de gelado ACSF sacarose por aproximadamente 10 minutos.
- Nesse meio tempo, prepare Vibratome para cortar. Primeiro, coloque um pouco de gelo triturado no banho espécime. Posição da câmara de amostra e aperte para segurá-la firme no lugar. Adicione mais gelo ao redor da câmara de amostra para preencher as lacunas, certificando-se sem gelo entra na câmara. Coloque a lâmina de barbear limpa no porta-lâmina sobre o Vibratome e encher a câmara de amostra com gelado ACSF sacarose.
- Para configurar uma superfície de trabalho para preparar o cérebro, derramar algumas ACSF sacarose frio em um pedaço de papel toalha que foi colocado sobre uma placa de Petri arrebitado. Fórceps usando transferência do cérebro para a placa de Petri preparada. Para cortes coronais, corte o cerebelo ao longo do eixo medial-lateral, com uma lâmina de barbear e descarte. Isto cria uma base plana que pode ser afixado ao palco Vibratome.
- Lugaruma gota do adesivo Loctite (colocado no balde de gelo durante a Etapa 1) no palco da amostra. Imediatamente, apor a extremidade plana do cérebro preparado no palco, mantendo-o mais vertical possível. Coloque o estágio na câmara de amostra e aperte o parafuso, garantindo que o cérebro está completamente imerso no ACSF sacarose na câmara.
- Usando os controles na parte frontal do Vibratome ajustar o estágio para que as linhas lâmina de barbear-se com a parte superior do cérebro. Parâmetros ótimos para a Vibratome são obtidos através da definição da freqüência e velocidade para baixa. Velocidades mais baixas são as preferidas para minimizar a força da lâmina de esmagar o cérebro, o que é observado em velocidades mais altas. Espessura de corte é definida para 400 m.
- As fatias primeiros não irá conter o striatum. Repita até que o corte fatias contendo o striatum são obtidos. Uma vez que a região estriatal é alcançado (afirmada por marcos anatômicos), use um pincel para levantar a fatia e coloque num copo comoxigenado, ACSF temperatura ambiente. Tipicamente, pode-se obter 3-4 fatias contendo o complexo estriado de modo que o núcleo caudado putamen e nucleus accumbens, estão incluídos.
- Permitir que as fatias se aclimatar em ACSF oxigenada em temperatura ambiente por pelo menos 1 hora antes de usar para os experimentos.
3. Gravações voltamétricos de fatias
Enquanto as fatias estiverem incubando, a câmara de gravação fatia pode ser preparado.
- Tome tubagem ligada à câmara de gravação de submersão (Custom Scientific, Denver, CO) e coloque em oxigenar, ACSF temperatura ambiente. Conjunto de bomba de perfusão (Watson Marlow Limited, Falmouth, Inglaterra) para um fluxo de 1 mL / min. Defina o controlador de temperatura para 32 ° C. Depois ACSF enche o titular fatia custom-built (modificado malha estágio disco), prepará-lo para a fatia, removendo as bolhas de ar, utilizando uma seringa de agulha (BD agulha espinhal).
- Banho do primeiro-slice pelo desenho de um vácuo notubulação de saída (levando a garrafa de vidro de resíduos líquidos), utilizando uma seringa para iniciar o fluxo. Coloque um kimwipe para atuar como um pavio na borda do titular fatia para controle de buffer overflow.
- Após a incubação de 1 hora, as fatias de transferência para o titular fatia na câmara de gravação, que é continuamente perfundidos com 95% O 2 / 5% CO 2 ACSF temperatura ambiente.
- Submergir o eletrodo de referência Ag / AgCl no porta-slice (gravada para a tampa da câmara de fatia) e conectar o eletrodo usando um jacaré para o palco cabeça.
- O eletrodo de referência Ag / AgCl pode ser feita em casa por anodização (+1 V) um fio de prata 250 mM (AM Systems, Carlsborg, WA) em 1 M HCl por 5 minutos para depositar uma fina camada de AgCl sobre a superfície do fio de prata.
- Inferior o eletrodo de tungstênio estimulante (plásticos One, Roanoke, VA) para a superfície da fatia do cérebro estriado. O eletrodo estimulando faz contato com a fatia como ela repousa no topodela, mas não deve perfurar a fatia. No nosso set-up experimental, o estímulo é gerado por um estimulador neurológico.
- O microeletrodo de fibra de carbono de trabalho é back-preenchido com uma solução 150 mM KCl usando uma agulha BD espinhal. Um cabo é então inserido (Squires Electronics, Cornelius, OR), que é conectado ao palco cabeça do baixo ruído ChemClamp potenciostato (Corporações Dagan, Minneapolis, MN), utilizando um jacaré. O eletrodo de trabalho é colocado cerca de 100-200 mM de distância do eletrodo bipolar estimulante, cerca de 75 mM profundamente na fatia.
- Estímulos elétricos, utilizando uma única (monofásica, 350 mA, 60 Hz, e 4 ms de largura de pulso) ou múltiplos (por exemplo, 5 pulsos, 350 mA, 20 Hz, e 4 ms de largura) pulsos, são entregues pelo eletrodo estimulante para evocar neurotransmissor release 3.
- Para medir a dopamina eletricamente evocado utilizando FSCV, uma forma de onda triangular é aplicada ao eletrodo. Parâmetros típicos para dopdetecção de aminas: potencial do microeletrodo de fibra de carbono é realizada em -0,4 V versus um eletrodo de referência Ag / AgCl, ramped a um limite positivo de 1,2 V, então levado de volta para -0,4 V com uma taxa de varredura de 400 V / s .
- A fatia é estimulado eletricamente a cada 5 minutos e medidas voltamétricas do efluxo de dopamina resultantes são feitos por 15 segundos.
- Depois de pelo menos três estáveis gravações dopamina estimula a liberação eletricamente (diferença entre a altura máxima é de <10%), ACSF contendo agente farmacológico de interesse é perfundido a um fluxo de 1 mL / min sobre a fatia de 30 minutos para obter o efeito máximo. Gravações de dopamina estimulada eletricamente são feitas a cada 5 minutos durante a perfusão farmacológica.
4. A análise dos dados
Resultando traços atuais versus tempo obtidas no corte podem ser enquadrados por regressão não linear a um conjunto de equações de Michaelis-Menten com base, como descrito por Wightmane colegas em software escrito em LabVIEW (National Instruments, Austin, TX) 4-6. Neste software, os traços atuais versus tempo pode ser equipado variando dois parâmetros, V max (nM / s, correspondente à taxa de absorção por parte do transportador de dopamina como demonstra a fase descendente do traço) e concentração de dopamina por pulso (nM ; correspondente à altura máxima de pico). O valor de K m, reflete a afinidade de dopamina para o transportador de dopamina, é definida a 160 nM e não mudou. Fator do eletrodo pós-calibração que é determinado após o experimento é necessária antes da montagem. O software LabView contém o coeficiente de determinação (R 2) parâmetro para determinar a qualidade do ajuste (R 2> 0,8 são usados).
5. Resultados representante
FSCV foi usado para examinar um único pulso, estimulado eletricamente a liberação de dopamina e absorção no caudado-putamen (CPU), núcleo accumbens core (NAC), e NAc shell em camundongos. Resultados representativos mostrado na Figura 1A demonstrar parcelas de corrente (ou concentração) versus tempo. A seta vermelha indica quando a estimulação elétrica é aplicada à fatia seguido por um aumento correspondente na quantidade de corrente atribuível a mudanças na concentração de dopamina no microeletrodo de fibra de carbono. O processo predominante durante a estimulação elétrica é a liberação de dopamina, mas outros processos, como a captação e difusão contribuir para a altura do pico global observada também. A fase descendente do pico é atribuído principalmente a recaptação do neurotransmissor por seu transportador já que a estimulação neuronal foi parado sete. No entanto, a decadência de pico não se limita a recaptação, como difusão e metabolismo também contribuem para a diminuição da corrente. Tem sido postulado que, desde a escala de tempo de medidas eletroquímicas é uma questão de segundos, FSCV é muito rápido de medir contributions do metabolismo 7. Nesses traços atual versus o tempo, o eixo-y é convertido em concentração (mM), utilizando o fator de calibração pós-experimento. A inserção de Figura 1A é o fundo subtraído respectivos voltamogramas cíclicos para os traços atuais versus tempo. Plotagem a corrente medida (eixo y) contra o potencial aplicado ao eletrodo (eixo-x), a dopamina é quimicamente identificado com um pico de oxidação observada em 0,6 V e um pico de redução correspondente de dopamina orto-quinona é observado na - 0,2 V contra um eletrodo de referência Ag / AgCl. A terceira representação dos dados usa uma imagem tridimensional trama pseudo-cor (Figura 1B) combinando as informações de ambos os traços atuais em função do tempo e do voltamograma cíclico para formar um único lote. Na trama de cor pseudo-representante, o tempo é plotado em segundos ao longo do eixo x, a tensão aplicada ao microeletrodo de fibra de carbono de trabalho é representada graficamente ao longo do eixo y, ea corrente é representada como falsi só cor ao longo do eixo z. Devido ao pequeno tamanho de microeletrodos de fibra de carbono (~ 7 m de diâmetro), dinâmica de dopamina estimulada eletricamente pode ser detectado em discreta regiões anatômicas do corpo estriado (CPU versus NAc núcleo comparado NAc shell; Figura 2).
Uma vantagem de usar estriatal cortes coronais é que elimina as contribuições dos corpos celulares dopaminérgicos, e permite uma investigação da dinâmica pré-sinápticos. Controle pré-sináptica da liberação de dopamina e absorção não é estritamente limitado a auto-receptor de dopamina ou funções transportador como os outros têm mostrado 16, 17. Heteroreceptores de outros sistemas neurotransmissores também modular a dinâmica da dopamina 18, 19. Traços atual representante versus o tempo mostrado na Figura 3A demonstram que quando as fatias são tratados com um M Quimpirol (D2/D3 agonista do receptor) por 30 minutos, uma diminuição na liberação de dopamina eletricamente evocado é observado. Por outro lado, quando um substratopara o transportador de dopamina, como metanfetamina, é perfundido sobre a fatia de 30 minutos, nenhuma diferença na liberação de dopamina é observada (Figura 3B). A decadência de pico é deslocado para a direita, que é tipicamente associada a alterações na cinética de transportador de dopamina (K m) 3. Finalmente, a Figura 3C é um traço representativo do traço atual versus o tempo uma vez que a fatia foi banhado por um ng / mL derivado do cérebro solução a 100 fator neurotrófico (BDNF), que tem sido levantada a hipótese de influenciar a liberação de dopamina dinâmica 20 e 21. A partir deste traço representativo, pode-se ver que o BDNF tem a capacidade de aumentar a liberação de dopamina eletricamente evocado. Juntos, esses tratamentos farmacológicos enfatizar a utilidade de FSCV para sondar a dinâmica dopamina no estriado.
A principal limitação do uso de fatias do cérebro para investigar a dinâmica pré-sinápticos por FSCV é que o neurocircuitos de um cérebro intacto é perdido.Com FSCV fatia é impossível estudar os efeitos de neurotransmissores de outras regiões do cérebro, tornando-se difícil compreender as contribuições desses sistemas sobre a funcionalidade da região a ser investigada (por exemplo, o striatum) ou para avaliar os níveis de dopamina não-estimulada. No entanto, recentes avanços técnicos na FSCV permitiu dopamina medidas transitórias (com e sem estimulação elétrica) em ratos movimentando-se livremente em resposta a uma manipulação farmacológica, a auto-administração, ou novidade 22-24. Globalmente, a fatia FSCV fornece informações valiosas sobre a dinâmica pré-sinápticos, e acoplamento resultados FSCV fatia para técnicas neuroquímicos complementares, tais como microdiálise, eletrofisiologia, e / ou movimentando-se livremente FSCV oferece uma visão mais abrangente do funcionamento de neurotransmissores no cérebro.
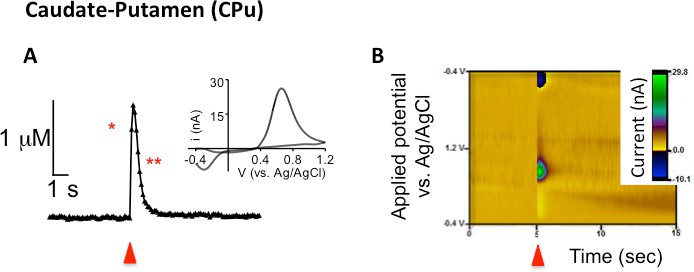
Figura 1. Eletricamente evocado dopaminarelease e medido utilizando FSCV estimulação de pulso único na sequência de CPU em fatias dorsal de ratos C57Bl/6J. (A) A concentração contra o traço do tempo em que a liberação de dopamina foi evocado por um único pulso (seta vermelha). O único asterisco representa os fatores que contribuem para o aumento da concentração, que é predominantemente a liberação de dopamina, mas a captação e difusão também contribuir. O asterisco duplo representa o sinal de pico retornando à linha de base, principalmente devido à absorção, mas também de difusão contribui. Inset exibe o voltamogramas cíclicos correspondentes. (B) parcelas Representante de cor a partir do momento dorsal de CPU display (eixo-x), aplicado potencial para o microeletrodo de fibra de carbono em relação Ag / AgCl eletrodo de referência (eixo y), e corrente de cor-pseudo.
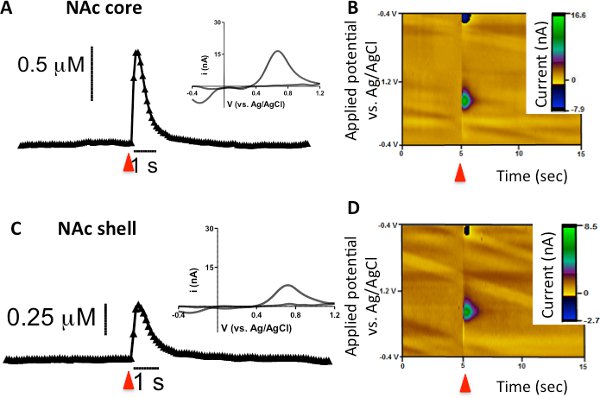
Figura liberação de dopamina 2. Evocado por um pulso de estímulo elétrico isolado (indicado pela seta vermelha) no núcleo NAce casca de camundongos C57BL/6J. (A e C) A concentração versus tempo e os seus traços voltamogramas cíclicos correspondentes (inset) a partir do núcleo NAc e shell. (B e D) Conforme descrito anteriormente, parcelas cor representativa do núcleo NAc e shell.
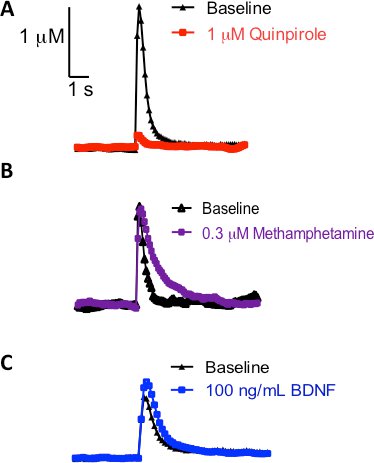
Figura 3 traços Representante após a fatia foi tratado com um agente farmacológico por 30 minutos;. Em todos os casos, um único pulso foi usado para evocar a liberação de dopamina na CPU. (A) Aplicação do agonista do receptor de dopamina D2, Quimpirol (vermelho traço) em comparação com o pré-tratamento (traço preto). (B) de perfusão metanfetamina (lilás), em comparação ao pré-tratamento (traço preto). (C) A capacidade do cérebro de fator neurotrófico derivado de influenciar a dinâmica da dopamina (azul traço) em comparação com o pré-tratamento (traço preto).
Discussão
O protocolo apresentado aqui demonstra como preparar e usar fatias do mouse coronal do cérebro para experimentos FSCV. Embora este método é específico para obtenção e medição dinâmica da dopamina, outros neurotransmissores, como a adenosina, peróxido de hidrogênio, noradrenalina e serotonina têm sido monitoradas in vivo ou in vitro com FSCV 3, 8-11. FSCV pode ser usado para monitorar algumas dessas substâncias neuroquímicas outros por simples modificações da forma de onda apl...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Financiamento fornecido pelo Instituto Nacional de Abuso do Álcool e Alcoolismo (NIAAA; AA-016967 e AA016967-01S1; TAM), Wayne State University arranque fundos, e Wayne State University Program Research Grant. O conteúdo é da exclusiva responsabilidade dos autores e não representam a posição oficial da NIAAA ou o National Institutes of Health.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Companhia | Número CAS | |
Reagente | |||
Cloreto de Potássio | Pescador | 7447407 | |
Cloreto de sódio | Merck Química | 7647145 | |
Cloreto de magnésio | Pescador | 7791186 | |
Cloreto de cálcio | Pescador | 10035048 | |
Bicarbonato de sódio | Merck Química | 144558 | |
Fosfato de sódio, dibásico | EMD Chemicals | 7558794 | |
D-glucose | Pescador | 50997 | |
Ácido ascórbico | Pescador | 50817 | |
Sacarose | Pescador | 57501 | |
|
| ||
Materiais | Vendedor | Número de catálogo | |
Fibra de carbono | Goodfellow Oakdale, PA | ||
Capilar de vidro | AM Sistemas Carlsborg WA. | 602000 | |
Fio de prata | A-M Sistemas Carlsborg WA. | 787000 | |
Eletrodo de tungstênio estimulando | Um plásticos, Roanoke, VA | ||
Fio de platina | |||
Do cabo | Squires Electronics, Cornelius, OR | ||
Loctite adesivo instantâneo 404 | Hankal Corp Rocky Hill CT. | ||
Gilete | Mundial de precisão Instruments Inc. FL. | ||
BD Spinal agulha | Sistemas de BD Medical, Franlin Lake, NJ | REF 405234 | |
Lâmina cirúrgica | Feather Safety razor Co. LTD. Japão | ||
Software | Vendedor | Número de catálogo | |
Software TH | ESA Inc., Chelmsford, MA | ||
Instrumento | Vendedor | Número de catálogo | |
Câmara de gravação de submersão | Personalizado Científico, Denver, CO | ||
Neorolog isolador de estímulo | Digitmeter, Hertfordshire, Inglaterra | ||
Controlador de temperatura automático | Warner Instrument Corporation | ||
Microscópio (SZX7) | Olimpo | ||
Microscópio | Pescador | ||
Vibratome sistema de seccionamento 3000 | St. Loué, MO. | ||
Bomba de perfusão | Watson Marlow Limited, Falmouth Cornualha - Inglaterra | H110708 | |
Micropipeta extrator | Narishige, Tóquio, Japão | ||
ChemClamp potenciostato | Corporações Dagan, Minneapolis, MN. |
Referências
- Pike, C. M., Grabner, C. P., Harkins, A. B. Fabrication of Amperometric Electrodes. J. Vis. Exp. (27), e1040-e1040 (2009).
- Lack, A. K., Diaz, M. R., Chappell, A., DuBois, D. W., McCool, B. A. Chronic ethanol and withdrawal differentially modulate pre- and postsynaptic function at glutamatergic synapses in rat basolateral amygdala. J. Neuropyhysiol. 98, 3185-3196 (2007).
- John, C. E., Jones, S. R. Voltammetric characterization of the effect of monoamine uptake inhibitors and release on dopamine and serotonin uptake in mouse caudate-putamen and substantia nigra slices. Neuropharmacology. 52, 1596-1605 (2007).
- Wightman, R. M., Amatore, C., Engstrom, R. C., Hale, P. D., Kistensen, E. W., Kuhr, W. G., May, L. J. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25, 513-523 (1988).
- Wightman, R. M., Zimmerman, J. B. Control of dopamine extracellular concentration in rat striatum by impulse flow and uptake. Brain. Res. Brain. Res. Rev. 15, 135-144 (1990).
- Jones, S. R., Garris, P. A., Kilts, C. D., Wightman, R. M. Comparison of dopamine uptake in the basolateral amygdaloid nucleus, caudate-putamen, and nucleus accumbens of the rat. J. Neurochem. 64, 2581-2589 (1995).
- Michael, D. J., Wightman, R. M. Electrochemical monitoring of biogenic amine neurotransmission in real time. J. Pharm. Biomed. Anal. 19, 33-46 (1999).
- Pajski, M. L., Venton, B. J. Adenosine release evoked by short electrical stimulations in striatal brain slices is primarily activity dependent. A.C.S. Chem. Neurosci. 1, 775-787 (2010).
- Sanford, A. L., Morton, S. W., Whitehouse, K. L., Oara, H. M., Lugo-Morales, L. Z., Roberts, J. G., Sombers, L. A. Voltammetric detection of hydrogen peroxide at carbon fiber microelectrodes. Anal. Chem. 82, 5205-5210 (2010).
- Park, J., Kile, B. M., Wightman, R. M. In vivo voltammetric monitoring of norepinephrine release in the rat ventral bed nucleus of the stria terminalis and anteroventral thalamic nucleus. Eur. J. Neurosci. 30, 2121-2133 (2009).
- Hashemi, P., Dankoski, E. C., Petrovic, J., Keithley, R. B., Wightman, R. M. Voltammetric detection of 5-hydroxytryptamine release in the rat brain. Anal. Chem. 81, 9462-9471 (2009).
- Borue, X., Cooper, S., Hirsh, J., Condron, B., Venton, B. J. Quantitative evaluation of serotonin release and clearnece in drosophila. J. Neuroscience. Methods. 179, 300-308 (2009).
- Vickrey, T. L., Condron, B., Venton, B. J. Detection of endogenous dopamine changes in drosophila melanogaster using fast-scan cyclic voltammetry. Anal. Chem. 81, 9306-9313 (2009).
- Makos, M. A., Han, K. A., Heien, M. L., Ewing, A. G. Using in vivo electrochemistry to study the physiological effects of cocaine and other stimulants on the drosophila melanogaster dopamine transporter. A.C.S. Chem Neurosci. 1, 74-83 (2009).
- Budygin, E. A., John, C. E., Mateo, Y., Daunais, J. B., Friedman, D. P., Grant, K. A., Jones, S. R. Chronic ethanol exposure alters presynaptic dopamine function in striatum of monkeys: a preliminary study. Synapse. 50, 266-268 (2003).
- Jones, S. R., Gainetdinov, R. R., Jaber, M., Giros, B., Wightman, R. M., Caron, M. G. Profound neuronal plasticity in response to inactivation of the dopamine transporter. PNAS. 95, 4029-4034 (1998).
- Kennedy, R. T., Jones, S. R., Wightman, R. M. Dynamic observation of dopamine autoreceptor effects in rat striatal slices. J. Neurochem. 59, 449-445 (1992).
- Rice, M. E., Cragg, S. J. Nicotine amplifies reward-related dopamine signals in striatum. Nat. Neurosci. 7, 583-584 (2004).
- Zhang, L., Doyon, W. M., Clark, J. J., Phillips, P. E., Dani, J. A. Controls of tonic and phasic dopamine transmission in the dorsal and ventral. 76, 396-404 (2009).
- Paredes, D., Grnaholm, A. C., Bickford, P. C. Effects of NGF and BDNF on baseline glutamate and dopamine release in the hippocampal formation of the adult rat. Brain. Res. 11141, 56-64 (2007).
- Goggi, J., Puller, I. A., Carney, S. L., Bradford, H. F. Signalling pathways involved in the short-term potentiation of dopamine release by BDNF. Brain. Res. 968, 156-161 (2003).
- Cheer, J. F., Wassum, K. M., Heien, M. L., Phillips, P. E., Wightman, R. M. Cannabinoids enhance subsecond doapmine relese in the nucleus accumbens of awake rats. J. Neurosci. 24, 4393-4400 (2004).
- Phillips, P. E., Stuber, G. D., Heien, M. L., Wightman, R. M., Carelli, R. M. Subsecond dopamine release promotes cocaine seeking. Nature. 422, 614-618 (2003).
- Robinson, D. L., Heien, M. L., Wightman, R. M. Frequency of dopamine concentration transients increases in dorsal and ventral striatum of male rats duing introduction of conspecifics. J. Neurosci. 22, 10477-10486 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados