A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תיקון של דגם פגם Calvarial הקריטי בגודל תאי שומן באמצעות נגזרת סטרומה נקטפו מן Lipoaspirate
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר את הבידוד של שומן הנגזר מתאי סטרומה lipoaspirate ויצירת 4 calvarial פגם קריטי בגודל מ"מ להעריך התחדשות שלד.
Abstract
תיקון השלד Craniofacial והתחדשות מציעים את ההבטחה של יצירת רקמת דה נובו באמצעות גישה סלולרית מבוססת ניצול תאי גזע. תאי סטרומה שומן נגזר-(ASCs) הוכיחו להיות מקור שופע של תאי גזע multipotent מסוגלים לעבור התמיינות osteogenic, chondrogenic, adipogenic, וmyogenic. מחקרים רבים בחנו את פוטנציאל osteogenic של תאים אלה בגוף חי עם השימוש בחומרים ביולוגיים שונים פיגומים למסירה סלולרית. הוכח שעל ידי הניצול (חומצה גליקולית, לקטית-CO) osteoconductive, hydroxyapatite מצופה פולי (HA-PLGA) הפיגום seeded עם ASCs, פגם calvarial קריטי בגודלו, פגם שהוגדר על ידי חוסר היכולת שלה לעבור ספונטני ריפוי במשך החיים של בעלי החיים, יכול להיות יעיל להראות התחדשות גרמית חזקה. זה במודל vivo מדגים את בסיס גישות translational מטרה לחדש את רקמת העצם - הסלולרירכיב ומטריצה ביולוגית. שיטה זו משמשת כמודל ליישום הקליני האולטימטיבי של תא מוליד לקראת תיקון פגם רקמות ספציפית.
Protocol
1. בידוד סלולרי והרחבה
- כל הסכמת המטופל ופרוטוקולי ניסוי נבדקו ואושרו על ידי אוניברסיטת סטנפורד מוסדית מועצה לביקורת (פרוטוקול # 2188 ו# 9999).
- רקמת שומן תת עורי לקבל אדם מנהלי lipoaspiration אלקטיבי תחת הרדמה מקומית / כללית.
- תהיינה שתי שכבות בlipoaspirate (איור 1 א). Supernatant מכיל את הרוב המכריע של החומר התאי המעובד. השכבה התחתונה מוזרקת בעיקר מלוחה. שומן ממקור תאי סטרומה ניתן לקצור משתי השכבות, אבל התשואה היא הרבה יותר גדולה מsupernatant.
- כדי לבודד את שבר כלי דם סטרומה (SVF), לשטוף lipoaspirate נרחב עם נפחים שווים של 1X פוספט שנאגר מלוח (PBS) המכיל יוד 2.5% (X2), ואחריו נפח שווה של 1X PBS (x1) ללא פולידין. אפשר לשטוף לשקוע.
- להיות זהיר כדי לשמור על טה סטריליchnique לאורך כל התהליך כמו זיהום ברקמה אנושית מעובד יכול לקרות.
- לשאוב את השכבה התחתונה וזורק אחרי כל שטיפה.
- Aliquot 15 מ"ל של רקמת שומן לתוך צינורות חרוטים 50 מ"ל פלקון BD.
- לעכל את רקמת השומן בנפח שווה (15 מ"ל) של 0.075% מסונן מהסוג II collagenase בתמיסת המלח המאוזנת של האנק (HBSS) על 37 מעלות צלזיוס באמבט מים 60 דקות לתסיסה מתמדת תחת (כ 180 מנער / דקה) - לאוורר כל צינור בכל 15 דקות.
- לנטרל את פעילות אנזים עם 15 המ"ל PBS המכיל 10% (עוברי בסרום שור) FBS, וצנטריפוגה בסל"ד 1000 למשך 5 דקות ב 4 ° C כדי להשיג SVF גלולה בצפיפות גבוהה. הגלולה תהיה תערובת של תאי שומן כנגזרת של סטרומה ואריתרוציטים.
- בטל supernatant מבלי להפריע הגלולה.
- Resuspend גלול ב 10 מ"ל של תקשורת צמיחה המסורתית (שינוי הנשר הבינוני של Dulbecco [DMEM] / 10%% FBS / 1 פתרון פניצילין סטרפטומיצין).
- המסנן suspen שיאון דרך מסננת 100 מיקרומטר ניילון תא כדי להסיר פסולת תאית.
- שלב 3 לתוך אחד צינורות נקיים 50 מיליליטר חרוטים. צנטריפוגה בסל"ד 1000 למשך 5 דקות ב 4 ° C.
- בטל supernatant מבלי להפריע הגלולה.
- Resuspend גלול ב 5 מ"ל של תקשורת צמיחה המסורתית
- לשלב שני 50 conicals מ"ל לצלחת אחת 10 סנטימטר או 5 50 conicals מ"ל לצלחת אחת 15 סנטימטר.
- להקים תרבויות עיקריות לילה על 37 מעלות C/21% O 2, 5% CO 2.
- לאחר דגירת הלילה, היה שוטף את הכלים בהרחבה עם PBS להסיר תאי דם אדומים שיורית שאינם חסידים. את אוכלוסיות תאי התוצאה הן תאי שומן כנגזרת של סטרומה.
- לשמור על תאים ברמות תת confluent למניעת התמיינות ספונטנית על 37 מעלות C/21% O 2, 5% CO 2 בתקשורת צמיחה. התאים בדרך כלל צריכים להיות מפוצל לשלושה עד ארבעה ימים בתקשורת צמיחה הרגילה כאשר מצופים במפגש של 50%.
- פיגומים שנעשו על ידי ד"ר לי מינימום באוניברסיטת קליפורניה, לוס אנג'לס - בית הספר לרפואת שיניים.
- פיגומי PLGA היו מפוברקים מ( חומצה גליקולית, לקטית-CO) 85/15 פולי (צמיגות גלומה = 0.61 dl / g, פולימרים ברמינגהאם) על ידי יציקת ממס ותהליך שטיפת חלקיקים.
- פתרוני PLGA / כלורופורם היו מעורבים עם סוכרוז קוטר 200-300 מיקרומטר כדי להשיג 92% נקבוביים (שבריר נפח), ודחוס לתוך סדינים דקים בתבנית טפלון.
- לאחר ייבוש, הקפאת הלילה, פיגומים הייתם שקועים בשלושה שינויים המזוקקים פעמים (dd) H 2 O לפזר סוכרוז, ועדינות להסיר את צלחת הטפלון עם מרית טיפ וקנס.
- לאחר שטיפת חלקיקים, כל הפיגומים שחוטאו על ידי טבילה ב50%, 60% ו 70% אתנול למשך 30 דקות כל אחד, ואחריו שלוש שטיפות של DDH 2 O.
- כל הפיגומים יובשו תחת מכסה מנוע זרימה למינרית.
- לאחר פיגום ייצור, שלcaffolds היו מצופה באפטיט.
- פתרון SBF (נוזל גוף מדומה) הוכן עם ריכוזי יון שהיו 5 פעמים זה של פלזמת דם אנושית. כל הפתרונים היו סטרילי מסונן דרך קרום PES מיקרומטר 0.22 (Nalgene). מייד לפני תהליך הציפוי, התייבש פיגומי PLGA היו נתונים לפריקת זוהר, ארגון פלזמת תחריט (Harrick מדעי) כדי לשפר את ההרטבה ואחידות ציפוי.
- פיגומים חרוטים PLGA אז הודגרו בSBF על 37 מעלות צלזיוס בתוך חממת מים במעייל עבור 12 שעות, ואחריו Mg 2 + ו 3 HCO - SBF החופשי 2 עבור 12 שעות נוספות על 37 מעלות צלזיוס בערבוב עדין.
- פיגומי PLGA מצופים נשטפו בעדינות עם DDH 2 O סטרילי כדי לשטוף עודף נתרן כלורי פתרון, מיובש בברדס זרימה למינרית ולחטא עם אתנול 70%.
- שלמות ציפוי אפטיט נותחה באמצעות מיקרוסקופ אלקטרונים סורק (SEM). אפטיט מצופה SCAffolds היה רכוב על ספחי SEM (טד פלה) ומצופה בפחם כדי לשפר את המוליכות. מצב האלקטרונים המשני יושם במהלך SEM תצפית (פיי / פיליפס XL-30). ספקטרום פיזור אנרגית רנטגן הושג לאשר רכב יסודות של מבני אפטיט.
3. זריעת תאים
- עם רמות משנת המפגש להגיע, לשטוף את התאים עם PBS (X2) וtrypsinize.
- ספירת התאים לכמת לזריעה
- זרעים על פיגומים חתוכים מראש בקוטר 4.0 מ"מ עם 1.5 x 10 5 תאים.
- מקום יחיד פיגום לתוך באר של צלחת 96-היטב
- Re-להשעות תאים בתקשורת צמיחה הקבועה עם ריכוז של כ 1.5 x 10 5 תאים ל20 μl של תקשורת
- Pipet 20 μl ישירות על גבי הפיגום ומקום לתא תרבות חממה למשך 30 דקות.
- אחרי 30 דקות, להוסיף 200 μl של תקשורת ולאפשר לתאים כדי לדגורעל פיגום לילה לפני הניתוח
- אין זה הכרחי על מנת להבטיח הידבקות של התאים על גבי הפיגום כזריעת מספר מספיק של תאים תבטיח שרוב יהיה לצרף אל הגרדום. זו אומתה במעבדה שלנו בvivo עם פליטת אור וניתוח היסטולוגית.
4. יצירת פגמי Calvarial ובהשרשת Vivo
- הרדם מבוגר (60 בן יומו) CD-1 עכברים בעירום עם קוקטייל הרדמה. (קטמין / xylazine / acepromazine) בריכוז 50% (1:1 דילול עם 0.9% NaCl) או להרדמת טיפול מומלץ לפרוטוקולי מוסד. עכברים אלה הם athymic כך hASCs לא יגרום לתגובה חיסונית.
- מינון: קטמין הידרוכלוריד (80 מ"ג / ק"ג), Xylazine (2.5 מ"ג / ק"ג) Acepromazine (2.5 מ"ג / ק"ג)
- משך ההשפעה: כ 30 דקות
- ניתוח לעטוף את החיה ולעקר כירורגיתאתר עם פולידין ואלכוהול (x3) ולכסות את עיני עכבר עם משחה לפני ביצוע חתך sagittal קו אמצע בקרקפתו של בעל החיים כדי לחשוף את העצם הקודקודית הימני. הסר את מסב הגולגולת מהעצם הקודקודית הימני עם גירוד בוטה (1B איור).
- ליצור פגם חד צדדי 4-מ"מ בעובי מלא בעצמות הקודקודית הימניות שאינן משויכות תפר באמצעות מקדח סטרילי יהלומים מצופה קידוח. זהיר במיוחד יש להקפיד שלא להפריע מאטר הדורה הבסיסית (האיור 1B) כעובי calvarial העכבר הוא <.3 מ"מ.
- לפני ההשתלה, יש לשטוף את פיגומים עם PBS סטרילי כדי למנוע העברה של גורמי גדילה בינוני נגזרים.
- הנח את הפיגום לפגם.
- לבסוף, לתפור העור נסגר ולנטר את החיה לפרוטוקולים לאחר ניתוח שנקבעו.
- השתמש במשככי כאבים שהוקמו לפי הוראות פרוטוקולי הטיפול בבעלי החיים שלך במידת הצורך לאחר operatively-למשל. העצירות 0.1 מ"ג / kגרם.
5. כימות של גיבוש דמוי עצם
- לאחר MicroCT בוצע על העכבר, התמונה תלת הממדית שוחזרה באמצעות תוכנת MicroView כפי שתואר בעבר 1.
- באמצעות Adobe Photoshop, את התמונות היו בגודל סטנדרטי לגובה.
- שימוש בתכונת שרביט קסמי פיקסלים נמדדו של פגם calvarial.
- אחוז הריפוי של הפגם נקבע על ידי סריקות CT הבאות מדידת שטח הפגם calvarial וקביעת מספר פיקסל וחלוקתו במספר הפיקסלים של הפגם המקורי
- כתוצאה מכך, אם MicroCT אינו זמין, אלטרנטיבה היא באמצעות Adobe Photoshop וקציר מכסה הגולגולת בנקודתי זמן שנקבע ליסטולוגיה.
- שימוש בכתמי היסטולוגית כמו אנילין הכחול וPentachrome שיסמנו היווצרות דמוית עצם, מספר מקטעים לאורך התקופה של הפגם צריכים להיות מוכתמים
- באמצעות Adobe Photoshop, לחתוך את כל האזורים שאינםבפגם calvarial
- השתמש בתכונת שרביט הקסם ולקבוע מספרים הפיקסלים של היווצרות עצם דה נובו באזור של הפגם והשווה לבקרים או משתנה אחרים.
6. נציג תוצאות
רקמת שומן יש פוטנציאל למלא תפקיד חיוני ביצירת תאי אב ליישום קליני. רקמת שומן יש יתרון ייחודי בכך שיש אספקה זמינה שניתן לקצור בהליך פשוט יחסית שכרוך בתחלואה ותמותה מינימאליות. ברגע שהרקמה שנקטפה ונאספה, פרוטוקולנו מתואר באיור 2. תאי שומן כנגזרת של סטרומה מבודדים באמצעות סדרה של צעדי כביסה, עיכול collagenase, וצנטריפוגה. ברגע שהתאים מצופים בתרבות, הם יכולים להיות מורחבים, הניחו לפרוטוקולים שונים בידול במבחנה, או להציב ישירות בגוף חי.
גreation של 4 calvarial הפגם קריטי בגודל המ"מ מספק נגיש ולשעתק במודל vivo לבחון את יכולת ההתמיינות של התאים שלנו osteogenic סטרומה שומן נגזר-. באמצעות השימוש בMicroCT, אנו מסוגלים לבצע את ההיווצרות של רקמת שלד בגוף חי ולעקוב אחר ההתקדמות של ההתערבויות שלנו (איור 3). פגם calvarial קריטי בגודל לא לרפא בתוך חייו של בעל החיים ואנו רואים בערך 90% מהפגם יישארו פטנט סביב 8 שבועות. הפיגום עצמו (ראה דיון) יש תכונות אינדוקטיביים osteogenic והוכיח את יכולתו להשפיע כמה התחדשות גרמית. התוצאות הטיפוסיות של מיקום פיגום ללא תאים מראות שסביב שליש מהפגם תהיה דה נובו היווצרות עצם בגיל 8 שבועות. עם ההגדלה של תאי שומן כנגזרת של סטרומה, באופן מלא שני שליש או יותר מהפגם יציג התחדשות גרמית בסביבות 8 שבועות למרות שיש variability בין כל בעלי חיים ובניתוח. ההיווצרות של רקמת שלד ניתן לכמת באמצעות היסטולוגיה ותוצאות טיפוסיות להראות היווצרות דמוית עצם מוגבר בדגימות עם ASCs באמצעות אנילין הכחול וכתמי Pentachrome (האיור 3C). בנוסף, אנו מראים כי תאי האדם המושתל לתרום לדה נובו ההיווצרות הגרמית הבסיסית באמצעות hASCs GFP-כותרת שמראים כתמי in vivo ב2 שבועות סמוכים לאזור של היווצרות עצם דה נובו בפגם calvarial (האיור 3D) . בנוסף, אנו משתמשים באימונוהיסטוכימיה עם נוגדן ספציפי אדם להראות הישרדות תא אנושית ותרומה בתחום הפגם (איור 3E).
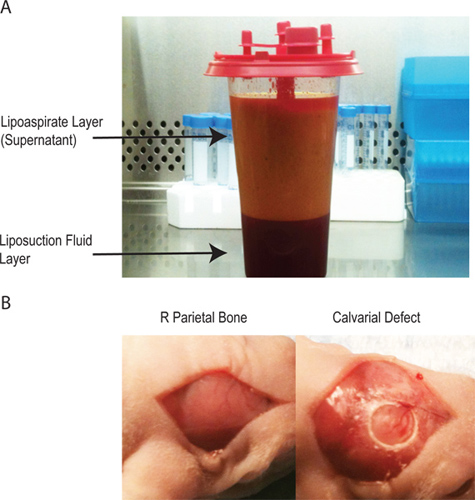
איור 1 -. Lipoaspirate יש שתי שכבות. השכבה העליונה מכילה את adipocytes ואת רוב יחסי הציבורocesses חומר תאי ואילו שכבה התחתונה מכילה תמיסת המלח משמשת במהלך הליך lipoaspiration. ב '- יצירתו של פגם calvarial דרך חתך קו אמצע מעל מסב הגולגולת לבודד את העצם הקודקודית הימני, היצירה הבאה של 4 פגם בגודל קריטי מ"מ calvarial ללא הפרעה של דורת מאטר הבסיסי.
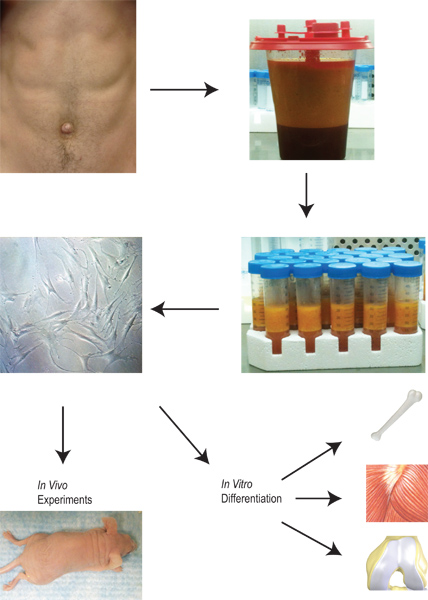
איור 2. סקירה כללית של הקציר והיישום של lipoaspirate מהבידוד של תאי שומן כנגזרת של סטרומה לרחבה, הבידול והשימוש במבחנת in vivo שלהם.
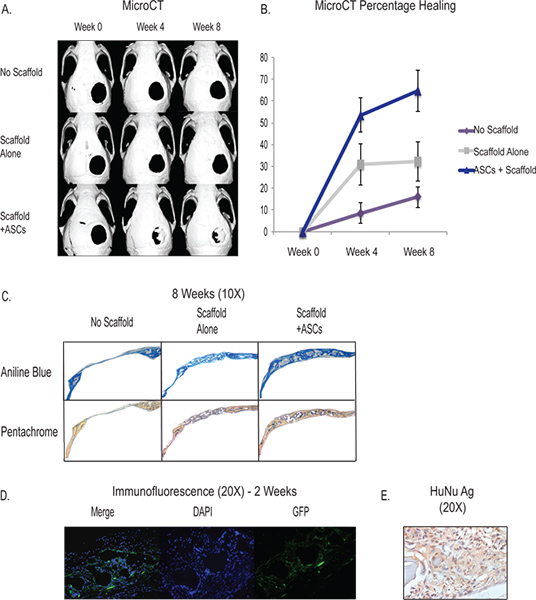
איור 3.-MicroCT מראה בריפוי vivo של פגם calvarial גודל הקריטי עם היישום של ASCs דרך Hydroxyapatitie הפיגום (בשורה תחתונה). בקרה כוללת לא פיגום ופגם (שורה העליונה) וליקוי במיקום של הפיגום ללא לינת תאים (שורה אמצעית) - כימות של החלמה גרמית מMicroCT מראה ריפוי גדל באופן משמעותי בקבוצת ASC. ג - היסטולוגיה מראה דמוית עצם היווצרות מוגברת של ASC הקבוצה (שורה התחתונה) דרך אנילין הכחול וכתמי Pentachrome. לאנילין הכחול, את הכתמים הדמויים העצם בצבע כחול כהה ולPentachrome, את הכתמים הדמויים העצם צהוב. ד - hASCS כותרתו עם GFP נזרע על פיגום והניח לפגם calvarial והקריב ב2 שבועות. צביעה נעשתה עם נוגדן ה-GFP שכותרתו להראות את התאים האנושיים התורמים להתחדשות באזור של הפגם. E -. אימונוהיסטוכימיה אנטיגן הגרעיני אנוש מראה שכיחות של תאי אדם באזור של הפגם ב2 שבועות לוחץ כאן לצפייה בדמות גדולה.
Discussion
מאז הבידוד של שומן ממקור תאי סטרומה 2 מ lipoaspirate, התאים הללו מובחנים למגוון רחב של שושלות סלולריות. רקמת שומן היא ממקורות mesodermal ולכן, תאי סטרומה שומן המופקים multipotent צפוי להיות יעילים ביותר עם יישום כלפי שושלת mesodermal. היכולת ליצור רקמות שלד היא קריטית במיוחד לנוכח המ...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
ברצוננו להודות לד"ר ג'ורג' וCommons ד"ר דין Vistnes על התמיכה ושיתוף הפעולה שלהם במחקר שלנו. עבודה זו נתמכת על ידי המכון הלאומי למענקי מחקר דנטלי Craniofacial ו1 R21 DE019274-01, R01EB009689 וRC2 DE020771-02, האלון וקרן Hagey המעבדה לרפואת הרגנרציה ילדים לMTL ד"ר יון נתמך על ידי בית החולים סנט ג'וזף מרסי GME .
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב: | חברה | מספר קטלוגים | תגובות (אופציונלי) |
| Lipoaspirate קציר | |||
| PBS | Gibco | 10010-023 | |
| תמיסת המלח המאוזן של האנק | Cellgro | 21-023-CV | |
| Collagenase | סיגמא | C6885-500 מ"ג | |
| 100 מיקרומטר מסננת התא | BD פלקון | 352360 | |
| 500 מ"ל .22 מסנן Steri העליון מיקרומטר | Millipore | SCGPT05RE | |
| פגם Calvarial | |||
| Z500 Brushless MicromotorsUM50C | NSK | NSKZ500 | |
| סכין עגול 4.0 מ"מ | Xemax כירורגים | CK40 |
References
- Levi, B., James, A. W., Nelson, E. R. Human adipose-derived stromal cells heal critical size mouse calvarial defect. PLoS One. 5, (2010).
- Zuk, P. A., Zhu, M., Ashjia, P. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. 13, 4279-4295 (2002).
- Keefe, M. S., Keefe, M. A. An evaluation of the effectiveness of different techniques for intraoperative antibiotics into alloplastic implants for use in facial reconstruction. Arch Facial Plastic Surg. 11, 246-251 (2009).
- Mitchell, J. B., McIntosh, K., Zvonic, S. Immunophenotype of human adipose-derived cells: Temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24, 376-385 (2006).
- Dominici, M., Blanc, K. L. e., Mueller, I. Minimal criteria for defining multipotent mesenchymal stroma cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Cowan, C. M., Shi, Y. Y., Aalami, O. O. Adipose-derived adult stromal cells heal critical-size calvarial defects. Nat Biotechnol. 22, 560-567 (2004).
- Levi, B., Nelson, E. R., Li, S. Dura mater stimulates human adipose-derived stromal cells to undergo bone formation in mouse calvarial defects. Stem Cells. 29, 1241-1255 (2011).
- Phipps, M. C., Clem, W. C., Catledge, S. A. Mesenchymal stem cells responses to bone-mimetic electrospun matrices composed of polycaprolactone, collagen I and nanoparticulate hydroxyapatite. PLoS One. 6, (2011).
- Yuan, H., Zang, Z., Li, Y. Osteoinduction by calcium phosphate biomaterials. J. Mater. Sci. Mater. Med. 9, 723-726 (1998).
- Wei, G., Jun, Q., Giannobile, W. V. The enchancement of osteogenesis by nano-fibrous scaffolds incorporating rhBMP-7 nanospheres. Biomaterials. 28, 2087-2096 (2007).
- Li, C., Verpari, C., Jin, H. J. Electrospun silk-BMP-2 scaffolds for bone tissue engineering. Biomaterials. 27, 3115-3124 (2006).
- Zhang, Y., Fan, W., Nothdurft, L. In vitro and in vivo evaluation of adenovirus combined silk fibroin scaffolds for bone morphogenetic protein-7 gene delivery. Tissue Eng Part C Methods. 17, 789-797 (2011).
- Levi, B., Hyun, J. S., Nelson, E. R. Non-integrating knockdown and customized scaffold design enhances human-adipose-derived stem cells in skeletal repair. Stem Cells. 29, 21028-21029 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved