Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Réparation d'un modèle de critique des défauts de taille crânienne Utilisation adipeuses cellules stromales prélevés sur des Lipoaspirate
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit l'isolement de tissu adipeux dérivé des cellules stromales de lipoaspirate et la création d'une 4 mm de taille critique défaut crânienne pour évaluer la régénération osseuse.
Résumé
Craniofaciale réparation et la régénération osseuse offre la promesse de la formation de novo des tissus grâce à une approche basée sur des cellules en utilisant des cellules souches. Adipeuses cellules stromales (ASC) se sont révélés être une source abondante de cellules souches multipotentes capables de subir ostéogénique, chondrogénique différenciation, adipogénique et myogénique. De nombreuses études ont exploré le potentiel ostéogénique de ces cellules in vivo avec l'utilisation de biomatériaux divers échafaudages pour la livraison cellulaire. Il a été démontré qu'en utilisant une ostéoconducteur, recouverte d'hydroxyapatite poly (acide lactique-co-acide glycolique) (PLGA-HA) échafaudage ensemencé avec CSA, un défaut critique entreprises crânienne, un défaut qui est défini par son incapacité à subir spontanée la guérison au cours de la vie de l'animal, peuvent être effectivement montrer robuste régénération osseuse. Ce modèle in vivo démontrent la base de l'approche translationnelle visant à régénérer le tissu osseux - le cellulairecomposant et la matrice biologique. Cette méthode sert de modèle pour l'application ultime clinique d'une cellule souche vers la réparation d'un défaut spécifique au tissu.
Protocole
1. Isolement cellulaire et l'expansion
- Tout le consentement du patient et des protocoles expérimentaux ont été examinés et approuvés par l'Université de Stanford institutionnel commission d'examen (Protocole # 2188 et # 9999).
- Obtenir humaine tissu adipeux sous-cutané des procédures électives lipoaspiration sous local / anesthésie générale.
- Il y aura deux couches dans le lipoaspirate (figure 1A). Le surnageant contient la grande majorité de la matière traitée cellulaire. La couche inférieure est le plus souvent injecté une solution saline. Adipeuses cellules stromales peuvent être récoltées à partir de chaque couche, mais le rendement est beaucoup plus élevé dans le surnageant.
- Pour isoler la fraction stroma vasculaire (SVF), laver abondamment avec de l'lipoaspirate volumes égaux de 1X tampon phosphate salin (PBS) contenant 2,5% de bétadine (x2), suivi par un volume égal de PBS 1X (x1) sans bétadine. Laissez le lavage à précipiter.
- Veillez à maintenir stérile technique tout au long du processus de la contamination avec les tissus humains transformés peut arriver.
- Aspirer la couche de fond et jeter après chaque lavage.
- Aliquote de 15 ml de tissu adipeux dans 50 ml tubes coniques Falcon BD.
- Digérer le tissu adipeux avec un volume égal (15 ml) d'eau filtrée 0,075% collagénase de type II dans une solution saline équilibrée de Hank (HBSS) à 37 ° C dans un bain-marie pendant 60 min sous agitation constante (environ 180 secousses / min) - ventiler chaque tube toutes les 15 min.
- Neutraliser l'activité de l'enzyme avec 15 ml de PBS contenant 10% (sérum de veau foetal) FBS, et centrifuger à 1000 rpm pendant 5 min à 4 ° C pour obtenir une haute densité SVF granulés. Le culot sera un mélange de adipeuses cellules stromales et les érythrocytes.
- Jeter le surnageant sans perturber le culot.
- Reprendre le culot dans 10 ml de milieu de culture traditionnels (Dulbecco Modified Eagle Medium [DMEM] / FBS à 10% / 1% de pénicilline-streptomycine solution).
- Filtrer suspension sion à travers une passoire en nylon 100 um cellule pour éliminer les débris cellulaires.
- Combinez 3 tubes dans un propre conique 50 ml. Centrifuger à 1000 rpm pendant 5 min à 4 ° C.
- Jeter le surnageant sans perturber le culot.
- Reprendre le culot dans 5 ml de milieu de culture traditionnels
- Combinez deux 50 ml coniques, par une plaque de 10 cm ou cinq Coniques 50 ml pour une plaque 15 cm.
- Mettre en place des cultures primaires pendant la nuit à 37 ° C/21% d'O 2, 5% de CO 2.
- Après une nuit d'incubation, laver les assiettes abondamment avec du PBS pour éliminer résiduels non adhérentes globules rouges. Les populations de cellules adipeuses qui en résultent sont dérivées de cellules stromales.
- Maintenir les cellules en sous-confluentes les niveaux pour prévenir la différenciation spontanée à 37 ° C/21% d'O 2, 5% de CO 2 dans les milieux de croissance. Les cellules doivent généralement être divisés tous les trois à quatre jours dans un milieu de croissance réguliers lorsque étalées à 50% de confluence.
- Les échafaudages ont été faites par le Dr Min Lee de l'Université de Californie, Los Angeles - School of Dentistry.
- Échafaudages ont été fabriquées à partir de PLGA 85/15 de poly (acide lactique-co-acide glycolique) (viscosité inhérente = 0,61 dl / g, Birmingham Polymers) par coulée en solvant et un processus de lessivage particulaire.
- PLGA / chloroforme solutions ont été mélangées avec du saccharose 200-300 um de diamètre pour obtenir 92% (fraction volumique) la porosité et comprimé en feuilles minces dans un moule en téflon.
- Après lyophilisation du jour au lendemain, les échafaudages ont été immergés dans trois changements de bidistillée (dd) H 2 O pour dissoudre le saccharose, et doucement retiré de la plaque en téflon avec une spatule fine pointe.
- Après le lessivage de particules, tous les échafaudages ont été désinfectés par immersion dans 50%, 60% et 70% d'éthanol pendant 30 minutes chacun, suivis par trois rinçages de ddH 2 O.
- Tous les échafaudages ont été séchés sous une hotte à flux laminaire.
- Après échafaudage fabrication, scaffolds ont été revêtues d'apatite.
- SBF (fluide corporel simulé) On prépare une solution avec des concentrations en ions qui sont 5 fois supérieure à celle du plasma sanguin humain. Toutes les solutions sont stérilisées par filtration à travers une membrane de 0,22 um PSE (Nalgene). Immédiatement avant l'opération de revêtement, on sèche échafaudages PLGA ont été soumis à une décharge luminescente, le plasma d'argon-gravure (Harrick Scientific) pour améliorer le mouillage et l'uniformité du revêtement.
- Gravées échafaudages PLGA ont ensuite été incubées dans du SBF à 37 ° C dans un incubateur à chemise d'eau pendant 12 heures, suivie par Mg 2 + et HCO 3 - libre SBF 2 pour un autre h 12 à 37 ° C sous agitation douce.
- Enduits échafaudages PLGA ont été rincés doucement avec ddH 2 O stérile pour laver l'excès de solution de chlorure de sodium, séchées dans une hotte à flux laminaire et désinfectés avec de l'éthanol à 70%.
- L'intégrité du revêtement d'apatite ont été analysées avec un microscope électronique à balayage (MEB). Apatite enduit scaffolds ont été montés sur les talons de SEM (Ted Pella) et revêtue de carbone pour améliorer la conductivité. Le mode électrons secondaires a été appliqué pendant SEM (FEI / Phillips XL-30) d'observation. Dispersion d'énergie de rayons X du spectre a été obtenu pour les composition élémentaire des structures d'apatite.
3. L'ensemencement de cellules
- Après avoir atteint des niveaux sous-confluence, laver les cellules avec du PBS (x2) et trypsiniser.
- Compter les cellules de quantifier pour l'ensemencement
- Semences sur échafaudages 4,0 prédécoupées mm de diamètre avec 1,5 x 10 5 cellules.
- Place de l'individu échafaudage dans un puits d'une plaque de 96 puits
- Remettre en suspension les cellules dans un milieu de croissance réguliers avec une concentration d'environ 1,5 x 10 5 cellules par 20 pi de médias
- Pipeter 20 pl directement sur l'échafaud, puis placer en incubateur de culture cellulaire pendant 30 min.
- Après 30 minutes, ajouter 200 ul de médias et de permettre aux cellules à incubersur l'échafaud pendant la nuit avant la chirurgie
- Il n'est pas nécessaire pour assurer l'adhérence des cellules sur l'échafaud comme l'ensemencement d'un nombre suffisant de cellules veillera à ce que la majorité se fixer sur l'échafaud. Ceci a été validé dans notre laboratoire in vivo avec la bioluminescence et l'analyse histologique.
4. Création de défauts crânienne et une implantation in vivo
- Anesthetize adulte (60 jours d'âge) CD-1 souris nude avec cocktail anesthésiant. (Kétamine / xylazine / acépromazine) à une concentration de 50% (1:1 dilution avec 0,9% de NaCl) ou par recommandé régime anesthésique selon les protocoles institution. Ces souris sont athymiques si les hASCs ne sera pas provoquer une réaction immunitaire.
- Dosage: Le chlorhydrate de kétamine (80 mg / kg), xylazine (2,5 mg / kg) acépromazine (2,5 mg / kg)
- Durée de l'effet: environ 30 min
- Chirurgicale drapent l'animal et stériliser la chirurgiele site avec de la bétadine et de l'alcool (x3) et couvrir les yeux de souris avec une pommade avant de faire une incision médiane sagittale dans le cuir chevelu de l'animal pour exposer l'os pariétal droit. Retirez le péricrâne de l'os pariétal droit avec grattage pointu (figure 1B).
- Créer un unilatéral de 4 mm d'épaisseur totale défaut dans le droit fil de suture non-pariétal associée en utilisant une solution stérile diamanté foret trépan. Précautions extrêmes doivent être prises pour ne pas perturber la dure-mère sous-jacente (figure 1B) que l'épaisseur crânienne de souris est <0,3 mm.
- Avant l'implantation, rincer échafaudages avec du PBS stérile pour empêcher le transfert de facteurs de croissance à moyen dérivés.
- Placez l'échafaud dans le défaut.
- Enfin, suturer la peau ferme et de surveiller l'animal par les protocoles établis postopératoires.
- Utilisez une analgésie établi selon les directives de vos protocoles de soins aux animaux, au besoin en post-opératoire, par exemple-. buprénorphine 0,1 mg / kg.
5. Quantification de la formation ostéoïde
- Après microCT a été réalisée sur la souris, l'image en trois dimensions a été reconstruite en utilisant un logiciel tel que décrit précédemment MicroView 1.
- Utilisation d'Adobe Photoshop, les images ont été dimensionnés pour une hauteur standard.
- Utilisation de la fonction Magic Wand, les pixels ont été mesurées de la défectuosité crânienne.
- Pourcentage de guérison de la lésion a été déterminée par la suite tomodensitométrie mesure de la zone de défaut crânienne et de déterminer le nombre de pixels et en le divisant par le nombre de pixels le défaut original
- Par conséquent, si le microCT n'est pas disponible, une alternative est d'utiliser Adobe Photoshop et la récolte de la calvaria à des moments déterminés pour l'histologie.
- Utilisation colorations histologiques comme le bleu d'aniline et Pentachrome qui dénotent formation ostéoïde, plusieurs sections le long de la durée du défaut doit être teinté
- Utilisation d'Adobe Photoshop, culture sur tous les domaines qui ne sont pasdans le défaut crânienne
- Utilisez la fonction de baguette magique et déterminer le nombre de pixels de la formation de l'os novo dans la zone de la lésion et de comparer à des contrôles ou d'autres variables.
6. Les résultats représentatifs
Le tissu adipeux a le potentiel de jouer un rôle essentiel dans la production de cellules souches pour une application clinique. Le tissu adipeux a un avantage unique en ce qu'il est une source facilement disponible qui peut être récoltée dans une procédure relativement simple qui consiste à la morbidité et de la mortalité minime. Une fois que le tissu est récolté et recueilli, notre protocole est décrit dans la figure 2. Adipeuses cellules stromales sont isolés par une série d'étapes de lavage, digestion à la collagénase, et la centrifugation. Une fois que les cellules sont étalées dans la culture, ils peuvent être étendus, placés dans des protocoles de différenciation in vitro différents, ou placés directement in vivo.
Le création de la critique 4 mm taille de défaut crânienne offre un accès facile et reproductible modèle in vivo pour tester la capacité de différenciation ostéogénique de nos tissus adipeux provenant des cellules stromales. Grâce à l'utilisation de microCT, nous sommes en mesure de suivre la formation de tissu osseux in vivo et suivre l'évolution de nos interventions (figure 3). Le défaut de taille critique crânienne ne guérit pas dans la vie de l'animal et l'on voit à peu près 90% de l'anomalie reste de brevets autour de 8 semaines. L'échafaud lui-même (voir la discussion) a ostéogéniques propriétés inductives et a démontré sa capacité à induire une régénération osseuse. Les résultats typiques de placement échafaudage sans cellules montre que près d'un tiers de la défectuosité aura formation de l'os novo à 8 semaines. Avec l'augmentation du tissu adipeux dérivés de cellules stromales, plus des deux tiers ou plus du défaut indique la régénération osseuse autour de 8 semaines, mais il est variabilité entre chaque animal et de la chirurgie. La formation de tissu osseux peuvent être quantifiés par l'histologie et montrent des résultats typiques augmentation de la formation ostéoïde dans les échantillons avec ASC par le bleu d'aniline et la coloration Pentachrome (figure 3C). En outre, nous montrons que les cellules implantées humaines contribuent à la formation sous-jacente de novo osseuse grâce à l'utilisation de hASCs GFP-étiquetés qui montrent une coloration in vivo à 2 semaines près de la zone de formation de l'os novo dans le défaut crânienne (figure 3D) . En outre, nous utilisons immunohistochimie avec un anticorps spécifique de l'homme pour montrer la survie des cellules humaines et de la contribution dans le domaine de l'anomalie (figure 3E).
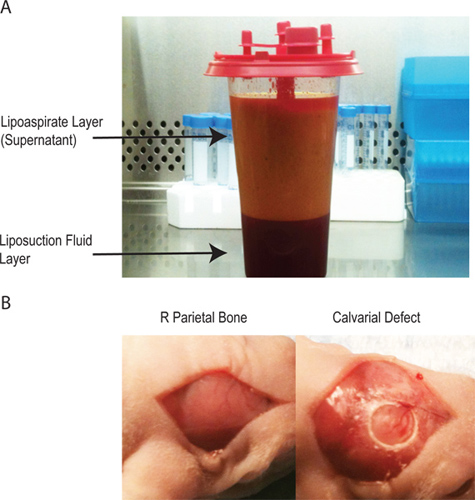
Figure 1 -. L'lipoaspirate a deux couches. La couche supérieure contient les adipocytes et la majorité de la processes matériel cellulaire tandis que la couche inférieure contient la solution saline utilisée lors de la procédure lipoaspiration. B - la création de l'anomalie crânienne par une incision médiane sur le péricrâne d'isoler l'os pariétal droit, de la création ultérieure d'un défaut critique 4 mm taille crânienne sans interruption de la dure-mère sous-jacente.
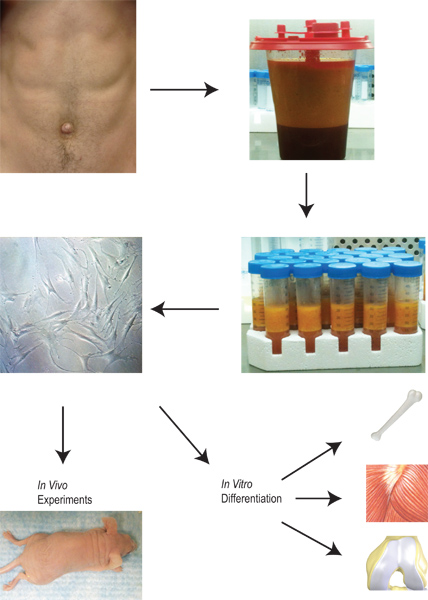
Figure 2. Vue d'ensemble de la récolte et l'application de lipoaspirate de l'isolement de adipeuses cellules stromales à leur expansion, la différenciation et l'utilisation in vitro et in vivo.
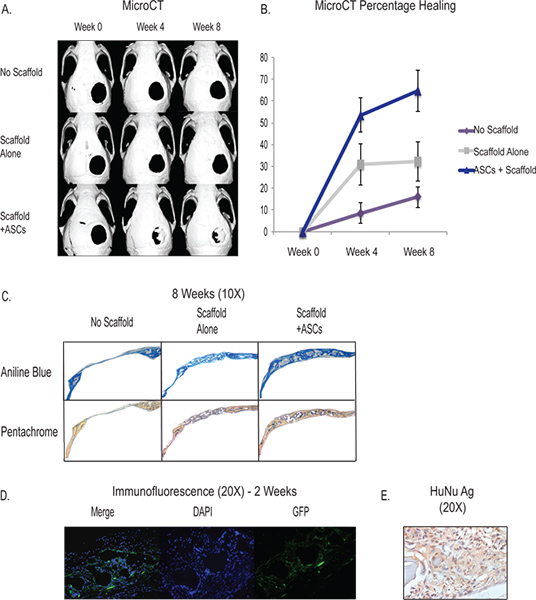
La figure 3. MicroCT-A montre la cicatrisation in vivo de la taille critique défaut crânienne avec l'application de l'ASC à travers une hydroxyapatitie échafaudage (rangée du bas). Les contrôles comprennent pas d'échafaudage et de défauts (rangée du haut) et le défaut de mise en place de l'échafaud sans cellules (rangée du milieu) B - Quantification de la cicatrisation osseuse de la microCT montrant la guérison significativement augmenté dans le groupe ASC. C - Histologie montrant augmentation de la formation ostéoïde du groupe ASC (rangée du bas) par le bleu d'aniline et la coloration Pentachrome. Pour le bleu d'aniline, les taches ostéoïdes bleu foncé et Pentachrome, les taches ostéoïdes jaune. D - hASCS étiquetées avec la GFP ont été ensemencées sur un échafaudage et placé dans un défaut crânienne et sacrifiés à 2 semaines. La coloration a été fait avec une GFP anticorps marqué pour montrer les cellules humaines qui contribuent à la régénération dans la zone du défaut. E -. Human immunohistochimie montrant la prévalence antigène nucléaire des cellules humaines dans le domaine de la défectuosité à 2 semaines Cliquez ici pour agrandir la figure .
Discussion
Depuis l'isolement de tissu adipeux dérivé des cellules stromales de 2 lipoaspirate, ces cellules ont été différenciées en une grande variété de lignées cellulaires. Le tissu adipeux est d'origine mésodermique et, par conséquent, multipotentes dérivées du tissu adipeux cellules stromales sera probablement plus efficace avec une application vers un lignage mésodermique. La capacité à générer du tissu squelettique est particulièrement important compte tenu de la pénurie de sites donn...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous tenons à remercier le Dr George communes et le Dr Dean Vistnes pour leur soutien et la collaboration de nos recherches. Ce travail est soutenu par l'Institut national de bourses de recherche dentaire et craniofaciale 1 R21 DE019274-01, RC2 et R01EB009689 DE020771-02, la Fondation Oak et Hagey Laboratoire de médecine régénérative de pédiatrie à MTL Dr Hyun est pris en charge par le Saint Joseph Mercy Hospital GME .
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif: | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Lipoaspirate récolte | |||
| PBS | Gibco | 10010-023 | |
| Hank Balanced Salt Solution | Cellgro | 21-023 CV- | |
| Collagénase | Sigma | C6885-500MG | |
| Crépine cellule 100 um | BD Falcon | 352360 | |
| Steri-dessus 500 ml 0,22 um filtre | Millipore | SCGPT05RE | |
| Défaut crânienne | |||
| Z500 Brushless MicromotorsUM50C | NSK | NSKZ500 | |
| Couteau circulaire 4,0 mm | Xemax chirurgicale | CK40 |
Références
- Levi, B., James, A. W., Nelson, E. R. Human adipose-derived stromal cells heal critical size mouse calvarial defect. PLoS One. 5, (2010).
- Zuk, P. A., Zhu, M., Ashjia, P. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. 13, 4279-4295 (2002).
- Keefe, M. S., Keefe, M. A. An evaluation of the effectiveness of different techniques for intraoperative antibiotics into alloplastic implants for use in facial reconstruction. Arch Facial Plastic Surg. 11, 246-251 (2009).
- Mitchell, J. B., McIntosh, K., Zvonic, S. Immunophenotype of human adipose-derived cells: Temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24, 376-385 (2006).
- Dominici, M., Blanc, K. L. e., Mueller, I. Minimal criteria for defining multipotent mesenchymal stroma cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Cowan, C. M., Shi, Y. Y., Aalami, O. O. Adipose-derived adult stromal cells heal critical-size calvarial defects. Nat Biotechnol. 22, 560-567 (2004).
- Levi, B., Nelson, E. R., Li, S. Dura mater stimulates human adipose-derived stromal cells to undergo bone formation in mouse calvarial defects. Stem Cells. 29, 1241-1255 (2011).
- Phipps, M. C., Clem, W. C., Catledge, S. A. Mesenchymal stem cells responses to bone-mimetic electrospun matrices composed of polycaprolactone, collagen I and nanoparticulate hydroxyapatite. PLoS One. 6, (2011).
- Yuan, H., Zang, Z., Li, Y. Osteoinduction by calcium phosphate biomaterials. J. Mater. Sci. Mater. Med. 9, 723-726 (1998).
- Wei, G., Jun, Q., Giannobile, W. V. The enchancement of osteogenesis by nano-fibrous scaffolds incorporating rhBMP-7 nanospheres. Biomaterials. 28, 2087-2096 (2007).
- Li, C., Verpari, C., Jin, H. J. Electrospun silk-BMP-2 scaffolds for bone tissue engineering. Biomaterials. 27, 3115-3124 (2006).
- Zhang, Y., Fan, W., Nothdurft, L. In vitro and in vivo evaluation of adenovirus combined silk fibroin scaffolds for bone morphogenetic protein-7 gene delivery. Tissue Eng Part C Methods. 17, 789-797 (2011).
- Levi, B., Hyun, J. S., Nelson, E. R. Non-integrating knockdown and customized scaffold design enhances human-adipose-derived stem cells in skeletal repair. Stem Cells. 29, 21028-21029 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon