É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Reparação de um modelo de defeito crítico porte calvária Usando derivadas de tecido adiposo células do estroma colhidas lipoaspirado
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve o isolamento de derivadas de tecido adiposo a partir de células do estroma lipoaspirado e a criação de um defeito de 4 milímetros de tamanho crítico calvária em avaliar a regeneração óssea.
Resumo
Reparação e regeneração do esqueleto craniofacial oferece a promessa de formação de tecido de novo através de uma abordagem com base em células, utilizando células estaminais. Derivadas de tecido adiposo células do estroma (ASC) têm provado ser uma fonte abundante de células estaminais multipotentes capazes de sofrer diferenciação osteogénica condrogénica, adipogênica e miogénica. Muitos estudos têm explorado o potencial osteogénico destas células in vivo com o uso de biomateriais de andaimes diferentes para entrega celular. Tem sido demonstrado que, utilizando um osteocondutor, hidroxiapatite revestido de poli (ácido láctico-co-glicólico) (PLGA-HA) scaffold semeado com ASCs, um defeito de tamanho crítico calvária, um defeito que é definido pela sua incapacidade de sofrer espontânea cura durante o tempo de vida do animal, podem ser eficazmente mostrar regeneração óssea robusta. Este modelo in vivo demonstra a base de abordagens de translação com vista a regenerar o tecido ósseo - o celularcomponente e matriz biológica. Este método serve como um modelo para a aplicação final clínico de uma célula progenitora para a reparação de um defeito do tecido específico.
Protocolo
1. Isolamento de células e Expansão
- Todos consentimento do paciente e os protocolos experimentais foram analisados e aprovados pela Universidade de Stanford Conselho de Revisão Institucional (Protocolo n º 2188 e n º 9999).
- Obtenção de tecido adiposo humano subcutânea de procedimentos lipoaspiração eletivas sob local / anestesia geral.
- Haverá duas camadas na lipoaspirado (Figura 1A). O sobrenadante contém a grande maioria do material processado celular. A camada inferior é geralmente injectado salino. Derivadas de tecido adiposo células estromais podem ser colhidas a partir de qualquer camada, mas o rendimento é muito maior do sobrenadante.
- Para isolar a fracção do estroma vascular (SVF), lava-se a lipoaspirado extensivamente com volumes iguais de 1X tampão de fosfato salino (PBS) contendo 2,5% de betadine (x2), seguido de igual volume de PBS 1X (x1) sem betadine. Permitir que a solução de lavagem a precipitar.
- Tenha o cuidado de manter te estérilchnique ao longo do processo como a contaminação com o tecido humano processado pode acontecer.
- Aspirar a camada inferior e descartar depois de cada lavagem.
- Alíquotas de 15 ml de tecido adiposo em tubos de 50 ml, BD Falcon cónicos.
- Digerir o tecido adiposo, com um volume igual (15 ml) de filtrado de 0,075% de colagenase do Tipo II em Solução Salina Equilibrada de Hank (HBSS) a 37 ° C em banho-maria durante 60 min, sob agitação constante (cerca de 180 agitações / min) - ventilar cada tubo a cada 15 min.
- Neutralizar a actividade da enzima com 15 ml de PBS contendo 10% (soro fetal bovino) de FBS, e centrifuga-se a 1000 rpm durante 5 min a 4 ° C para se obter uma alta densidade de SVF pellet. O sedimento será uma mistura de derivadas de tecido adiposo células estromais e eritrócitos.
- Desprezar o sobrenadante sem perturbar o sedimento.
- Ressuspender o sedimento em 10 ml de meio de crescimento tradicional (Dulbecco Modified Eagle Médium [DMEM] / FBS a 10% / 1% de solução de penicilina-estreptomicina).
- Filtro de suspensão Sion através de um coador de células 100 uM de nylon para remover os restos celulares.
- Combinar 3 tubos em um limpo de 50 ml. Centrifugar a 1000 rpm durante 5 min a 4 ° C.
- Desprezar o sobrenadante sem perturbar o sedimento.
- Ressuspender o sedimento em 5 ml de meio de crescimento tradicional
- Combinar duas cônicas 50 ml por uma placa de 10 cm ou cinco cônicas 50 ml para uma placa de 15 cm.
- Estabelecer culturas primárias durante a noite a 37 ° C/21% de O 2, 5% de CO 2.
- Após incubação durante a noite, lava-se as placas extensivamente com PBS para remover residuais não aderentes glóbulos vermelhos. As populações de células resultantes são derivadas de tecido adiposo células estromais.
- Manter as células em níveis sub-confluentes para prevenir a diferenciação espontânea a 37 ° C/21% de O 2, 5% de CO 2 em meio de crescimento. As células geralmente precisam ser divididas a cada 3-4 dias em meio de crescimento regular quando plaqueadas a 50% de confluência.
- Os andaimes foram feitas pelo Dr. Min Lee na Universidade da Califórnia, Los Angeles - Faculdade de Odontologia.
- Andaimes PLGA foram fabricados a partir de 85/15 poli (ácido láctico-co-glicólico) (viscosidade inerente = 0,61 dl / g, Birmingham Polymers) por evaporação de solvente e de um processo de lixiviação de partículas.
- PLGA / clorofórmio soluções foram misturadas com sacarose 200-300 um de diâmetro para se obter 92% de porosidade (percentagem, em volume), e comprimida em folhas finas de um molde de Teflon.
- Após liofilização durante a noite, os andaimes foram imersos em três mudas de bidestilada (dd) H 2 O para dissolver a sacarose, e suavemente removida da placa de Teflon com uma espátula de ponta fina.
- Após a lixiviação das partículas, todos os suportes foram desinfectados por imersão em 50%, 60% e etanol a 70% durante 30 min cada, seguido de três lavagens de DDH 2 O.
- Os andaimes foram secos sob uma câmara de fluxo laminar.
- Após a fabricação de andaime, scaffolds foram revestidos com apatite.
- SBF solução (fluido corporal simulado) foi preparada com concentrações de iões que eram 5 vezes aquela do plasma de sangue humano. Todas as soluções foram esterilizadas por filtração através de uma membrana de 0,22 ^ M PES (Nalgene). Imediatamente antes do processo de revestimento, secaram-se os andaimes de PLGA foram submetidos a descarga luminescente, de árgon-plasma etching (Harrick Scientific) para melhorar a molhagem e a uniformidade do revestimento.
- Andaimes gravadas PLGA foram então incubadas em SBF a 37 ° C dentro de uma incubadora com camisa de água durante 12 horas, seguido de Mg 2 + e HCO 3 - SBF livre 2 por um outro 12 hr a 37 ° C sob agitação suave.
- Andaimes revestidos PLGA foram lavadas suavemente com estéril DDH 2 O, para lavar o excesso de solução de cloreto de sódio, secou-se numa câmara de fluxo laminar e desinfectada com álcool a 70%.
- Integridade do revestimento apatita foi analisada com um microscópio eletrônico de varredura (MEV). Apatita revestido scaffolds foram montadas em bases de SEM (Ted Pella) e revestidas com carbono para melhorar a condutividade. O modo de elétron secundário foi aplicado durante SEM observação (FEI / Phillips XL-30). Espectro de dispersão de energia de raios X foram obtidos a confirmar a composição elementar das estruturas de apatite.
3. Sementeira celular
- Ao atingir os níveis de sub-confluência, lavar as células com PBS (x2) e Tripsinizar.
- Contar as células de quantificar para propagação
- Semente em pré-cortadas 4,0 andaimes com 1,5 mm de diâmetro x 10 5 células.
- Lugar individual andaime em um poço de uma placa de 96 poços
- Re-suspender as células em meio de crescimento regular com uma concentração de cerca de 1,5 x 10 5 células por 20 uL de meios
- Pipetar 20 uL diretamente sobre o andaime e coloque em cultura de células de incubadora para 30 min.
- Após 30 min, adiciona-se 200 ul de meio e permitir que as células a incubarno andaime durante a noite antes da cirurgia
- Não é necessário para assegurar a adesão das células sobre o andaime como semeando um número suficiente de células irá garantir que a maioria vai anexar para o andaime. Este foi validado em nosso laboratório in vivo com a bioluminescência e análise histológica.
4. Criação de defeitos de calvárias e na implantação Vivo
- Anesthetize adulto (60 dias de idade) CD-1 ratinhos nus com cocktail anestésico. (Cetamina / xilazina / acepromazina) na concentração de 50% (diluição 1:1 com NaCl 0,9%), ou por recomendada regime anestésico por protocolos instituição. Estes ratos são então as hASCs atímicos não irá causar uma reacção imune.
- Dosagem: cloridrato de cetamina (80 mg / kg), xilazina (2,5 mg / kg) de Acepromazina (2,5 mg / kg)
- Duração do efeito: aproximadamente 30 min
- Cirurgicamente armar o animal e esterilizar o cirúrgicolocal com betadine e álcool (x3) e cobrir os olhos do rato com óleo antes de fazer uma incisão na linha média sagital no escalpo do animal para expor o osso parietal direito. Remover o pericrânio do osso parietal direito com raspagem romba (Figura 1B).
- Criar um unilateral de 4 mm de espessura total defeito no osso parietal direito não sutura associada com um estéril diamantada broca trefina. Cuidado extremo deve ser tomado para não perturbar a dura-máter subjacente (Figura 1B) que a espessura do mouse calvária é <0,3 milímetros.
- Antes de implantação, lavar andaimes com PBS estéril para evitar a transferência de factores de crescimento derivados das médias.
- Coloque o andaime no defeito.
- Finalmente, suturar a pele fechada e monitorar o animal por protocolos estabelecidos no pós-operatório.
- Use analgesia estabelecido como dirigido por seus protocolos de animais cuidados necessários no pós-operatório, por exemplo. buprenorfina 0,1 mg / kg.
5. Quantificação de osteóide
- Após MicroCT foi realizada no rato, a imagem tridimensional foi reconstruída utilizando software MicroView como previamente descrito 1.
- Utilizando o Adobe Photoshop, as imagens foram dimensionados para uma altura padrão.
- Usando o recurso Magic Wand, os pixels foram medidos do defeito ósseo craniano.
- Percentual de cura do defeito foi determinada por exames posteriores CT medir a área do defeito ósseo craniano e determinar o número de pixels e dividindo-o pelo número de pixels do defeito original
- Consequentemente, se o MicroCT não estiver disponível, é uma alternativa utilizando Adobe Photoshop e colheita da calvária em pontos de tempo determinados para histologia.
- Usando manchas histológico como anilina azul e Pentachrome que denotam a formação de osteóide, várias seções ao longo do período do defeito deve ser manchado
- Utilizando o Adobe Photoshop, recortar todas as áreas que não sãono defeito ósseo craniano
- Use o recurso de varinha mágica e determinar o número de pixels de formação de osso novo na área do defeito e comparar com controles ou outras variáveis.
6. Resultados representativos
O tecido adiposo não tem o potencial de servir um papel vital na geração de células progenitoras para aplicação clínica. O tecido adiposo não tem uma vantagem única na medida em que existe um fornecimento facilmente disponível que pode ser colhida de um procedimento relativamente simples que envolve mínima morbidade e mortalidade. Uma vez que o tecido é colhido e recolhido, o nosso protocolo é descrito na Figura 2. Derivadas de tecido adiposo células estromais são isoladas através de uma série de passos de lavagem, a digestão com colagenase, e centrifugação. Uma vez que as células são plaqueadas em placas de cultura, que pode ser expandido, colocado em vários protocolos de diferenciação in vitro, ou colocado directamente in vivo.
O creation do defeito crítico 4-mm de tamanho calvária proporciona um fácil acesso e reprodutível modelo in vivo para testar a capacidade de diferenciação osteogénica nossos derivadas de tecido adiposo células estromais. Através da utilização de MicroCT, que são capazes de seguir a formação do tecido ósseo in vivo e controlar o progresso das intervenções (Figura 3). O defeito de tamanho crítico calvária não cicatrizam dentro do tempo de vida do animal, e podemos ver cerca de 90% do defeito permanecer patente cerca de 8 semanas. O andaime em si (ver discussão) tem propriedades osteogénicas indutivas e tem demonstrado a capacidade de induzir alguma regeneração óssea. Os resultados típicos de colocação de andaime sem células mostra que cerca de um terço do defeito terá de formação de osso novo às 8 semanas. Com o aumento das derivadas de tecido adiposo células estromais, inteiramente de dois terços ou mais do defeito irá mostrar regeneração óssea em cerca de 8 semanas, embora haja variability entre cada animal e cirurgia. A formação de tecido esquelético pode ser quantificado através de exame histológico e os resultados típicos mostram o aumento na formação osteóide em amostras com ASC por meio de coloração com azul de anilina e Pentachrome (Figura 3C). Além disso, mostra-se que as células implantadas humanos contribuem para a formação de base de novo óssea através da utilização de hASCs GFP-etiquetados que mostram a coloração in vivo de 2 semanas, perto da zona de formação de osso novo no defeito ósseo craniano (Figura 3D) . Além disso, podemos usar imuno-histoquímica com o anticorpo humano específico para mostrar a sobrevivência de células humanas e de contribuição na área do defeito (Figura 3E).
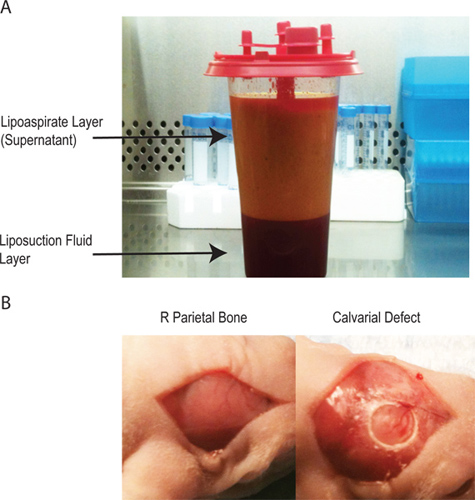
Figura 1 A -. Lipoaspirado A tem duas camadas. A camada superior contém os adipócitos e que a maioria do processes material celular, enquanto a camada inferior contém a solução salina utilizada durante o procedimento de lipoaspiração. B - a criação do defeito ósseo craniano através de uma incisão na linha média ao longo do pericrânio para isolar o osso parietal direito, subsequente criação de um defeito de 4 milímetros de tamanho crítico calvária sem rompimento da dura-máter subjacente.
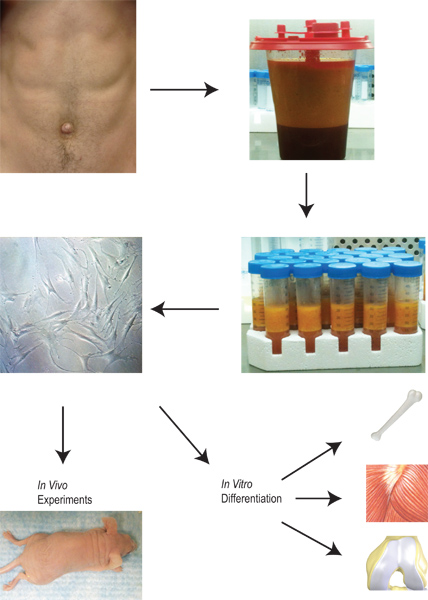
Figura 2. Resumo da colheita e da aplicação de lipoaspirado a partir do isolamento de células derivadas de tecido adiposo do estroma para a sua expansão, diferenciação e utilização in vitro e in vivo.
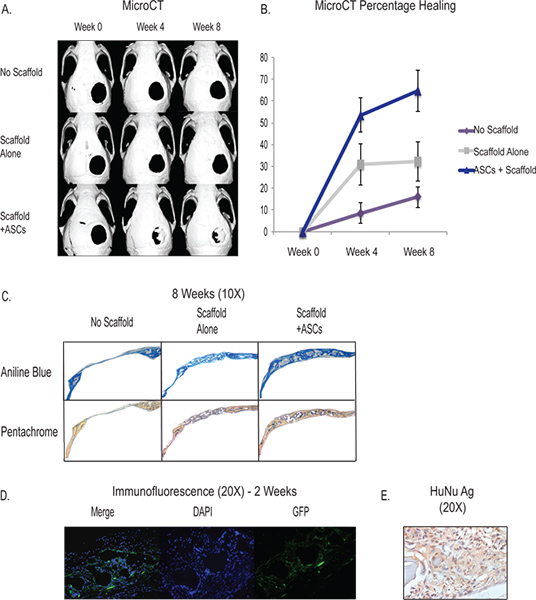
Figura 3. MicroCT-A mostra na cura vivo do defeito de tamanho crítico calvária com a aplicação de ASC por meio de um hydroxyapatitie andaime (linha de fundo). Os controles incluem nenhum andaime e defeito (linha superior) e defeito com a colocação do andaime sem células (linha do meio) B - Quantificação de cicatrização óssea do MicroCT mostrando cura aumentou significativamente no grupo ASC. C - Histologia mostrando aumento da formação de osteóide do grupo ASC (linha de fundo) através de azul de anilina e coloração Pentachrome. Para Anilina Azul, as manchas de osteóide azul escuro e para Pentachrome, as manchas de osteóide amarelo. D - hASCS marcadas com GFP foram semeadas sobre um andaime e colocados em um defeito calvária e sacrificados às 2 semanas. A coloração foi feita com um anticorpo marcado GFP para mostrar as células humanas que contribuem para a regeneração na área do defeito. E -. Imunohistoquímica antigénio nuclear humano que mostra a prevalência de células humanas na área do defeito de 2 semanas para ver figura maior .
Discussão
Uma vez que o isolamento do derivado de tecido adiposo a partir de células do estroma 2 lipoaspirado, estas células foram diferenciadas em uma grande variedade de linhagens celulares. O tecido adiposo é de origem mesodérmica e, portanto, multipotentes derivadas de tecido adiposo células estromais serão provavelmente mais eficaz com a aplicação para uma linhagem mesodérmica. A capacidade de gerar tecido ósseo é especialmente crítico dada a escassez de área doadora de um autoenxerto e as limitaçõ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Gostaríamos de agradecer ao Dr. George Commons e Dr. Dean Vistnes por seu apoio e colaboração da nossa pesquisa. Este trabalho é apoiado pelo Instituto Nacional de Bolsas de pesquisa Dental e Craniofacial um R21 DE019274-01, R01EB009689 e RC2 DE020771-02, da Fundação Oak e Hagey Laboratório de Medicina Regenerativa de Pediatria para MTL Dr. Hyun é apoiado pela Saint Joseph Mercy Hospital GME .
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente: | Companhia | Número de catálogo | Comentários (opcional) |
| Lipoaspirado Colheita | |||
| PBS | Gibco | 10010-023 | |
| Solução Salina Equilibrada de Hank | Cellgro | 21-023 CV- | |
| Colagenase | Sigma | C6885-500mg | |
| Célula de 100 um filtro | BD Falcon | 352360 | |
| Steri-top 500 ml 0,22 mM filtro | Millipore | SCGPT05RE | |
| Defeito calvária | |||
| Z500 Brushless MicromotorsUM50C | NSK | NSKZ500 | |
| Circular Faca 4,0 milímetros | Xemax Cirúrgica | CK40 |
Referências
- Levi, B., James, A. W., Nelson, E. R. Human adipose-derived stromal cells heal critical size mouse calvarial defect. PLoS One. 5, (2010).
- Zuk, P. A., Zhu, M., Ashjia, P. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. 13, 4279-4295 (2002).
- Keefe, M. S., Keefe, M. A. An evaluation of the effectiveness of different techniques for intraoperative antibiotics into alloplastic implants for use in facial reconstruction. Arch Facial Plastic Surg. 11, 246-251 (2009).
- Mitchell, J. B., McIntosh, K., Zvonic, S. Immunophenotype of human adipose-derived cells: Temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24, 376-385 (2006).
- Dominici, M., Blanc, K. L. e., Mueller, I. Minimal criteria for defining multipotent mesenchymal stroma cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Cowan, C. M., Shi, Y. Y., Aalami, O. O. Adipose-derived adult stromal cells heal critical-size calvarial defects. Nat Biotechnol. 22, 560-567 (2004).
- Levi, B., Nelson, E. R., Li, S. Dura mater stimulates human adipose-derived stromal cells to undergo bone formation in mouse calvarial defects. Stem Cells. 29, 1241-1255 (2011).
- Phipps, M. C., Clem, W. C., Catledge, S. A. Mesenchymal stem cells responses to bone-mimetic electrospun matrices composed of polycaprolactone, collagen I and nanoparticulate hydroxyapatite. PLoS One. 6, (2011).
- Yuan, H., Zang, Z., Li, Y. Osteoinduction by calcium phosphate biomaterials. J. Mater. Sci. Mater. Med. 9, 723-726 (1998).
- Wei, G., Jun, Q., Giannobile, W. V. The enchancement of osteogenesis by nano-fibrous scaffolds incorporating rhBMP-7 nanospheres. Biomaterials. 28, 2087-2096 (2007).
- Li, C., Verpari, C., Jin, H. J. Electrospun silk-BMP-2 scaffolds for bone tissue engineering. Biomaterials. 27, 3115-3124 (2006).
- Zhang, Y., Fan, W., Nothdurft, L. In vitro and in vivo evaluation of adenovirus combined silk fibroin scaffolds for bone morphogenetic protein-7 gene delivery. Tissue Eng Part C Methods. 17, 789-797 (2011).
- Levi, B., Hyun, J. S., Nelson, E. R. Non-integrating knockdown and customized scaffold design enhances human-adipose-derived stem cells in skeletal repair. Stem Cells. 29, 21028-21029 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados