A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חקירות על שינויים בתפקוד המעגל היפוקמפוס בעקבות פגיעה מוחית טראומטית קלה
In This Article
Summary
גישה רבת פנים לחקר שינויים הפונקציונליים למעגלי היפוקמפוס מוסברת. טכניקות אלקטרו מתוארות יחד עם פרוטוקול פציעה, בדיקה התנהגותית ושיטת נתיחה אזורית. שילוב של טכניקות אלה יכול להיות מיושם באופן דומה לאזורים אחרים במוח ושאלות מדעיות.
Abstract
פגיעה מוחית טראומטית (TBI) פוגעת יותר מ -1.7 מיליון בני אדם בארצות הברית בכל שנה ואפילו TBI קל עלול להוביל לליקויים נוירולוגיים מתמשכים 1. שני סימפטומים חודרניים וההשבתה שחוו ניצולי TBI, גירעונות זיכרון וירידה בסף תפיסה, הם חשבו להיות מתווכים על ידי תפקוד TBI-Induced היפוקמפוס 2,3. כדי להמחיש עד כמה שונה פונקצית המעגל היפוקמפוס משפיעה לרעה על התנהגות לאחר TBI בעכברים, אנחנו מעסיקים פגיעה רוחבית נוזל כלי קשה, מודל נפוץ חיה של TBI המשחזר תכונות רבות של אדם TBI כולל אובדן הנוירונים תא, דבק, והפרעות יוניות - 4 6.
כאן אנו מדגימים שיטת קומבינטורית לחקירת תפקוד היפוקמפוס TBI מושרה. הגישה שלנו משלבת טכניקות גופיים פיסיולוגיות רבות יחד עם התנהגות בעלי חיים וניתוח ביוכימי, כדי לנתחשינויים שלאחר TBI ביפוקמפוס. אנחנו מתחילים בפרדיגמה הניסויית פציעה יחד עם ניתוח התנהגותי להעריך מוגבלות קוגניטיבית בעקבות TBI. בשלב בא, המכילים שלוש טכניקות שונות גופיים הקלטה: הקלטת פוטנציאל תחום תאית, דימו את תיקון clamping-כל תאים, ורישום צבע רגיש מתח. לבסוף, אנחנו מדגימים את שיטה לביתור אזורי משנה של ההיפוקמפוס, שיכול להיות שימושית לניתוח מפורט של שינויי neurochemical וחילוף חומרים שלאחר TBI אזורי.
שיטות אלה היו בשימוש כדי לבחון את השינויים במעגלים ביפוקמפוס לאחר TBI ולחקור את השינויים המנוגדים בתפקוד מעגל רשת המתרחשים ברכס המשונן וCA1 אזורי המשנה של ההיפוקמפוס (ראה תרשים 1). היכולת לנתח את השינויים שלאחר TBI בכל אזור משנה היא חיונית להבנת המנגנונים התורמים להתנהגות TBI מושרה וקוגניטיבי דeficits.
המערכת רבת הפנים המתוארים כאן מאפשרת לחוקרים לדחוף אפיון העבר של הפנומנולוגיה הנגרם על ידי מצב של מחלה (במקרה זה TBI) ולקבוע את המנגנונים האחראים לפתולוגיה הנצפית קשורה עם TBI.
Protocol
1. פגיעת כלי קשה נוזל לרוחב
- לטשטש את העכבר באמצעות תערובת של intraperitoneally קטמין וxylazine הנתון. אז להכין את ראשו של העכבר לחתך באמצעות קרצוף יוד.
- בצע craniectomy מעל האזור הקודקודית הימני, באמצעות 3 מ"מ (קוטר חיצוני) מקדחה.
- רכזת מאובטחת luer-loc מחט (בתוך 3 מ"מ קוטר) על craniectomy באמצעות אקריליק cyanoarylate ושיניים.
- 24 שעות מאוחר יותר, לטשטש את העכבר באמצעות isoflurane באמצעות שאיפה.
- קורות חי נשימת רגע נורמלים, אבל לפני שהעכבר הופך להיות רגיש לגירוי, לספק 20 אלפית דופק של מי מלח לתוך הגולגולת, באמצעות התקן פציעת הקשת הנוזל.
- מייד לאחר פציעה להסיר את הרכזת, reanaesthetize העכבר באמצעות isoflurane, ולתפור הקרקפת סגורה.
פקדים שאם המופעלים יקבלו הליך זהה לצעד 1.5 הושמט.
2. ניתוח התנהגות - שו"ת פחד מיזוגonse
- טפל בעכברים בשני ימים רצופים שקדמו לתגובת פחד מותנה (CFR) אימון.
- עכבר מקום בחדר מיזוג ל3 דקות לפני מתן הלם רצפת mA 1.5 ל 2 שניות. השאר את העכבר בתא עבור 30 שניות נוספות.
- לאחר תקופת עיכוב (בדרך כלל 24 שעות), לחזור לעכבר קאמרי מיזוג למשך 5 דקות. הערך את ההקפאה במרווחי 5 שניות.
ניתוח מורכב של השוואת הכמות היחסית של הקפאת זמן בשתי אוכלוסיות, במקרה עכברי מוח פגוע ובקרות אחיזת עיניים המופעלות עלינו. שיעורי הקפאה נמוכים יותר (בהשוואה לקבוצת ביקורת) מצביעים על חוסר יכולת לשמור על הקשר בין ההקשר והלם הרצפה, אינדיקציה לפגיעה בזיכרון ותפקוד הקוגניטיבי.
3. הכנת פרוסות ביפוקמפוס חריפות
* הערה: הרדמה באמצעות פעמון זכוכית רק יכולה להיות מיושמת לנהלי מסוף (כגון נתיחת המוח שתוארה לעיל).
- 7 ימים לאחרפציעה, עושה 1 ליטר של תמיסת סוכרוז חיתוך 250 מיליליטר נוזל שדרת מוחות מלאכותיים (aCSF) ו.
- השתמש בקרח בנדיבות כדי להבטיח שכל המכשירים ופתרונות המשמשים בהכנת פרוסת המוח הם קרים כקרח.
- לטשטש את העכבר באמצעות isoflurane. במהירות ובעדינות להסיר ממוח העכבר והמקום בסוכרוז.
- מוח חתוך ומניח על משטח החיתוך בטיפת דבק המגע בחזית בלוק אגר.
- לחתוך פרוסות 350 מיקרומטר עטרה עבה, אתה אמור להיות מסוגל לקבל 4 או 5 פרוסות ביפוקמפוס המעגל השלם.
- דגירת פרוסות לשעה לפחות 1 ב 37 ° C.
4. הקלטת פוטנציאל שדה תאית
- משוך אלקטרודות זכוכית ורוסיליקט ל2-5 MΩs באמצעות חולץ אנכי.
- פרוסת מקום בחדר והאלקטרודה להוסיף על מחזיק האלקטרודה.
- הנמך האלקטרודה מגרה לפרוסה בדרכי axonal כגון נתיב perforant או ביטחונות שפר. האלקטרודה הקלטה נמוכהלמקום תוך עקבות פלט ניטור כדי לוודא שהאלקטרודות הן באותה רמת Z (עומק). כאשר תגובה מקסימלי מושגת, מחזיקה רמה נוכחית גירוי מתמיד, האלקטרודות הן באותה רמת z.
- עקבות התוצאה מורכבת משלושה מרכיבים: מטח presynaptic סיבים, פוטנציאל postsynaptic תאי השדה (fEPSP), וספייק האוכלוסייה סינפטי. הרכיבים עשויים לחפוף באופן זמני בכמה הכנות, ביצוע ניתוח קשה יותר. אם יש עמימות בין אם תגובות הן presynaptic או סינפטי, ניתן להוסיף APV וCNQX לאמבטיה כדי לחסום העברה מעוררת, וכל האותות שנותרו יהיו מקור סינפטי.
- פרוטוקולי גירוי להשתנות לייצר שלושה סוגי ניסוי שונים: עיקולי קלט / פלט, הקלטות דופק לזווג, וניסויים פלסטיים לטווח ארוך.
ניתוח בדרך כלל מורכב ממדידות המשווות את השיפוע של fEPSP פני בשני עכברי מוח פגועים ומזויפת-פעל פקדים, שליטה על עוצמת הקלט על ידי מדידת מטח הסיבים.
5. דמיין הקלטת תיקון-מהדק
- הכן פרוסות, אלקטרודות, ומתקן כדי להקליט כפי שתואר לעיל לעיל עד שלב 4.2.
- רק לשקול תאים עמוקים יותר מ 80 מיקרומטר לתוך רקמת תאים כקרובים יותר לפני השטח יהיה מת ו / או צמצמו את הקישוריות. מתקרב לתא עם לחץ חיובי על האלקטרודה כדי להבטיח שזה לא מתאבן כפי שהוא נע מטה דרך הרקמות. כאשר האלקטרודה נוגעת בעדינות בתא לחץ שלילי להחיל על מנת ליצור 'gigaseal' בין האלקטרודה וקרום הפלזמה.
- החל צרורות קצרות של לחץ שלילי כדי קרע קרום plama תחת האלקטרודה ולהשיג תצורה כל התא.
- לחסל ארעיים קיבול באמצעות מגבר ולפצות על התנגדות סדרה. מפצה על התנגדות הסדרה של התא הוא חיוני כדי להבטיחccurate מדידות.
- שני מצבים של תאים בודדים יכולים להתבצע: מהדק נוכחי (מתח קרום מדידה) ומהדק מתח (מדידת זרם העובר דרך תעלות יונים בקרום).
סוגים אפשריים של ניתוח הם רבים אבל במקרה שלנו מורכבים בעיקר מניתוח biophysical כימות השיעור והגודל של זרמים הסינפטיים ספונטניים בשני עכברי מוח פגועים ובקרות אחיזת עיניים המופעלות.
6. מתח רגיש דיי הדמיה (VSD)
- הכן את הפרוסות ותלבושת להקליט כפי שתואר לעיל לעיל עד שלב 4.2.
- הכן מלאה צבע על ידי ערבוב 1 מ"ג di-3-ANEPPDHQ לתוך אתנול μl 50; לוותר 2 aliquots μl לתוך צינורות עטופים נייר, חנות ב -20 ° C. להפוך את עבודת פתרון לצבוע יומית, על ידי דילול 1:200 בaCSF.
- דגירה על פרוסת aCSF טבולה נייר סינון וכתם עם 90 μl של צבע ל16 דקות; לשטוף עם aCSF ומקום בתא הקלטת ממשק.
- התאם האור stimulatioעוצמת n עד שתגובה מרוכזת באמצע טווח מצלמה. תמונות נרכשות בדרך כלל בשיעור של 500-1,000 פריימים לשניים.
- תריס טריגר להבזקי אור 200 אלפיות שני לפני שהגירוי חשמלי כדי לאפשר photobleaching המהיר הראשוני לייצוב. ניסויי רכישה חלופיים בין חשמלי מגורה, ולא מגורה חשמלי, כדי לאפשר המשך החיסור של רקע שאינו מגורה-. עוצמת שיא מנוחה קלה (קריאת פלואורסצנטי עם תריס סגור) לפני פתיחת תריס. כל ניסוי VSD יהיה כ פיקסלים ידי פיקסלים y בזמן "סרט" של קריאות קרינה. שיא 10-12 ניסויי VSD בכל תנאי מבחן.
- כל המדידות מבוצעות על שינוי פלואורסצנטי-גירוי חשמלי מראש מנורמל התוך פיקסל, DF / F, המחושב באופן בא:
חיסור עוצמת אור מנוחה ממשפט VSD הגלם שנרכש. עבור כל פיקסל בכל ניסוי, לנרמל לפי ממוצע ערך גירוי חשמלי מראש שלמשפט, ואת הפחתת אחדות. האם זה עבור שני ניסויי המגורה חשמלי ולא חשמליים המגורה. צור משפט ממוצע "רקע פלואורסצנטי" מניסויי המגורה שאינם החשמליים, ולחסר ניסיון רקע זה מניסויי המגורה חשמלי. ניתוח נוסף מבוצע בדרך כלל בממוצע של 10-12 ניסויים כאלה, שהם גם בדרך כלל מסוננים בחלל ובזמן כדי לשפר את יחס האות לרעש.
7. נתיחות אזוריות לניתוח ביוכימיים
- הסר את המוח מהעכבר כפי שתואר לעיל.
- הכן פרוסות באמצעות מסוק רקמות.
- שכב סעיף שטוח, microdissect האזור CA1 וDG.
- מייד יטבול במעכב פרוטאז מכיל מאגר תמוגה. להקפיא בחנקן נוזלי ובחנות -80 ° C.
8. נציג תוצאות
הניסויים שלנו בדרך כלל מתחילים עם נתונים התנהגותיים כדי לאשר מצפיםגירעונות ed קוגניטיביות שקיימים בעכברי מוח פגועים. אנו מעסיקים בדיקות תגובה קונטקסטואליות מותנות פחד כפי שהוא התנהגות תלויה ביפוקמפוס שהוא אמין ודורש רק אימון והפעלת בדיקה אחת. הנתונים המוצגים באיור 2 מייצג בדיקה התנהגותית למדוד זכרון האנטרוגרד, עם זאת, בדיקה יכולה לשמש גם כדי למדוד זיכרון מדרדר אם האימון מתבצע לפני הפציעה.
פוטנציאלים מעוררי postsynaptic שדה (fEPSPs) נמדדים כדי לקבוע את היעילות הסינפטית הנקיה של אוכלוסייה גדולה של תאים (איור 3 א). אנחנו בדרך כלל להעסיק שלושה סוגים שונים של דפוסי גירוי, כל אחד ונותן תוצאות ומסקנות משלו. ראשית, על ידי הגדלת עוצמת הגירוי באמצעות סדרה של צעדים, אנו יוצרים עקומת קלט / פלט (האיור 3B / ג).
בשלב הבא, על ידי אספקת גירויים 2 של אותה העצמה הנפרדתד על ידי עיכוב קצר (בדרך כלל 50 אלפית שני) אנו חוקרים שינויים פוטנציאליים בהסתברות שחרור שלפוחית הסינפטית;. בנוסף, אנו לעתים קרובות לבצע הגברה לטווח ארוך (LTP) ניסויים. לאחר שבסס את תגובה בסיסית, גירוי בתדר גבוה קצר (בדרך כלל 100Hz) באותה העצמה מועברת, וגורם מפל תאי שמוביל לתגובה הסינפטית potentiated כאשר גירוי נורמלי יתחדש.
פעילות חשמלית מכל תא תיקון-הדקה תאים ניתן להקליט בשני מצבים. במצב מהדק מתח, הנסיין שולט מתח הקרום של תא תיקון-הדק בהתייחסות לאמבטיה, באמצעות תוכנת מחשב הקשור למגבר. במקרה זה זרמים המתווכים אירועי postsynaptic נרשמים, מתן מידע על תדירות השחרור סינפטי, מספר הקולטנים postsynaptic הופעלו וריכוז הנוירוטרנסמיטר פוחי (איור 4 א). במצב נוכחי מהדק הנסייניתהזריק מתפעלים נוכחי ומודד את תגובת המתח. זה יכול להיות שימושי כדי לקבוע מאפיינים של פוטנציאל הפעולה, כגון סף פוטנציאל פעולה וחצי רוחב. מאפיינים אלה מאפשרים לסיווג התפקודי של תאי עצב כמעורר או המבוסס על דפוסי הפעולה הפוטנציאליים ירי (איור 4B) מעכב. על מנת לאמת את הזהות הסלולרית אנו ממליצים למלא תאים עם צהוב לוציפר לאחר הקלטה וזהות חזותית המאשרת על ידי הנוכחות או עדר של קוצים הדנדריטים. (האיור 4C, ד).
דוגמה לתוצאות מניסוי באמצעות צבע רגיש מתח כדי למדוד שינויים במתח קרום מתואר באיור 5. במקרה זה, האלקטרודה מגרה הושמה במסלול ביטחונות שפר וכתוצאה מכך הפעילות העצבית באזור CA1 הוא נתחה. צבע רגיש מתח אינו מדווח ערכים מוחלטים של מתח קרום, אלא לאהוא השינוי במתח ממצב בסיסי ללא גירוי. עם זאת, ניתוח משווה שני תנאים (למשל המוח נפגע, לעומת דמה מופעל) יכול לשמש כדי לקבוע את פרמטרי החלל ובזמן של שינויים פיסיולוגיים שאינו ניתן למדידה באמצעות fEPSPs או הקלטה כל תא תיקון-clamp.

איור 1. תרשים היפוקמפוס מעגל. סעיף אופקי ביפוקמפוס. המסלולים העיקריים דרך ההיפוקמפוס מוצגים בצהוב. האקסונים מתאי עצב בקליפת מוח entorhinal הפרויקט דרך מסלול perforant לרכס המשונן יוצר סינפסות עם הדנדריטים של תאי גרגר gyrus משוננות. פרויקט גרעין תא אקסונים דרך מסלול סיבים הטחוב לCA3 בו הם יוצרים סינפסות עם הדנדריטים של CA3 הנוירונים. האקסונים של פרויקט CA3 הנוירונים דרך מסלול ביטחונות שפר על dendrites של CA1 תאי פירמידה. האקסונים של תאי CA1 פירמידליים להקרין מתוך ההיפוקמפוס דרך subiculum. הערה: כמו כן מתוארות הם CA3 טחונות האקסון סלולרית פירמידה מקרינות ליפוקמפוס הנגדי באמצעות fimbria. (CA1: Cornu 1 Ammonis, CA2: Cornu Ammonis 2, CA3: Cornu 3 Ammonis, DG: gyrus המשוננת, קו מקווקו מציין שכבת גוף תא, קו קבוע מציין גבולות מבניים.)
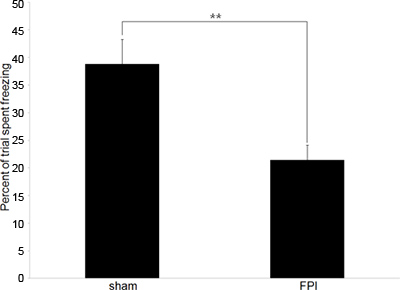
איור 2. נתוני התנהגות מייצגים:. נתונים התנהגותיים המתארים את ההבדל בשיעורים מקפיאים בין עכברי המוח פגועים (FPI) ובקרות אחיזת עיניים המופעלות (דמה) בפרדיגמה תגובת הפחד מותנה. אימון התרחש בפציעה הבאה היום 6 ב, עם תקופת מבחן המתרחשת 24 שעות מאוחר יותר. (** מציין p <.01).

איור 3. נתוני הקלטה תאיים יציגים:. דוגמה לפוטנציאל שדה מעורר פוסט סינפטי (fEPSP) הקלטה באזור CA1. הסטייה כלפי מטה הראשונה היא חפץ הגירוי, ואחרי מטח סיבי presynaptic ולבסוף fEPSP. ב: עקומות קלט / פלט המתארות ירידה ביעילות הסינפטית נקיה בפציעת CA1 הבאה נוזל כלי קשה (FPI). ג: עקומות קלט / פלט המתאר עלייה ביעילות הסינפטית נקיה ברכס משונן (DG) בעקבות FPI. (* P מסמן <.05). לחץ כאן לצפייה בדמות גדולה.
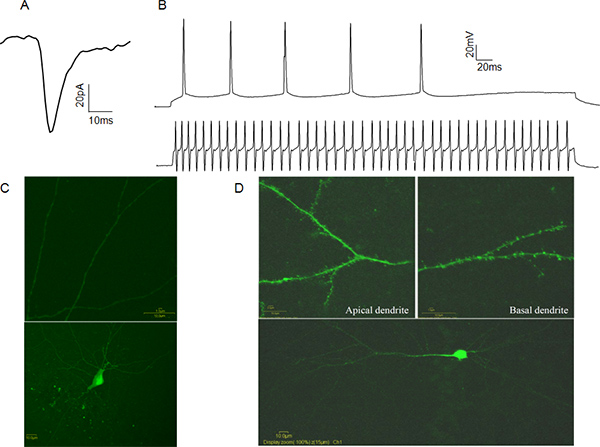
איור 4. כל תא יציגים נתוני תיקון-מהדק.: דוגמה ספונטניתמעורר נוכחי postsynaptic (sEPSC) מתא פירמידלי CA1. ב ': דוגמאות של רכבות פוטנציאל פעולה מתא CA1 פירמידלי (זכר העליון) ומהר spiking CA1 interneuron (עקבות נמוכות יותר). C: דוגמה לוציפר צהוב מלא interneuron המעכב CA1. שים לב להעדרו של קוצים הדנדריטים (פנל העליון). D: דוגמה לוציפר צהוב מלא נוירון פירמידלי CA1. שים לב לנוכחותו של קוצים הדנדריטים (פנל העליון). לחץ כאן לצפייה בדמות גדולה.
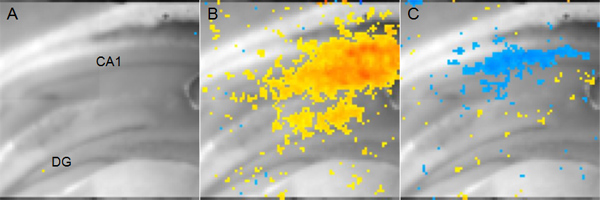
איור 5. נתונים מייצגים מתח רגיש דיי הדמיה:. פרוסת ההיפוקמפוס עטרה מאוסה מוצגת להראות אנטומיה. (DG: gyrus המשוננת, CA1: Cornu 1 Ammonis) B: צהוב לפיקסלים אדומים מייצגים פעילות מעוררת באזור CA1 14 אלפיות שני לאחר גירוי הביטחונות שפר מביא. אדום בdicates יותר תוך שלילת קוטביות צהובה מציין נמוכה יותר, אך עדיין משמעותית שלילת קוטביות. C: פיקסלים כחולים מייצגים אתרים של פעילות מעכבת באזור CA1 56 אלפיות אחרי אותו גירוי ביטחונות שפר מביא מוצג בכחול כהה יותר ב 'מצביעים יותר hyperpolarization.
Discussion
כל טכניקה שתוארה לעיל תורמת להבנה הטובה יותר של המנגנון הבסיסי שגורם לגרעון התנהגותית הנצפה. על ידי שילוב של המידע הייחודי שנרכש מכל שיטה שאנחנו יכולים לבחון את המנגנונים הביולוגיים עם יותר דיוק.
fEPSPs מדידה שימושית לכימות היעילו?...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
המחברים מבקשים להודות לאליוט ורז'ואה לסיוע הטכני שלו. עבודה זו מומנה על ידי המכונים הלאומיים לבריאות מענקי R01HD059288 וR01NS069629.
Materials
| Name | Company | Catalog Number | Comments |
| שם הציוד | חברה | מספר קטלוגים | תגובות (אופציונלי) |
| Axopatch 200B מגבר | התקנים מולקולריים | AXOPATCH 200B | אסדת תיקון-מהדק |
| Digidata 1322A digitizer | התקנים מולקולריים | אסדת תיקון-מהדק | |
| MP-225 micromanipulator | סאטר | MP-225 | אסדת תיקון-מהדק |
| מיקרוסקופ DMLFSA | ליקה | אסדת תיקון-מהדק | |
| Multiclamp מגבר 700B | התקנים מולקולריים | MULTICLAMP 700B | רב תכליתי (שדה)מעטה |
| Digidata 1440 digitizer | התקנים מולקולריים | Multipurpos (שדה) אסדה | |
| MPC-200 micromanipulator | סאטר | MPC-200 | רב תכליתי (שדה) אסדה |
| מיקרוסקופ BX51WI | אולימפוס | BX51WI | רב תכליתי (שדה) אסדה |
| Axoclamp מגבר 900A | התקנים מולקולריים | AXOCLAMP 900A | VSD אסדה |
| Digidata 1322 digitizer | התקנים מולקולריים | VSD אסדה | |
| מצלמת Redshirt CCD-SMQ | Redshirt | NCS01 | VSD אסדה |
| VT 1200s vibratome | ליקה | 14048142066 | |
| P-30 חולץ אלקטרודה | סאטר | P-30 / P | |
| מעכב פרוטאז מלא | רוש | 11697498001 |
References
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved