È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Indagini su Alterazioni della funzione del circuito ippocampale seguito lieve trauma cranico
In questo articolo
Riepilogo
Un approccio multi-angolare per indagare cambiamenti funzionali al circuito ippocampale è spiegato. Tecniche elettrofisiologiche sono descritte con il protocollo infortunio, test comportamentali e metodo di dissezione regionale. La combinazione di queste tecniche possono essere applicate in modo simile ad altre regioni del cervello e domande scientifiche.
Abstract
Traumatic Brain Injury (TBI) colpisce più di 1,7 milioni di persone negli Stati Uniti ogni anno e anche lieve trauma cranico può portare a deficit neurologici persistenti 1. Due sintomi pervasivi e disattivazione incontrati dai sopravvissuti TBI, deficit di memoria e una riduzione della soglia convulsiva, si pensa siano mediati da TBI-indotta disfunzione ippocampale 2,3. Al fine di dimostrare come alterazione della funzione del circuito ippocampale influenza negativamente il comportamento dopo TBI nei topi, ci avvaliamo di laterale lesioni percussioni fluido, un modello animale comunemente usato per trauma cranico che riproduce molte caratteristiche del trauma cranico umano tra cui la perdita neuronale, gliosi, e la perturbazione ionica 4 - 6.
Qui mostriamo un metodo combinatorio per indagare TBI-indotta disfunzione ippocampale. Il nostro approccio comprende molteplici tecniche fisiologiche ex vivo con comportamento animale e analisi biochimica, per analizzarepost-TBI cambiamenti nell'ippocampo. Cominciamo con il paradigma sperimentale di danno con l'analisi comportamentale per valutare la disabilità cognitiva dopo trauma cranico. Successivamente, caratterizzato da tre distinte ex vivo le tecniche di registrazione: registrazione di campo extracellulare potenziale, visualizzabili whole-cell patch-bloccaggio, e della tensione di registrazione colorante sensibile. Infine, si dimostra un metodo per dissezione regionale sottoregioni dell'ippocampo che può essere utile per l'analisi dettagliata delle alterazioni neurochimiche e metaboliche post-TBI.
Questi metodi sono stati utilizzati per esaminare le alterazioni nella circuiteria dell'ippocampo dopo TBI e per sondare i cambiamenti opposti in funzione rete circuitale che si verificano nel giro dentato e sottoregioni CA1 dell'ippocampo (vedi Figura 1). La capacità di analizzare i cambiamenti post-TBI in ogni sottoregione è essenziale per comprendere i meccanismi sottostanti che contribuiscono al trauma cranico indotta comportamentali e cognitive deficits.
Il multi-sfaccettato sistema qui delineato consente agli investigatori di spingere caratterizzazione passato di fenomenologia indotta da uno stato di malattia (in questo caso TBI) e determinare i meccanismi responsabili della patologia osservata associata a trauma cranico.
Protocollo
1. Laterale Fluid Infortunio Percussioni
- Anestetizzare il mouse usando una miscela di ketamina e xilazina intraperitoneale dato. Preparare quindi la testa del mouse per incisione con uno scrub iodio.
- Eseguire una craniectomia sopra la zona parietale destra con 3 mm (diametro esterno) trapano.
- Sicuro Luer-loc mozzo dell'ago (diametro interno 3 mm) sul craniectomia utilizzando acrilico cyanoarylate e dentale.
- 24 ore più tardi, anestetizzare il mouse usando isoflurano per inalazione.
- Una volta riprende respirazione normale, ma prima che il mouse diventa sensibile alla stimolazione, fornire impulsi 20 msec di soluzione fisiologica nel cranio attraverso il dispositivo fluido pregiudizio percussioni.
- Subito dopo l'infortunio rimuovere l'hub, reanaesthetize il mouse usando isoflurano, e suturare il cuoio capelluto chiuso.
Sham comandi azionati riceverà una procedura identica a passo 1,5 omesso.
2. Behavioral Analysis - Resp. paura condizionataOnse
- Maneggiare i topi in due giorni consecutivi prima della risposta di paura condizionata (CFR) di formazione.
- Del mouse posto in camera di condizionamento per 3 minuti prima di somministrare 1,5 scosse piano mA per 2 sec. Lasciare mouse in camera per altri 30 sec.
- Dopo il periodo di ritardo (di solito 24 ore), il mouse per tornare camera di condizionamento per 5 min. Valutare il congelamento a intervalli di 5 sec.
L'analisi consiste nel confrontare la quantità relativa di congelamento tempo in due popolazioni, nel nostro caso cerebrolesi e topi sham comandi azionati. Tassi più bassi di congelamento (rispetto al controllo) indica l'incapacità di mantenere l'associazione tra il contesto e lo shock pavimento, l'indicazione di deficit di memoria e di disfunzione cognitiva.
3. Preparazione di acuta fettine di ippocampo
* Nota: anesthetization utilizzando una campana può essere implementato solo per le procedure terminali (la dissezione cervello qui descritto).
- 7 giorni dopolesioni, fare 1 l di liquido cerebrospinale artificiale (aCSF) e 250 ml di soluzione di saccarosio di taglio.
- Utilizzare il ghiaccio liberamente per assicurare che tutti gli strumenti e le soluzioni utilizzate durante la preparazione del cervello fetta sono fredda come il ghiaccio.
- Anestetizzare mouse utilizzando isoflurano. In modo rapido e rimuovere delicatamente cervello da topo e il luogo in saccarosio.
- Cervello assetto e posto sulla superficie di taglio su una goccia di colla di fronte a un blocco agar.
- Tagliare 350 micron fette coronali, si dovrebbe essere in grado di ottenere 4 o 5 fette con il circuito intatto ippocampale.
- Incubare fette per almeno 1 ora a 37 ° C.
4. Campo di registrazione extracellulare potenziale
- Tirare elettrodi in vetro borosilicato a 2-5 MΩs con estrattore verticale.
- Fetta Mettere in camera e l'elettrodo inserto sul porta elettrodo.
- Abbassare elettrodo stimolante in sezione in un tratto assonale come il percorso perforante o dei collaterali Schaffer. Registrazione elettrodo inferiorein posizione mentre tracce di uscita monitoraggio per garantire che gli elettrodi siano allo stesso livello Z (profondità). Quando una risposta massima viene raggiunto, tenendo livello di stimolazione corrente costante, elettrodi sono allo stesso livello Z.
- La traccia risultante è costituito da tre componenti: il volley in fibra presinaptica, il potenziale di campo extracellulare postsinaptico (fEPSP), e il picco della popolazione postsinaptico. I componenti possono coincidere temporalmente in alcune preparazioni, rendendo più difficile l'analisi. Se c'è ambiguità tra se le risposte sono presinaptica o postsinaptico, APV e CNQX può essere aggiunto al bagno di bloccare la trasmissione eccitatoria, e tutti i segnali rimanenti saranno di origine presinaptica.
- Protocolli di stimolazione variano per produrre tre diversi tipi di esperimento: ingresso / uscita curve, registrazioni impulsi appaiati, e lungo termine esperimenti di plasticità.
L'analisi consiste tipicamente di misure confrontando la pendenza della fEPSP tutto in entrambi i cerebrolesi topi e fintiComandi azionati, per controllare la resistenza di ingresso misurando il volley fibra.
5. Visualizzati Patch-clamp registrazione
- Preparare fette, elettrodi, e rig per registrare come precedentemente descritto sopra fino al punto 4.2.
- Considerazione solo le cellule più profonde di 80 micron nel tessuto come le cellule più vicine alla superficie sarà morto e / o hanno ridotto la connettività. Avvicina a una cella con pressione positiva sull'elettrodo per garantire che non intasarsi mentre si sposta verso il basso attraverso il tessuto. Quando l'elettrodo tocca delicatamente la cella applicare pressione negativa per creare un 'gigaseal' tra l'elettrodo e la membrana plasmatica.
- Applicare brevi sequenze di pressione negativa per rompere le membrane Plama sotto l'elettrodo e conseguire configurazione whole-cell.
- Eliminare transienti di capacità con amplificatore e compensare la resistenza serie. Compensare la resistenza serie della cella è essenziale per garantire unccurate misurazioni.
- Due modi di registrazioni singola cellula può essere effettuata: pinza amperometrica (potenziale di membrana di misura) e morsetto di tensione (misura corrente che passa attraverso i canali ionici della membrana).
Possibili tipi di analisi sono numerosi, ma nel nostro caso consistono per lo più di analisi biofisica quantificare la frequenza e le dimensioni delle correnti sinaptiche spontanee in entrambi i cerebrolesi topi e sham-operati controlli.
6. Tensione Dye Sensitive Imaging (VSD)
- Preparare fette e rig per registrare come precedentemente descritto sopra fino al punto 4.2.
- Preparare magazzino colorante mescolando 1 mg di-3-ANEPPDHQ in 50 microlitri di etanolo; erogare 2 pl aliquote in provette stagnola avvolto, conservare a -20 ° C. Preparare la soluzione di tintura al giorno, diluendo 1:200 in aCSF.
- Incubare fetta su aCSF inumidito carta da filtro e colorare con 90 ml di colorante per 16 minuti, risciacquare con aCSF e mettere in camera di interfaccia di registrazione.
- Regolare la luce stimulatiointensità fino a n risposta è centrata nel mezzo della gamma di telecamere. Le immagini sono acquisite tipicamente ad una velocità di 500-1000 fotogrammi al secondo.
- Shutter trigger per la stimolazione della luce 200 msec prima della stimolazione elettrica per consentire un rapido iniziale photobleaching a stabilizzarsi. Prove di acquisizione alternate tra stimolati elettricamente, e non stimolati elettricamente, per consentire successivamente la sottrazione del fondo non stimolata. Record intensità luminosa di riposo (lettura della fluorescenza con otturatore chiuso) prima di aprire di scatto. Ogni prova VSD sarà un pixel per pixel x y dal tempo "film" di letture di fluorescenza. Record 10-12 VSD prove in ogni condizione di test.
- Tutte le misure sono effettuate su intra-pixel cambiamento pre-stimolo elettrico-fluorescenza normalizzata, dF / F, che viene calcolato come segue:
Sottrarre l'intensità di riposo luce del VSD prima prova acquisita. Per ogni pixel in ogni prova, normalizzare secondo il pre-elettrico-stimolo per tale valore medioprova, e sottraendo l'unità. Fate questo per entrambe le prove elettricamente stimolate e non stimolate elettricamente. Creare un media "fluorescenza di fondo" prova dalle prove non stimolate elettricamente, e sottrarre questo studio sfondo dalle prove elettricamente stimolati. Ulteriori analisi viene tipicamente eseguita in media di 10 - 12 tali prove, che sono di solito filtrati nello spazio e nel tempo per migliorare il rapporto segnale-rumore.
7. Dissezioni regionali per analisi biochimiche
- Rimuovere il cervello dal mouse come precedentemente descritto.
- Preparare le fette che utilizzano chopper tessuto.
- Lay sezione piatta, microdissect zona CA1 e DG.
- Subito immergere in inibitore della proteasi tampone di lisi contenente. Congelare in azoto liquido e conservare a -80 ° C.
8. Risultati rappresentativi
I nostri esperimenti iniziano tipicamente con i dati comportamentali per confermare l'aspettaEd deficit cognitivi che esistono in cerebrolesi topi. Ci avvaliamo di contestuale condizionata test risposta di paura in quanto è un comportamento ippocampale dipendente che sia affidabile e richiede solo una sessione di allenamento e una sessione di test. I dati illustrati nella figura 2 rappresenta test comportamentale per misurare memoria anterograda, tuttavia, il test può essere utilizzato per misurare la memoria retrograda se l'allenamento viene eseguita prima della lesione.
Campo potenziale postsinaptico eccitatorio (fEPSPs) sono misurate per determinare l'efficacia sinaptica netto di una vasta popolazione di cellule (Figura 3A). Noi comunemente impiegano tre diversi tipi di pattern di stimolazione, ciascuno offrendo i propri risultati e le conclusioni. Prima, aumentando l'intensità di stimolazione attraverso una serie di passi, si crea un ingresso / uscita curva (Figura 3B / C).
Successivo, fornendo due stimolazioni della stessa intensità separatad da un breve ritardo (di solito 50 msec) indaghiamo alterazioni potenziali probabilità di rilascio delle vescicole sinaptiche,. Inoltre, spesso eseguire potenziamento a lungo termine (LTP) esperimenti. Dopo aver stabilito una risposta basale, breve stimolazione ad alta frequenza (solitamente 100Hz) alla stessa intensità viene consegnato, provocando una cascata intracellulare che porta ad una risposta sinaptica potenziato quando la stimolazione riprende normalmente.
L'attività elettrica da whole-cell patch-bloccato le cellule può essere registrato in due modi. In modalità morsetto di tensione, lo sperimentatore controlla la tensione di membrana della cellula di patch-clamp in riferimento alla vasca, tramite software associato con l'amplificatore. In questo caso le correnti di mediazione eventi postsinaptici sono registrate, fornendo informazioni sulla frequenza di rilascio presinaptico, il numero dei recettori post-sinaptici attivati e la concentrazione dei neurotrasmettitori vescicolare dei suini (Figura 4A). In modalità pinza amperometrica lo sperimentatoremanipola corrente iniettata e misura la risposta di tensione. Ciò può essere utile per determinare le caratteristiche del potenziale d'azione, come soglia del potenziale d'azione e metà larghezza. Queste caratteristiche permettono la classificazione funzionale di neuroni come eccitatoria o inibitoria sulla base delle loro modelli cottura potenziale di azione (Figura 4B). Al fine di verificare l'identità cellulare si consiglia di riempire le celle con Giallo Lucifero dopo la registrazione e l'identità visiva conferma per la presenza o l'assenza di spine dendritiche. (Figura 4C, D).
Un esempio dei risultati di un esperimento utilizzando tensione colorante sensibile per misurare le variazioni di tensione della membrana è illustrato in Figura 5. In questo caso, un elettrodo stimolante è stato posizionato nella via collaterale Schaffer e l'attività neuronale risultante nella zona CA1 viene analizzato. Tensione colorante sensibile non riporta i valori assoluti di potenziale di membrana, ma tha cambiato in tensione da una condizione di base senza stimolazione. Tuttavia, analisi confrontando due condizioni (ad es cerebrolesi vs sham-operated) può essere usato per determinare i parametri spazio-temporali di alterazioni fisiologiche che non possono essere misurati usando fEPSPs o whole-cell patch-clamp.

Figura 1. Schema del circuito ippocampale. Una sezione orizzontale attraverso l'ippocampo. Le vie principali attraverso l'ippocampo sono mostrati in giallo. Gli assoni dei neuroni nella corteccia entorinale progetto attraverso la via perforante nel giro dentato formare sinapsi con i dendriti delle cellule granulari del giro dentato. Granule progetto assoni delle cellule attraverso la via fibra di muschio CA3 dove formano sinapsi con i dendriti dei neuroni CA3. Gli assoni dei neuroni CA3 progetto attraverso la via Schaffer garanzia sul Dendrites di cellule piramidali CA1. Gli assoni delle cellule piramidali CA1 sporgere dell'ippocampo attraverso il subiculum. Nota: anche raffigurati sono piramidali CA3 collaterali degli assoni delle cellule sporgenti all'ippocampo controlaterale attraverso la fimbria. (CA1: Cornu Ammonis 1, CA2: Cornu Ammonis 2, CA3: Cornu Ammonis 3, DG: giro dentato, linea tratteggiata indica il corpo strato di cellule, linea continua indica i limiti strutturali.)
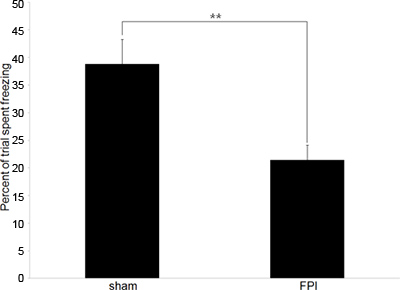
Figura 2. Rappresentante dei dati comportamentali A:. Dati comportamentali che rappresentano la differenza nei tassi di congelamento tra topi cerebrolesi (FPI) e sham comandi azionati (sham) nel paradigma condizionato risposta di paura. La formazione si è verificato l'infortunio giorno 6 ° successivo, con il periodo di prova nel 24 ore più tardi. (** Indica p <.01).

Figura 3. Dati rappresentativi registrazione extracellulare A:. Un esempio di un campo eccitatorio postsinaptico potenziale (fEPSP) registrazione nella zona CA1. La prima deviazione verso il basso è il manufatto stimolo, seguita dalla volley fibra presinaptica e infine il fEPSP. B: ingresso / uscita curva che rappresenta una diminuzione netta efficacia sinaptica in CA1 lesioni seguente percussioni fluido (FPI). C: ingresso / uscita delle curve che rappresentano un incremento netto di efficacia sinaptica in giro dentato (DG) a seguito di FPI. (* Indica p <.05.) Clicca qui per ingrandire la figura .
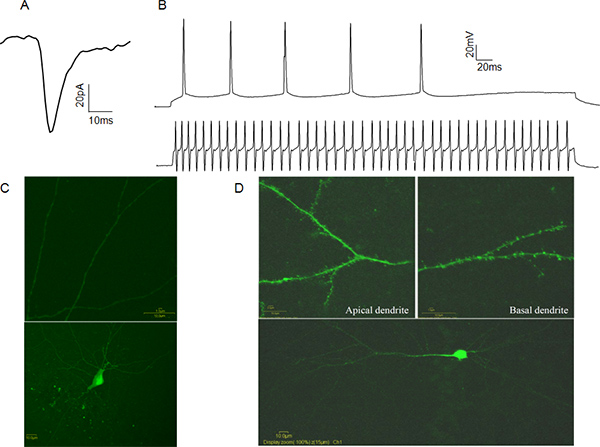
Figura 4. Rappresentativi whole-cell patch-clamp. Dati A: Un esempio spontaneaeccitatori corrente postsinaptica (sEPSC) da una cella CA1 piramidale. B: Esempi di treni potenziale di azione da una cella CA1 piramidale (traccia superiore) e un veloce spiking CA1 interneuroni (traccia inferiore). C: Esempio di un giallo Lucifero riempito CA1 interneurone inibitorio. Si noti l'assenza di spine dendritiche (pannello superiore). D: Esempio di Lucifero giallo riempito CA1 neurone piramidale. Si noti la presenza di spine dendritiche (pannello superiore). Clicca qui per ingrandire la figura .
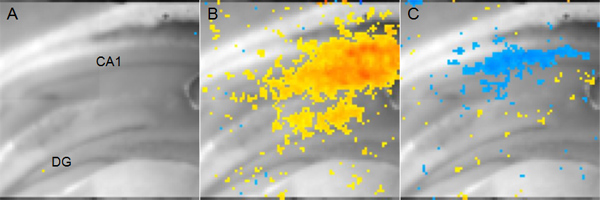
Figura 5. Rappresentante di tensione Dati sensibili Imaging Dye A:. Topo fetta coronale ippocampale visualizzata per mostrare l'anatomia. (DG: giro dentato, CA1: Cornu Ammonis 1) B: giallo per pixel rossi che rappresentano l'attività eccitatoria nella zona CA1 14 msec dopo la stimolazione afferente collaterali Schaffer. Rosso indicates più depolarizzazione mentre il giallo indica una depolarizzazione inferiore, ma comunque significativa. C: pixel blu che rappresentano siti di attività inibitoria nella zona CA1 56 msec dopo la stessa stimolazione afferente garanzia Schaffer in blu scuro B. indica più iperpolarizzazione.
Discussione
Ogni tecnica di cui sopra contribuisce alla maggiore comprensione del meccanismo di fondo che ha causato il deficit osservato comportamentale. Combinando le informazioni uniche acquisite da ciascun metodo siamo in grado di esaminare i meccanismi biologici con più precisione.
FEPSPs di misura è utile per quantificare l'efficacia sinaptica netto di grandi regioni spazialmente definiti di neuroni. E 'anche in grado di fornire informazioni circa la possibilità di un gruppo di cellule ...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Elliot Bourgeois per la sua assistenza tecnica. Questo lavoro è stato finanziato dal National Institutes of concede Salute R01HD059288 e R01NS069629.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome dell'apparecchiatura | Azienda | Numero di catalogo | Commenti (opzionale) |
| Axopatch 200B amplificatore | Molecular Devices | AXOPATCH 200B | Patch-clamp rig |
| Digidata 1322A digitalizzatore | Molecular Devices | Patch-clamp rig | |
| MP-225 micromanipolatore | Sutter | MP-225 | Patch-clamp rig |
| DMLFSA microscopio | Leica | Patch-clamp rig | |
| Multiclamp amplificatore 700B | Molecular Devices | Multiclamp 700B | Multiuso (campo)impianto |
| Digidata 1440 digitalizzatore | Molecular Devices | Multipurpos (campo) rig | |
| MPC-200 micromanipolatore | Sutter | MPC-200 | Multiuso (campo) rig |
| BX51WI microscopio | Olimpo | BX51WI | Multiuso (campo) rig |
| Axoclamp amplificatore 900A | Molecular Devices | Axoclamp 900A | VSD rig |
| Digidata 1322 digitalizzatore | Molecular Devices | VSD rig | |
| Redshirt CCD-SMQ fotocamera | Redshirt | NCS01 | VSD rig |
| VT 1200S vibratomo | Leica | 14048142066 | |
| P-30 Elettrodo estrattore | Sutter | P-30 / P | |
| inibitore della proteasi COMPLETO | Roche | 11697498001 |
Riferimenti
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon