このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
軽度の外傷性脳損傷後の海馬回路機能の改変に関する調査
要約
海馬の回路への機能的な変化を調べるために多面的なアプローチを説明する。電気生理学的手法は、傷害プロトコル、行動試験および地域切開法と共に説明されています。これらの技術の組み合わせは、他の脳領域と科学的な質問のために、同様の方法で適用することができます。
要約
外傷性脳損傷(TBI)を毎年、米国で170万人以上の人々を苦しめている、さらには軽度のTBIの永続的な神経障害を1につながることができます。 TBIの生存者、記憶障害および発作閾値の減少によって経験された二つの広汎化と無効化症状は、TBIの誘発性海馬機能障害2,3によって媒介されると考えられている。海馬回路機能に悪影響マウスにおけるTBIの後の行動にどのように影響するか、変更された実証するために、我々は、横方向の流体のパーカッション·傷害、神経細胞の損失、グリオーシス、およびイオン摂動4を含む人間のTBIの多くの特徴を再現し、TBIの一般的に使用される動物モデルを用いて- 6。
ここでは、TBIの誘発性海馬機能障害を調査するためのコンビナトリアル手法を実証している。我々のアプローチは、分析するために、動物行動学的および生化学的解析と一緒に複数のex vivo生理学的手法を取り入れ海馬におけるポストTBIの変化。我々は、TBI後に認知障害を評価するために、行動分析とともに実験的外傷パラダイムで始まります。細胞外電場電位記録、可視化ホールセルパッチクランプ、電圧感受性色素記録:次に、我々は、3つの別個のex vivoでの記録技術が備わっています。最後に、私たちは、地域のポストTBIの神経化学的および代謝の変化を詳細に分析するのに便利です海馬の部分領域を解剖するための方法を示しています。
これらのメソッドは、TBIの後に海馬回路の変化を調べ、歯状回と海馬のCA1サブ領域( 図1参照)で発生するネットワーク回路機能における対向変化を調べるために用いられてきた。各小領域におけるポストTBIの変化を分析する能力は、TBI誘発性行動と認知dに貢献根本的なメカニズムを理解するために不可欠であるeficits。
ここで概説多面的システムは、捜査官は、疾患状態(TBIのこのケースでは)によって誘発される現象学の過去のキャラをプッシュし、TBIに関連付けられている観測病理の責任のメカニズムを決定することができます。
プロトコル
1。横方向の流体パーカッション傷害
- ケタミンおよびキシラジン与えられた腹腔内の混合物を使用してマウスをAnaesthetize。その後、ヨウ素のスクラブを使って切開するためのマウスの頭を準備します。
- 3ミリメートル(外径)トレパンを使用して、右頭頂領域にわたってクレイニエクトミを実行します。
- cyanoarylateと歯科アクリルを使用してクレイニエクトミ上での安全なルアーlocの針ハブ(直径3ミリメートルの内側)。
- 24時間後、吸入イソフルランを使用してマウスをanaesthetize。
- 一度正常な呼吸が再開しますが、マウスが刺激に敏感になる前に、流体パーカッション傷害デバイスを介して頭蓋骨に生理食塩水を20ミリ秒パルスを実現します。
- 直ちに損傷後、ハブを取り外しイソフルランを使用してマウスをreanaesthetize、頭皮が閉じ縫合。
偽手術対照は、ステップ1.5を省略して同じ手順を受け取ることになります。
2。行動分析 - 恐怖条件Respのオンセ
- エアコン恐怖反応(CFR)の訓練に先立って2日間連続でマウスを扱う。
- 2秒1.5ミリアンペアの床衝撃を投与する前に3分間の空調室に置きマウス。さらに30秒間チャンバ内でマウスを残す。
- 遅延期間(通常24時間)した後、5分間の空調室にマウスを返す。 5秒間隔で凍結を評価する。
分析は、我々の場合、脳障害マウスと偽手術対照では、2つの集団で時間凍結の相対量を比較することで構成されています。低い凝固率(対照と比較して)コンテキストと床衝撃、記憶障害と認知機能障害の指標との関連付けを保持することができないことを示しています。
3。急性海馬スライスの準備
*注意:ベルジャーを用いて麻酔が専用端末の手続き(例えば、本明細書に記載の脳の解剖など)を実装することができます。
- 7日後傷害は、人工脳脊髄液(ACSF)と250ミリリットルのスクロース切削液1Lを作る。
- 脳スライス標本中に使用されるすべての機器やソリューションが氷冷であることを確実にするために自由に氷を使用しています。
- イソフルラン使用してマウスをAnaesthetize。迅速かつ穏やかに蔗糖にマウスや場所から脳を除去します。
- 寒天ブロックの前に瞬間接着剤を一滴で表面を切削のトリム脳と場所。
- 350μmの厚さの冠状スライスをカットすると、そのまま海馬回路で4または5のスライスを得ることができる必要があります。
- 37℃で少なくとも1時間のスライスをインキュベート℃に
4。細胞外電場電位記録
- 垂直プラーを使用して2月5日MΩsにホウケイ酸ガラス電極を引き出します。
- 電極ホルダーの上にチャンバーとインサート電極に置きスライス。
- そのようなperforantパスやシャファー側枝として軸索路でスライスに刺激電極を下げます。低い記録電極位置にその電極が同じzレベル(深さ)であることを確認するために、出力トレースを監視しながら。最大応答は刺激電流レベルを一定に保ち、達成されると、電極が同じzレベルにあります。
- シナプス前線維のボレー、フィールド外シナプス後電位(fEPSP)と、シナプス後の人口スパイク:結果のトレースは、次の3つのコンポーネントから構成されています。コンポーネントは、解析をより困難にする、いくつかの準備時間的に重複してもよい。応答がシナプス前あるいはシナプス後であるかどうかの間に曖昧さがある場合には、APVとCNQXは興奮性伝達をブロックする浴に添加することができ、残りのすべての信号は、シナプス前の起源であろう。
- 入力/出力曲線、対パルス録音、長期可塑性実験:刺激プロトコルは、3つの別個の実験タイプを生成するように異なります。
分析では、一般的に脳障害マウスと偽の両方にまたがっfEPSPの傾きを比較測定で構成されていますファイバーボレーを測定することにより、入力の強さをコントロールし、コントロールを操作する。
5。可視化パッチクランプ記録
- 以前に4.2に移行するまで上記のように記録するようにスライス、電極、およびリグを準備します。
- 表面だけ近い細胞が死んでいるおよび/または接続が低下しているであろうように、組織には80μmより深い細胞を検討してください。それが組織を貫通して下に移動すると、それが詰まるないことを保証するために電極に正圧と細胞に近づく。電極は優しくセルは電極と細胞質膜と 'ギガシール "を作成するために負圧を適用するに触れたとき。
- 電極の下plama膜破裂するために負圧の短いバーストを適用し、全細胞構成を実現。
- アンプを使用して容量トランジェントを除去すると、直列抵抗を補償します。電池の直列抵抗の補償は確保することが不可欠である測定をccurate。
- 単一セルの録音の2つのモードを実行できます:現在のクランプ(測定膜電位)と電圧クランプ(膜中のイオンチャネルに流れる電流を測定する)。
分析の可能なタイプは数多くありますが、我々の場合には主に脳障害マウスや偽手術コントロールの両方での自発的なシナプス電流の速度と大きさを定量化する生物物理学的分析で構成されています。
6。膜電位感受性色素イメージング(VSD)
- 以前に4.2に移行するまで上記のように記録するようにスライスやリグを準備します。
- 50μlのエタノールに1 mgのジ-3 - ANEPPDHQを混合することにより、染料の在庫を準備し、ホイルラップチューブに2μlのアリコートを分配、-20℃で保存ACSFで1:200に希釈することにより、毎日の作業色素溶液を作る。
- ろ紙を湿らACSF上にスライスをインキュベートし、16分間、90μlの染料で染色し、インターフェース録音室でACSFと場所ですすいでください。
- 光stimulatioを調整応答するまでのn個の強度がカメラの範囲の中央にセンタリングされます。画像は、通常、毎秒500〜1,000フレームのレートで集録されています。
- 初期の迅速な退色を安定させるために電気的な刺激の前に光の刺激200ミリ用のトリガーシャッター。電気的に刺激し、非電気的に刺激、非刺激背景の後の減算を許可するようにとの間の代替取得試験。前にシャッターを開くにレコード休息光強度(シャッター閉で蛍光読み取り)。各VSD試験は、蛍光測定値の時間 "映画"ではyのピクセルのxピクセルになります。レコード10 - 各試験条件における12 VSD試験。
- すべての測定は、以下のように計算される画素内プレ電気刺激正規化された蛍光の変化、DF / F、上で実行されます。
VSDの生の取得については、体験版から休憩光強度を引きます。各試験における各画素について、そのための事前の電気刺激の平均値に応じて正規化するトライアル、減算団結。電気刺激と非電気刺激試験の両方に対して、この手順を実行します。非電気刺激試験からの平均的な "バックグラウンド蛍光"トライアルを作成し、電気的に刺激試験から、この背景裁判を引きます。 12そのような試験は、また、通常の信号対雑音比を改善するために空間的にも時間的にフィルタリングされます - それ以上の分析は、典型的には10の平均で実行されます。
7。生化学的解析のための地域の解剖
- 前述のように、マウスから脳を取り出します。
- 組織チョッパーを用いてスライスを準備します。
- 平坦部を置き、地域CA1及びDGを顕微解剖。
- すぐにプロテアーゼ阻害剤を含む溶解緩衝液に浸す。 -80℃で液体窒素や店舗で凍結℃、
8。代表的な結果
我々の実験は、一般的に期待を確認するために行動データで始まる脳障害マウスに存在するED認知赤字。それが信頼であり、唯一の1つのトレーニングセッションと1つのテストセッションを必要とする海馬に依存する動作であるように我々は文脈恐怖条件応答試験を採用しています。 図2に示されたデータは、順行性メモリを測定するための行動試験を表しトレーニングセッションが怪我する前に実行された場合でも、試験も逆行メモリを測定するために使用することができます。
フィールド興奮性シナプス後電位(fEPSPs)は細胞の大集団( 図3A)の純シナプス伝達効率を決定するために測定されています。我々は、一般的に刺激パターン、3つの異なるタイプの、独自の結果と結論を得たそれぞれを採用しています。まず、一連の手順を刺激強度を増加させることにより、我々は、入力/出力曲線( 図3B / C)を作成します。
次に、別の同じ強度の二刺激を提供することにより、。さらに、私たちはしばしば長期増強(LTP)実験を行い、我々はシナプス小胞の放出確率で潜在的な変化を調査する短い遅延(通常50ミリ)によるd。同じ強度でベースライン応答、短い高周波刺激(通常100Hz)の確立した後、通常の刺激を再開したときに増強されたシナプス応答をもたらす細胞内カスケードを引き起こして、配信されます。
ホールセルパッチクランプセルは二つのモードで記録することができますから電気的活動電圧クランプ·モードでは、実験者がアンプに関連付けられたコンピュータソフトウェアを介して、お風呂を参考にパッチクランプ細胞の膜電位を制御します。このケースでは、シナプス後のイベントを仲介する電流は、シナプス前のリリース頻度に関する情報を提供する、アクティブにシナプス後受容体と小胞の神経伝達物質の濃度( 図4A)の数を計上しております。電流クランプモードでの実験注入された電流は、操作し、電圧応答を測定します。これは、このような活動電位の閾値および半値幅として活動電位の特性を決定するのに役立ちます。これらの特性は、それらの活動電位発火パターン( 図4B)に基づいて興奮性または抑制性ニューロンの機能として分類を可能にします。携帯識別情報を検証するために、我々は樹状突起棘の有無で録音後にルシファーイエロー、視覚的に確認したアイデンティティを持つ細胞を充填をお勧めします。 ( 図4C、D)。
膜電位の変化を測定する膜電位感受性色素を用いた実験から得られた結果の一例を図5に示します。このケースでは、刺激電極をシャファー側副路に配置されており、地域CA1における結果のニューロンの活動を解析した。電位感受性色素は膜電位の絶対値を報告するのではなく、トンはありません彼は刺激せずに、ベースラインの状態から電圧に変更します。しかし、2つの条件( 例えば 、脳障害対偽手術)を比較分析はfEPSPsまたは全細胞パッチクランプ記録を用いて測定することができません生理的変化の時空間パラメータを決定するために使用することができます。

図1。海馬の回路図。海馬を通る水平セクション。海馬を通じて主要な経路は、黄色で表示されます。歯状回顆粒細胞の樹状突起とシナプスを形成する歯状回に有孔質路を経由して嗅内皮質プロジェクト内のニューロンからの軸索。彼らはCA3ニューロンの樹状突起とシナプスを形成CA3に苔状線維の経路を介して顆粒細胞の軸索のプロジェクト。 dendritへシャファー側副経路を介してCA3ニューロンプロジェクトの軸索CA1錐体細胞のES。 CA1錐体細胞の軸索は、鉤状回通って海馬から突出。注:また描かは采を経由して反対側の海馬に投射する錐体細胞の軸索側枝である。 (CA1:アンモン角1、CA2:アンモン角2、CA3:アンモン角3、DG:海馬歯状回、破線は細胞体層を示し、実線は構造境界を示しています。)
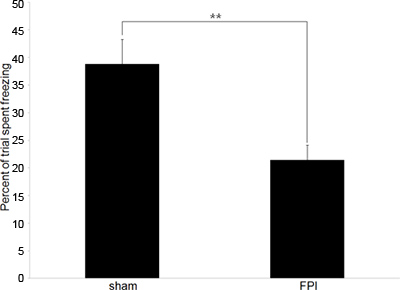
図2。代表的な行動データ:恐怖条件応答パラダイムにおける脳障害マウス間凍結速度(FPI)と偽手術対照(偽)の差を描いた行動データ。訓練は後24時間に発生するテスト期間で、6日目 、次の傷害発生しました。 (**はp <0.01)。
図3。代表的な細胞外記録データ:フィールド興奮性シナプス後電位(fEPSP)領域CA1における記録の一例を示している。第一下方への撓みは、シナプス前線維のボレー、最後にfEPSP続く刺激アーチファクトです。 B:入力/出力曲線CA1以下の流体パーカッション傷害における正味のシナプス伝達効率(FPI)の減少を示した。 C:入力/出力曲線FPIは以下の海馬歯状回における正味のシナプス伝達効率の増加(DG)を描いた。 (*はp <0.05)。 拡大図を表示するには、ここをクリックしてください 。
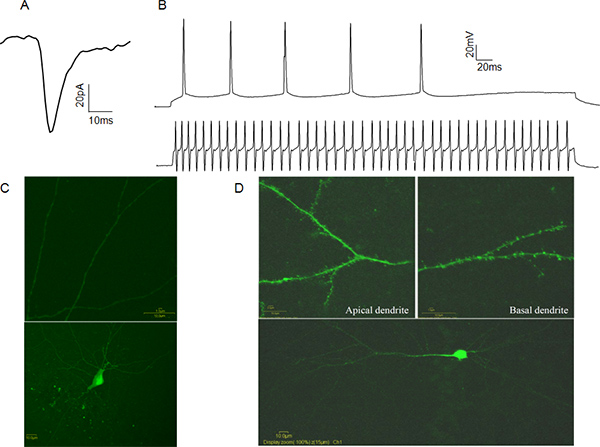
図4。代表的な全細胞パッチクランプデータ:自発例CA1錐体細胞からシナプス後電流(sEPSC)を興奮。 B:CA1錐体細胞(上のトレース)と高速スパイクCA1介在ニューロン(下のトレース)から活動電位列車の例。 C:ルシファーイエロー埋めCA1の抑制性介在の例。樹状突起棘(上のパネル)が存在しないことを注意してください。 D:ルシファーイエローの例では、CA1錐体細胞を埋め尽くした。樹状突起棘(上部パネル)の存在に注意してください。 拡大図を表示するには、ここをクリックしてください 。
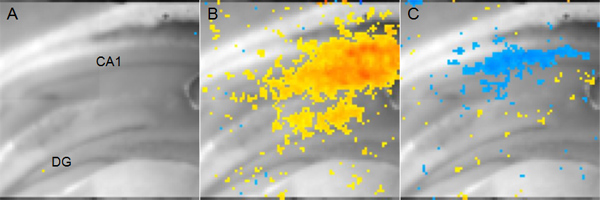
図5。代表的な膜電位感受性色素イメージングデータ:解剖学的構造を示すために表示マウス冠状海馬スライス。 (DG:歯状回、CA1:アンモン角1)B:求心シャファー担保刺激後14ミリ秒CA1領域における興奮性活動を表す赤色の画素にイエロー。で赤黄色は低いが、それでもかなりの脱分極を示しながら、より脱分極をdicates。 C:Bの濃い青で示したものと同じ求心シャファー担保刺激がより過分極を示した後は、CA1領域56ミリ秒で阻害活性の部位を表すブルーピクセル。
ディスカッション
上記の各手法は、観測された行動の赤字の原因となっているメカニズムのより深い理解に貢献しています。それぞれの方法から得られた固有の情報を組み合わせることにより、我々はより精度の生物学的メカニズムを調べることができます。
測定fEPSPsは、ニューロンの大規模な、空間的に定義された領域の正味のシナプス伝達効率を定量化するために有用である。また?...
開示事項
特別な利害関係は宣言されません。
謝辞
作者は彼の技術支援のためにブルジョワエリオットに感謝したいと思います。この作品は、健康助成R01HD059288とR01NS069629の国立研究所によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 機器の名称 | 会社 | カタログ番号 | コメント(オプション) |
| Axopatch 200Bアンプ | 分子デバイス | AXOPATCH 200B | パッチクランプリグ |
| Digidata 1322Aデジタイザ | 分子デバイス | パッチクランプリグ | |
| MP-225マニピュレーター | サッター | MP-225 | パッチクランプリグ |
| DMLFSA顕微鏡 | ライカ | パッチクランプリグ | |
| 700BアンプをMulticlamp | 分子デバイス | MULTICLAMP 700B | 多目的(フィールド)リグ |
| Digidata 1440デジタイザ | 分子デバイス | Multipurpos(フィールド)リグ | |
| MPC-200マニピュレーター | サッター | MPC-200 | 多目的(フィールド)リグ |
| BX51WI顕微鏡 | オリンポス | BX51WI | 多目的(フィールド)リグ |
| 900AアンプをAxoclamp | 分子デバイス | AXOCLAMP 900A | VSDのリグ |
| Digidata 1322デジタイザ | 分子デバイス | VSDのリグ | |
| 留年選手CCD-SMQカメラ | 留年選手 | NCS01 | VSDのリグ |
| バーモント1200Sビブラトーム | ライカ | 14048142066 | |
| P-30電極プラー | サッター | P-30 / P | |
| 完全プロテアーゼ阻害剤 | ロッシュ | 11697498001 |
参考文献
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved