Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Исследования О внесении изменений гиппокампа Функция Circuit после легкой черепно-мозговой травмой
В этой статье
Резюме
Многогранный подход к изучению функциональных изменений в гиппокампе схемы объясняется. Электрофизиологические методы описаны наряду с травмой протокол, поведенческие тестирование и региональных метод рассечения. Сочетание этих методов могут быть применены аналогично для других регионов мозга и научные вопросы.
Аннотация
Черепно-мозговой травмы (ЧМТ) страдают более 1,7 миллионов человек в Соединенных Штатах каждый год и даже легкой ЧМТ может привести к стойким неврологическим нарушениями 1. Два распространенных и отключение симптомы, наблюдаемые у TBI оставшихся в живых, нарушения памяти и снижение судорожного порога, как полагают, быть опосредованы TBI-индуцированной дисфункции гиппокампа 2,3. Для того, чтобы продемонстрировать, как измененная функция гиппокампа цепи отрицательно сказывается на поведении после ЧМТ у мышей, мы используем боковые травмы перкуссия жидкостью, обычно используются модели животных TBI, которая воссоздает многие черты человека TBI, включая потерю нейронов клетки, глиоза и ионной возмущения 4 - 6.
Здесь мы показываем, комбинаторный метод исследования TBI-индуцированной дисфункции гиппокампа. Наш подход включает в себя несколько бывших естественных физиологических методов совместно с поведением животных и биохимический анализ, с целью анализапост-ЧМТ изменения в гиппокампе. Начнем с экспериментальной парадигмы травмы наряду с поведенческого анализа для оценки когнитивных инвалидности после ЧМТ. Далее, есть три отдельных бывших естественных методов записи: внеклеточный потенциал поля записи, визуализировал цельноклеточной патч-зажима, и напряжение чувствительных записи красителя. Наконец, мы демонстрируем метод рассечения региональном субрегионов гиппокампа, которая может быть полезна для детального анализа нейрохимические и метаболические изменения пост-ЧМТ.
Эти методы были использованы для изучения изменений в гиппокампе схемы после ЧМТ и прощупать противоположных изменений в сетевую функцию схемы, которые происходят в зубчатой извилине и субрегионов CA1 гиппокампа (см. Рисунок 1). Способность анализировать пост-ЧМТ изменений в каждом субрегионе имеет важное значение для понимания основных механизмов, способствующих TBI-индуцированной поведенческих и когнитивных гeficits.
Многогранной системой, изложенные здесь, позволяет следователям пройти мимо характеристика феноменологии индуцированных болезненного состояния (в данном случае ЧМТ) и определить механизмы, ответственные за наблюдаемые патологии, связанной с ЧМТ.
протокол
1. Боковая травма ударных Fluid
- Анестезию мыши с использованием смеси кетамина и ксилазина внутрибрюшинно. Затем подготовить голове мыши для разреза использованием йода скраб.
- Выполните удаление фрагментов костей черепа над правой теменной области с использованием 3 мм (наружный диаметр) трепаном.
- Безопасность Luer-Loc иглы (внутренний диаметр 3 мм) по сравнению с использованием cyanoarylate удаление фрагментов костей черепа и зубного акрила.
- 24 часов спустя, анестезию мыши, используя изофлурана при вдыхании.
- Как только восстанавливается нормальное дыхание, но прежде, чем мышь становится чувствительной к стимуляции, доставить 20 мс импульс засоленных в череп через жидкость устройство травмы перкуссия.
- Сразу после травмы удалить хаб, reanaesthetize мыши, используя изофлуран, и шовный головы закрыты.
Ложнооперированных управления будут получать такую же процедуру с шагом 1,5 опущены.
2. Поведенческий анализ - условные Респ страхаOnse
- Ручка мышей в течение двух последовательных дней до условного рефлекса страха (CFR) обучения.
- Место мышь в камере кондиционирования в течение 3 мин перед введением 1,5 мА этаже шок на 2 сек. Оставьте мышь в камере в течение 30 сек.
- После периода задержки (обычно 24 часов), возвращение мыши, чтобы камера кондиционирования в течение 5 мин. Оценка замораживании на 5-секундными интервалами.
Анализ заключается в сравнении относительного количества времени замораживания в двух популяциях, в нашем случае с поражением мозга мышей и ложнооперированных управления. Нижняя замораживание цены (по сравнению с контролем) указывают на неспособность сохранить связь между контекстом и пол шок, указание ухудшение памяти и когнитивной дисфункции.
3. Подготовка Острый срезов гиппокампа
* Примечание: обезболивание использованием Bell Jar могут быть реализованы только для терминала процедур (таких как мозг рассечение описано здесь).
- 7 дней послетравм, сделать 1 л искусственной спинномозговой жидкости (ACSF) и 250 мл сахарозы резки решение.
- Используйте лед свободно, чтобы убедиться, что все документы и решения, используемые при подготовке срез мозга являются ледяной.
- Анестезию мыши, используя изофлурана. Быстро и аккуратно удалить из мозга мышей и место в сахарозу.
- Комплектация мозга и место на режущей поверхности по капле суперклея перед агар блока.
- Вырезать 350 мкм корональные срезы, вы должны быть в состоянии получить 4 или 5 ломтиков с интактной цепи гиппокампа.
- Инкубировать ломтиками, по крайней мере 1 час при температуре 37 ° C.
4. Внеклеточной записи потенциального поля
- Потяните боросиликатного стеклянные электроды до 2-5 MΩs с использованием вертикальных съемника.
- Место среза в камере и вставить электрод в держатель электрода.
- Нижняя стимулирующий электрод в ломтик в аксональной тракта, такие как перфорантных пути или Шаффер залогов. Нижняя записи электродав этом положении в то время как следы контроля выходной, чтобы электроды в то же Z-уровня (глубины). При максимальной реакции достигается, проведение стимуляции нынешнем уровне постоянно, электроды находятся на том же Z-уровня.
- Полученные след состоит из трех компонентов: пресинаптического залпа волокна, поле внеклеточных постсинаптического потенциала (fEPSP) и постсинаптические шипованные населения. Компоненты могут перекрываться временно в некоторых препаратов, что делает анализ более сложным. Если есть неоднозначность между ли ответы пресинаптического или постсинаптического, APV и CNQX можно добавить в ванну, чтобы блокировать возбуждающие передач, а все остальные сигналы будут пресинаптического происхождения.
- Протоколы стимуляции зависят производить три различных типа экспериментов: вход / выход кривые, в паре записи пульса и долгосрочных экспериментов пластичность.
Анализ обычно состоит из измерений сравнения наклон fEPSP на обоих поражением мозга мышей и мнимоеРаботающий контроля, контроля за входом силы путем измерения волоконно залп.
5. Визуализация Patch-зажим записи
- Подготовка ломтиками, электродов и установки для записи, как описано выше, до шага 4.2.
- Только учтите, клетки глубже, чем 80 мкм в ткани и клетки ближе к поверхности будет мертв и / или сократили подключения. Подойдите к клетке с положительным давлением на электрод, чтобы убедиться, что он не забиваются, как она движется вниз через ткань. Когда электрод осторожно прикасается к ячейке применяется отрицательное давление для того, чтобы создать "gigaseal» между электродом и мембраной плазмы.
- Применить короткими очередями отрицательное давление для того, чтобы привести к разрыву мембраны Плама под электродом и достижения цельноклеточной конфигурации.
- Ликвидация емкости переходных использованием усилителя и компенсации последовательное сопротивление. Компенсация последовательное сопротивление ячейки необходимо обеспечитьccurate измерений.
- Два режима записи одной клетке могут быть выполнены: токовые клещи (измерение напряжения мембрана) и напряжения зажимом (измерение тока, проходящего через ионные каналы в мембране).
Возможные виды анализа множество, но в нашем случае в основном состоят из биофизического анализа количественного скорость и размер спонтанные синаптические токи в обоих поражением мозга мышей и ложнооперированных управления.
6. Напряжение чувствительной краски Imaging (VSD)
- Подготовка ломтиками и установки для записи, как описано выше, до шага 4.2.
- Подготовить запас красителя путем смешивания 1 мг ди-3-ANEPPDHQ в 50 мкл этанола; обойтись 2 мкл аликвоты в фольге труб, хранить при -20 ° C. Сделать рабочего раствора красителя ежедневно, путем разбавления 1:200 в ACSF.
- Инкубируйте срез на ACSF смоченной фильтровальной бумаги и пятно с 90 мкл красителя в течение 16 минут, промыть ACSF и места в интерфейсе камеры записи.
- Регулировка света stimulatioп интенсивностью до ответа сосредоточена в середине диапазона камеры. Изображения, как правило, приобретенные в размере 500-1000 кадров в секунду.
- Триггера затвора для световой стимуляции 200 мс до электрической стимуляции, чтобы начальные быстрые фотообесцвечивания стабилизироваться. Альтернативные испытания приобретения между электрически стимулировать, и не электрической стимуляции, чтобы позже вычитание нестимулированных фоне. Запись отдыха интенсивности света (флуоресценция чтении затвор закрыт) до открытия затвора. Каждый VSD суд будет х пикселей, пиксели у по времени "фильм" флуоресценции показания. Запись 10 - 12 VSD испытаний, в каждом тесте состоянии.
- Все измерения проводятся на внутри-пиксель предварительного электрического стимула нормированной флуоресценции изменения, дР / F, который рассчитывается следующим образом:
Вычтите отдыха интенсивность света от VSD сырья приобрела суда. Для каждого пикселя в каждом испытании, нормализовать в соответствии с предварительно электрическим стимулом среднее значение для этогосуд, и вычитая единицу. Сделайте это для электрической стимуляции и не стимулировали электрическим испытаниям. Создать средний "фоновой флуоресценции« проб от не-электрической стимуляции испытания, и вычесть из этого суда от электрической стимуляции испытаний. Дальнейший анализ обычно выполняется в среднем на 10 - 12 таких испытаний, которые также обычно фильтруется в пространстве и времени, чтобы улучшить отношение сигнал-шум.
7. Региональные вскрытия биохимической Анализы
- Удалить мозга от мыши, как описано выше.
- Подготовка срезов при использовании тканей вертолет.
- Положите раздел квартиру, microdissect области CA1 и DG.
- Немедленно погрузите в лизис буфера, содержащего ингибитор протеазы. Замораживание в жидком азоте и хранят при температуре -80 ° C.
8. Представитель Результаты
Наши эксперименты обычно начинаются с поведенческими данными для подтверждения ожидатьред когнитивных дефицитов, которые существуют в мозге мышей-мозговой травмой. Мы используем контекстной кондиционером тестирование реакции страха, так как это гиппокампа зависимого поведения, что является надежным и требует только одной тренировке и одной тестовой сессии. Данные показано на рисунке 2 представляет собой поведенческий тестирования для измерения антероградной памяти, однако, тест также может быть использован для измерения ретроградной памяти, если тренировка проводится до травмы.
Поле возбуждающих постсинаптических потенциалов (fEPSPs) измеряется для определения чистой синаптической эффективности большого числа клеток (рис. 3А). Мы обычно используют три различных типа стимуляции моделей, каждая предоставляя свои результаты и выводы. Во-первых, за счет увеличения интенсивности стимуляции через ряд шагов, мы создаем ввода / вывода кривой (рис. 3B / C).
Далее, в силу поставку двух стимуляции той же интенсивностью, отдельныед к небольшой задержки (обычно 50 мс) мы исследуем потенциальные изменения в синаптических везикул вероятность выпуска;. Кроме того, мы часто выполняют долгосрочное потенцирование (LTP) экспериментов. После установления базового ответ, кратко высокие частоты стимуляции (обычно 100 Гц) при той же интенсивности поставляется, вызывая каскад внутриклеточных, что приводит к потенцированные синаптического ответа, когда нормальная стимуляция возобновляется.
Электрическая активность целых клеток патч-зажат клетки могут быть записаны в двух режимах. В режиме напряжения зажима, экспериментатор контролирует мембранные напряжения патч-зажат ячейки по отношению к ванне, с помощью компьютерных программ, связанных с усилителем. В этом случае токи посреднические постсинаптических события регистрируются, предоставляя информацию о пресинаптических частота выпуска, количество постсинаптические рецепторы активируются и везикулярного концентрации нейромедиаторов (рис. 4а). В текущем режиме зажим экспериментаторманипулирует вводят тока и измеряет напряжение ответа. Это может быть полезно для определения характеристик потенциала действия, такие как действия пороговый потенциал и половинной ширины. Эти характеристики позволяют функциональной классификации нейронов, возбуждающих или тормозных основе их действия потенциальных моделей стрельбы (рис. 4В). Для того, чтобы проверить идентичность сотовой мы рекомендуем заполнения ячеек с Люцифером Желтые после записи и визуально подтверждающий личность, наличие или отсутствие дендритных шипиков. (Рис. 4С, D).
Пример результатов эксперимента с использованием напряжения чувствительных красителей для измерения изменений в мембранных напряжений изображена на рисунке 5. В этом случае, стимулирующий электрод был помещен в пути обеспечения Шаффер и в результате активности нейронов в области CA1 анализируется. Напряжение чувствительных красителей не сообщает абсолютных значений мембранного напряжения, а тОн изменение напряжения от исходного состояния без стимуляции. Тем не менее, анализ сравнения двух условий (например, мозга пострадавший против ложнооперированных) может быть использован для определения пространственно-временных параметров физиологических изменений, которые не могут быть измерены с помощью fEPSPs или целых клеток патч-зажим записи.

Рисунок 1. Гиппокампа схеме. Горизонтальное сечение через гиппокамп. Основными путями через гиппокамп показаны желтым цветом. Аксоны от нейронов в коре энторинальной проекта через перфорантных путь в зубчатой извилине формирования синапсов с дендритами клеток зубчатой извилины гранул. ЗК аксонов проекта через мшистые пути волокна к CA3, где они образуют синапсы с дендритами СА3 нейроны. Аксоны нейронов CA3 проекта через пути обеспечения Schaffer на Dendritх годов CA1 пирамидальных клеток. Аксонов пирамидальных клеток CA1 проект из гиппокампа через подлежащая ткань. Примечание: Также изображен являются CA3 пирамидальные клетки аксона залогов проектирования до противоположной гиппокампе через бахромкой. (CA1: Корню Ammonis 1, CA2: Корню Ammonis 2, CA3: Корню Ammonis 3, Д. Г.: зубчатой извилине, пунктирная линия указывает слой клеток тела, сплошная линия указывает структурных границ).
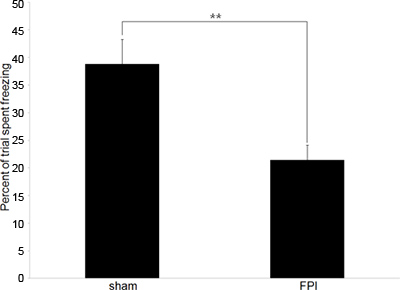
Рисунок 2. Представитель поведенческих данных. Поведенческие данные изображающий разницу в замораживании тарифов с поражением мозга мышей (FPI) и ложнооперированных управления (обман) в условных парадигмы реакцию страха. Обучение происходит на 6-й день после травмы, с тестового периода происходит 24 часа в сутки позже. (** Обозначает р <0,01).

Рисунок 3. Представитель внеклеточной записи данных. Пример поля возбуждающих постсинаптических потенциалов (fEPSP) запись в области CA1. Первое отклонение вниз является стимулом артефакт, за которым следуют пресинаптического залпа волокна и, наконец, fEPSP. B: вход / выход кривые изображающие снижение чистой синаптической эффективности в CA1 после травмы перкуссия жидкости (FPI). C: вход / выход кривые изображающие увеличение чистой синаптической эффективности в зубчатой извилине (DG) после FPI. (* Означает р <0,05). Нажмите, чтобы увеличить показатель .
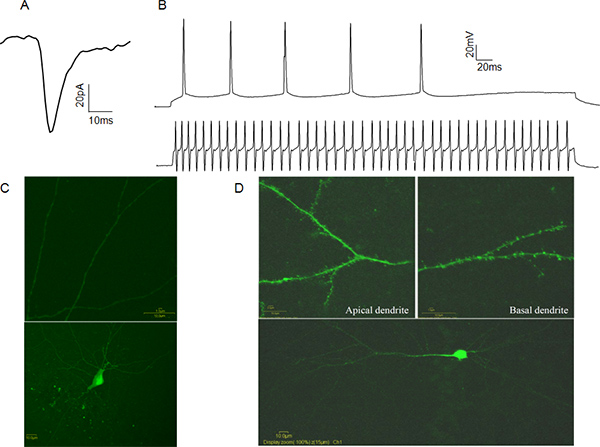
Рисунок 4. Представитель Цельноклеточная Patch-зажим данных. Пример спонтаннойвозбуждающих постсинаптических током (sEPSC) от CA1 пирамидальных клеток. B: Примеры потенциал действия поездов из CA1 пирамидальных клеток (верхний луч) и быстро пики CA1 интернейронов (нижний луч). C: Пример Люцифер желтый заполнены CA1 ингибирующее интернейронов. Обратите внимание на отсутствие дендритных шипиков (верхняя панель). D: Пример Люцифер желтый заполнены CA1 пирамидальных нейронов. Обратите внимание на наличие дендритных шипиков (верхняя панель). Нажмите, чтобы увеличить показатель .
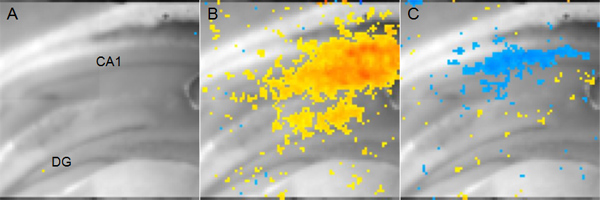
Рисунок 5. Представитель напряжения чувствительной краска данных изображений. Мыши корональной гиппокампа ломтик отображается, чтобы показать анатомию. (DG: зубчатой извилине, CA1: Корню Ammonis 1) B: от желтого до красного пикселов, представляющие возбуждающие деятельность в области CA1 14 мсек после афферентной стимуляции обеспечения Шаффер. Красные вdicates более деполяризации в то время как желтый цвет означает более низкий, но все же значительная деполяризация. C: синие пиксели, представляющих сайтов ингибирующей активности в области CA1 56 мс после того же афферентного обеспечения Шаффер стимуляции показаны синим цветом темнее B. указывает на более гиперполяризации.
Обсуждение
Каждый метод изложенных выше вносит свой вклад в более глубокое понимание основной причиной, приводящей к наблюдаемым поведенческим дефицитом. Сочетание уникальных информацию, полученную от каждого метода мы можем исследовать биологические механизмы, с большей точностью.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Эллиот Буржуазные за техническую помощь. Эта работа финансировалась Национальным институтом здоровья гранты R01HD059288 и R01NS069629.
Материалы
| Name | Company | Catalog Number | Comments |
| Наименование оборудования | Компания | Номер в каталоге | Комментарии (по желанию) |
| Axopatch 200B Усилитель | Molecular Devices | Axopatch 200B | Patch-зажим установка |
| Digidata 1322A дигитайзер | Molecular Devices | Patch-зажим установка | |
| MP-225 микроманипулятора | Sutter | MP-225 | Patch-зажим установка |
| DMLFSA микроскопом | Leica | Patch-зажим установка | |
| Multiclamp 700B Усилитель | Molecular Devices | MULTICLAMP 700B | Многоцелевой (поле)установка |
| Digidata 1440 дигитайзер | Molecular Devices | Multipurpos (поле) установка | |
| MPC-200 микроманипулятора | Sutter | MPC-200 | Многоцелевой (поле) установка |
| BX51WI микроскопом | Олимп | BX51WI | Многоцелевой (поле) установка |
| Axoclamp 900A Усилитель | Molecular Devices | Axoclamp 900A | VSD установки |
| Digidata 1322 дигитайзер | Molecular Devices | VSD установки | |
| Редшерт CCD-камера СМК | Редшерт | NCS01 | VSD установки |
| VT 1200S Vibratome | Leica | 14048142066 | |
| P-30 электрод съемник | Sutter | P-30 / P | |
| полный ингибитор протеазы | Roche | 11697498001 |
Ссылки
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены