Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hafif Travmatik Beyin Hasarı takiben Hipokampal Devre İşlev değişimler üzerine araştırmalar
Bu Makalede
Özet
Hipokampal devresinde fonksiyonel değişikliklerin araştırıldığı A çok yönlü bir yaklaşım açıklanmıştır. Elektrofizyolojik teknikler hasar protokol, davranışsal testleri ve bölgesel diseksiyon yöntem ile birlikte tarif edilmiştir. Bu tekniklerin kombinasyonu diğer beyin bölgeleri ve bilimsel sorular için benzer bir şekilde uygulanabilir.
Özet
Travmatik Beyin Hasarı (TBI) her yıl Amerika Birleşik Devletleri fazla 1,7 milyon kişi afflicts ve hatta hafif TBH kalıcı nörolojik bozuklukları 1 yol açabilir. TBI kurtulanlar, bellek kusuru ve nöbet eşiğinin bir azalma yaşadığı iki yaygın ve devre dışı bırakma belirtileri, TBI bağlı hipokampal disfonksiyon 2,3 aracılık düşünülmektedir. Hipokampal devresi fonksiyonu olumsuz farelerde TBH sonrası davranışını nasıl etkilediğini değişmiş göstermek için, biz yanal sıvı perküsyon yaralanma, nöronal hücre kaybı, gliozis ve iyonik pertürbasyon 4 dahil olmak üzere insan TBI birçok özelliği yeniden TBI yaygın olarak kullanılan bir hayvan modeli istihdam - 6.
Burada TBI bağlı hipokampal disfonksiyonunun araştırılmasında bir Kombinatoryal yöntem gösterilmektedir. Bizim yaklaşımımız analiz etmek amacıyla, hayvan davranışları ve biyokimyasal analiz ile birlikte birden ex vivo fizyolojik teknikleri içermektedirhipokampusta sonrası TBI değişir. Biz TBH sonrası zihinsel özürlü değerlendirmek için davranışsal analiz ile birlikte deneysel yaralanma paradigma ile başlar. Tam hücreli patch-klemp görselleştirilmiş ekstraselüler alanda potansiyel kayıt, ve voltaj duyarlı boya Kaydı: Sonra, biz üç farklı ex vivo kayıt teknikleri bulunmaktadır. Son olarak, bölgesel olarak nörokimyasal ve metabolik değişimler sonrası TBI ayrıntılı analiz için yararlı olabilir hipokampusun alt-bölgeler kesme için bir yöntem göstermektedir.
Bu yöntemler TBI sonrası hipokampal devresinde değişiklikleri incelemek ve dentat girus ve hipokampus CA1 alt bölgelerini (bkz. Şekil 1) meydana şebeke devresi fonksiyon karşıt değişiklikleri araştırmak için kullanılmıştır. Her subregion sonrası TBI değişiklikleri analiz yeteneği TBI bağlı davranışsal ve bilişsel d katkıda yatan mekanizmaları anlamak için esastıreficits.
Burada özetlenen çok yönlü sistem araştırmacılar bir hastalık durumu (TBI bu durumda) tarafından uyarılan fenomenoloji geçmiş karakterizasyonu itin ve TBH ile ilişkili gözlenen patoloji sorumlu mekanizmaları belirlemenize olanak sağlar.
Protokol
1. Yanal Akışkan Perküsyon Sakatlık
- Ketamin ve ksilazin verilen intraperitoneal bir karışımını kullanarak fare Anesteziyoloji. Sonra bir iyot fırçalayın kullanarak kesi için farenin kafasını hazırlamak.
- 3 mm (dış çap) trepan kullanarak sağ parietal alan üzerinde kraniektomi gerçekleştirin.
- Cyanoarylate ve diş akrilik kullanarak kranyektomi üzerinden Güvenli Luer-loc iğne hub (çapı 3 mm içinde).
- 24 saat sonra, inhalasyon yolu ile izofluran kullanılarak fare narkoz.
- Sonra normal nefes özgeçmiş, ancak fare uyarılması duyarlı hale gelmeden önce, sıvı perküsyon yaralanma cihazı ile kafatasının içine salin 20 msn darbe sunmak.
- Hemen yaralanma sonrası, göbek çıkarmak izofluran kullanılarak fare reanaesthetize, ve kafa derisi kapalı dikiş.
Sham kontrol adım 1.5 ihmal ile özdeş bir prosedürü alacaksınız.
2. Davranış Analizi - Conditioned Korku Response
- Klimalı korku tepkisi (CFR) antrenman öncesinde iki gün üst üste fareler taşıyınız.
- 2 sn için 1,5 mA katta şok uygulamadan önce 3 dakika süreyle klima odasında Yeri fare. Ek bir 30 saniye odasında fare bırakın.
- Gecikme süresi (genellikle 24 saat) sonra, 5 dakika süreyle klima odasına fare dönün. 5 saniye aralıklarla donma değerlendirin.
Analiz Olgumuzda beyin hasarlı fareler ve sham kontrol, iki popülasyonlarında zaman donma göreceli miktarı karşılaştırarak oluşur. Alt dondurma oranları (kontrol ile karşılaştırıldığında) bağlam ve zemin şok, hafıza bozukluğu ve bilişsel işlev bozukluğunun bir göstergesi arasındaki ilişkiyi korumak için yetersizlik göstermektedir.
3. Akut Hipokampal Dilim hazırlanması
* Not: Bell Jar kullanarak anestezisi sadece terminal prosedürleri (örneğin burada anlatılan beyin diseksiyon gibi) için uygulanabilir.
- 7 gün sonrayaralanma, yapay beyin omurilik sıvısı (aCSF) ve 250 ml sükroz kesim solüsyonu 1 L olun.
- Beyin dilim hazırlanması sırasında kullanılan tüm alet ve çözümleri buz soğuk olduğundan emin olmak için bolca buz kullanın.
- Izofluran kullanarak fare Anesteziyoloji. Hızlı ve yavaşça sukroz fare ve yerden beyin çıkarın.
- Agar blok önünde superglue bir damla yüzey kesme Trim beyin ve yer.
- 350 mikron kalınlığında koronal dilim kes, seni sağlam hipokampal devresi ile 4 veya 5 dilim almak mümkün olmalıdır.
- 37, en az 1 saat boyunca inkübe dilim ° C.
4. Ekstrasellüler Saha Potansiyeli Kaydı
- Dikey çektirmenin kullanarak 2-5 MΩs için borosilikat cam elektrotlar çekin.
- Elektrot tutucu üzerine kamara ve insert elektrot Yeri dilim.
- Böyle perforant yolu veya Schaffer teminat olarak aksonal yollarında dilimde uyarıcı elektrot indirin. Alt kayıt elektroduçıkışının izleri elektrotları aynı z-seviyesi (derinlik) altında olduğu sağlamak için ise yerleştir. Maksimal bir yanıt uyarım geçerli seviyesini sabit tutarak, elde edildiğinde, elektrotlar aynı z-düzeydedir.
- Presinaptik lif voleybolu, hücre dışı alan postsinaptik potansiyeller (fEPSP) ve postsinaptik nüfus başak: Elde edilen iz üç bileşenden oluşur. Bileşenler analizi daha zor yapma, bazı hazırlıkları zamansal çakışabilir. Yanıtları presinaptik veya postsinaptik olup arasında belirsizlik varsa, APV ve CNQX eksitatör iletimi bloke banyoya ilave edilebilir ve geri kalan bütün sinyallerin presinaptik kökenli olacaktır.
- Giriş / çıkış eğrileri, paired pulse kayıtları ve uzun vadeli plastisite deneyler: Uyarım protokolleri üç farklı deney çeşitleri üretmek için değişir.
Analiz genellikle beyin hasarlı fareler ve sham hem genelinde fEPSP eğimi karşılaştırarak ölçümünden oluşanLif voleybolu ölçerek girişi güç için kontrol, denetim-işletilmektedir.
5. Görüntülenmiştir Patch-clamp Kaydı
- Daha önce 4.2 adıma yukarıda anlatıldığı gibi kayıt dilimleri, elektrotlar ve teçhizat hazırlayın.
- Sadece yüzeye yakın hücreleri gibi doku içine hücreleri daha derine 80 mikron düşünebilirsiniz ölü ve / olacaktır veya bağlantı azaltmıştır. Bu doku boyunca aşağı hareket olarak tıkanmış almaz emin olmak için elektrot üzerinde pozitif basınç ile bir hücre yaklaşın. Elektrot yavaşça hücre elektrot ve plazma zar arasında bir 'gigaseal' oluşturmak için negatif basınç uygulamak değdiğinde.
- Elektrodu altında Plama membran rüptürü için negatif basınç öbekler uygulayın ve tam hücreli yapılandırma elde.
- Amplifikatör kullanarak kapasitans geçici eleyin ve seri direnç telafi. Hücre dizisi direncini dengeleyerek bir sağlamak için gereklidirölçümleri ccurate.
- Tek hücre kayıtları iki modları yapılabilir: akım pensi (ölçüm membran gerilimi) ve gerilim kelepçe (zarında iyon kanalları geçen akıma ölçüm).
Analiz Olası türleri çoktur ama bizim durumumuzda çoğunlukla beyin hasarlı fareler ve sham kontrol hem de spontan sinaptik akımların hızı ve boyutu miktarının biyofiziksel analiz oluşur.
6. Gerilim Hassas Boya Görüntüleme (VSD)
- Daha önce 4.2 adıma yukarıda anlatıldığı gibi kayıt dilimleri ve teçhizat hazırlayın.
- 50 ul etanol içine 1 mg di-3-ANEPPDHQ karıştırılarak boya stok hazırlayın; folyo sarılı tüpler, -20 ° C'de depoya 2 ul alikotları dağıtmak ACSF yılında 1:200 sulandırarak, günlük boya çözeltisi çalışıyor olun.
- Filtre kağıdı nemlendirilmiş aCSF üzerine dilim inkübe edin ve 16 dakika boyunca boya 90 ul leke; arabirim kayıt odasında aCSF ve yer ile durulayın.
- Işık stimulatio ayarlayıncevabı kadar n yoğunluğu kamera aralık ortasında ortalanır. Görüntü tipik olarak saniyede 500-1,000 kare oranında elde edilir.
- Başlangıçta hızlı photobleaching stabilize etmek için izin vermek için elektriksel stimülasyon önce hafif stimülasyon 200 msn için Tetikleme deklanşör. Elektrikle arasında gidip satın çalışmalarda sigara uyarılan arka plan daha sonra çıkarma izin, teşvik, ve non-elektriksel olarak uyarıldı. Öncesinde deklanşör açılış Rekor dinlenme ışık yoğunluğu (deklanşör kapalı olan floresans okuma). Her VSD deneme floresans ölçümlerinin zaman "film", y piksel bir x piksel olacak. Record 10 - Her bir test koşulu 12 VSD denemeler.
- Tüm ölçümler içi piksel ön-elektrik-uyaran normalize floresan değişimi gerçekleştirilir, gibi hesaplanır dF / F, aşağıdaki gibidir:
VSD ham edinilen deneme dinlenme ışık yoğunluğunu çıkarın. Her denemede her piksel için, bunun için ön-elektrik-uyarana ortalama değerine göre normalizedeneme ve birlik çıkarılarak. Elektrikle uyarılmış ve non-elektrikle uyarılmış çalışmalar için bunu yapın. Olmayan elektriksel olarak uyarıldı çalışmalarda ortalama bir "arka plan floresan" deneme oluşturun ve elektrikle uyarılmış çalışmalarda bu arka plan deneme çıkarma. 12. Bu tür deneyler, aynı zamanda, genellikle alan ve gürültü oranını geliştirmek sinyali için zaman içinde süzülmüş - daha fazla analiz tipik olarak 10 arasında ortalama gerçekleştirilir.
7. Biyokimyasal analizler için Bölgesel Diseksiyonlarında
- Daha önce tarif edildiği gibi fare beyin çıkarın.
- Doku kıyıcı kullanarak dilimleri hazırlayın.
- Bölümü düz Lay, bölge CA1 ve DG microdissect.
- Lizis tamponu içeren proteaz inhibitörü hemen batırmayın. -80 Sıvı azot ve mağaza içinde dondurun ° C.
8. Temsilcisi Sonuçlar
Bizim deneyler genellikle bekliyoruz onaylamak için davranışsal verileri ile başlarBeyin-Yaralı farelerde mevcut ed bilişsel. Güvenilir ve tek bir eğitim oturumu ve bir test oturumu gerektiren bir hipokampal bağımlı davranış olarak biz bağlamsal şartlı korku tepkisini test kullanır. Şekil 2 'de gösterilen veriler anterograd bellek ölçmek için davranışsal testleri temsil eder; antrenman yaralanma önce gerçekleştirilirse, ancak, aynı zamanda deney retrograd bellek ölçmek için kullanılabilir.
Alan eksitatör postsinaptik potansiyelleri (fEPSPs) hücrelerin büyük bir nüfus (Şekil 3A) net sinaptik etkinliğini belirlemek için ölçülür. Biz sık stimülasyon desenleri üç farklı türde, kendi sonuçları ve affording her istihdam. Öncelikle, bir dizi adım yoluyla uyarılması yoğunluğu artırarak, biz bir girdi / çıktı eğrisi (Şekil 3B / C) oluşturun.
Sonra, ayrı aynı yoğunlukta iki uyaranları sunarak. Ayrıca, genellikle uzun vadeli potansiyasyonu (LTP) deneyleri, biz sinaptik vezikül serbest olasılığının potansiyel değişiklikleri incelemeyi kısa bir gecikme (genellikle 50 msn) ile d. Aynı yoğunlukta bir temel yanıtı, kısa yüksek frekanslı stimülasyon (genellikle 100Hz) oluşturulduktan sonra, normal uyarılması devam edildiğinde bir potentiation sinaptik tepki neden olan intrasellüler cascade neden teslim edilir.
Tam hücreli gelen elektriksel aktivitesi hücre iki modda kaydedilebilir patch-klemp. Voltaj kelepçesi modunda deneyi yükseltici ile bağlantılı bilgisayar yazılımı vasıtasıyla, banyo için referans olarak yama-kenetlenmiş hücre membran voltaj kontrol eder. Bu durumda, postsinaptik etkinlik aracılık postsinaptik akımlar aktive reseptörleri ve veziküler nörotransmiter konsantrasyon (Şekil 4A), presinaptik bırakma frekansı hakkında bilgi, sayı sağlayan kaydedilir. Geçerli kelepçe modunda deneyci olarakişlediği akım enjekte ve gerilim tepkisini ölçüyor. Bu, eylem potansiyel eşik ve yarı genişliği kadar aksiyon potansiyelinin özelliklerini belirlemek için yararlı olabilir. Bu özellikler, uyarıcı veya bunların aksiyon potansiyeli ateşlemesini kalıpları (Şekil 4B) esas olarak inhibitör nöronların fonksiyonel sınıflandırılması için izin verir. Hücresel kimliğini doğrulamak için biz kayıt sonrasında Lucifer Sarı ve dendritik diken varlığı veya yokluğu ile görsel olarak teyit kimliği ile hücreleri doldurmak öneririz. (Şekil 4C, D).
Membran gerilim değişiklikleri ölçmek üzere voltaj duyarlı boya kullanarak bir deney sonuçlarının bir örneği Şekil 5'te gösterilmektedir. Bu durumda, bir uyarıcı elektrot Schaffer kollateral yolu yerleştirildi ve alanı CA1 bölgesindeki nöronal aktivite analiz edilir. Gerilimi hassas boya membran gerilimi mutlak değerleri rapor değil, t vermezO uyarımı olmaksızın bir temel durum gerilim değiştirin. Ancak, iki koşul (örneğin sham vs beyin yaralı) karşılaştırmalı analizler fEPSPs veya tam hücreli yama kelepçe kayıt kullanılarak ölçülen olamaz fizyolojik değişikliklerin zamanmekansal parametrelerini belirlemek için kullanılabilir.

Şekil 1. Hipokampal Circuit Diagram. Hipokampus yoluyla yatay bir bölümü. Hipokampüs ana yollar sarı 'de gösterilmiştir. Dentat girus granüllü hücrelerin dendrit ile sinaps oluşturarak dentat girus içine perforant yolağı üzerinden entorinal korteks projede nöronların aksonları. Onlar CA3 nöronların dendrit ile sinaps oluşturur CA3 için mossy lif yolağı üzerinden Granül hücre aksonları projesi. Dendrit üzerine Schaffer teminat yolağı üzerinden CA3 nöronlarının projesinin aksonlarCA1 piramidal hücre es. CA1 piramidal hücre aksonlar subiculum aracılığıyla hipokampus dışında proje. Not: Ayrıca fimbriyalarına ile kontralateral hipokampus projelendirme CA3 piramidal hücre akson teminat vardır tasvir. (CA1: Cornu Ammonis 1, CA2: Cornu Ammonis 2, CA3: Cornu Ammonis 3, DG: dentat girus, kesikli çizgi çizgi katı yapısal sınırlarını işaret eder, hücre gövdesi tabakası gösterir.)
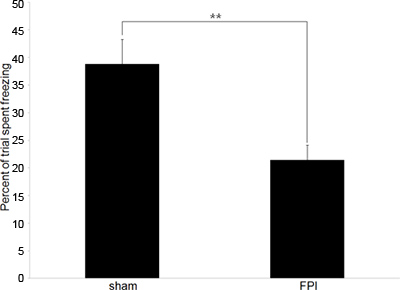
Şekil 2. Örnek Davranış Veri A:. Beyin hasarlı fareler (FPI) ve şartlı korku tepkisi paradigma (sham) denetimleri sham arasındaki donma oranlarındaki farklılık gösteren Davranış verileri. Eğitim sonrası 24 saat gerçekleşen test süresi ile, 6. gün aşağıdaki yaralanma oluştu. (** Temsil eder p <.01).
Şekil 3,. Örnek Ekstrasellüler Kaydı Data A:. Alan eksitatör post-sinaptik potansiyel (fEPSP) alanı CA1 bölgesindeki kayıt örneği. Ilk olarak aşağıya doğru sapma presinaptik elyaf vole ve son olarak fEPSP ardından uyarıcı artifakt olup. B: Giriş / çıkış eğrileri CA1 aşağıdaki sıvı perküsyon yaralanma (FPI) net sinaptik etkinliği azalma gösteren. C: Giriş / çıkış eğrileri FPI takip dentat girus net sinaptik etkinliği artış (DG) tasvir. (* Temsil eder p <.05.) büyük bir rakam görmek için buraya tıklayın .
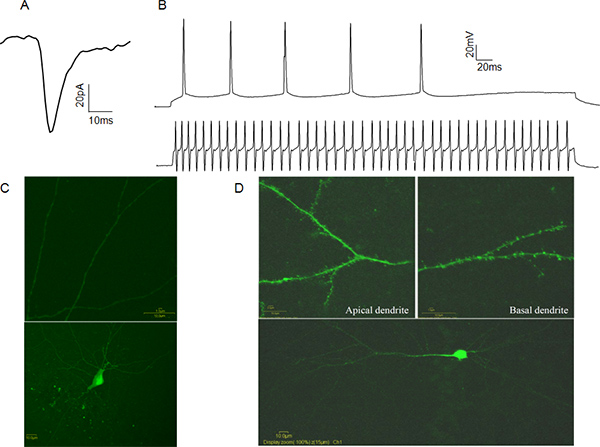
Şekil 4. Temsilci Tüm hücre Patch-clamp Data A:. Spontan bir örnekBir CA1 piramidal hücre postsinaptik akım (sEPSC) eksitatör. B: CA1 piramidal hücre (üst iz) ve hızlı bir smaç CA1 interneuron (alt iz) adlı aksiyon potansiyeli trenler örnekleri. C: Bir Lucifer Sarı örneği CA1 inhibitör internöron doldurdu. Dendritik dikenler (üst panel) olmadığına dikkat edin. D: Lucifer Sarı Örneği CA1 piramidal nöron doldurdu. Dendritik dikenler (üst panel) varlığını unutmayın. büyük bir rakam görmek için buraya tıklayın .
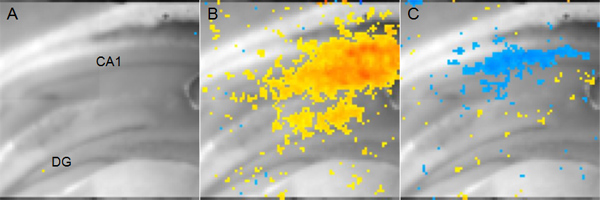
Şekil 5,. Örnek Gerilim Hassas Boya Görüntüleme Data A:. Anatomisi göstermek için görüntülenir Fare koronal hipokampal dilim. (DG: dentat girus, CA1: Cornu Ammonis 1) B: afferent Schaffer teminat uyarılmasından sonra alanı CA1 14 msn eksitatör faaliyeti temsil eden kırmızı piksel Sarı. Kırmızısarı düşük, ancak yine de önemli depolarizasyon gösterir iken daha depolarizasyon gös termektedir. C: alanı CA1 bölgesindeki inhibitör aktivitesinin siteleri temsil eden Mavi piksel 56 msn B. Koyu mavi gösterilen aynı afferent Schaffer teminat stimülasyon sonra daha hiperpolarizasyon gösterir.
Tartışmalar
Yukarıda özetlenen her tekniği gözlenen davranışsal açığı neden altta yatan mekanizmanın daha iyi anlaşılması için katkıda bulunur. Her yöntemin elde benzersiz bilgiler birleştirerek daha hassas biyolojik mekanizmaları incelemek edebiliyoruz.
Ölçüm fEPSPs nöronların büyük açısal olarak tanımlanmış bölgeleri arasında net sinaptik etkinliğinin ölçülmesi için yararlıdır. Aynı zamanda sinaptik plastisite geçmesi bir grup hücre potansiyeli hakkında bilg...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar kendi teknik yardım için Burjuva Elliot teşekkür etmek istiyorum. Bu çalışma Sağlık hibe R01HD059288 ve R01NS069629 Ulusal Sağlık Enstitüleri tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ekipman Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| 200B amplifikatör Axopatch | Molecular Devices | AXOPATCH 200B | Patch-clamp kulesi |
| Digidata 1322A sayısallaştırıcı | Molecular Devices | Patch-clamp kulesi | |
| MP-225 mikromanipülatör | Sutter | MP-225 | Patch-clamp kulesi |
| DMLFSA mikroskop | Leica | Patch-clamp kulesi | |
| 700B amplifikatör Multiclamp | Molecular Devices | 700B MULTICLAMP | Çok Amaçlı (alan)teçhizat |
| Digidata 1440 sayısallaştırıcı | Molecular Devices | Multipurpos (alan) kulesi | |
| MPC-200 mikromanipülatör | Sutter | MPC-200 | Çok Amaçlı (alan) kulesi |
| BX51WI mikroskop | Olimpos | BX51WI | Çok Amaçlı (alan) kulesi |
| 900A amplifikatör Axoclamp | Molecular Devices | 900A AXOCLAMP | VSD kulesi |
| Digidata 1322 sayısallaştırıcı | Molecular Devices | VSD kulesi | |
| Redshirt CCD-SMQ kamera | Redshirt | NCS01 | VSD kulesi |
| VT 1200S Vibratome | Leica | 14048142066 | |
| P-30 Elektrot çektirmesi | Sutter | P-30 / P | |
| Komple proteaz inhibitörü | Roche | 11697498001 |
Referanslar
- Faul, M., Xu, L., Wald, M. M., Coronado, V. G. Traumatic Brain Injury in the United States: Emergency Department Visits Hospitalizations and Deaths 2002-2006. Centers for Disease Control and Prevention, National Center for Injury Prevention and Control. , (2010).
- McAllister, T. W. Neuropsychiatric sequelae of head injuries. Psychiatr. Clin. North Am. 15, 395-413 (1992).
- Pierce, J. E., Smith, D. H., Trojanowski, J. Q., McIntosh, T. K. Enduring cognitive, neurobehavioral and histopathological changes persist for up to one year following severe experimental brain injury in rats. NSC. 87, 359-369 (1998).
- Dixon, C. E., et al. A fluid percussion model of experimental brain injury in the rat. J. Neurosurg. 67, 110-119 (1987).
- McIntosh, T. K., et al. Traumatic brain injury in the rat: characterization of a lateral fluid-percussion model. Neuroscience. 28, 233-244 (1989).
- Carbonell, W. S., Grady, M. S. Regional and temporal characterization of neuronal, glial, and axonal response after traumatic brain injury in the mouse. Acta Neuropathol. 98, 396-406 (1999).
- Toth, Z., Hollrigel, G. S., Gorcs, T., Soltesz, I. Instantaneous perturbation of dentate interneuronal networks by a pressure wave-transient delivered to the neocortex. J. Neurosci. 17, 8106-8117 (1997).
- D'Ambrosio, R., Maris, D. O., Grady, M. S., Winn, H. R., Janigro, D. Selective loss of hippocampal long-term potentiation, but not depression, following fluid percussion injury. Brain Res. 786, 64-79 (1998).
- Witgen, B. M. Regional hippocampal alteration associated with cognitive deficit following experimental brain injury: A systems, network and cellular evaluation. Neuroscience. 133, 1-15 (2005).
- Schwarzbach, E., Bonislawski, D. P., Xiong, G., Cohen, A. S. Mechanisms underlying the inability to induce area CA1 LTP in the mouse after traumatic brain injury. Hippocampus. 16, 541-550 (2006).
- Cole, J. T. Dietary branched chain amino acids ameliorate injury-induced cognitive impairment. Proceedings of the National Academy of Sciences. 107, 366-371 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır